Method Article
ヒト間葉系幹細胞の電気的挙動を特徴付けるための光誘起誘起誘電泳動
要約
ここでは、不均一な細胞株、特にヒト間葉系幹細胞(hMSC)の特性評価のためのラベルフリーアプローチとして、光誘導性誘起誘電泳動を紹介します。この論文では、hMSCのネイティブ状態を変えることなく電気的挙動を特徴付けるために、光導電層を備えたマイクロ流体デバイスを使用および最適化するためのプロトコルについて説明します。
要約
ヒト間葉系幹細胞(hMSC)は、疾患の機構研究の実施やいくつかの治療用途のための患者由来の細胞源を提供します。近年、hMSCの様々な成熟段階での電気的挙動などの特性を理解することがますます重要になっています。誘電泳動(DEP)は、不均一な電場で細胞を操作できる方法であり、細胞膜の容量や誘電率などの細胞の電気的特性に関する情報を得ることができます。DEPの従来のモードでは、3次元電極などの金属電極を使用して、DEPに対するセルの応答を特徴付けます。この論文では、容易に順応可能な形状を持つin situ 仮想電極として機能する光投影を介して細胞を操作できる感光体層で構築されたマイクロ流体デバイスを紹介します。ここでは、hMSCの特性評価のために、光誘起DEP(LiDEP)と呼ばれるこの現象を実証するプロトコルを紹介します。セル速度として測定されるLiDEP誘導セル応答は、入力電圧、光投影の波長範囲、光源の強度などのさまざまなパラメータによって最適化できることを示しています。将来的には、このプラットフォームがラベルフリーで、hMSCまたは他の幹細胞株の不均一な集団のリアルタイム特性評価を実行する技術への道を開くことができると想定しています。
概要
ヒト間葉系幹細胞(hMSC)は、その免疫抑制特性1が認められており、II型糖尿病2、移植片対宿主病3、肝疾患4など、さまざまな疾患の治療のための治療薬での使用につながっています。HMSCは不均一であり、脂肪細胞、軟骨細胞、および骨芽細胞に分化する細胞の亜集団を含みます。HMSCは脂肪組織、臍帯組織、骨髄に由来し、その分化能は起源組織と使用する細胞培養プロセスによって異なります5。例えば、坂口らの研究によると、脂肪組織由来のhMSCは脂肪細胞に分化する可能性が高く、骨髄由来のhMSCは骨細胞に分化する可能性が高い6。しかし、hMSCの組織起源が分化能に与える影響は、さらに理解する必要がある現象です。さらに、hMSCの多様な分化の可能性は、その固有の不均一性に寄与し、hMSCを治療に適用する際の課題を生み出します。そのため、不均一な幹細胞株の特性評価と選別は、これらの細胞のin vitroおよび臨床応用を開発するために重要です。フローサイトメトリーは、細胞表現型の違いを調べるためのゴールドスタンダード技術であり、細胞表面抗原と蛍光色素を利用して標的細胞を標識し、光散乱または細胞特異的蛍光特性に基づいてそれらを特徴付けます6,7,8。この方法の欠点には、細胞表面抗原バイオマーカーの入手可能性が限られていること、機器および操作のコストが高いこと、および細胞表面染色が細胞膜を損傷し、治療用途に影響を与える可能性があるという事実が含まれます9,10,11。したがって、細胞膜の本来の状態を損なうことなく細胞特性評価のための新しい技術を探求することは、幹細胞治療の臨床性能に利益をもたらす可能性があります。
表面標識を使用しない細胞特性評価の方法である誘電泳動(DEP)は、この現在の研究の焦点です。DEPは、マイクロ流体プラットフォーム上に実装されたラベルフリーまたは非染色法であり、電気的特性に基づいて細胞の不均一な集団を特徴付けます。DEPは、蛍光染色の代わりに交流(AC)電界を使用します(すなわち、ラベルベースの方法)7。細胞の特性評価にDEPベースのマイクロ流体デバイスを使用する他の利点には、少量(マイクロリットル)の使用、迅速な分析時間、最小限の細胞サンプル調製要件、サンプル汚染のリスクの最小化、最小限の廃棄物生産、および低コストが含まれます12,13。DEPの別の利点は、セル14、15、16のリアルタイム監視です。DEPの場合、懸濁液中のセルは、電極で生成された不均一なAC電界にさらされ、分極します6。この分極は細胞の動きを引き起こし、印加されたAC電界の周波数と電圧に基づいて細胞操作を可能にします。周波数を典型的には5kHz〜20MHzの間で調整することにより、セルを電極に引き付けたり、電極から引き離したりすることができ、それぞれ正および負のDEP挙動に対応する6。
DEPの特性評価には、電極構成および/または動作戦略によって分類されるように、従来のモード、フィールドフロー分画、および光誘導モードの複数のモードがあります17。DEPの従来のモードである3DEPアナライザーは、物理的な金属電極を組み込み、AC電界に対するセルラー応答を監視します。このシステムは、複数の3次元円形電極を備えたマイクロウェルからなるチップを使用し、光強度の変化を検出して、セルDEP挙動を特徴付ける18,19,20,21。正のDEPは、セルがマイクロウェルの壁に沿って円形電極の端に向かって移動し、マイクロウェルの中心で光強度が増加するにつれて観察されます。負のDEPは、円形電極から離れたマイクロウェルの中心に細胞がクラスター化し、マイクロウェルの中心で光強度が低下することが観察されます。これら2つの現象を図1に示します。従来のDEP法は、不均一な細胞集団の電気的特性を特徴付ける能力を有する18、20、21。例えば、Mulhallらは、3DEP分析装置を用いて、膜容量21の違いに基づいて、正常な口腔ケラチノサイト(HOK)と悪性口腔ケラチノサイト(H357)細胞株を区別する可能性を実証した。ただし、DEPの従来のモードの1つの制限は、固定電極の形状です。hMSCは不均一であるため、DEP評価中に電極形状を簡単に変更できるという利点があります。たとえば、単一セルトラップ用に電極または電極アレイをリアルタイムで変更できるため、速度とDEPの動作に基づいてセルの特性評価を行うことができます。hMSCのDEP評価にリアルタイムの電極修飾を適用することで、サンプル組織からhMSCを調達した直後にhMSCのシングルセル分析が可能になり、サンプル集団の不均一性を特徴付けることができます。
従来のDEPモード(すなわち、固定物理電極)の限界を克服し、DEP現象を使用してリアルタイムの電極構成変更の新しい機会を探求するために、光誘起DEP(LiDEP)が探求されてきました。LiDEPは、光投影を介して光伝導マイクロ流体デバイス22、23を使用して細胞を操作するDEPの非伝統的なモードであり、局在化した電極は、従来のDEP法と同様に、不均一な電場を作り出す。このアプローチにより、電極形状の柔軟性とマイクロ流体デバイス内での電極の移動も可能になります。これにより、固定電極で見られる制限が緩和され、細胞の不均一性に関するより多くの情報を得る機会が得られます。LiDEPは、細胞22、23、24の均質および不均一な集団における異なる細胞型を検出および分析するために使用されています。例えば、LiaoらはLiDEPを用いて、上皮細胞接着モジュール(EpCAMneg)を発現する循環腫瘍細胞(CTC)を赤血球から分離し、癌転移におけるそれらの重要性を探った22。LiDEPによる単一細胞分析は、膵臓造腫瘍性の層別化23および転移前後のサンプル中のCTCの分析24により、癌細胞の特性評価と操作に成功しています。
ここでは、LiDEPを利用して、さまざまな電極形状(円、ひし形、星形、平行線)とシステム設定(印加電圧、光強度、マイクロ流体デバイス材料)でhMSCを操作する方法について説明し、仮想電極でヒト由来の幹細胞の挙動を特徴付けるアプローチを提供します。
プロトコル
1. LiDEPマイクロ流体デバイスの作製
注:製造プロセスは、3つの層状コンポーネントを組み合わせることで構成されています:(i)酸化インジウムスズ(ITO)ガラス基板上に堆積されたアモルファスシリコン(A:Si)とモリブデンを含む感光体層。(ii)両面テープから切り出されたマイクロチャネル層と、(iii)細胞懸濁液の入口および出口のために開けられた穴を有する上部ITOガラス基板。
- 光伝導性酸化インジウムスズ(ITO)のガラスコーティング
- ITOコーティングされたガラス基板(15〜20 Ω抵抗)を、目に見えるほこり粒子を移動するのに十分な流量で表面に窒素(N2)ガスを流して洗浄します。このステップの後、基板をアセトンですすいでください。
- ITOコーティングされたスライドガラスをイソプロピルアルコール浴に移してアセトン残留物を洗い流し、DI水ですすぎ、基板が完全に乾くまでN2 ガスを再度流します。
- ITOコーティング面を上にしてスライドガラスを真空スパッタリング装置に入れます。
- ITOコーティングされたガラス基板(モリブデンターゲット)上に、厚さ10nmのモリブデン層を蒸着速度0.7 Å/s、蒸着時間140秒でスパッタします。
- ガラス基板の片側にシャドウマスクを追加して、電気接続のためにガラス基板の端から2 mmのところに覆いを出さないようにします。Medjdoubら25に記載されているように、誘導結合プラズマプラズマ強化化学気相成長(ICP-PECVD)を使用して1μmのA:Siを堆積させます。
- N2 ガスでスライドを清掃して、ほこりやその他の不純物を取り除きます。シャドウマスクの下に堆積したA:Siの場合は、25%w/v水酸化カリウム溶液にエッジを2mmマークまで沈めてA:Siをエッチングします。
- LiDEPチップデバイス製造
- マイクロチャネルを形成するには、両面テープ(52 mm x 25 mm)を取得し、短辺の端から5〜6 mm離し、テープの長辺の間を中心とするパンチ穴(直径= 4 mm)を取得します。メスを使用して、穴を横切る2本の直線(3 mm間隔)を切り取ります。両面テープの両面の保護シートが、マイクロチャネル切断ステップ全体を通してオンになっていることを確認してください。
- 上部のITOスライドガラスに直径3mmの穴を2つ開けます。テープは、ITOコーティングされたガラスの上に位置合わせすることができ、テープの長辺はガラスの長辺に合わせることができます。洗えるマーカーで穴の位置をマークします。ドリルで開けた穴が両面テープに開けられた穴と揃っていることを確認してください。これらの2つの穴は、マイクロ流体デバイスの入口穴と出口穴として機能します。
- 両面テープの保護フィルムの片側をはがし、テープの穴と上部のITOスライドを合わせ、一緒に押します。軽く押して、特にマイクロチャネルの近くでエアポケットを取り外します。エアポケットは、媒体または他の溶液がテープの下に浸透することを可能にし、マイクロ流体デバイスの損傷またはカビを引き起こす可能性がある。
- 両面テープからもう一方の保護フィルムをはがし、モリブデンとA:SiコーティングされたITOガラス側に押し付けます。2 mmクリアランス側の反対側にある感光性スライドの端を、上部のITOスライドの中央に向かっている両面テープの端に合わせます。上部のITOスライドガラスと光伝導材料でコーティングされたITOスライドから二日酔いがあります。
- 平らな面を押して、良好な接着を確保します。ガラス基板と両面テープ層の概略図を 図1Aに示します。側面の余分なテープを切り取ります。
- A層とC層の端に銅テープを貼って、関数発生器を接続します。これを行うには、ITOまたは光導電材料の側面にテープを巻き付け、層Aか層Cかに応じて、両面テープの端からガラス基板のコーティングされていない側に約3cmまで巻き付けます。
- デバイスの製造を成功させるには、マルチメーターを使用して、両方のガラス基板のコーティングされたスライドとガラスに取り付けられた銅テープの間の抵抗の読み取り値をテストします。
- DEP バッファーの準備
- 4.25 gのスクロースを計量し、50 mLのコニカルチューブに入れます。次に、0.15 gのグルコースを測定し、同じ50 mLのコニカルチューブに入れます。
- コニカルチューブに超純水25mLを満たし、蓋を閉めて混合します。ショ糖とブドウ糖の約半分が溶解したら、コニカルチューブに50 mLラインまでの超純水を満たします。すべてのスクロースとグルコースが溶解するまで激しく混合します。DEP緩衝液は、8.5%(w/v)のスクロースおよび0.3%(w/v)のグルコースを含有する。
- 調製したスクロースとグルコース溶液20 mLを入手し、50 mLのコニカルチューブに入れます。次に、ウシ血清アルブミン(BSA)0.1 gを測定し、ショ糖とグルコース溶液を入れた50 mLのコニカルチューブに入れます。BSAが溶解するまで渦。最終的なDEPバッファー溶液には、0.5%(w / v)のBSAが含まれています。
- 細胞調製
- 以前の研究26,27に記載されている細胞培養プロトコルを使用して、1 mLの増殖培地に懸濁した少なくとも1 x 106細胞(hMSCまたはHEK 293)を取得します。細胞懸濁液を10 mLの遠沈管に入れます。
- HEK 293細胞を201 x gで5分間、hMSC細胞を290 x gで10分間遠心分離します。遠心分離後、上清を吸引し、細胞を0.5%BSAを含む1 mLのDEP緩衝液に再懸濁した。気泡が発生する可能性があるため、緩衝液の添加が速すぎないように注意してください。
- 遠心分離プロセスをさらに2回繰り返してから、LiDEPの特性評価のために0.5%BSAを含むDEPバッファーに細胞を再懸濁します。記載されている細胞調製プロトコルは、10回の実行に十分です。たとえば、1回の周波数テストでは少なくとも15回の実行が必要なため、1 x 106 細胞/mLの濃度で2 mLの細胞を作成する必要があります。
2. LiDEPの特性評価
- 実験のセットアップ
- LiDEPに対する細胞応答を定量化するための実験セットアップ用に、ラップトップ、プロジェクター、対物レンズ、デジタル顕微鏡、関数発生器の機器を組み立てます。ラップトップを使用して光の投影(星、ひし形、3本の線、楕円形)を設計し、プロジェクターに接続します。
- プロジェクターを光源として使用して、LiDEPチップの光伝導面(層C)に光の投影を表示します。光源(プロジェクター)からの光が10倍の対物レンズを通ってLiDEPチップのマイクロチャネル領域に移動するように設定します。10倍対物レンズはプロジェクターレンズの上にあります。 補足図1 は、LiDEPシステムへのプロジェクターの統合を示しています。
- LiDEPチップを関数発生器に接続して交流電界を印加します。LiDEP力を受けている細胞を、デジタルマイクロスコープを使用してイメージングとビデオ録画に観察します。図1Bは、実験装置の概略を示す。試験したすべての細胞について、標準的な細胞培養プロトコル26,27に従ってください。
- 実験手順
- マイクロチャネルを70%エタノールで洗い流し、続いて0.5%BSA溶液で洗い流します。マイクロチャネルを0.5%BSA溶液でさらに2回フラッシュして、エタノールと以前の細胞が完全に洗い流されるようにします。すでにDEPフィールドに公開されているセルは、新しいセルとは異なる応答を示し、データ収集を中断する可能性があります。
- ピペットで0.5%BSA溶液を取り出し、マイクロ流体デバイスをデバイスホルダーに取り付けます。
- ワニ口クリップをデバイスの各銅テープ接続に取り付けます。関数発生器を目的の電圧(電圧ピークtoピーク、Vpp)と周波数(Hz)に設定します。ここでテストされた周波数範囲は30kHzから20MHzでした。
- 70 μLの細胞懸濁液(細胞+ 0.5%BSAを含むDEP緩衝液)をデバイスのマイクロチャネルに追加します。マイクロ流路の薄さ(~0.05mm)により、入口と出口の穴からこぼれることがあります。こぼれる量を減らすために、より小さなピペットチップを使用し、穴のチップをマイクロチャネルに向かってわずかに傾けます。アクセスソリューション(0.5%BSAまたは溶液中の細胞)は、使い捨ての紙拭きで拭き取り、バイオハザード廃棄物に廃棄することができます。
- 目的の仮想電極形状(ここでは、円、ダイヤモンド、星、および/または平行線)をLiDEPチップに投影します。
- デジタル顕微鏡ソフトウェアで、ビデオの長さを3分に設定します。ラボ タイマーを 2 分 30 秒に設定します。セルがLiDEPチップのマイクロチャネルに静止したら、デジタル顕微鏡ソフトウェアの [開始 ]を押して、ビデオ録画プロセスを開始します。
- 10秒待ってから、ファンクションジェネレータチャンネル出力の ON ボタンを押してAC電界を印加し、タイマーの Start を押します。デジタル顕微鏡でセルのDEP動作を監視し、セットアップ周辺の揺れや動きを防ぎます。
- タイマーが鳴ったら、ファンクションジェネレータチャンネル出力の ON ボタンを押します。これにより、関数発生器のチャンネル出力がオフになり、電極からAC電界が供給されなくなります。3分でビデオ録画を停止し、将来の分析のためにデジタル顕微鏡に保存します。
- 0.5% BSAを含む60 μLのDEPバッファーをマイクロチャネルにゆっくりと押し込み、同時に出口で収集することにより、LiDEPチップの出口端から細胞をピペットで取り出します。マイクロチャネルにセルがほとんどまたはまったくなくなるまで続けます。
- すべての周波数がテストされるまで、手順2.2.3〜2.2.9を繰り返します。
結果
電圧と電極のカラーテストは、上記の手順を使用して完了しましたが、ステップ2.2.3とステップ2.2.10でわずかに変化しました。電圧試験では、電極の色と周波数を一定に保ち、5 V pp、10 V pp、および20 Vppを適用しました。電極発色試験では、印加電圧と周波数を30kHzと20Vppで一定に保ち、青、赤、白、黄色(それぞれHEXカラーコード#4472C4、#FF0000、#FFFFFF、#FFFF00で参照)の投影電極を調べました。細胞をトリパンブルーで染色し、血球計算盤を用いて生細胞と死細胞の数をカウントすることにより、細胞生存率を調べた。
LiDEPのセットアップにより、hMSCを操作し、入力周波数に応じてDEP応答曲線を生成することができました。印加電圧や投影電極の色(グラフィックエディタソフトウェアで作成した色違いの形状)などのパラメータを操作して、仮想電極で発生する不均一な交流電界に対して一貫したセルの挙動を観察することで、最適な動作条件を見つけるための一連の実験が行われました。非従来型DEPであるLiDEPを使用した細胞応答について収集されたデータを、3DEPアナライザーである従来のDEPの結果と比較しました。
最初の最適化テストでは、LiDEPチップ内のhMSC(つまり、仮想電極に向かって移動するセル)の正のDEP応答に焦点を当てました。正のDEP応答を示さないセルは、仮想電極から離れることによって負のDEP応答を示したか、静止して回転しているか、または電界に応答しなかった。細胞の応答は、2分30秒の期間にImageJでそれらの速度(μm / s)を追跡することによって定量化されました。仮想電極には黄色の楕円投影を用い、設定周波数30kHzで5V pp、10V pp、20V ppの印加電圧を調べた。仮想電極から50 μm以内にあり、AC電界がオンのセルに焦点を当てて、一貫性と外れ値を最小限に抑えました。20 V ppは、HEK 293セルの平均速度0.035 μm/sで最速のセル移動をもたらし、これに続いて10 V ppで0.032 μm/s、5 Vppで0.020 μm/sと、これらのセルは比較的均質なコントロールを表しています。図2Aのように、20 V ppで0.051 μm/s、10 V ppで0.036 μm/s、5 V ppで0.025 μm/sの平均速度を持つhMSCについても同様の傾向が観察されました(ここで、*はp<0.05を示します)。20 Vppでは、hMSCが同時に陽性および負のDEPを経験することが観察された。これは、10 V ppおよび5 V ppでは観察されなかった。 DEP力を経験した後のhMSCの生存率の所見は、より高い電圧が一般に細胞生存率の低下をもたらし、細胞の66%が5 V ppで生存可能、細胞の58%が10 Vppで生存可能、および細胞の57%が20 V ppで生存可能であることを示しました。 図2Bのように(ここで、**はp<0.01を示す)。
LiDEPは光学ベースのシステムであるため、光強度と電極の色は、LiDEPチップのパフォーマンスを制御するために簡単に調整できるパラメーターです。ここでは、投影される形状に基づいて生成された異なる電極色(白、黄、赤、および青)を評価して、セルのDEP応答への影響を決定しました。HEK 293細胞およびhMSCを20 Vppおよび30 kHzで評価した。白色、黄色、赤色、青色の電極が選択されましたが、LiDEPチップを介した照明は、赤橙色の感光体層の影響を受けました。したがって、投影された白い電極は黄色で内部が白く、赤い電極はオレンジ色に赤い輪郭で見え、青い電極は薄緑色に見えました(図3A-D)。これらの4色の出力は、白、黄、赤、青でそれぞれ0.7μW±77.7μW、1.3μW±92.7μW、0.2μW±21.9μW、0.9μW±56.7μWでした。これは、図3Eのように、黄色と白が最も強いDEPフィールドを持ち、青と赤が弱いことを強く示唆しています(ここで、***はHEK 293細胞p<0.01を示します)。DEP力の印加中の黄色および白色の仮想電極の縁部上のセルの静止回転も観察された。すべての電極の色の変化について、負と正のDEP応答が同時に発生し、電圧テストで20 Vppで示されたものと相関しました。さらに、セルの速度は電極の色によって変化しましたが、50 μm境界内のほぼすべてのセルがLiDEPに応答しました。hMSCのサイズは19.2 μm±5.8 μmと測定しました。
従来の電極を用いたDEPと比較したLiDEPの能力を評価するために、LiDEPを用いた細胞のDEP挙動と3DEP分析装置で解析した細胞のDEP挙動の違いを評価した。hMSCのDEP応答は、0.5%BSA(~100 μS/cm)を含む低導電率DEP緩衝溶液で測定されました。3DEPアナライザーを模倣するために、単一の楕円形の黄色の仮想電極を10 Vppで投影しました。hMSCのDEP動作は、30kHzから20MHzまで特徴付けられました。25kHz以下の周波数では、マイクロ流体デバイス内の金属層の表面に気泡が発生する電気分解が観察されました。LiDEPの場合、より低い周波数では、 図4Aのように、hMSCは正のDEP力を受け、仮想電極に引き付けられたセルの割合として表されます。細胞は強い正のDEP力で始まり、周波数が増加するにつれて弱まりました。セルは、30kHzから97kHzまで最も強い正のDEP力を経験しました。これらの周波数で交流電界を印加した後、一部の細胞は応答しなくなり、他の細胞は負のDEP挙動を示しました。この傾向は、3DEPアナライザを使用して定量化された観測応答から逸脱しています。 図4Bに示すように、セルは正のDEPで37kHzから255kHzに増加し、正のDEPで1,772kHzから20MHzに減少しました。
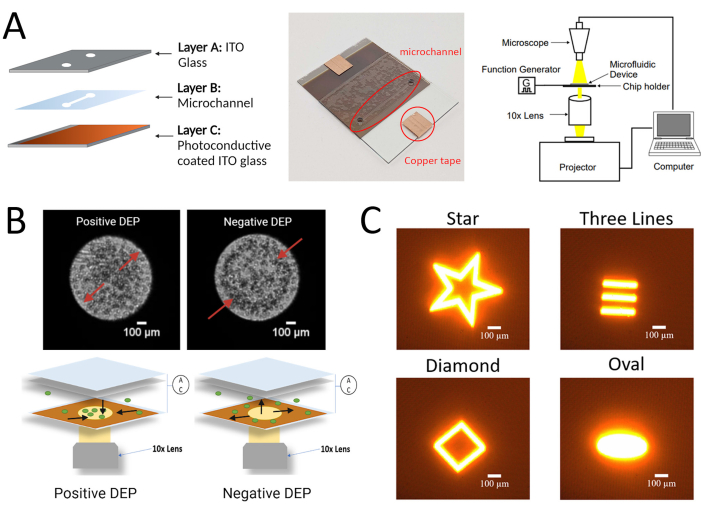
図1:hMSCについてここで説明したLiDEPプロトコルの実験セットアップ。 (A)感光体層と実験セットアップを備えたLiDEPチップの概略図と実画像。(B)3DEP分析装置における細胞の正負のDEP応答の代表画像(上段)とLiDEPを用いた細胞の正負のDEP応答の模式図(光投影を仮想電極として使用、下)。(C)仮想電極としてデバイスに投影できるさまざまな形状の例。BioRender.com で作成された図。 この図の拡大版を表示するには、ここをクリックしてください。
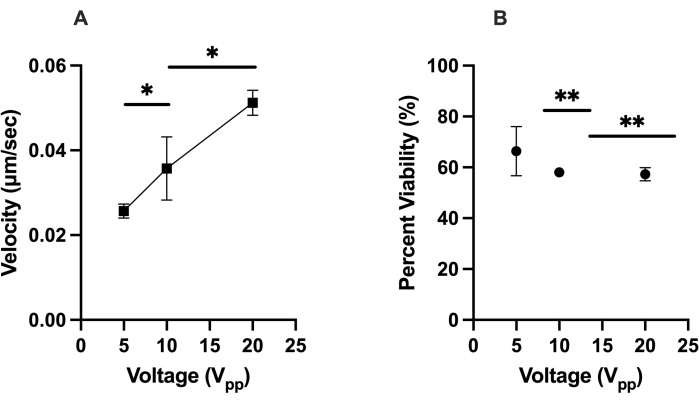
図2:hMSCのDEP応答(速度)の特性評価と、与えられた条件下でのそれらの生存率。 (A)5 V pp、10 Vpp、および20 Vppに対するhMSCの正のDEP応答の測定速度。hMSCは、20 V ppで0.051 μm/s、10 Vppで0.036 μm/s、5 Vppで0.025 μm/sで移動しました。(B)仮想電極で発生する正のDEP力を経験した後のhMSCの生存率。生存率は、20 Vpp、10 V pp、および5 Vppでそれぞれ57%、58%、および66%でした。エラーバーは標準偏差(SD)を表します。t検定(*p < 0.05および**p < 0.01)を使用して、プールされたデータセットの統計分析が完了しました。この図の拡大版を表示するには、ここをクリックしてください。
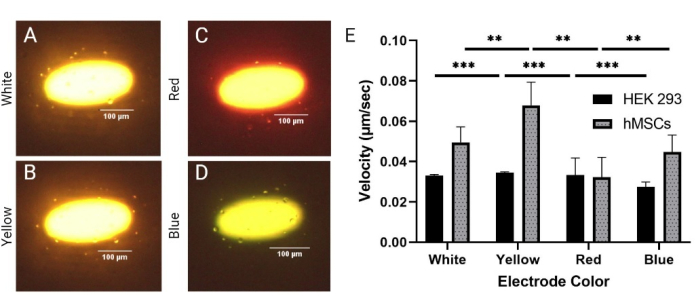
図3:均質(HEK 293)細胞株と異種(hMSC)細胞株間のDEP応答の比較。20 Vppおよび30 kHzでの(A)白色、(B)黄色、(C)赤色、および(D)青色の電極に対するhMSC細胞の正のDEP応答。(E)異なる色の電極に対するHEK 293セルとhMSCの速度応答。HEK 293セルは、黄色と赤の電極でそれぞれ0.035 μm/sと0.033 μm/sで最高の速度を示しました。HEK 293セルは、青色の電極で0.027 μm/sの最低速度を示しました。hMSCは、黄色の電極と白色の電極でそれぞれ0.068 μm/sと0.049 μm/sで最も高い速度を示しました。hMSCは、赤色電極で0.039 μm/sの最低速度を経験しました。エラーバーはSDを表します。 t検定(*p < 0.05、**p < 0.01、および***p < 0.001)を使用してプールされたデータセットで完了した統計分析。この図の拡大版を表示するには、ここをクリックしてください。
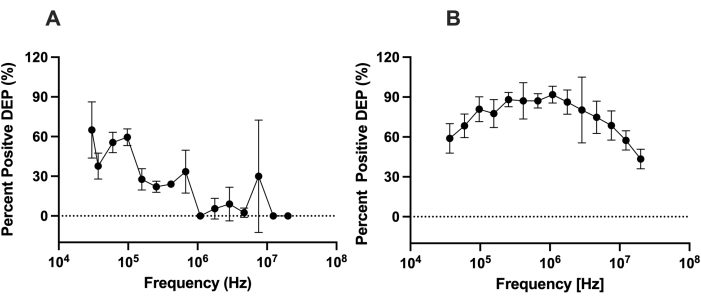
図4:LiDEPと3DEPを使用したhMSCのDEP応答の比較。 (A)LiDEPおよび(B)3DEPアナライザーで10 Vppで測定したhMSCのDEP応答。LiDEPでは、hMSCの正のDEP応答が30kHzから20MHzに減衰しました。3DEPアナライザーから、セルは正のDEPで37kHzから255kHzに増加し、正のDEPで1,772kHzから20MHzに減少しました。 エラーバーはSDを表します。 この図の拡大版を表示するには、ここをクリックしてください。
補足図1:このプロトコルの実験に使用されたLiDEPセットアップの代表的な画像。 プロジェクターの統合を示すLiDEPシステムのズームイン写真。光は光源(プロジェクター)から10倍の対物レンズを通ってLiDEPチップのマイクロチャネルに移動します。10倍対物レンズはプロジェクターレンズの上にあります。各コンポーネントは写真で番号が付けられ、側面にリストされています。 このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオ1:白、黄、赤、青の仮想電極に応答するhMSCの代表的なビデオ。 セルは、正のDEP(仮想電極に向かって移動する)、負のDEP(仮想電極から離れる)、静止して回転している、または電界に応答しないとして視覚化されます。hMSCは37kHzと20Vppでテストされ、ビデオは20倍に高速化されました。 このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
hMSCの不均一性を調べることは、治療における進歩にとって重要です。この研究は、LiDEPをhMSCの評価のための分析ツールとして使用するための最初のステップを提供します。LiDEPにおける細胞の正のDEP応答の電圧依存性を速度を定量化して調べた。電圧が高いほどDEPの正の力が強くなると予想され、測定した速度でこのパターンを観察しました。10 V ppおよび20 Vppの電圧は、LiDEPを使用したhMSCの操作に十分でした。電圧が低い(つまり、5 Vpp)と、セル応答が遅くなります。hMSCには最適ではありませんが、これは他の細胞タイプには有利である可能性があります。hMSCの生存率は電圧依存的に約9%低下した。これは、生物学的細胞の検査における伝統的なDEPおよびLiDEPの使用が細胞生存率を低下させなかった以前の文献6,12,28,29とはわずかに異なる。ただし、各研究の実験目的はさまざまでした。GlasserおよびFuhrは、細胞培養培地28中の金属電極上の接着性L929マウス線維芽細胞の増殖をモニターした。逆に、Luらは、異なる期間にわたって交流電界にばく露された神経幹細胞の生存率を調べた12。Adamsらは金属電極12でhMSCの誘電特性を特徴付け、LiらはLiDEP29で白血病細胞を操作した。これらの研究と我々の研究との違いはBSAの使用であり、これが我々が観察した生存率の低下の原因である可能性がある。ただし、全体的な生存率が低いのは、ここで確立されたプロトコルで使用される曝露時間(2分30秒)にも起因する可能性があります。この時間は、不均一なAC電界への曝露中の細胞操作を視覚化するのに十分な時間を提供するために選択された。
セルの特性評価の方法は、プロトコルに記載されているように構築されたLiDEPシステムの機能と制限を決定するために、電極の色を介してテストされました。この特定のプロトコルでは、電極の色は、グラフィックエディタファイルを介して投影される形状の色に基づいて制御できます。白、黄、赤、青の4色を使用しました。各色の出力測定値から、投影された黄色(#FFFF00)および白色(#FFFFFF)電極はより高い強度を有することが測定され、それがこれらの色がその後の実験で使用するのにより有利であった理由の基礎となった。さらに、光伝導材料30,31の確立された光強度依存性のために、結果はLiDEPデバイスの性能が光伝導性A:Siに依存し、投影された電極色の選択によって調整できることを示唆している。LiDEPを用いて、hMSCの陽性および陰性のDEP応答の組み合わせも観察され、これは従来のDEP法で見られる現象に似ています。各電極の色で、hMSCは負のDEP力、正のDEP力、およびセル回転を経験し、セルサンプルが単一の周波数で不均一であることを示しています(補足ビデオ1)。これは、hMSCが単一の周波数で負のDEP挙動と正のDEP挙動の両方を示すというAdamsらの発見と一致しています。これらの条件(電極の色、電極の形状、および光導電材料)は、hMSCサンプルの不均一性のレベルを検出するための追加のパラメーターを提供する可能性があります。
最後に、LiDEP評価の結果は、hMSC DEP挙動のベンチマークとして3DEPアナライザーの結果と比較されました。hMSCsの正のDEP応答の周波数範囲に差は見られたが、LiDEPと3DEP分析装置 を介して 収集されたデータの傾向は全体的に類似していた(すなわち、正のDEP応答は頻度の増加とともに減少した)。LiDEPチップに交流電界を供給し、そこに光を投射すると、光投影内の領域のコンダクタンスが低下し、不均一な電界が生じました。したがって、光源の特性(すなわち、強度および波長)は、電圧および電極の色変化試験の結果から分かるように、LiDEPチップ内のセルの予想される応答に影響を与える。変更可能な他のパラメータは、感光体層の材料およびDEP緩衝溶液の導電率である。そのため、セルのDEP動作を評価するために使用される条件は、LiDEPシステムのセットアップに基づいて評価する必要があります。逆に、3DEP分析装置など、金属電極を使用してDEP力を加える方法では、電極特性は一定であり、調査中のセルに必要なものに適応するために即座に変化させることはできません。この陽性DEP挙動の変動は、hMSCサンプル内のさまざまな細胞タイプの特性評価、シングルセル分析、またはセルソーティングに関する将来の研究に役立つ可能性があります。さらに、セルが仮想電極から離れるにつれて、AC電界は弱くなります。ただし、3DEPアナライザー、または金属電極を使用する他の従来のDEPモードでは、より大きな電界領域を適用できるため、より多くのセルを操作できます。したがって、LiDEP実験あたりの細胞数は少なく、LiDEPチップのマイクロチャネル内のAC電界の影響を経験しました。さらなる不一致は、時間の経過に伴うデバイスのパフォーマンスの変化(つまり、2時間または3時間)によって引き起こされる可能性があり、これはまだ調査中です。水、エタノール、およびDEP緩衝溶液の一定の流れは、マイクロチャネル層(すなわち、光伝導性材料)の表面を破壊する可能性があり、考慮する必要があります。セル特性評価のための経時的なデバイス性能も、1つのLiDEPチップの長期使用のために考慮する必要があります。リアルタイムでの実験パラメータの変更には、数秒から数分しかかかりませんでした。電極の色と形状は、グラフィックエディタソフトウェア内の設定を使用して即座に調整されました。
要約すると、この論文は、hMSCなどの不均一な細胞集団を持つ細胞株を操作および特性評価するLiDEPの能力を示しています。このセットアップと説明されているプロトコルを使用して、20 Vpp および投影された仮想黄色電極の条件下でhMSCの特性評価を成功させることができました。今後の研究では、LiDEP を介して 生成されたAC電界へのhMSCの曝露時間を調整し、仮想電極の光強度を高め、hMSC(または他の幹細胞集団)のさまざまなソースを評価して、不均一な幹細胞集団の電気的特徴のLiDEPカタログを開発することに焦点を当てる必要があります。
開示事項
著者らは利益相反を報告していない。
謝辞
この研究は、 CBETを介して 全米科学財団CAREER賞(2048221)によってサポートされました。UCIの統合ナノシステム研究施設(INRF)のMo Kebaili氏に感謝の意を表します。さらに、LiDEPシステムの開発を支援してくれたデビン・ケック博士に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 10x objective | AmScope | --- | |
| Amorphous silicon (A:Si) | Millipore Sigma | S5130 | |
| Antibiotic-Antimycotic (100X) | Gibco | 15240-062 | |
| Bovine Serum Albumin (BSA) | Fisher | BP9706-100 | |
| Copper Tape | Zehhe | BF4964 | |
| Dextrose (glucose) | Fisher | D16-1 | |
| Digital microscope | Keyence | VHX-7000 | |
| Double Sided Tape | Insulectro | FLX000484 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Gibco | 14190-144 | |
| Fetel Bovine Serum (FBS) | Corning | 35-011-CV | |
| Function Generator | Tektronix | AFG 31102 | |
| Graphic editor software | Microsoft Office Powerpoint | --- | |
| Indium tin oxidec coated glass slides | MSE Supplied | GL0333 | |
| L-Alanyl-L-Glutamine | ATCC | PCS-999-034 | |
| Laptop | Dell | Inspiron 14, 2-in-1 | |
| Mesenchymal Stem Cell Basal Medium | ATCC | PCS-500-030 | |
| Mesenchymal Stem Cell Growth Kit for Umbilical and Adipose Cord-Derived MSCs | ATCC | PCS-500-040 | |
| Minimum Essential Mediaum Alpha (MEM a, 1X) | Giblo | A10490-01 | |
| Molybdenum, 99.95% | Kurt J. Lesker | EJTMOXX352A4 | Sputtering target |
| Phenol Red | Sigma | P5530 | |
| Power Meter | Thor Labs | S130VC/PM400 | |
| Projector | Vecupoi | --- | |
| Roswell Park Memorial Institute (RPMI) 1640 Media | Gibco | 11875-093 | This media has L-Glutamine and Phenol Red. |
| Sucrose | Fisher | BP220-1 | |
| Trypan Blue Stain | Gibco | 15250-061 | 0.40% |
| Trypsin Neutralizer | Gibco | R002100 | |
| Vacuum Sputtering System | Denton | DV-502M |
参考文献
- Mahla, S. R. Stem cells applications in regenerative medicine and disease therapeutics. International Journal of Cell Biology. 2016, (2016).
- Bhansali, A. Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cells and Development. 18 (10), 1407-1416 (2009).
- Bouchlaka, M. N. Human mesenchymal stem cell-educated macrophages are a distinct high IL-6-producing subset that confer protection in graft-versus-host-disease and radiation injury models. Biology of Blood and Marrow Transplantation. 23 (6), 897-905 (2017).
- Alfaifi, M., Eom, Y. W., Newsome, P. N., Baik, S. K. Mesenchymal stromal cell therapy for liver diseases. Journal of Hepatology. 68 (6), 1272-1285 (2018).
- Oswald, J. Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells. 22 (3), 377-384 (2004).
- Sakaguchi, Y., Sekiya, I., Yagishita, K., Muneta, T. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis and rheumatism. 52 (8), 2521-2529 (2005).
- Poirier, J. T., Uthamanthil, R., Tinkey, P. Chapter 5 - Genetic profiling of tumors in PDX models. In Patient Derived Tumor Xenograft Models: Promise, Potential and Practice. , 149-159 (2017).
- . Sino Biological. Fluorescence-activated cell sorting (FACS) Available from: https://www.sinobiological.com/category/fcm-facs-facs (2023)
- González-González, M., Vázquez-Villegas, P., García-Salinas, C., Rito-Palomares, M. Current strategies and challenges for the purification of Stem Cells. Journal of Chemical Technology and Biotechnology. 87 (1), 2-10 (2011).
- Flanagan, A. L. Unique dielectric properties distinguish stem cells and their differentiated progeny. Stem Cells. 23 (3), 656-665 (2007).
- Vykoukal, J., Vykoukal, D. M., Freyberg, S., Alt, E. U., Gascoyne, P. R. C. Enrichment of putative stem cells from adipose tissue using dielectrophoretic field-flow fractionation. Lab on a Chip. 8 (8), 1386-1393 (2008).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cells and the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), (2014).
- Wu, H. W., Lin, C. C., Lee, G. B. Stem cells in microfluidics. Biomicrofluidics. 5 (1), (2011).
- Adams, T. N. G. Label-free enrichment of fate-biased human neural stem and progenitor cells. Biosensors and Bioelectronics. 152, 111982 (2020).
- Zhao, K., Larasati, ., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Song, H. Continuous-flow sorting o stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15, 1320-1328 (2015).
- Khoshmanesh, K., Nahavandi, S., Baratchi, S., Mitchell, A., Kalantar-Zadeh, K. Dielectrophoretic platforms for bio-microfluidic systems. Biosensors and Bioelectronics. 26 (5), 1800-1814 (2010).
- Hoettges, K. F. Ten-second electrophysiology: Evaluation of the 3DEP platform for high-speed, high-accuracy cell analysis. Scientific Reports. 9, 19153 (2019).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. IEE Proceedings - Nanobiotechnology. 152 (4), 150-154 (2005).
- Hoettges, K. F. Dielectrophoresis-activated multiwell plate for label-free high-throughput drug assessment. Analytical Chemistry. 80 (9), 2063-2068 (2008).
- Mulhall, H. J. Cancer, pre-cancer and normal oral cells distinguished by dielectrophoresis. Analytical and Bioanalytical Chemistry. 401 (8), 2455-2463 (2011).
- Liao, C. -. J. An optically induced dielectrophoresis (ODEP)-based microfluidic system for the isolation of high-purity CD45neg/EPCAMNEG cells from the blood samples of cancer patients-Demonstration and initial exploration of the clinical significance of these cells. Micromachines. 9 (11), 563 (2018).
- McGrath, J. S. Electrophysiology-based stratification of pancreatic tumorigenicity by label-free single-cell impedance cytometry. Analytica Chimica Acta. 1101, 90-98 (2019).
- Chiu, T. K. Optically-induced-dielectrophoresis (ODEP)-based cell manipulation in a microfluidic system for high-purity isolation of integral circulating tumor cell (CTC) clusters based on their size characteristics. Sensors and Actuators, B: Chemical. 258, 1161-1173 (2018).
- Medjdoub, M., Courant, J. L., Maher, H., Post, G. Inductively coupled plasma - plasma enhanced chemical vapor deposition silicon nitride for passivation of InP based high electron mobility transistors (HEMTs). Material Science and Engineering: B. 80 (1-3), 252-256 (2001).
- . Umbilical cord-derived mesenchymal stem cells; Normal, human Available from: https://www.atcc.org/products/pcs-500-010 (2023)
- . 293 [HEK-293] Available from: https://www.atcc.org/products/crl-1573 (2023)
- Glasser, H., Fuhr, G. Cultivation of cells under strong ac-electric field-differentiation between heating and trans-membrane potential effects. Bioelectrochemistry and Bioenergetics. 47 (2), 301-310 (1998).
- Li, B. Implementation of flexible virtual microchannels based on optically induced dielectrophoresis. Nanotechnology. 33, 295102 (2022).
- Schellenberg, J. J., Kao, K. C. On the relationship between photoconductivity and light intensity in solids. Journal of Physics D: Applied Physics. 21, 1764-1768 (1988).
- Aoyagi, Y., Masuda, K., Namba, S. Explaination of light-intensity dependence of photoconductivity in zinc phthalocyanine. Journal of Applied Physics. 43, 249-251 (1972).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved