Method Article
Dielettroforesi indotta dalla luce per caratterizzare il comportamento elettrico delle cellule staminali mesenchimali umane
In questo articolo
Riepilogo
Qui, presentiamo la dielettroforesi indotta dalla luce come un approccio label-free per caratterizzare linee cellulari eterogenee, in particolare le cellule staminali mesenchimali umane (hMSCs). Questo articolo descrive un protocollo per l'utilizzo e l'ottimizzazione di un dispositivo microfluidico con uno strato fotoconduttivo per caratterizzare il comportamento elettrico delle hMSC senza alterare il loro stato nativo.
Abstract
Le cellule staminali mesenchimali umane (hMSC) offrono una fonte di cellule derivate dal paziente per condurre studi meccanicistici di malattie o per diverse applicazioni terapeutiche. Comprendere le proprietà delle hMSC, come il loro comportamento elettrico nelle varie fasi di maturazione, è diventato più importante negli ultimi anni. La dielettroforesi (DEP) è un metodo in grado di manipolare le cellule in un campo elettrico non uniforme, attraverso il quale è possibile ottenere informazioni sulle proprietà elettriche delle cellule, come la capacità e la permittività della membrana cellulare. Le modalità tradizionali di DEP utilizzano elettrodi metallici, come gli elettrodi tridimensionali, per caratterizzare la risposta delle celle al DEP. In questo articolo, presentiamo un dispositivo microfluidico costruito con uno strato fotoconduttivo in grado di manipolare le cellule attraverso proiezioni luminose che agiscono come elettrodi virtuali in situ con geometrie facilmente conformabili. Qui viene presentato un protocollo che dimostra questo fenomeno, chiamato DEP indotto dalla luce (LiDEP), per caratterizzare le hMSC. Mostriamo che le risposte cellulari indotte da LiDEP, misurate come velocità delle celle, possono essere ottimizzate variando parametri come la tensione di ingresso, gli intervalli di lunghezze d'onda delle proiezioni luminose e l'intensità della sorgente luminosa. In futuro, prevediamo che questa piattaforma potrebbe aprire la strada a tecnologie prive di etichette ed eseguire la caratterizzazione in tempo reale di popolazioni eterogenee di hMSC o altre linee di cellule staminali.
Introduzione
Le cellule staminali mesenchimali umane (hMSC) sono riconosciute per leloro proprietà immunosoppressive1, che hanno portato al loro uso in terapia per il trattamento di una varietà di malattie, come il diabete di tipo II2, la malattia del trapianto contro l'ospite3 e la malattia epatica4. Gli HMSC sono eterogenei, contenenti sottopopolazioni di cellule che si differenziano in adipociti, condrociti e osteoblasti. Le HMSC derivano dal tessuto adiposo, dal tessuto del cordone ombelicale e dal midollo osseo e il loro potenziale di differenziazione dipende dal tessuto di origine e dal processo di coltura cellulare utilizzato5. Ad esempio, secondo uno studio di Sakaguchi et al., le hMSC derivate dal tessuto adiposo hanno maggiori probabilità di differenziarsi in adipociti, mentre le hMSC derivate dal midollo osseo hanno maggiori probabilità di differenziarsi in osteociti6. Tuttavia, l'impatto dell'origine tissutale delle hMSC sul loro potenziale di differenziazione è un fenomeno che deve ancora essere ulteriormente compreso. Inoltre, i vari potenziali di differenziazione delle hMSC contribuiscono alla loro intrinseca eterogeneità e creano sfide nell'applicazione delle hMSC per le terapie. Pertanto, la caratterizzazione, così come l'ordinamento, di linee di cellule staminali eterogenee è fondamentale per lo sviluppo dell'applicazione in vitro e clinica di queste cellule. La citometria a flusso, la tecnica gold standard per esaminare le differenze nei fenotipi cellulari, utilizza antigeni della superficie cellulare e coloranti fluorescenti per marcare le cellule bersaglio e caratterizzarle in base alla diffusione della luce o alle caratteristiche di fluorescenza specifiche delle cellule 6,7,8. Gli svantaggi di questo metodo includono la limitata disponibilità di biomarcatori dell'antigene della superficie cellulare, l'alto costo dell'attrezzatura e del funzionamento e il fatto che la colorazione della superficie cellulare potrebbe potenzialmente danneggiare la membrana cellulare e influenzare le applicazioni terapeutiche 9,10,11. Pertanto, esplorare nuove tecniche per la caratterizzazione cellulare senza compromettere lo stato nativo della membrana cellulare potrebbe giovare alle prestazioni cliniche delle terapie con cellule staminali.
La dielettroforesi (DEP), un metodo di caratterizzazione cellulare che non utilizza etichette superficiali, è al centro di questo lavoro attuale. DEP è un metodo label-free o non colorante implementato su piattaforme microfluidiche per caratterizzare popolazioni eterogenee di cellule in base alle loro proprietà elettriche. DEP utilizza un campo elettrico a corrente alternata (CA) in sostituzione della colorazione a fluorescenza (cioè un metodo basato su etichette)7. Gli altri vantaggi dell'utilizzo di dispositivi microfluidici basati su DEP per la caratterizzazione delle celle includono l'uso di piccoli volumi (microlitri), tempi di analisi rapidi, requisiti minimi di preparazione del campione di celle, rischio minimo di contaminazione del campione, produzione minima di rifiuti e basso costo12,13. Un altro vantaggio del DEP è il monitoraggio in tempo reale delle celle14,15,16. Per DEP, le celle in sospensione sono esposte a un campo elettrico AC non uniforme creato con elettrodi e diventano polarizzate6. Questa polarizzazione provoca il movimento delle celle e consente la manipolazione delle celle in base alla frequenza e alla tensione del campo elettrico CA applicato. Regolando la frequenza, tipicamente tra 5 kHz e 20 MHz, le celle possono essere attratte o respinte lontano dagli elettrodi, corrispondenti rispettivamente al comportamento DEP positivo e negativo,6.
Esistono molteplici modalità di caratterizzazione DEP, vale a dire, tradizionale, frazionamento del flusso di campo e indotto dalla luce, come classificato dalla loro configurazione dell'elettrodo e / o strategia operativa17. L'analizzatore 3DEP, una modalità tradizionale di DEP, incorpora elettrodi metallici fisici e monitora la risposta cellulare a un campo elettrico CA. Questo sistema utilizza un chip costituito da micropozzetti con più elettrodi circolari tridimensionali e rileva i cambiamenti nelle intensità luminose per caratterizzare il comportamento DEP delle celle 18,19,20,21. Il DEP positivo viene osservato mentre le cellule si muovono verso i bordi degli elettrodi circolari lungo le pareti del micropozzetto, con conseguente aumento dell'intensità luminosa al centro del micropozzetto. Il DEP negativo si osserva quando le cellule si raggruppano al centro del micropozzetto lontano dagli elettrodi circolari, con conseguente diminuzione dell'intensità luminosa al centro del micropozzetto. Questi due fenomeni sono rappresentati nella Figura 1. I metodi DEP tradizionali hanno la capacità di caratterizzare le proprietà elettriche di popolazioni cellulari eterogenee 18,20,21. Ad esempio, Mulhall et al. hanno dimostrato il potenziale per distinguere tra cheratinociti orali normali (HOK) e linee cellulari di cheratinociti orali maligni (H357) sulla base delle differenze nella capacità di membrana21 utilizzando l'analizzatore 3DEP. Tuttavia, una limitazione delle modalità tradizionali di DEP è la geometria dell'elettrodo fisso. Poiché le hMSC sono eterogenee, è vantaggioso avere la possibilità di modificare facilmente le geometrie degli elettrodi durante le valutazioni DEP. Ad esempio, essere in grado di modificare gli elettrodi o gli array di elettrodi in tempo reale per l'intrappolamento a cella singola consente di caratterizzare le celle in base alla velocità e al comportamento DEP. L'applicazione della modifica degli elettrodi in tempo reale nelle valutazioni DEP delle hMSC consente l'analisi a singola cellula delle hMSC subito dopo averle prelevate dal tessuto campione per caratterizzare l'eterogeneità della popolazione campione.
Per superare la limitazione delle modalità tradizionali di DEP (cioè elettrodi fisici fissi) ed esplorare nuove opportunità per modifiche della configurazione degli elettrodi in tempo reale utilizzando il fenomeno DEP, è stato esplorato il DEP indotto dalla luce (LiDEP). LiDEP è una modalità non tradizionale di DEP che manipola le cellule utilizzando un dispositivo microfluidico fotoconduttivo22,23 tramite proiezioni luminose, elettrodi localizzati creano un campo elettrico non uniforme, simile al metodo DEP tradizionale. Questo approccio consente anche flessibilità nella geometria dell'elettrodo e per spostare gli elettrodi all'interno del dispositivo microfluidico. Ciò attenua la limitazione osservata con gli elettrodi fissi e offre l'opportunità di ottenere maggiori informazioni sull'eterogeneità cellulare. LiDEP è stato utilizzato per rilevare e analizzare diversi tipi di cellule in popolazioni omogenee ed eterogenee di cellule22,23,24. Ad esempio, Liao et al. hanno utilizzato LiDEP per separare le cellule tumorali circolanti (CTC) che esprimono il modulo di adesione delle cellule epiteliali (EpCAMneg) dai globuli rossi per esplorare il loro significato nelle metastasi tumorali22. L'analisi di singole cellule con LiDEP è stata utilizzata con successo per caratterizzare e manipolare le cellule tumorali con la stratificazione della tumorigenicità pancreatica23 e l'analisi delle CTC in campioni pre e post-metastasi24.
Qui, descriviamo come LiDEP può essere utilizzato per manipolare hMSC con una varietà di geometrie di elettrodi (cerchio, diamante, stella e linee parallele) e impostazioni di sistema (tensione applicata, intensità luminosa e materiale del dispositivo microfluidico), offrendo così un approccio per caratterizzare il comportamento delle cellule staminali derivate dall'uomo con elettrodi virtuali.
Protocollo
1. Fabbricazione di dispositivi microfluidici LiDEP
NOTA: Il processo di fabbricazione consiste nel combinare tre componenti stratificati: (i) uno strato fotoconduttivo con silicio amorfo (A: Si) e molibdeno depositato su un substrato di vetro di ossido di indio-stagno (ITO); ii) uno strato di microcanali ritagliato da nastro biadesivo; e (iii) un substrato superiore in vetro ITO con fori praticati per l'ingresso e l'uscita della sospensione cellulare.
- Rivestimento in vetro di ossido di indio-stagno (ITO) fotoconduttivo
- Pulire il substrato di vetro rivestito con ITO (resistenza al 15-20 Ω) facendo scorrere il gas di azoto (N2) sulla superficie a una portata sufficiente a spostare le particelle di polvere visibili. Dopo questo passaggio, sciacquare il substrato con acetone.
- Trasferire il vetrino rivestito di ITO in un bagno di alcool isopropilico per lavare via il residuo di acetone, risciacquare con acqua DI e far scorrere nuovamente il gas N2 fino a quando il substrato è completamente asciutto.
- Posizionare il vetrino con il lato rivestito ITO verso l'alto nel sistema di sputtering sottovuoto.
- Sputter uno strato di molibdeno spesso 10 nm sul substrato di vetro rivestito di ITO (bersaglio di molibdeno) con una velocità di deposizione di 0,7 Å/s e un tempo di deposizione di 140 s.
- Aggiungere una maschera ombra su un lato del substrato di vetro per lasciare 2 mm dal bordo del substrato di vetro scoperto per i collegamenti elettrici. Depositare 1 μm di A:Si utilizzando la deposizione chimica da vapore potenziata al plasma accoppiato induttivamente (ICP-PECVD), come descritto in Medjdoub et al.25.
- Pulire il vetrino con gas N2 per rimuovere polvere e altre impurità. Per qualsiasi A:Si depositato sotto la maschera d'ombra, immergere il bordo fino al segno di 2 mm in una soluzione di idrossido di potassio al 25% p/v per incidere l'A:Si.
- Fabbricazione di dispositivi chip LiDEP
- Per formare il microcanale, ottenere nastro biadesivo (52 mm x 25 mm) e fori di punzonatura (diametro = 4 mm) a 5-6 mm di distanza dal bordo della dimensione più corta e centrati tra i lati più lunghi del nastro. Usa un bisturi per tagliare due linee rette (a 3 mm di distanza) attraverso i fori. Assicurarsi che i fogli protettivi su entrambe le facce del nastro biadesivo siano indossati durante l'intera fase di taglio a microcanali.
- Praticare due fori di 3 mm di diametro nella vetrata superiore ITO. Il nastro può essere allineato sopra il vetro rivestito ITO, con il bordo lungo del nastro allineato con il bordo lungo del vetro. Contrassegnare la posizione del foro con un pennarello lavabile. Assicurarsi che i fori praticati siano allineati con i fori perforati nel nastro biadesivo. Questi due fori fungeranno da fori di ingresso e uscita del dispositivo microfluidico.
- Rimuovere un lato della pellicola protettiva sul nastro biadesivo, allineare i fori nel nastro e nella vetrina superiore ITO e premerli insieme. Premere delicatamente per rimuovere le sacche d'aria, specialmente vicino al microcanale. Le sacche d'aria possono consentire al mezzo o ad altre soluzioni di filtrare sotto il nastro, il che può danneggiare o causare muffa nel dispositivo microfluidico.
- Rimuovere l'altra pellicola protettiva dal nastro biadesivo e premere sul lato in vetro ITO rivestito di molibdeno e A:Si. Abbinare il bordo della slitta fotoconduttiva opposto al lato di gioco di 2 mm rispetto al bordo del nastro biadesivo che si trova verso il centro della slitta in vetro ITO superiore. Ci saranno postumi di una sbornia dallo scivolo in vetro ITO superiore e dallo scivolo in vetro ITO rivestito in materiale fotoconduttivo.
- Premere su una superficie piana per garantire una buona adesione. Uno schema del substrato di vetro e degli strati di nastro biadesivo è illustrato nella Figura 1A. Tagliare il nastro in eccesso sul lato.
- Applicare del nastro di rame ai bordi del livello A e del livello C per collegare il generatore di funzioni. A tale scopo, avvolgere il nastro sul lato dell'ITO o del materiale fotoconduttivo, a seconda che si tratti dello strato A o dello strato C, dal bordo del nastro biadesivo a circa 3 cm sul lato non rivestito del substrato di vetro.
- Per garantire la corretta fabbricazione del dispositivo, utilizzare un multimetro per verificare una lettura della resistenza tra le guide rivestite di entrambi i substrati di vetro e il nastro di rame collegato al vetro.
- Preparazione del buffer DEP
- Misurare 4,25 g di saccarosio e metterlo in un tubo conico da 50 ml. Quindi, misurare 0,15 g di glucosio e metterlo nello stesso tubo conico da 50 ml.
- Riempire il tubo conico con 25 ml di acqua ultrapura, chiudere il coperchio e mescolare. Una volta che circa la metà del saccarosio e del glucosio si sono sciolti, riempire il tubo conico con acqua ultrapura fino alla linea di 50 ml. Mescolare energicamente fino a quando tutto il saccarosio e il glucosio sono sciolti. La soluzione tampone DEP contiene l'8,5% (p/v) di saccarosio e lo 0,3% (p/v) di glucosio.
- Ottenere 20 ml della soluzione di saccarosio e glucosio preparata e metterla in un tubo conico da 50 ml. Quindi, misurare 0,1 g di albumina sierica bovina (BSA) e inserirla nel tubo conico da 50 ml contenente la soluzione di saccarosio e glucosio. Vortice fino allo scioglimento della BSA. La soluzione tampone DEP finale contiene lo 0,5% (p/v) di BSA.
- Preparazione cellulare
- Ottenere almeno 1 x 106 cellule (hMSCs o HEK 293) sospese in 1 mL di terreno di coltura utilizzando il protocollo di coltura cellulare descritto negli studi precedenti26,27. Introdurre la sospensione cellulare in una provetta da centrifuga da 10 ml.
- Centrifugare le celle HEK 293 a 201 x g per 5 minuti e le hMSC a 290 x g per 10 minuti. Dopo la centrifugazione, aspirare il surnatante e risospendere le cellule in 1 mL della soluzione tampone DEP con BSA allo 0,5%. Assicurarsi di non aggiungere la soluzione tampone troppo velocemente perché potrebbero formarsi bolle.
- Ripetere il processo di centrifugazione altre due volte, quindi risospendere le celle nel tampone DEP con BSA allo 0,5% per la caratterizzazione LiDEP. Il protocollo di preparazione delle celle elencato è sufficiente per 10 esecuzioni. Ad esempio, un test di frequenza richiede almeno 15 esecuzioni e, quindi, devono essere effettuati 2 ml di cellule a una concentrazione di 1 x 106 cellule / ml.
2. Caratterizzazione LiDEP
- Configurazione sperimentale
- Assemblare le seguenti apparecchiature per la configurazione sperimentale per quantificare le risposte cellulari a LiDEP: un laptop, un proiettore, una lente obiettiva, un microscopio digitale e un generatore di funzioni. Utilizzare il portatile per progettare le proiezioni luminose (stella, diamante, tre linee e ovale) e collegarlo al proiettore.
- Utilizzare il proiettore come sorgente luminosa per visualizzare le proiezioni luminose sulla superficie fotoconduttiva (strato C) del chip LiDEP. Impostarlo in modo che la luce proveniente dalla sorgente luminosa (proiettore) viaggi attraverso una lente obiettivo 10x sulla regione microcanale del chip LiDEP. L'obiettivo 10x si trova sulla parte superiore dell'obiettivo del proiettore. La figura supplementare 1 mostra l'integrazione del proiettore nel sistema LiDEP.
- Collegare il chip LiDEP al generatore di funzioni per applicare il campo elettrico CA. Osservare le cellule che sperimentano la forza LiDEP utilizzando il microscopio digitale per l'imaging e la registrazione video. La figura 1B mostra uno schema dell'apparato sperimentale. Seguire i protocolli standard di coltura cellulare26,27 per tutte le cellule testate.
- Procedure sperimentali
- Lavare il microcanale con etanolo al 70%, seguito da una soluzione BSA allo 0,5%. Lavare nuovamente il microcanale con una soluzione di BSA allo 0,5% altre due volte per assicurarsi che l'etanolo e le cellule precedenti siano completamente lavati via. Le celle che sono già state esposte al campo DEP risponderanno in modo diverso rispetto alle celle nuove e potrebbero interrompere la raccolta dei dati.
- Rimuovere la soluzione di BSA allo 0,5% con una pipetta e inserire il dispositivo microfluidico nel supporto del dispositivo.
- Attaccare clip a coccodrillo a ciascuna delle connessioni del nastro di rame sul dispositivo. Impostare il generatore di funzioni sulla tensione desiderata (tensione picco-picco, Vpp) e frequenza (Hz). La gamma di frequenza testata qui era da 30 kHz a 20 MHz.
- Aggiungere 70 μL di sospensione cellulare (celle + soluzione tampone DEP con BSA allo 0,5%) nel microcanale del dispositivo. A causa della sottigliezza del microcanale (~ 0,05 mm), può verificarsi fuoriuscita dai fori di ingresso e uscita. Per ridurre la quantità di fuoriuscita, utilizzare una punta per pipetta più piccola e inclinare leggermente la punta nel foro verso il microcanale. Qualsiasi soluzione di accesso (0,5% BSA o celle in soluzione) può essere spazzata via con salviette di carta monouso e gettata nei rifiuti a rischio biologico.
- Proietta la geometria dell'elettrodo virtuale desiderata (qui, cerchi, diamanti, stelle e / o linee parallele) sul chip LiDEP.
- Nel software del microscopio digitale, impostare la durata del video su 3 minuti. Impostare un timer di laboratorio su 2 min 30 s. Una volta che le cellule sono ferme nel microcanale del chip LiDEP, premere Start nel software del microscopio digitale per iniziare il processo di registrazione video.
- Attendere 10 secondi, quindi premere il pulsante ON dell'uscita del canale del generatore di funzioni per applicare il campo elettrico CA e premere Start per il timer. Monitorare il comportamento DEP della cella attraverso il microscopio digitale e prevenire scuotimenti o movimenti intorno alla configurazione.
- Una volta spento il timer, premere il pulsante ON dell'uscita del canale del generatore di funzioni. Ciò disattiva l'uscita del canale del generatore di funzioni e il campo elettrico CA non viene più alimentato attraverso gli elettrodi. Interrompere la registrazione video a 3 minuti e salvarla al microscopio digitale per analisi future.
- Pipettare le celle fuori dall'estremità di uscita del chip LiDEP spingendo lentamente 60 μL di tampone DEP con BSA allo 0,5% nel microcanale e raccogliendo contemporaneamente all'uscita. Continuare fino a quando ci sono poche o nessuna cellula nel microcanale.
- Ripetere i passaggi 2.2.3-2.2.9 fino a quando tutte le frequenze sono state testate.
Risultati
I test di tensione e colore dell'elettrodo sono stati completati utilizzando la procedura di cui sopra con una leggera variazione nel punto 2.2.3 e nel passaggio 2.2.10. Per il test di tensione, il colore e la frequenza dell'elettrodo sono rimasti costanti e sono stati applicati 5 V pp, 10 V pp e 20 Vpp. Per il test del colore dell'elettrodo, la tensione e la frequenza applicate sono state mantenute costanti a 30 kHz e 20 Vpp, e sono stati esaminati gli elettrodi proiettati blu, rosso, bianco e giallo (a cui fanno riferimento i codici colore HEX #4472C4, #FF0000, #FFFFFF e #FFFF00, rispettivamente). La vitalità cellulare è stata esaminata colorando le cellule con tripano blu e contando il numero di cellule vive e morte utilizzando un emocitometro.
Con la configurazione LiDEP, siamo stati in grado di manipolare le hMSC e generare curve di risposta DEP in risposta alla frequenza di ingresso, che è un modo per caratterizzare il comportamento elettrico delle celle. Sono stati condotti una serie di esperimenti per trovare le condizioni operative ottimali manipolando parametri come la tensione applicata e il colore dell'elettrodo proiettato (cioè forme con colori distinti creati con un software di editor grafico) per osservare il comportamento coerente della cella al campo elettrico CA non uniforme generato con gli elettrodi virtuali. I dati raccolti per le risposte cellulari utilizzando LiDEP, DEP non tradizionale, sono stati confrontati con i risultati dell'analizzatore 3DEP, DEP tradizionale.
Il primo test di ottimizzazione si è concentrato sulla risposta DEP positiva delle hMSC (cioè le celle che si muovono verso l'elettrodo virtuale) nel chip LiDEP. Le cellule che non mostravano una risposta DEP positiva mostravano una risposta DEP negativa allontanandosi dall'elettrodo virtuale, erano ferme e rotanti, o non rispondevano al campo elettrico. La risposta delle cellule è stata quantificata monitorando le loro velocità (μm/s) in ImageJ durante un periodo di 2 min 30 s. Per l'elettrodo virtuale è stata utilizzata una proiezione ovale gialla e le tensioni applicate di 5 V pp, 10 V pp e 20 Vpp sono state esaminate a una frequenza impostata di 30 kHz. Ci siamo concentrati su celle che si trovavano entro 50 μm dall'elettrodo virtuale mentre il campo elettrico CA era attivo per coerenza e per ridurre al minimo i valori anomali. Il 20 V pp ha portato al movimento cellulare più veloce delle celle HEK 293, con una velocità media di 0,035 μm / s, e questo è stato seguito da 0,032 μm / s a 10 V pp e 0,020 μm / s a 5 Vpp, il che significa che queste cellule rappresentano un controllo relativamente omogeneo. Una tendenza simile è stata osservata per le hMSC, che avevano una velocità media di 0,051 μm/s a 20 V pp, 0,036 μm/s a 10 V pp e 0,025 μm/s a 5 Vpp, come nella Figura 2A (qui, * indica p < 0,05). A 20 Vpp, è stato osservato che le hMSC hanno sperimentato contemporaneamente DEP positivo e negativo. Ciò non è stato osservato a 10 V pp e 5 V pp. I risultati di vitalità delle hMSC dopo aver sperimentato la forza DEP hanno mostrato che tensioni più elevate hanno generalmente portato a una minore vitalità cellulare, con il 66% delle cellule vitali a 5 V pp, il 58% delle cellule vitali a 10 V pp e il 57% delle cellule vitali a 20 V pp, come nella Figura 2B (qui, ** indica p < 0,01).
Poiché LiDEP è un sistema basato sull'ottica, l'intensità della luce e il colore dell'elettrodo sono parametri che possono essere facilmente regolati per controllare le prestazioni del chip LiDEP. Qui, sono stati valutati diversi colori di elettrodi (bianco, giallo, rosso e blu) generati in base alla forma proiettata per determinare l'effetto sulle risposte DEP delle cellule. Le celle HEK 293 e le hMSC sono state valutate a 20 Vpp e 30 kHz. Sono stati scelti elettrodi di colore bianco, giallo, rosso e blu, ma l'illuminazione attraverso il chip LiDEP è stata influenzata dallo strato fotoconduttivo, che aveva un colore rosso-arancio. Pertanto, l'elettrodo bianco proiettato appariva giallo con un interno bianco, l'elettrodo rosso appariva arancione con un contorno rosso e l'elettrodo blu appariva verde chiaro (Figura 3A-D). Le potenze erogate per questi quattro colori erano le seguenti: 77,7 μW ± 0,7 μW, 92,7 μW ± 1,3 μW, 21,9 μW ± 0,2 μW e 56,7 μW ± 0,9 μW per bianco, giallo, rosso e blu, rispettivamente. Ciò suggerisce fortemente che il giallo e il bianco avevano il campo DEP più forte, mentre il blu e il rosso erano più deboli, come nella Figura 3E (qui, *** indica p < 0,001 per le celle HEK 293 e ** indica p < 0,01 per le hMSC). È stata osservata anche la rotazione stazionaria delle celle sui bordi degli elettrodi virtuali gialli e bianchi durante l'applicazione della forza DEP. Per tutte le variazioni di colore dell'elettrodo, si sono verificate risposte DEP negative e positive simultanee, correlate a quanto mostrato a 20 Vpp per il test di tensione. Inoltre, mentre la velocità delle celle variava in base al colore dell'elettrodo, quasi tutte le celle all'interno del limite di 50 μm rispondevano al LiDEP. La dimensione delle hMSC è stata misurata come 19,2 μm ± 5,8 μm.
Per valutare la capacità di LiDEP rispetto al DEP con elettrodi convenzionali, abbiamo valutato le differenze tra il comportamento DEP delle cellule che utilizzano LiDEP e quello delle celle analizzate dall'analizzatore 3DEP. La risposta DEP delle hMSC è stata misurata in una soluzione tampone DEP a bassa conduttività con BSA allo 0,5% (~100 μS/cm). Per imitare l'analizzatore 3DEP, è stato proiettato un singolo elettrodo virtuale ovale giallo a 10 Vpp. Il comportamento DEP delle hMSC è stato caratterizzato da 30 kHz a 20 MHz. A frequenze inferiori a 25 kHz, abbiamo osservato l'elettrolisi, che ha provocato la generazione di bolle sulla superficie dello strato metallico all'interno del dispositivo microfluidico. Per LiDEP, a frequenze più basse, le hMSC hanno sperimentato una forza DEP positiva, come nella Figura 4A, rappresentata come la percentuale di celle attratte dall'elettrodo virtuale. Le cellule hanno iniziato con una forte forza DEP positiva, che si è indebolita all'aumentare della frequenza. Le celle hanno sperimentato la più forte forza DEP positiva da 30 kHz a 97 kHz. Dopo aver applicato il campo elettrico AC a queste frequenze, alcune cellule non rispondevano, mentre altre cellule mostravano un comportamento DEP negativo. Questa tendenza si discosta dalla risposta osservata quantificata utilizzando l'analizzatore 3DEP; le celle sono aumentate in DEP positivo da 37 kHz a 255 kHz e diminuito in DEP positivo da 1.772 kHz a 20 MHz, come nella Figura 4B.
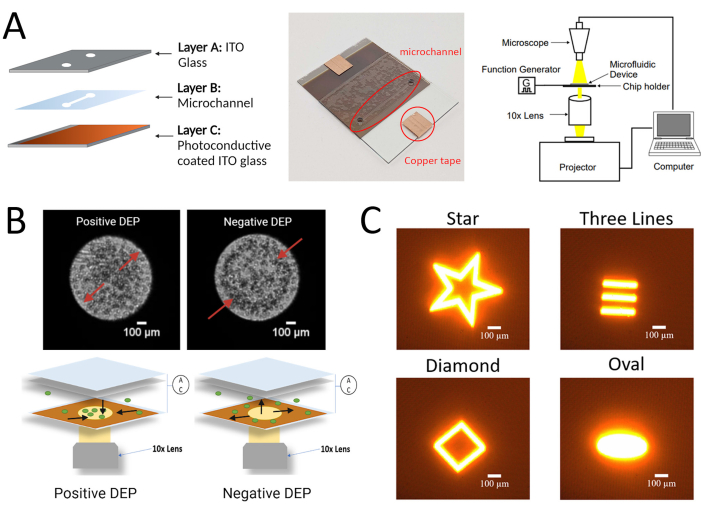
Figura 1: Configurazione sperimentale per il protocollo LiDEP qui descritto per hMSCs. (A) Immagine schematica e reale del chip LiDEP con lo strato fotoconduttivo e il set-up sperimentale. (B) Immagini rappresentative delle risposte DEP positive e negative delle cellule nell'analizzatore 3DEP (utilizzando elettrodi DEP convenzionali, in alto) e rappresentazione schematica delle risposte DEP positive e negative delle cellule utilizzando LiDEP (utilizzando proiezioni luminose come elettrodi virtuali, in basso). (C) Esempi di forme diverse che possono essere proiettate sul dispositivo come elettrodi virtuali. Figura creata con BioRender.com. Fare clic qui per visualizzare una versione ingrandita di questa figura.
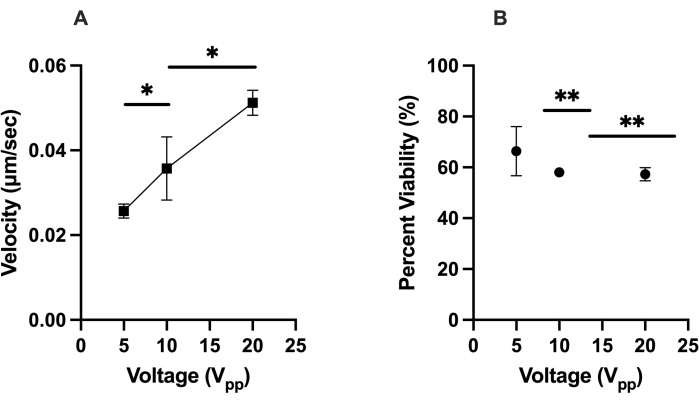
Figura 2: Caratterizzazione delle risposte DEP (velocità) delle hMSC e loro vitalità nelle condizioni date. (A) Le velocità misurate delle risposte DEP positive delle hMSC a 5 V pp, 10 V pp e 20 V pp. Le hMSC si muovevano a 0,051 μm/s a 20 V pp, 0,036 μm/s a 10 V pp e 0,025 μm/s a 5 Vpp. (B) La vitalità delle hMSC dopo aver sperimentato la forza DEP positiva generata con elettrodi virtuali. La redditività era del 57%, 58% e 66% rispettivamente per 20 V pp, 10 V pp e 5 Vpp. Le barre di errore rappresentano la deviazione standard (SD). Analisi statistica completata su set di dati aggregati utilizzando t-test (*p < 0,05 e **p < 0,01). Fare clic qui per visualizzare una versione ingrandita di questa figura.
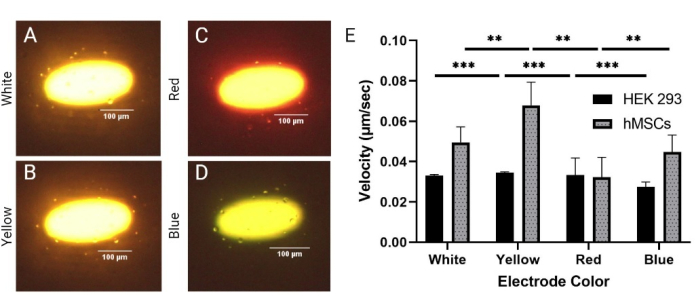
Figura 3: Confronto delle risposte DEP tra linee cellulari omogenee (HEK 293) ed eterogenee (hMSCs). Risposta DEP positiva delle celle hMSCs agli elettrodi (A) bianchi, (B) gialli, (C) rossi e (D) blu a 20 Vpp e 30 kHz. (E) Risposte di velocità delle celle HEK 293 e hMSC ai diversi elettrodi colorati. Le celle HEK 293 hanno mostrato le velocità più elevate con gli elettrodi gialli e rossi rispettivamente a 0,035 μm/s e 0,033 μm/s. Le celle HEK 293 hanno mostrato la velocità più bassa con gli elettrodi blu a 0,027 μm / s. Le hMSC hanno mostrato le velocità più elevate con gli elettrodi gialli e bianchi rispettivamente a 0,068 μm/s e 0,049 μm/s. Le hMSC hanno sperimentato la velocità più bassa con gli elettrodi rossi a 0,039 μm / s. Le barre di errore rappresentano la SD. Analisi statistica completata su set di dati aggregati utilizzando test t (*p < 0,05, **p < 0,01 e ***p < 0,001). Fare clic qui per visualizzare una versione ingrandita di questa figura.
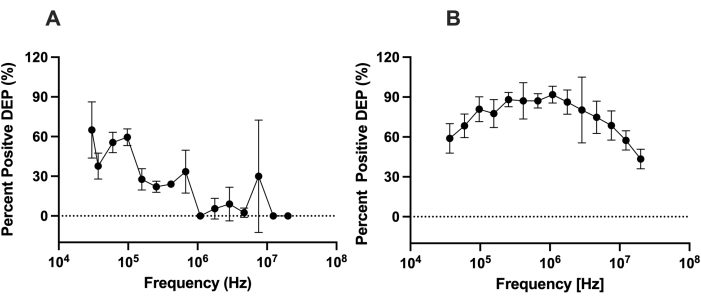
Figura 4: Confronto delle risposte DEP delle hMSC utilizzando LiDEP e 3DEP. Le risposte DEP delle hMSC misurate con (A) LiDEP e (B) l'analizzatore 3DEP a 10 Vpp. Con LiDEP, c'è stato un decadimento nella risposta DEP positiva delle hMSC da 30 kHz a 20 MHz. Dall'analizzatore 3DEP, le celle sono aumentate in DEP positivo da 37 kHz a 255 kHz e diminuite in DEP positivo da 1.772 kHz a 20 MHz. Le barre di errore rappresentano la SD. Fare clic qui per visualizzare una versione ingrandita di questa figura.
Figura supplementare 1: Immagini rappresentative della configurazione LiDEP utilizzata per gli esperimenti in questo protocollo. Immagine ingrandita del sistema LiDEP che mostra l'integrazione del proiettore. La luce viaggia dalla sorgente (proiettore) attraverso una lente obiettivo 10x sul microcanale del chip LiDEP. L'obiettivo 10x si trova sopra l'obiettivo del proiettore. Ogni componente è numerato nelle immagini ed elencato a lato. Clicca qui per scaricare questo file.
Video supplementare 1: Video rappresentativo di hMSC che rispondono agli elettrodi virtuali bianchi, gialli, rossi e blu. Le cellule sono visualizzate come sperimentando DEP positivo (che si muove verso l'elettrodo virtuale), sperimentando DEP negativo (allontanandosi dall'elettrodo virtuale), stazionario e rotante, o non risponde al campo elettrico. Le hMSC sono state testate a 37 kHz e 20 Vpp, e il video è stato accelerato di 20x. Clicca qui per scaricare questo file.
Discussione
Esaminare l'eterogeneità delle hMSC è importante per il loro progresso terapeutico. Questo lavoro fornisce un primo passo per l'utilizzo di LiDEP come strumento analitico per la valutazione delle hMSC. Abbiamo esaminato la dipendenza dalla tensione della risposta DEP positiva delle celle in LiDEP quantificando la velocità. Ci si aspetta che tensioni più elevate producano una forza DEP positiva più forte, e abbiamo osservato questo modello con le velocità misurate. Le tensioni di 10 V pp e 20 Vpp erano sufficienti per la manipolazione di hMSC utilizzando LiDEP. Tensioni più basse (cioè 5 Vpp) hanno comportato risposte più lente delle celle; sebbene non ottimale per le hMSC, questo potrebbe essere vantaggioso per altri tipi di cellule. C'è stata una diminuzione dipendente dalla tensione della vitalità delle hMSC di circa il 9%. Ciò differisce leggermente dalla precedente letteratura 6,12,28,29, in cui l'uso di DEP e LiDEP tradizionali nell'esame delle cellule biologiche non ha diminuito la vitalità cellulare. Tuttavia, l'obiettivo sperimentale in ogni studio variava. Glasser e Fuhr hanno monitorato la crescita di fibroblasti di topo aderenti L929 su elettrodi metallici in terreno di coltura cellulare28. Al contrario, Lu et al. hanno esaminato la vitalità delle cellule staminali neurali esposte a campi elettrici AC per diversi periodi di tempo12. Adams et al. hanno caratterizzato le proprietà dielettriche delle hMSC con elettrodi metallici12, e Li et al. hanno manipolato le cellule leucemiche con LiDEP29. La differenza tra questi studi e i nostri è stato l'uso di BSA, che potrebbe essere la causa della diminuzione della redditività che abbiamo osservato. Tuttavia, la minore vitalità complessiva può anche essere dovuta al tempo di esposizione (2 min 30 s) utilizzato nel protocollo qui stabilito. Questo tempo è stato scelto per fornire abbastanza tempo per visualizzare la manipolazione cellulare durante l'esposizione al campo elettrico CA non uniforme.
I metodi di caratterizzazione delle celle sono stati testati tramite il colore dell'elettrodo per determinare le capacità e i limiti del nostro sistema LiDEP costruito come descritto nel protocollo. In questo protocollo specifico, il colore dell'elettrodo può essere controllato in base al colore della forma proiettata attraverso un file di editor grafico. Abbiamo usato quattro colori: bianco, giallo, rosso e blu. Dalle letture di potenza per ciascun colore, gli elettrodi proiettati gialli (#FFFF00) e bianchi (#FFFFFF) sono stati misurati per avere intensità più elevate, che è stata la base del motivo per cui questi colori erano più favorevoli all'uso negli esperimenti successivi. Inoltre, a causa della dipendenza stabilita dall'intensità luminosa dei materiali fotoconduttivi30,31, i risultati suggeriscono che le prestazioni dei dispositivi LiDEP si basano su A:Si fotoconduttivo e possono essere regolate dalla scelta del colore dell'elettrodo proiettato. Una combinazione di risposte DEP positive e negative di hMSC è stata osservata anche utilizzando LiDEP, che è simile al fenomeno osservato nei metodi DEP tradizionali. Con ogni colore dell'elettrodo, le hMSC hanno sperimentato una forza DEP negativa, una forza DEP positiva e una rotazione cellulare, indicando che il campione di cella era eterogeneo a una singola frequenza (Video supplementare 1). Ciò concorda con i risultati di Adams et al.6 che le hMSC mostrano un comportamento DEP sia negativo che positivo a una singola frequenza. Queste condizioni (colore dell'elettrodo, forma dell'elettrodo e materiale fotoconduttivo) possono fornire parametri aggiuntivi per rilevare il livello di eterogeneità nei campioni hMSC.
Infine, i risultati della valutazione LiDEP sono stati confrontati con i risultati dell'analizzatore 3DEP come punto di riferimento del comportamento di hMSC DEP. È stata osservata una differenza nell'intervallo di frequenza della risposta DEP positiva delle hMSC, ma le tendenze nei dati raccolti tramite LiDEP e l'analizzatore 3DEP erano complessivamente simili (cioè, la risposta DEP positiva diminuiva con l'aumentare della frequenza). Quando il campo elettrico CA è stato fornito al chip LiDEP e la luce è stata proiettata su di esso, la conduttanza nell'area all'interno della proiezione luminosa è diminuita, creando un campo elettrico non uniforme. Pertanto, le caratteristiche della sorgente luminosa (cioè intensità e lunghezza d'onda) influenzano la risposta attesa delle celle all'interno del chip LiDEP, come si vede dai risultati dei test di variazione della tensione e del colore dell'elettrodo. Altri parametri che possono essere modificati sono il materiale dello strato fotoconduttivo e la conduttività della soluzione tampone DEP. Pertanto, le condizioni utilizzate per valutare il comportamento DEP delle celle devono essere valutate in base alla configurazione del sistema LiDEP. Al contrario, per l'analizzatore 3DEP, o altri metodi che utilizzano elettrodi metallici per applicare la forza DEP, le caratteristiche dell'elettrodo sono costanti e non possono essere modificate istantaneamente per adattarsi a ciò che è necessario per le celle in esame. Questa variazione del comportamento positivo del DEP potrebbe essere utile per la ricerca futura sulla caratterizzazione di diversi tipi di cellule all'interno di campioni hMSC, analisi a singola cellula o ordinamento cellulare. Inoltre, man mano che le celle si allontanano dagli elettrodi virtuali, il campo elettrico CA diventa più debole. Tuttavia, con l'analizzatore 3DEP o altre modalità DEP tradizionali che utilizzano elettrodi metallici, è possibile applicare una regione di campo elettrico più ampia, che consente di manipolare più celle. Pertanto, un minor numero di celle per esperimento LiDEP ha sperimentato gli effetti del campo elettrico AC all'interno del microcanale del chip LiDEP. Ulteriori discrepanze possono essere causate da cambiamenti nelle prestazioni del dispositivo nel tempo (ad esempio, 2 ore o 3 ore), che è ancora in fase di indagine. Il flusso costante di acqua, etanolo e soluzione tampone DEP potrebbe abbattere la superficie dello strato di microcanali (cioè il materiale fotoconduttivo) e deve essere considerato. Le prestazioni del dispositivo nel tempo per la caratterizzazione delle celle devono essere considerate anche per l'uso esteso di un chip LiDEP. Le modifiche ai parametri sperimentali in tempo reale hanno richiesto solo pochi secondi o minuti. Il colore e le geometrie degli elettrodi sono stati regolati istantaneamente utilizzando le impostazioni all'interno del software di editor grafico.
In sintesi, questo articolo dimostra le capacità di LiDEP di manipolare e caratterizzare una linea cellulare con popolazioni cellulari eterogenee come le hMSC. Utilizzando questa configurazione e il protocollo descritto, siamo stati in grado di ottenere la caratterizzazione di successo delle hMSC nelle condizioni di 20 Vpp e degli elettrodi gialli virtuali proiettati. Gli studi futuri dovrebbero concentrarsi sulla regolazione del tempo di esposizione delle hMSC al campo elettrico CA creato tramite LiDEP, aumentando l'intensità luminosa degli elettrodi virtuali e valutando diverse fonti di hMSC (o altre popolazioni di cellule staminali) per sviluppare un catalogo LiDEP delle firme elettriche di popolazioni eterogenee di cellule staminali.
Divulgazioni
Gli autori non segnalano conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Science Foundation CAREER award (2048221) tramite CBET. Vorremmo ringraziare Mo Kebaili dell'Integrated Nanosystems Research Facility (INRF) dell'UCI. Inoltre, vorremmo ringraziare il Dr. Devin Keck per l'assistenza nello sviluppo del sistema LiDEP.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.05% Trypsin-EDTA | Gibco | 25300054 | |
| 10x objective | AmScope | --- | |
| Amorphous silicon (A:Si) | Millipore Sigma | S5130 | |
| Antibiotic-Antimycotic (100X) | Gibco | 15240-062 | |
| Bovine Serum Albumin (BSA) | Fisher | BP9706-100 | |
| Copper Tape | Zehhe | BF4964 | |
| Dextrose (glucose) | Fisher | D16-1 | |
| Digital microscope | Keyence | VHX-7000 | |
| Double Sided Tape | Insulectro | FLX000484 | |
| Dulbecco's Phosphate-Buffered Saline (DPBS) | Gibco | 14190-144 | |
| Fetel Bovine Serum (FBS) | Corning | 35-011-CV | |
| Function Generator | Tektronix | AFG 31102 | |
| Graphic editor software | Microsoft Office Powerpoint | --- | |
| Indium tin oxidec coated glass slides | MSE Supplied | GL0333 | |
| L-Alanyl-L-Glutamine | ATCC | PCS-999-034 | |
| Laptop | Dell | Inspiron 14, 2-in-1 | |
| Mesenchymal Stem Cell Basal Medium | ATCC | PCS-500-030 | |
| Mesenchymal Stem Cell Growth Kit for Umbilical and Adipose Cord-Derived MSCs | ATCC | PCS-500-040 | |
| Minimum Essential Mediaum Alpha (MEM a, 1X) | Giblo | A10490-01 | |
| Molybdenum, 99.95% | Kurt J. Lesker | EJTMOXX352A4 | Sputtering target |
| Phenol Red | Sigma | P5530 | |
| Power Meter | Thor Labs | S130VC/PM400 | |
| Projector | Vecupoi | --- | |
| Roswell Park Memorial Institute (RPMI) 1640 Media | Gibco | 11875-093 | This media has L-Glutamine and Phenol Red. |
| Sucrose | Fisher | BP220-1 | |
| Trypan Blue Stain | Gibco | 15250-061 | 0.40% |
| Trypsin Neutralizer | Gibco | R002100 | |
| Vacuum Sputtering System | Denton | DV-502M |
Riferimenti
- Mahla, S. R. Stem cells applications in regenerative medicine and disease therapeutics. International Journal of Cell Biology. 2016, (2016).
- Bhansali, A. Efficacy of autologous bone marrow-derived stem cell transplantation in patients with type 2 diabetes mellitus. Stem Cells and Development. 18 (10), 1407-1416 (2009).
- Bouchlaka, M. N. Human mesenchymal stem cell-educated macrophages are a distinct high IL-6-producing subset that confer protection in graft-versus-host-disease and radiation injury models. Biology of Blood and Marrow Transplantation. 23 (6), 897-905 (2017).
- Alfaifi, M., Eom, Y. W., Newsome, P. N., Baik, S. K. Mesenchymal stromal cell therapy for liver diseases. Journal of Hepatology. 68 (6), 1272-1285 (2018).
- Oswald, J. Mesenchymal stem cells can be differentiated into endothelial cells in vitro. Stem Cells. 22 (3), 377-384 (2004).
- Sakaguchi, Y., Sekiya, I., Yagishita, K., Muneta, T. Comparison of human stem cells derived from various mesenchymal tissues: superiority of synovium as a cell source. Arthritis and rheumatism. 52 (8), 2521-2529 (2005).
- Poirier, J. T., Uthamanthil, R., Tinkey, P. Chapter 5 - Genetic profiling of tumors in PDX models. In Patient Derived Tumor Xenograft Models: Promise, Potential and Practice. , 149-159 (2017).
- . Sino Biological. Fluorescence-activated cell sorting (FACS) Available from: https://www.sinobiological.com/category/fcm-facs-facs (2023)
- González-González, M., Vázquez-Villegas, P., García-Salinas, C., Rito-Palomares, M. Current strategies and challenges for the purification of Stem Cells. Journal of Chemical Technology and Biotechnology. 87 (1), 2-10 (2011).
- Flanagan, A. L. Unique dielectric properties distinguish stem cells and their differentiated progeny. Stem Cells. 23 (3), 656-665 (2007).
- Vykoukal, J., Vykoukal, D. M., Freyberg, S., Alt, E. U., Gascoyne, P. R. C. Enrichment of putative stem cells from adipose tissue using dielectrophoretic field-flow fractionation. Lab on a Chip. 8 (8), 1386-1393 (2008).
- Adams, T. N. G., Turner, P. A., Janorkar, A. V., Zhao, F., Minerick, A. R. Characterizing the dielectric properties of human mesenchymal stem cells and the effects of charged elastin-like polypeptide copolymer treatment. Biomicrofluidics. 8 (5), (2014).
- Wu, H. W., Lin, C. C., Lee, G. B. Stem cells in microfluidics. Biomicrofluidics. 5 (1), (2011).
- Adams, T. N. G. Label-free enrichment of fate-biased human neural stem and progenitor cells. Biosensors and Bioelectronics. 152, 111982 (2020).
- Zhao, K., Larasati, ., Duncker, B. P., Li, D. Continuous cell characterization and separation by microfluidic alternating current dielectrophoresis. Analytical Chemistry. 91 (9), 6304-6314 (2019).
- Song, H. Continuous-flow sorting o stem cells and differentiation products based on dielectrophoresis. Lab on a Chip. 15, 1320-1328 (2015).
- Khoshmanesh, K., Nahavandi, S., Baratchi, S., Mitchell, A., Kalantar-Zadeh, K. Dielectrophoretic platforms for bio-microfluidic systems. Biosensors and Bioelectronics. 26 (5), 1800-1814 (2010).
- Hoettges, K. F. Ten-second electrophysiology: Evaluation of the 3DEP platform for high-speed, high-accuracy cell analysis. Scientific Reports. 9, 19153 (2019).
- Hubner, Y., Hoettges, K. F., Kass, G. E. N., Ogin, S. L., Hughes, M. P. Parallel measurements of drug actions on Erythrocytes by dielectrophoresis, using a three-dimensional electrode design. IEE Proceedings - Nanobiotechnology. 152 (4), 150-154 (2005).
- Hoettges, K. F. Dielectrophoresis-activated multiwell plate for label-free high-throughput drug assessment. Analytical Chemistry. 80 (9), 2063-2068 (2008).
- Mulhall, H. J. Cancer, pre-cancer and normal oral cells distinguished by dielectrophoresis. Analytical and Bioanalytical Chemistry. 401 (8), 2455-2463 (2011).
- Liao, C. -. J. An optically induced dielectrophoresis (ODEP)-based microfluidic system for the isolation of high-purity CD45neg/EPCAMNEG cells from the blood samples of cancer patients-Demonstration and initial exploration of the clinical significance of these cells. Micromachines. 9 (11), 563 (2018).
- McGrath, J. S. Electrophysiology-based stratification of pancreatic tumorigenicity by label-free single-cell impedance cytometry. Analytica Chimica Acta. 1101, 90-98 (2019).
- Chiu, T. K. Optically-induced-dielectrophoresis (ODEP)-based cell manipulation in a microfluidic system for high-purity isolation of integral circulating tumor cell (CTC) clusters based on their size characteristics. Sensors and Actuators, B: Chemical. 258, 1161-1173 (2018).
- Medjdoub, M., Courant, J. L., Maher, H., Post, G. Inductively coupled plasma - plasma enhanced chemical vapor deposition silicon nitride for passivation of InP based high electron mobility transistors (HEMTs). Material Science and Engineering: B. 80 (1-3), 252-256 (2001).
- . Umbilical cord-derived mesenchymal stem cells; Normal, human Available from: https://www.atcc.org/products/pcs-500-010 (2023)
- . 293 [HEK-293] Available from: https://www.atcc.org/products/crl-1573 (2023)
- Glasser, H., Fuhr, G. Cultivation of cells under strong ac-electric field-differentiation between heating and trans-membrane potential effects. Bioelectrochemistry and Bioenergetics. 47 (2), 301-310 (1998).
- Li, B. Implementation of flexible virtual microchannels based on optically induced dielectrophoresis. Nanotechnology. 33, 295102 (2022).
- Schellenberg, J. J., Kao, K. C. On the relationship between photoconductivity and light intensity in solids. Journal of Physics D: Applied Physics. 21, 1764-1768 (1988).
- Aoyagi, Y., Masuda, K., Namba, S. Explaination of light-intensity dependence of photoconductivity in zinc phthalocyanine. Journal of Applied Physics. 43, 249-251 (1972).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon