このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
ライン走査型振動和周波数発生顕微鏡を用いたマルチモーダル非線形ハイパースペクトルケミカルイメージング
要約
広帯域振動和周波数発生(VSFG)画像と明視野第2高調波発生(SHG)イメージングモダリティを取得するために、マルチモーダルで高速ハイパースペクトルイメージングフレームワークが開発されました。赤外線周波数は分子振動と共鳴するため、対称性が許容されるサンプルの微視的構造およびメゾスコピックな形態学の知識が明らかになります。
要約
2次の非線形光信号である振動和周波数発生(VSFG)は、~100μmの空間分解能を持つ分光法として、界面の分子を研究するために伝統的に使用されてきました。ただし、分光法はサンプルの不均一性に敏感ではありません。メゾスコピック的に不均一なサンプルを研究するために、私たちは他の研究者とともに、VSFG分光法の分解能の限界を~1μmレベルまで下げ、VSFG顕微鏡を構築しました。このイメージング技術は、イメージングによってサンプルの形態を分解できるだけでなく、画像のすべてのピクセルで広帯域のVSFGスペクトルを記録することもできます。2次非線形光学技術であるため、その選択規則により、生物学、材料科学、生物工学などで一般的に見られる非中心対称またはキラルな自己組織化構造を可視化できます。本稿では、固定されていないサンプルのイメージングを可能にする倒立透過設計について説明します。また、この研究は、VSFG顕微鏡をニューラルネットワーク関数ソルバーと組み合わせることで、個々の自己組織化シートの化学的特異的な幾何学的情報を解像できることも示しています。最後に、さまざまなサンプルの明視野、SHG、およびVSFG構成で得られた画像は、VSFGイメージングによって明らかにされる固有の情報について簡単に説明します。
概要
2次非線形光学技術1,2である振動和周波数発生(VSFG)は、対称性で許容されるサンプル3,4,5,6,7,8,9,10,11,12,13を化学的にプロファイリングするための分光ツールとして広く使用されています。14、15、16、17、18、19、20、21、22。従来、VSFGは界面系8,9,10,11(気液、液液、気体-固体、固液)に適用されてきましたが、VSFG活性の要件である反転対称性を欠いています。VSFGのこの応用により、埋もれた界面12,13、界面14,15,16,17,18の水分子の配置、界面19,20,21,22の化学種の豊富な分子詳細が得られました。
VSFGは、界面の分子種や配置を決定するのに強力ですが、反転中心を欠く物質の分子構造を測定する可能性はまだ十分に発揮されていませんでした。これは、材料が化学的環境、組成、および幾何学的配置において不均一である可能性があり、従来のVSFG分光計は100μm2程度の広い照明面積を有することによるものです。したがって、従来のVSFG分光法は、典型的な100μm2の照明領域におけるサンプルのアンサンブル平均情報を報告します。このアンサンブル平均化は、反対の配向を持つ整然としたドメイン間のシグナルキャンセルと、局所的な不均一性の誤った特徴付けにつながる可能性があります15,20,23,24。
色収差がほとんどない高開口数(NA)、反射型顕微鏡対物レンズ(シュワルツシルトおよびカセグレン形状)の進歩により、VSFG実験における2つのビームの焦点サイズを100μm2から1〜2μm2に、場合によってはサブミクロン25に縮小することができます。この技術的進歩を含め、私たちのグループなどはVSFGを顕微鏡プラットフォームに開発しました20,23,26,27,28,29,30,31,32,33,34,35,36。最近、我々は、マルチモーダル画像(VSFG、第2高調波発生(SHG)、および明視野光学)のシームレスな収集を可能にする反転光学レイアウトおよび広帯域検出スキーム37を実装した。マルチモダリティイメージングにより、光学イメージング、さまざまなタイプの画像を相関させ、サンプル画像上の信号位置を特定することで、サンプルの迅速な検査が可能になります。アクロマティック照明光学系とパルスレーザー照明光源の選択により、この光学プラットフォームは、蛍光顕微鏡38やラマン顕微鏡などの追加技術を将来シームレスに統合することができます。
この新しい配置では、階層組織や分子自己組織化(MSA)のクラスなどのサンプルが研究されています。これらの材料には、コラーゲンとバイオミメティクスが含まれ、化学組成と幾何学的構造の両方が材料の最終的な機能にとって重要です。VSFGは2次の非線形光信号であるため、分子間距離やねじれ角などの分子間配列39,40に特に敏感であり、化学組成と分子配列の両方を明らかにするための理想的なツールとなる。この作業は、光パラメトリック増幅器(OPA)をポンピングするイッテルビウムドープ共振器固体レーザー、自作のマルチモーダル倒立顕微鏡および2次元荷電結合素子(CCD)検出器27に結合されたモノクロメーター周波数分析器からなるコア機器のVSFG、SHG、および明視野モダリティについて説明する。ステップバイステップの構造と位置合わせ手順、およびセットアップの完全な部品リストが提供されます。基本的な分子サブユニットが、一般的な界面活性剤である1分子のドデシル硫酸ナトリウム(SDS)と、2分子のβ-シクロデキストリン(β-CD)(本明細書ではSDS@2 β-CD)で構成されるMSAの詳細な分析も、VSFGが組織化物質の分子固有の幾何学的詳細を明らかにする方法を示す例として提供されています。また、MSAの化学的特異的な幾何学的詳細は、ニューラルネットワーク関数ソルバーアプローチで決定できることも実証されています。
Access restricted. Please log in or start a trial to view this content.
プロトコル
1. ハイパースペクトルライン走査型VSFG顕微鏡
- レーザーシステム
- 1025nm±5nmを中心とするパルスレーザーシステム( 材料表を参照)を使用します。レーザーは40W、200kHz(200μJ/パルス)、パルス幅は~290fsに設定されています。
注:正確な繰り返し率は異なる場合があり、このVSFG顕微鏡では一般的に高繰り返し率のレーザーの方がうまく機能します。 - シードレーザーの出力を市販の光パラメトリック増幅器(OPA)に誘導して、中赤外(MIR)ビームを生成します( 材料表を参照)。MIRを対象周波数に調整します(図1A)。
注:本研究では、MIRは3450 nm±85 nm(~2900 ± 72 cm-1)を中心とし、パルス幅は~290 fs、パルスエネルギーは~6 μJで、-CHx 官能基領域の一部を包含しています。
- 1025nm±5nmを中心とするパルスレーザーシステム( 材料表を参照)を使用します。レーザーは40W、200kHz(200μJ/パルス)、パルス幅は~290fsに設定されています。
- アップコンバージョンビーム
- OPAからの残留1025 nmビームをファブリ・ペローエタロン( 材料表を参照)に通し、半値幅が~4.75 cm-1のスペクトル的に狭くなったアップコンバージョンビームを生成します。
- 狭くなった1025 nmのビームを8 μmのサファイアピンホールで空間的にフィルタリングします。
注:1025nmビームは、NIRカードを使用して視覚化できます。 - 1025 nmパルスの偏光をλ/2波長板で制御します( 材料表を参照)。
- MIRビーム
- MIRビームを遅延ステージに誘導し、時間的なオーバーラップを細かく制御します。
- MIRの偏光をλ/2波長板で制御します。
- VSFG顕微鏡
- MIRを透過し、近赤外を反射するカスタマイズされたダイクロイックミラー(DM、図1B)で、アップコンバージョンビームとMIRビームの両方を空間的に重ね合わせます( 材料表を参照)。2つの虹彩を使用して、DMの直後と遠端の2つの虹彩を使用します。虹彩の後にパワーメーターを使用してMIRが中央に配置されているかどうかを判断し、NIRカードを使用してNIR位置を特定します。
注:オーバーラップ後、NIRビームを使用して両方のビームをガイドできます。 - 重なり合ったビームを、内蔵の325 Hz単軸共鳴ビームスキャナー(統合2ポジションスキャナー(I2PS)に取り付けられた倒立顕微鏡、 図1B)に導きます( 資料表を参照)。
注:レゾナントスキャナーは、重なり合った2つのビームの線をコンデンサー対物レンズの背面開口部に投影します。スライダーに取り付けられており、VSFG/SHGと明視野モダリティ間のシームレスな再構成が可能です。 - 空間的に重なり合った2つのビームを、純粋に反射するシュワルツシルト対物レンズ(SO、 図1B、D)でサンプルに集束します( 材料表を参照)。
- 無限遠補正屈折対物レンズ(RO、 図1B、D)でサンプルによって生成されたVSFG信号を収集します( 材料表を参照)。
- コリメートされた出力VSFG信号を直線偏光子に通し、次に2枚のf = 60 mm焦点レンズ(TL1およびTL2、 図1B、C)で構成されるテレセントリックチューブレンズシステムに通します( 材料表を参照)。
注:チューブレンズからの拡大画像は、モノクロメーターの入射スリットに形成され(MC、図1B、C)、空間/周波数分解データは2次元CCD検出器(CCD、図1B)で検出されます。
- MIRを透過し、近赤外を反射するカスタマイズされたダイクロイックミラー(DM、図1B)で、アップコンバージョンビームとMIRビームの両方を空間的に重ね合わせます( 材料表を参照)。2つの虹彩を使用して、DMの直後と遠端の2つの虹彩を使用します。虹彩の後にパワーメーターを使用してMIRが中央に配置されているかどうかを判断し、NIRカードを使用してNIR位置を特定します。
- SHGモード
- SHGイメージングに切り替えるには、IRビームを遮断し、分光器の回折格子を501.5 nmに回転させてSHG信号をイメージングします。
- 明視野モード
- 明視野光学イメージングに切り替えるには、白色光源をオンにします( 材料表を参照)。内蔵スライダ(I2PS、 図1B)を動かして、結像対物レンズ(RO)を集光器、集光器対物レンズ(SO)を結像対物レンズとして、対向伝搬方向の明視野画像を収集します。
- 市販のチューブレンズシステムを使用して、RGB明視野カメラのセンサー面での屈折対物レンズのコリメート出力の画像を形成します( 材料表を参照)。

図1:マルチモーダルハイパースペクトルVSFG顕微鏡。 (ア) コア・セットアップの上面図 1025nmの励起レーザーをOPAに送り、調整可能な中赤外パルスを生成しました。残留1025 nmは、エタロン(E)によって頻繁に狭められ、空間フィルター(SFG)によって空間的にフィルタリングされてガウシアンビームになりました。中赤外および1025nmのビームは、カスタマイズされたダイクロイックミラー(DM)で空間的に重なり合い、倒立顕微鏡( Aのボックス領域)に導かれます。(B)2つのビームは、統合された2ポジションスライダー(I2PS)に取り付けられた325Hzの共鳴ビームスキャナーに送られ、明視野と非線形光学モダリティのシームレスな切り替えを可能にします。顕微鏡プラットフォームには、コンデンサーとして機能する反射ベースの無限遠補正シュワルツシルト対物レンズ(SO)と、垂直ナノポジショニング(VNP)z軸ステージに取り付けられた屈折ベースの無限遠補正イメージング対物レンズ(RO)が装備されています。SOは、共振ビームスキャナーがサンプルに反射する入射ビームのラインを集束し、ROは信号のVSFGラインセクションを収集します。ROのz軸位置を1μmの精度で微調整し、サンプルを高品質のイメージングに最適な焦点条件にすることが重要です。次に、VSFG信号のコリメートされた線は、2つのタブレンズ(TL1およびTL2)で構成されるチューブレンズシステムに向けられ、モノクロメーター(MC)の入射スリットで拡大画像を形成します。次に、周波数分解されたスペクトル線が電荷結合素子(CCD)上でハイパースペクトル画像化されます。各ハイパースペクトル線を収集した後、NPを使用して、共鳴ビームスキャナーのスキャン軸に垂直な軸でサンプルをスキャンします。サンプルの明視野画像を収集するために、I2PSを明視野位置に移動し、白色光源(WLS)を遮断するミラーを取り付けます。その後、光はROによって集束され、SOによって結像されます。次に、倒立顕微鏡の上部にある明視野カメラ(BC)のセンサー面に画像が形成されます。(C)チューブレンズ領域からMCおよびCCDへの光路の詳細図。(D)SOとROの間のサンプル領域の詳細図。 この図の拡大版をご覧になるには、ここをクリックしてください。
2.ハイパースペクトル顕微鏡のアライメントと垂直CCD軸の空間校正
- 15 mm x 15 mm x 0.170 mm ± 0.005 mmのカバーガラスでコーティングされたZnO(厚さ1 μm)パターンスパッタリングの標準サンプルを使用してサンプル平面(ナノポジショナーz軸)の位置を大まかに最適化し、明視野イメージングモダリティを使用して明視野焦点に焦点を合わせます。
注:ROのZ位置と白色光のアライメントは、必要に応じて調整する必要がある場合があります。アライメントキャリブレーションに用いたガラスパターン上のZnOの代表的な画像を 図2に示します。 - I2PSを非線形照明アームに戻し、CCDカメラで観察されたZnO領域によって生成される最大の非共振VSFG強度が得られるようにサンプルの高さを最適化します。
注意: ROのZ位置は、最大強度になるように調整する必要があります。サンプルの最適な高さに達する前に、ステップ2.1と2.2を数回繰り返す必要があり、ROに達する必要があります。 - 共鳴ビームスキャナーをオンにして、画像の線を収集します。
- 試料をビームスキャナーの方向に垂直に走査することにより、非共振強度の画像を収集します。画像データの垂直スライスを取得し、ピクセルとミクロンの比率を確立します。( 図 3 とその凡例を参照)。
注:これらのラインセクションの微分は、将来の画像に使用される垂直CCD軸のピクセル:ミクロン比を生成するために分析されます。

図2:ZnOパターンの明視野イメージングモダリティのラフアライメントの代表的な画質。 この図の拡大版をご覧になるには、ここをクリックしてください。
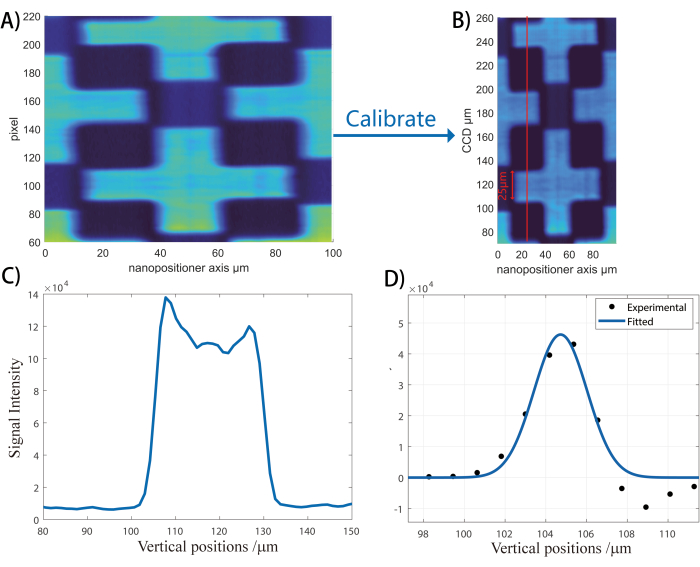
図3:垂直軸キャリブレーションのワークフロー。 この図は、CCD画素をμm単位で垂直空間寸法に変換する方法を示しています。 (A)ZnOパターンカバーガラスの画像を収集し、再構成する。次に、パターンの一方のエッジから他方のエッジまでのピクセル距離( Aの小さな垂直バー)。ZnOパターンクロスは25μm幅に設計されているため、ここでは物理幅とピクセル幅の比を使用して、物理/ピクセル寸法比を計算できます。代表的な縦軸キャリブレーション画像を(B)に示す。 (C) 最後に、赤い線で示されているように垂直スライスが取られます。(D)垂直スライスの微分を取り、空間分解能を求めます。垂直スライスの微分は、空間分解能を取得するために使用されます。 この図の拡大版をご覧になるには、ここをクリックしてください。
3. ハイパースペクトルデータ収集
- VSFG信号の垂直線のスペクトルをCCD上に収集し、そのスペクトルを横軸に沿って分散させ、空間位置をCCDの縦軸に記録します。
注: この結果、1 行セクションの 2 次元データ セットが作成されます。 - サンプルのラインセクションをハイパースペクトル画像化した後、3次元ナノポジショナーを使用して、ラインスキャン軸に垂直な軸でサンプルをスキャンします( NP、図1)。
注:3Dナノポジショナーは、サンプル領域(x-y平面)の位置特定とサンプルの焦点合わせ(z軸)において、高精度と再現性のために重要です。 - ステップ 3.1 とステップ 3.2 を繰り返して、VSFG ハイパースペクトル イメージを収集します。
4. ハイパースペクトルデータ解析
- MatLab イメージング ツールボックスのハイパースペクトル イメージング ライブラリ ワークフロー41 を使用して、データをスペクトル的にアンミックスします。
注:スペクトルアンミキシングは、空間的な位置を一意のスペクトルに関連付けます。ハイパースペクトル データ解析用の Matlab コードは、 補足ファイル 1 で提供されています。- Matlab 画像処理ツールボックスのハイパースペクトル画像ライブラリ41 の関数 hypercube を使用して、4 次元の超立方体 (x = 空間、y = 空間、z = 周波数依存強度、ω = 周波数) を作成します。
- 誤警報の確率 (PFA) 値が 10 から 7 の関数 countEndmembersHFC を使用して、一意のスペクトルの数を特定します。
- 関数 nfindr スペクトル アンミキシングを使用して一意のスペクトルを同定します。
- 最後に、 関数 sid を使用して、各ピクセルを前の手順で特定した一意のスペクトルの 1 つに関連付けます。
注: 追加のスペクトルアンミキシングおよびマッチング方法は、MatLab Hyperspectral Imaging Library41 で提供される代替関数/アルゴリズムを使用して実行できます。
- 各孤立シートの合計データをフォイト関数42(補足ファイル1)に当てはめます。
注:ローレンツ関数は純粋な同次線形状の限界を表しますが、ガウス関数は不均一な極限に由来します。実際には、系は均質な限界と不均質な限界の組み合わせになる可能性があり、これにはVSFGを含む凝縮相分光法の一般的な方法であるVoigt関数が必要です。
5. 試料の幾何学的解析
- ステップ5.2-5.3で説明した手順に従って、サンプルの形状を決定します。本研究では、SDS@2 β-CDを例に挙げる。χ(2) の対称性許容テンソル要素は、SDS@2 β-CD メソシート試料の分子サブユニットの C7 対称性に基づいて導出されます。
注: χ(2) で許容される対称性は対称性に依存します。対称性の許容非線形感受率を計算するには、参考文献43を参照してください。 - オイラー回転27 を適用して、ラボ フレームの測定値を分子フレームに関連付けます。
注:SDS@2 β-CDの場合、そのC7対称性は、8つの出力(ラボフレームχ(2))と8つの入力(6つの独立した過分極性β(2))と2つの角度(Θ、すべてのシートのサンプル面に対する傾斜角、およびφ、シートの面内回転(図4)))に関連する8つの独立した方程式につながります。2枚のシートを使用して、2枚のシートに共通する分子配列を抽出します。明視野画像から、φ1とφ2の関係(2枚のシートの面内回転角度)を抽出することができます。現在の例では、φ2 = φ1 + 60°です。すべての分子単位が同じ角度でタイル状になっていると仮定すると、Θ1=Θ2になります。この結果、16の既知物質(1枚あたり8つのラボフレーム偏光、2枚のシート)に対して、11個の未知物質(6個の独立した過分極性β(2))、Θ1およびφ1、シートN間の相対被覆率、および2つの従属角度(φ2、Θ2)を含む9個の独立した未知数)が得られた。 - 偏光分解ラボフレーム χ(2) と分子フレーム過分極性 β(2) をニューラル ネットワーク関数ソルバーに関連付けます。
注: このアプローチの詳細な概要については、参考文献27 を参照してください。- Python44で、200-100-50 のノード構造と双曲線正接活性化関数で構成される Keras を使用して、階層化されたニューラル ネットワーク モデルを作成します。
- β(2)、Θ 1、Θ2、φ1、φ 2、N の値からランダムに生成された 100000 x 11 行列を作成します。 オイラー回転によって 5.2 で決定された式を使用して、対応するラボ フレーム 16 χ(2) を計算します。
- 計算されたχ(2)値(合計100,000×16の値)を入力として使用し、16個のχ(2)値が与えられたときに11個の値(β(2)、Θ 1、Θ 2、φ1、φ2、N)を予測する方法を学習します。
- トレーニングが完了したら、入力と出力の両方を含む別の 1000 エントリのセットを使用して、トレーニング済みモデルをテストします。予測出力と実際の出力は、傾きが 1 の線形関係を示す必要があります。
- 最後に、実験的に測定された χ(2) を 2 枚のシートから供給し (各シートには 8 個の χ(2) が測定されています)、トレーニング済みのモデルを使用して、傾斜角 Θ を他のプロパティと共に予測します。
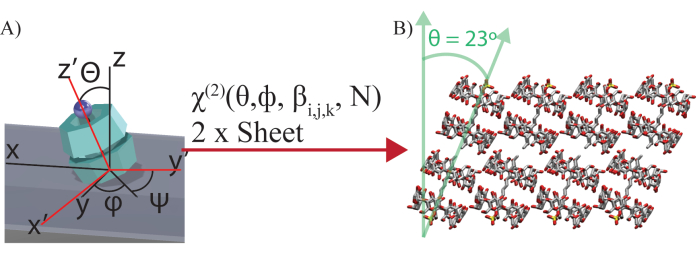
図4:オイラー変換の図。 (A)実験室座標(XYZ)の2次感受率χ(2)と分子座標(XYZ)の超分極率βijkの間のオイラー変換の図。z-y'-z'' オイラー回転は分子座標に対して行われ、φ を面内回転角、θ を傾斜角、ψ をねじれ角とします。ψは、分子軸周りの任意のねじれ角度に対して積分されています。φは、すべての分子がラボフレームに対して特定の角度に回転して自己組織化シートを形成するため、集積されません。N は 2 枚のシートの相対的なサーフェス カバレッジです。(B)ニューラルネットワークの結果によって決定されるシートを形成する傾斜したサブユニットの視覚化。この図は Wagner et al.27 から修正されたものである。この図の拡大版をご覧になるには、ここをクリックしてください。
Access restricted. Please log in or start a trial to view this content.
結果
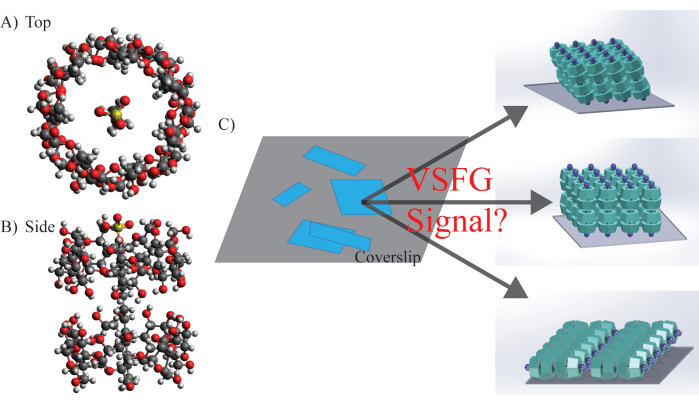
図5:SDS@β-CDの分子構造、形態、ポテンシャル配向 。 (A)SDS@β-CDの上面図と(B)側面図の化学構造。(C)試料面上のメソスケールシートの代表的な不均質な試料分布。分子サブユニットは、基質上で異なる配向とアライメントを持?...
Access restricted. Please log in or start a trial to view this content.
ディスカッション
最も重要なステップは 1.42 から 1.44 です。光学空間分解能を得るためには、対物レンズの位置を合わせることが重要です。また、出射された信号を集めて中継し、入射スリットに走査ビームを線状に投影することも重要です。適切なアライメントにより、最高の分解能とS/N比が保証されます。SDS@2 β-CD 100 μm x 100 μm シートのような一般的なサンプルでは、高い S/N 比で高解像度の画像(~1 μm 分...
Access restricted. Please log in or start a trial to view this content.
開示事項
著者は何も開示していません。
謝辞
装置の開発は、Grant NSF CHE-1828666によってサポートされています。ZW、JCW、WXは、米国国立衛生研究所、国立総合医学研究所、助成金1R35GM138092-01の支援を受けています。BYは、中国科学院青年イノベーション促進協会(CAS、2021183)の支援を受けています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 1x Camera Por | Thorlabs | WFA4100 | connect a camera to a microscope or optical system |
| 25.0 mm Right-Angle Prism Mirror, Protected Gold | Thorlabs | MRA25-M01 | reflect light and produce retroreflection, redirecting light back along its original path |
| 3” Universal Post Holder-5 Pack | Thorlabs | UPH3-P5 | hold and support posts of various sizes and configurations |
| 30 mm to 60 mm Cage Plate, 4 mm Thick | Thorlabs | LCP4S | convert between a 30 mm cage system and a 60 mm cage system |
| 500 mm Tall Cerna Body with Epi Arm | Thorlabs | CEA1500 | provide the function of enabling top illumination techniques in microscopy |
| 60 mm Cage Mounted Ø50.0 mm Iris | Thorlabs | LCP50S | control the amount of light passing through an optical system |
| 60 mm Cage Mounting Bracket | Thorlabs | LCP01B | mount and position a 60 mm cage system in optical setups |
| Air spaced Etalon | SLS Optics Ltd. | Customized | generate narrow-band 1030 nm light |
| Cage Plate Mounting Bracket | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| CCD | Andor Technologies | Newton | 2D CCD for frequency and spatial resolution |
| Collinear Optical Parametric Amplifier | Light Conversion | Orpheus-One-HP | Tunable MID light generator |
| Copper Chloride | Thermo Fischer Scientific | A16064.30 | Self-assembly component |
| Customized Dichroic Mirror | Newport | Customized | selectively reflects or transmits light based on its wavelength or polarization |
| Ext to M32 Int Adapter | Thorlabs | SM1A34 | provide compatibility and facilitating the connection between components with different thread types |
| Infinity Corrected Refractive Objective | Zeiss | 420150-9900-000 | Refractive Objective |
| Infinity Corrected Schwarzschild Objective | Pike Technologies Inc. | 891-0007 | Reflective objective |
| Laser | Carbide, Light-Conversion | C18212 | Laser source |
| M32x0.75 External to Internal RMS | Thorlabs | M32RMSS | adapt or convert the threading size or type of microscope objectives |
| M32x0.75 External to M27x0.75 Internal Engraving | Thorlabs | M32M27S | adapt or convert the threading size or type of microscope objectives |
| Manual Mid-Height Condenser Focus Module | Thorlabs | ZFM1030 | adjust the focus of an optical element |
| Monochromator | Andor Technologies | Shamrock 500i | Provides frequency resolution for each line scan |
| Motorized module with 1" Travel for Edge-Mounted Arms | Thorlabs | ZFM2020 | control the vertical positon of the imaging objective |
| Nanopositioner | Mad City Labs Inc. | MMP3 | 3D sample stage |
| Resonant Scanner | EOPC | SC-25 | 325Hz resonant beam scanner |
| RGB Color CCD Camera | Thorlabs | DCU224C | Brightfield camera, discontinued but other cameras will work just as well |
| RGB tube lens | Thorlabs | ITL200 | white light collection |
| Right Angle Kinematic Breadboard | Thorlabs | OPX2400 | incorporate a sliding mechanism with two fixed positions |
| Right Angle Kinematic Mirror Mount, 30 mm | Thorlabs | KCB1 | hold and adjust mirrors at a precise angle |
| Right Angle Kinematic Mirror Mount, 60 mm | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| SM2, 60 mm Cage Arm for Cerna Focusing Stage | Thorlabs | CSA2100 | securely mount and position condensers |
| Snap on Cage Cover for 60 mm Cage, 24 in Long, | Thorlabs | C60L24 | enclose and protect the components inside the cage |
| Sodium dodecyl sulfate | Thermo Fischer Scientific | J63394.AK | Self-assembly component |
| Three-Chnnale Controller and Knob Box for 1" Cerna Travel Stages | Thorlabs | MCM3001 | control ZFM2020 |
| Tube lens | Thorlabs | LA1380-AB - N-BK7 | SFG signal collection |
| Visible LED Set | Thorlabs | WFA1010 | provide illumination in imaging setup |
| Whitelight Source | Thorlabs | WFA1010 | Whitelight illumination source for brightfield imaging |
| WPH05M-1030 - Ø1/2" Zero-Order Half-Wave Plate, Ø1" Mount, 1030 nm | Thorlabs | WPH05M-1030 | alter the polarization state of light passing through it |
| WPLQ05M-3500 - Ø1/2" Mounted Low-Order Quarter-Wave Plate, 3.5 µm | Thorlabs | WPLQ05M-3500 | alter the polarization state of light passing through it |
| X axis Long Travel Steel Extended Contact Slide Stages | Optosigma | TSD-65122CUU | positioning stages that offer extended travel in the horizontal (X) direction |
| XT95 4in Rail Carrier | Thorlabs | XT95RC4 | mount and position optical components |
| X-Y Axis Translation Stage w/ 360 deg. Rotation | Thorlabs | XYR1 | precise movement and positioning of objects in two dimensions, along with the ability to rotate the platform |
| XY(1/2") Linear Translator with Central SM1 Thru Hole | Thorlabs | XYT1 | provide precise movement and positioning in two dimensions |
| Yb doped Solid State Laser | Light Conversion | CB3-40W | Seed laser |
| β-Cyclodextrin | Thermo Fischer Scientific | J63161.22 | Self-assembly component |
参考文献
- Zhu, X. D., Suhr, H., Shen, Y. R. Surface vibrational spectroscopy by infrared-visible sum frequency generation. Physical Review B. 35 (6), 3047-3050 (1987).
- Shen, Y. R. Surface properties probed by second-harmonic and sum-frequency generation. Nature. 337 (6207), 519-525 (1987).
- Li, Y., Shrestha, M., Luo, M., Sit, I., Song, M., Grassian, V. H., Xiong, W. Salting up of proteins at the air/water interface. Langmuir. 35 (43), 13815-13820 (2019).
- Wang, C., Li, Y., Xiong, W. Extracting molecular responses from ultrafast charge dynamics at material interfaces. Journal of Materials Chemistry C. 8 (35), 12062-12067 (2020).
- Nihonyanagi, S., Mondal, J. A., Yamaguchi, S., Tahara, T. Structure and dynamics of interfacial water studied by heterodyne-detected vibrational sum-frequency generation. Annual Review of Physical Chemistry. 64 (1), 579-603 (2013).
- Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast dynamics at water interfaces studied by vibrational sum frequency generation spectroscopy. Chemical Reviews. 117 (16), 10665-10693 (2017).
- Singh, P. C., Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast vibrational dynamics of water at a charged interface revealed by two-dimensional heterodyne-detected vibrational sum frequency generation. The Journal of Chemical Physics. 137 (9), 094706(2012).
- Jubb, A. M., Hua, W., Allen, H. C. Environmental chemistry at vapor/water interfaces: insights from vibrational sum frequency generation spectroscopy. Annual Review of Physical Chemistry. 63 (1), 107-130 (2012).
- Ishiyama, T., Sato, Y., Morita, A. Interfacial structures and vibrational spectra at liquid/liquid boundaries: molecular dynamics study of water/carbon tetrachloride and water/1,2-dichloroethane interfaces. The Journal of Physical Chemistry C. 116 (40), 21439-21446 (2012).
- Sapi, A., Liu, F., Cai, X., Thompson, C. M., Wang, H., An, K., Krier, J. M., Somorjai, G. A. Comparing the catalytic oxidation of ethanol at the solid-gas and solid-liquid interfaces over size-controlled pt nanoparticles: striking differences in kinetics and mechanism. Nano Letters. 14 (11), 6727-6730 (2014).
- Chen, X., Wang, J., Sniadecki, J. J., Even, M. A., Chen, Z. Probing α-helical and β-sheet structures of peptides at solid/liquid interfaces with SFG. Langmuir. 21 (7), 2662-2664 (2015).
- Dramstad, T. A., Wu, Z., Gretz, G. M., Massari, A. M. Thin films and bulk phases conucleate at the interfaces of pentacene thin films. The Journal of Physical Chemistry C. 125 (30), 16803-16809 (2021).
- Xiang, B., Li, Y., Pham, C. H., Paesani, F., Xiong, W. Ultrafast direct electron transfer at organic semiconductor and metal interfaces. Science Advances. 3 (11), e1701508(2017).
- Livingstone, R. A., Nagata, Y., Bonn, M., Backus, E. H. G. Two types of water at the water-surfactant interface revealed by time-resolved vibrational spectroscopy. Journal of the American Chemical Society. 137 (47), 14912-14919 (2015).
- Wagner, J. C., Hunter, K. M., Paesani, F., Xiong, W. Water capture mechanisms at zeolitic imidazolate framework interfaces. Journal of the American Chemical Society. 143 (50), 21189-21194 (2021).
- Montenegro, A., Dutta, C., Mammetkuliev, M., Shi, H., Hou, B., Bhattacharyya, D., Zhao, B., Cronin, S. B., Benderskii, A. V. Asymmetric response of interfacial water to applied electric fields. Nature. 594 (7861), 62-65 (2021).
- Nihonyanagi, S., Ishiyama, T., Lee, T., Yamaguchi, S., Bonn, M., Morita, A., Tahara, T. Unified molecular view of the air/water interface based on experimental and theoretical χ(2) spectra of an isotopically diluted water surface. Journal of the American Chemical Society. 133 (42), 16875-16880 (2011).
- Shen, Y. R., Ostroverkhov, V. Sum-frequency vibrational spectroscopy on water interfaces: polar orientation of water molecules at interfaces. Chemical Reviews. 106 (4), 1140-1154 (2006).
- Hosseinpour, S., Roeters, S. J., Bonn, M., Peukert, W., Woutersen, S., Weidner, T. Structure and dynamics of interfacial peptides and proteins from vibrational sum-frequency generation spectroscopy. Chemical Reviews. 120 (7), 3420-3465 (2020).
- Wang, H., Xiong, W. Vibrational sum-frequency generation hyperspectral microscopy for molecular self-assembled systems. Annual Review of Physical Chemistry. 72 (1), 279-306 (2021).
- Wang, H. -F., Velarde, L., Gan, W., Fu, L. Quantitative sum-frequency generation vibrational spectroscopy of molecular surfaces and interfaces: lineshape, polarization, and orientation. Annual Review of Physical Chemistry. 66 (1), 189-216 (2015).
- Inoue, K., Ahmed, M., Nihonyanagi, S., Tahara, T. Reorientation-induced relaxation of free oh at the air/water interface revealed by ultrafast heterodyne-detected nonlinear spectroscopy. Nature Communications. 11 (1), 5344(2020).
- Wang, H., Gao, T., Xiong, W. Self-phase-stabilized heterodyne vibrational sum frequency generation microscopy. ACS Photonics. 4 (7), 1839-1845 (2017).
- Wang, H., Xiong, W. Revealing the molecular physics of lattice self-assembly by vibrational hyperspectral imaging. Langmuir. 38 (10), 3017-3031 (2022).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. -H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891(2011).
- Wang, H., Wagner, J. C., Chen, W., Wang, C., Xiong, W. Spatially dependent h-bond dynamics at interfaces of water/biomimetic self-assembled lattice materials. Proceedings of the National Academy of Sciences. 117 (38), 23385-23392 (2020).
- Wagner, J. C., Wu, Z., Wang, H., Xiong, W. Imaging orientation of a single molecular hierarchical self-assembled sheet: the combined power of a vibrational sum frequency generation microscopy and neural network. The Journal of Physical Chemistry B. 126 (37), 7192-7201 (2022).
- Han, Y., Hsu, J., Ge, N. -H., Potma, E. O. Polarization-sensitive sum-frequency generation microscopy of collagen fibers. The Journal of Physical Chemistry B. 119 (8), 3356-3365 (2015).
- Chung, C. -Y., Potma, E. O. Biomolecular imaging with coherent nonlinear vibrational microscopy. Annual Review of Physical Chemistry. 64 (1), 77-99 (2013).
- Potma, E. O. Advances in vibrationally resonant sum-frequency generation microscopy. Optics in the Life Sciences Congress. , OSA: Washington, DC, 2017. p NM4C.2 (2017).
- Han, Y., Raghunathan, V., Feng, R. R., Maekawa, H., Chung, C. -Y. Y., Feng, Y., Potma, E. O., Ge, N. -H. H. Mapping molecular orientation with phase sensitive vibrationally resonant sum-frequency generation microscopy. The Journal of Physical Chemistry B. 117 (20), 6149-6156 (2013).
- Hsu, J., Haninnen, A., Ge, N. -H., Potma, E. O. Molecular imaging with sum-frequency generation microscopy. Optics in the Life Sciences. , OSA: Washington, DC, 2015. p NT4C.4 (2015).
- Hanninen, A., Shu, M. W., Potma, E. O. Hyperspectral imaging with laser-scanning sum-frequency generation microscopy. Biomedical Optics Express. 8 (9), 4230(2017).
- Wang, H., Chen, W., Wagner, J. C., Xiong, W. Local ordering of lattice self-assembled SDS@2β-CD materials and adsorbed water revealed by vibrational sum frequency generation microscope. The Journal of Physical Chemistry B. 123 (29), 6212-6221 (2019).
- Cimatu, K., Baldelli, S. Chemical imaging of corrosion: sum frequency generation imaging microscopy of cyanide on gold at the solid−liquid interface. Journal of the American Chemical Society. 130 (25), 8030-8037 (2008).
- Shah, S. A., Baldelli, S. Chemical imaging of surfaces with sum frequency generation vibrational spectroscopy. Accounts of Chemical Research. 53 (6), 1139-1150 (2020).
- Wagner, J. ackson C., Zishan, W. u, Xiong, W. Multimodal nonlinear vibrational hyperspectral imaging. ChemRxiv. , (2023).
- Yan, C., Wagner, J., Wang, C., Ren, J., Lee, C., Wan, Y., Wang, S., Xiong, W. Multi-dimensional widefield infrared-encoded spontaneous emission microscopy: distinguishing chromophores by ultrashort infrared pulses. ChemRxiv. , (2023).
- Lin, Y., Fromel, M., Guo, Y., Guest, R., Choi, J., Li, Y., Kaya, H., Pester, C. W., Kim, S. H. Elucidating interfacial chain conformation of superhydrophilic polymer brushes by vibrational sum frequency generation spectroscopy. Langmuir. 38 (48), 14704-14711 (2022).
- Choi, J., Lee, J., Makarem, M., Huang, S., Kim, S. H. Numerical simulation of vibrational sum frequency generation intensity for non-centrosymmetric domains interspersed in an amorphous matrix: a case study for cellulose in plant cell wall. The Journal of Physical Chemistry B. 126 (35), 6629-6641 (2022).
- Matlab Image Processing Toolbox Hyperspectral Imaging Library. , The Mathworks, Inc., Natick, MA USA. Google Scholar Forthcoming.
- Armstrong, B. H. Spectrum line profiles: the Voigt function. Journal of Quantitative Spectroscopy and Radiative Transfer. 7 (1), 61-88 (1967).
- Wu, Z., Xiong, W. Neumann's principle based eigenvector approach for deriving non-vanishing tensor elements for nonlinear optics. The Journal of Chemical Physics. 157 (13), 134702(2022).
- Chollet, F. Keras Neural Network Library. https://github.com/fchollet/keras accessed Apr 12. , (2021).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nature Methods. 15 (3), 173-182 (2018).
- Xiong, W., Laaser, J. E., Mehlenbacher, R. D., Zanni, M. T. Adding a dimension to the infrared spectra of interfaces using heterodyne detected 2D sum-frequency generation (HD 2D SFG) spectroscopy. Proceedings of the National Academy of Sciences. 108 (52), 20902-20907 (2011).
- Lukas, M., Backus, E. H. G., Bonn, M., Grechko, M. Passively stabilized phase-resolved collinear sfg spectroscopy using a displaced sagnac interferometer. The Journal of Physical Chemistry A. 126 (6), 951-956 (2022).
- Ji, N., Ostroverkhov, V., Chen, C., Shen, Y. Phase-sensitive sum-frequency vibrational spectroscopy and its application to studies of interfacial alkyl chains. Journal of the American Chemical Society. 129 (33), 10056-10057 (2007).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved