Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Imagerie chimique hyperspectrale non linéaire multimodale à l’aide de la microscopie à génération de somme et de fréquence vibrationnelle à balayage linéaire
Dans cet article
Résumé
Un cadre d’imagerie hyperspectrale multimodale rapide a été développé pour obtenir des images de génération de somme de fréquence vibratoire (VSFG) à large bande, ainsi que des modalités d’imagerie de génération de deuxième harmonique (SHG) en fond clair. En raison de la fréquence infrarouge en résonance avec les vibrations moléculaires, des connaissances microscopiques structurelles et morphologiques mésoscopiques sont révélées à partir d’échantillons autorisés par symétrie.
Résumé
La génération de somme de fréquence vibrationnelle (VSFG), un signal optique non linéaire de second ordre, est traditionnellement utilisée pour étudier les molécules aux interfaces en tant que technique de spectroscopie avec une résolution spatiale de ~100 μm. Cependant, la spectroscopie n’est pas sensible à l’hétérogénéité d’un échantillon. Pour étudier des échantillons mésoscopiquement hétérogènes, nous avons, avec d’autres, repoussé la limite de résolution de la spectroscopie VSFG jusqu’à ~1 μm et construit le microscope VSFG. Cette technique d’imagerie permet non seulement de résoudre les morphologies d’échantillons par imagerie, mais aussi d’enregistrer un spectre VSFG à large bande à chaque pixel des images. Comme il s’agit d’une technique optique non linéaire de second ordre, sa règle de sélection permet de visualiser des structures auto-assemblées non centrosymétriques ou chirales que l’on trouve couramment en biologie, en science des matériaux et en bio-ingénierie, entre autres. Dans cet article, le public sera guidé à travers une conception de transmission inversée qui permet d’imager des échantillons non fixés. Ce travail montre également que la microscopie VSFG peut résoudre des informations géométriques spécifiques à des produits chimiques de feuilles individuelles auto-assemblées en les combinant avec un solveur de fonction de réseau neuronal. Enfin, les images obtenues sous fond clair, SHG et VSFG de divers échantillons discutent brièvement des informations uniques révélées par l’imagerie VSFG.
Introduction
La génération de somme de fréquence vibrationnelle (VSFG), une technique optique non linéaire de second ordre1,2, a été largement utilisée comme outil de spectroscopie pour profiler chimiquement des échantillons de symétrie autorisés 3,4,5,6,7,8,9,10,11,12,13, 14,15,16,17,18,19,20,21,22. Traditionnellement, le VSFG a été appliqué aux systèmes interfaciaux 8,9,10,11 (c’est-à-dire gaz-liquide, liquide-liquide, gaz-solide, solide-liquide), qui n’ont pas de symétrie d’inversion - une exigence pour l’activité VSFG. Cette application de VSFG a fourni une multitude de détails moléculaires sur les interfaces enfouies 12,13, les configurations des molécules d’eau aux interfaces 14,15,16,17,18 et les espèces chimiques aux interfaces 19,20,21,22.
Bien que le VSFG ait été puissant dans la détermination des espèces moléculaires et des configurations aux interfaces, son potentiel dans la mesure des structures moléculaires de matériaux dépourvus de centres d’inversion n’a pas été exploité. Cela s’explique en partie par le fait que les matériaux peuvent être hétérogènes dans leur environnement chimique, leur composition et leur disposition géométrique, et qu’un spectromètre VSFG traditionnel a une grande zone d’éclairage de l’ordre de 100 μm2. Ainsi, la spectroscopie VSFG traditionnelle rapporte des informations moyennées par ensemble de l’échantillon sur une zone d’éclairage typique de 100 μm2. Cette moyenne d’ensemble peut conduire à des annulations de signaux entre des domaines bien ordonnés avec des orientations opposées et à une mauvaise caractérisation des hétérogénéités locales 15,20,23,24.
Grâce aux progrès réalisés dans le domaine des objectifs de microscope à haute ouverture numérique (NA) et à réflexion (géométries Schwarzschild et Cassegrain), qui sont presque exempts d’aberrations chromatiques, la taille de la mise au point des deux faisceaux dans les expériences VSFG peut être réduite de 100 μm 2 à 1-2 μm2 et, dans certains cas, submicronique25. En tenant compte de cette avancée technologique, notre groupe et d’autres ont développé VSFG en une plate-forme de microscopie 20,23,26,27,28,29,30,31,32,33,34,35,36. Récemment, nous avons mis en place une disposition optique inversée et un schéma de détection à large bande37, qui permet une collecte transparente d’images multimodales (VSFG, génération de deuxième harmonique (SHG) et optique à fond clair). L’imagerie multimodale permet d’inspecter rapidement les échantillons à l’aide de l’imagerie optique, de corréler différents types d’images et de localiser les positions des signaux sur les images d’échantillons. Grâce à l’optique d’éclairage achromatique et au choix de la source d’éclairage laser pulsé, cette plate-forme optique permet l’intégration transparente de techniques supplémentaires telles que la microscopie à fluorescence38 et la microscopie Raman, entre autres.
Dans ce nouvel arrangement, des échantillons tels que des organisations hiérarchiques et une classe d’auto-assemblages moléculaires (MSA) ont été étudiés. Ces matériaux comprennent le collagène et le biomimétique, où la composition chimique et l’organisation géométrique sont importantes pour la fonction ultime du matériau. Parce que le VSFG est un signal optique non linéaire de second ordre, il est particulièrement sensible aux arrangements intermoléculaires39,40, tels que la distance intermoléculaire ou les angles de torsion, ce qui en fait un outil idéal pour révéler à la fois les compositions chimiques et les arrangements moléculaires. Ce travail décrit les modalités VSFG, SHG et fond clair de l’instrument de base constitué d’un laser à semi-conducteurs à cavité dopé à l’ytterbium qui pompe un amplificateur paramétrique optique (OPA), d’un microscope inversé multimodal et d’un analyseur de fréquence monochromateur de fabrication artisanale couplé à un détecteur à dispositif à couplage chargé (CCD)bidimensionnel 27. Des procédures de construction et d’alignement étape par étape, ainsi qu’une liste complète des pièces de l’installation, sont fournies. Une analyse approfondie d’un MSA, dont la sous-unité moléculaire fondamentale est composée d’une molécule de sulfate de sodium-dodécyle (SDS), un tensioactif commun, et de deux molécules de β-cyclodextrine (β-CD), connue sous le nom de SDS@2 β-CD ici, est également fournie à titre d’exemple pour montrer comment le VSFG peut révéler des détails géométriques spécifiques à la molécule de la matière organisée. Il a également été démontré que les détails géométriques spécifiques à la chimie de la MSA peuvent être déterminés avec une approche de solveur de fonction de réseau neuronal.
Access restricted. Please log in or start a trial to view this content.
Protocole
1. Microscope VSFG hyperspectral à balayage linéaire
- Système laser
- Utiliser un système laser pulsé (voir tableau des matériaux) centré à 1025 nm ± 5 nm. Le laser est réglé à 40 W, 200 kHz (200 μJ/impulsion) avec une largeur d’impulsion de ~290 fs.
REMARQUE : Le taux de répétition exact peut varier, et un laser à taux de répétition élevé fonctionne généralement mieux pour ce microscope VSFG. - Guidez la sortie du laser d’amorçage dans un amplificateur paramétrique optique (OPA) commercial pour générer un faisceau dans l’infrarouge moyen (MIR) (voir le tableau des matériaux). Réglez le MIR sur la fréquence des centres d’intérêt (Figure 1A).
NOTE : Dans la présente étude, le MIR est centré à 3450 nm ± 85 nm (~2900 ± 72 cm-1) avec une durée d’impulsion de ~290 fs et une énergie d’impulsion de ~6 μJ, ce qui englobe une partie de la région du groupe fonctionnel -CHx .
- Utiliser un système laser pulsé (voir tableau des matériaux) centré à 1025 nm ± 5 nm. Le laser est réglé à 40 W, 200 kHz (200 μJ/impulsion) avec une largeur d’impulsion de ~290 fs.
- Poutre de conversion ascendante
- Faire passer le faisceau résiduel de 1025 nm de l’OPA à travers un étalon Fabry-Perot (voir Tableau des matériaux) pour produire un faisceau de conversion ascendante spectralement rétréci avec une FWHM de ~4,75 cm-1.
- Filtrez spatialement le faisceau rétréci de 1025 nm avec un trou d’épingle en saphir de 8 μm.
REMARQUE : Le faisceau de 1025 nm peut être visualisé à l’aide d’une carte NIR. - Contrôlez la polarisation de l’impulsion de 1025 nm à l’aide d’une lame d’onde λ/2 (voir le tableau des matériaux).
- Faisceau MIR
- Guidez le faisceau MIR à travers un étage de retard pour un contrôle fin du chevauchement temporel.
- Contrôlez la polarisation du MIR à l’aide d’une lame d’onde λ/2.
- Microscope VSFG
- Superposez spatialement les faisceaux de conversion ascendante et MIR sur un miroir dichroïque personnalisé (DM, Figure 1B) qui est transmissif vers MIR et réfléchissant vers NIR (voir le tableau des matériaux). Utilisez deux iris pour guider l’alignement : l’un juste après le MD et l’autre à l’extrémité. Utilisez un wattmètre après l’iris pour déterminer si le MIR est centré et utilisez une carte NIR pour localiser les positions NIR.
REMARQUE : Après le chevauchement, le faisceau NIR peut être utilisé pour guider les deux faisceaux. - Dirigez les faisceaux superposés dans un microscope inversé à l’aide d’un scanner de faisceau résonant à axe unique intégré de 325 Hz (monté sur un scanner intégré à deux positions (I2PS), Figure 1B) (voir le tableau des matériaux).
REMARQUE : Le scanner résonant projette une ligne des deux faisceaux superposés sur l’ouverture arrière de l’objectif du condenseur. Il est monté sur un curseur qui permet la reconfiguration transparente entre les modalités VSFG/SHG et fond clair. - Focaliser les deux faisceaux superposés dans l’espace sur l’échantillon à l’aide d’un objectif Schwarzschild purement réfléchissant (SO, Figure 1B,D) (voir Tableau des matériaux).
- Recueillir le signal VSFG généré par l’échantillon avec un objectif de réfraction corrigé à l’infini (RO, Figure 1B,D) (voir Tableau des matériaux).
- Guider le signal VSFG de sortie collimatée à travers un polariseur linéaire, puis à travers un système de lentilles à tube télécentrique composé de deux lentilles focales f = 60 mm (TL1 et TL2, Figure 1B,C) (voir le tableau des matériaux).
REMARQUE : L’image agrandie des lentilles du tube est formée à la fente d’entrée du monochromateur (MC, Figure 1B, C), et les données résolues dans l’espace/fréquence sont détectées sur un détecteur CCD bidimensionnel (CCD, Figure 1B).
- Superposez spatialement les faisceaux de conversion ascendante et MIR sur un miroir dichroïque personnalisé (DM, Figure 1B) qui est transmissif vers MIR et réfléchissant vers NIR (voir le tableau des matériaux). Utilisez deux iris pour guider l’alignement : l’un juste après le MD et l’autre à l’extrémité. Utilisez un wattmètre après l’iris pour déterminer si le MIR est centré et utilisez une carte NIR pour localiser les positions NIR.
- Mode SHG
- Pour passer à l’imagerie SHG, bloquez le faisceau IR et faites pivoter le réseau du spectrographe à 501,5 nm pour imager le signal SHG.
- Mode fond clair
- Pour passer à l’imagerie optique à fond clair, allumez la source de lumière blanche (voir Tableau des matériaux). Déplacez le curseur intégré (I2PS, Figure 1B) pour collecter des images en fond clair dans la direction de la contre-propagation, l’objectif d’imagerie (RO) faisant office de condenseur et l’objectif de condensateur (SO) d’objectif d’imagerie.
- Formez une image de la sortie collimatée de l’objectif réfractif sur le plan du capteur d’une caméra à fond clair RVB à l’aide d’un système tube-lentille disponible dans le commerce (voir le tableau des matériaux).

Figure 1 : Microscope VSFG hyperspectral multimodal. (UNE) Vue de dessus de la configuration de base. Un laser de pompe de 1025 nm a été envoyé à un OPA pour générer une impulsion mid-IR accordable. Les 1025 nm résiduels ont souvent été rétrécis par un étalon (E) et filtrés spatialement en un faisceau gaussien par un filtre spatial (SFG). Les faisceaux de l’infrarouge moyen et de 1025 nm sont superposés dans l’espace au niveau d’un miroir dichroïque (DM) personnalisé et guidés à travers le microscope inversé (région encadrée en A). (B) Les deux faisceaux sont envoyés à un scanner de faisceau résonant de 325 Hz monté sur un curseur intégré à 2 positions (I2PS), permettant une commutation transparente entre les modalités optiques à fond clair et non linéaires. La plate-forme du microscope est équipée d’un objectif Schwarzschild (SO) à réflexion corrigé à l’infini agissant comme un condenseur et d’un objectif d’imagerie (RO) corrigé à l’infini basé sur la réfraction monté sur une platine à axe z de nanopositionnement vertical (VNP). L’OS focalise la ligne de faisceaux entrants que le scanner de faisceaux résonants réfléchit sur l’échantillon tandis que le RO recueille la section de ligne VSFG des signaux. Il est important de contrôler avec précision la position de l’axe z de l’osmose inverse avec une précision de 1 μm pour s’assurer que l’échantillon est dans les meilleures conditions focales pour une imagerie de haute qualité. La ligne collimatée du signal VSFG est ensuite dirigée vers un système de lentilles tubulaires composé de 2 lentilles tubulaires (TL1 et TL2), formant une image agrandie à la fente d’entrée du monochromateur (MC). La raie de spectres résolue en fréquence est ensuite imagée hyperspectralement sur un dispositif à couplage de charge (CCD). Après avoir collecté chaque raie hyperspectrale, l’échantillon est balayé dans l’axe perpendiculaire à l’axe de balayage du scanner à faisceau résonant à l’aide du NP. Pour collecter des images en fond clair de l’échantillon, l’I2PS est déplacé en position de fond clair et un miroir interceptant la source de lumière blanche (WLS) est installé. La lumière est ensuite focalisée par l’osmose inverse et imagée par l’OS. Une image est ensuite formée sur le plan du capteur de la caméra à fond clair (BC) au sommet du microscope inversé. (C) Vue détaillée du trajet optique à travers la zone tube-lentille dans le MC et le CCD. (D) Vue détaillée de la zone d’échantillonnage entre l’AI et le DS. Veuillez cliquer ici pour voir une version agrandie de cette figure.
2. Alignement du microscope hyperspectral et étalonnage spatial de l’axe vertical CCD
- Optimiser grossièrement la position du plan d’échantillonnage (axe z du nano-positionneur) à l’aide d’un échantillon standard de ZnO (1 μm d’épaisseur) revêtu d’une lamelle de 15 mm x 15 mm x 0,170 mm ± 0,005 mm et en le mettant au point en fond clair à l’aide de la modalité d’imagerie en fond clair.
REMARQUE : La position z de l’OI ainsi que l’alignement de la lumière blanche peuvent avoir besoin d’être ajustés si nécessaire. Une image représentative du ZnO sur le motif de verre utilisé pour l’étalonnage de l’alignement est présentée à la figure 2. - Replacez l’I2PS vers le bras d’éclairage non linéaire et optimisez la hauteur de l’échantillon pour l’intensité VSFG non résonante maximale générée par les régions ZnO observées sur la caméra CCD.
REMARQUE : La position z de l’OI doit être ajustée pour une intensité maximale. Il peut être nécessaire d’itérer plusieurs fois les étapes 2.1 et 2.2 avant que la hauteur optimale de l’échantillon et l’osmose inverse ne soient atteintes. - Allumez le scanner de faisceau résonant et collectez une ligne d’images.
- Collectez des images d’intensité non résonante en balayant l’échantillon perpendiculairement à la direction du scanner de faisceau. Prenez des tranches verticales des données d’image et établissez le rapport pixel/micron. (voir la figure 3 et sa légende).
REMARQUE : La dérivée de ces sections de ligne est analysée pour produire le rapport pixel/micron de l’axe vertical CCD qui sera utilisé pour les images futures.

Figure 2 : Qualité d’image représentative pour l’alignement approximatif de la modalité d’imagerie en fond clair d’un motif ZnO. Veuillez cliquer ici pour voir une version agrandie de cette figure.
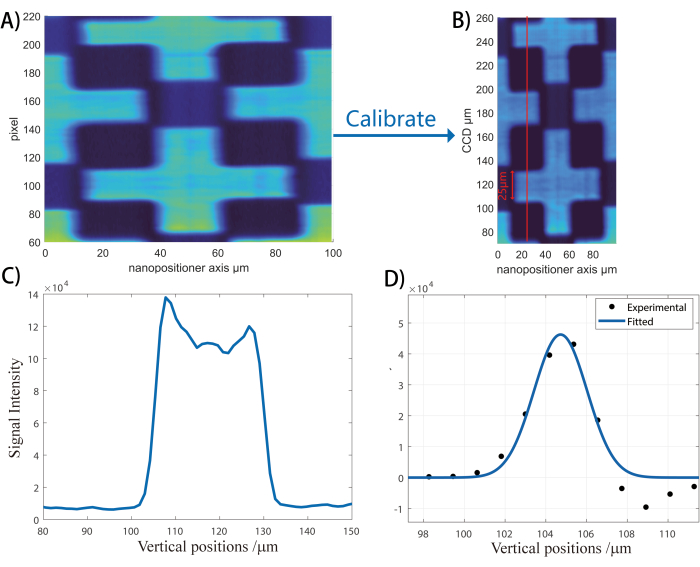
Figure 3 : Workflow d’étalonnage de l’axe vertical. Cette figure illustre comment convertir les pixels CCD en dimensions spatiales verticales en μm. (A) Une image est collectée et reconstruite de la lamelle à motif ZnO. Ensuite, la distance en pixels de l’un à l’autre bord du motif (petite barre verticale en A). Étant donné que la croix de motif ZnO est conçue pour avoir une largeur de 25 μm, on peut utiliser ici le rapport entre la largeur physique et la largeur des pixels pour calculer le rapport physique/dimension des pixels. Une image représentative calibrée sur l’axe vertical est illustrée en (B). (C) Enfin, une tranche verticale est prise comme indiqué par la ligne rouge. (D) La dérivée de la tranche verticale est prise pour obtenir la résolution spatiale. La dérivée de la tranche verticale est utilisée pour obtenir la résolution spatiale. Veuillez cliquer ici pour voir une version agrandie de cette figure.
3. Collecte de données hyperspectrales
- Collectez les spectres d’une ligne verticale des signaux VSFG sur le CCD, dont les spectres sont dispersés le long de l’axe horizontal et les positions spatiales sont enregistrées sur l’axe vertical du CCD.
REMARQUE : Il en résulte un jeu de données bidimensionnel pour une section d’une seule ligne. - Une fois que la section linéaire de l’échantillon a été imagée hyperspectralement, balayez l’échantillon dans l’axe perpendiculaire à l’axe de balayage linéaire à l’aide du nano-positionneur tridimensionnel (NP, Figure 1).
REMARQUE : Le nano-positionneur 3D est important pour une précision et une reproductibilité élevées dans la localisation des régions d’échantillon (plan x-y) ainsi que pour la mise au point de l’échantillon (axe z). - Effectuez une itération entre l’étape 3.1 et l’étape 3.2 pour collecter une image hyperspectrale VSFG.
4. Analyse de données hyperspectrales
- Démixez spectralement les données à l’aide du flux de travail de la bibliothèque d’imagerie hyperspectrale de la boîte à outils d’imagerieMatLab 41.
REMARQUE : Le démixage spectral permet de corréler les emplacements spatiaux à des spectres uniques. Le code Matlab pour l’analyse des données hyperspectrales est fourni dans le fichier supplémentaire 1.- Créez un hypercube à 4 dimensions (x = spatial, y = spatial, z = intensité dépendante de la fréquence, ω = fréquence) à l’aide de la fonction hypercube de la bibliothèque d’imagerie hyperspectrale de la boîte à outils de traitement d’images Matlab41.
- Identifiez le nombre de spectres uniques à l’aide de la fonction countEndmembersHFC avec une valeur de probabilité de fausse alarme (PFA) de 10 à 7.
- Identifiez des spectres uniques à l’aide de la fonction de démixage spectral nfindr .
- Enfin, à l’aide de la fonction sid , associez chaque pixel à l’un des spectres uniques identifiés à l’étape précédente.
REMARQUE : Des méthodes supplémentaires de démixage et d’appariement spectral peuvent être effectuées avec d’autres fonctions/algorithmes proposés dans la bibliothèque d’imagerie hyperspectraleMatLab 41.
- Ajustez la somme des données de chaque feuille isolée à la fonction de Voigt42 (Fichier supplémentaire 1).
NOTE : La fonction lorentzienne représente la limite de forme de ligne homogène pure, tandis que la fonction gaussienne provient de limites inhomogènes. En réalité, les systèmes pourraient être dans une combinaison de limites homogènes et inhomogènes, ce qui nécessite une fonction de Voigt - une pratique courante pour la spectroscopie de phase condensée, y compris le VSFG.
5. Analyse géométrique de l’échantillon
- Déterminer la géométrie des échantillons en suivant la procédure mentionnée à l’étape 5.2-5.3. Dans cette étude, SDS@2 β-CD est utilisé comme exemple. Dériver les éléments tensoriels de χ(2) en fonction de la symétrie C7 de la sous-unité moléculaire de l’échantillon de méso-feuillets SDS@2 β-CD.
NOTE : La symétrie admise χ(2) dépend de la symétrie. Pour calculer la susceptibilité non linéaire autorisée de toute symétrie, reportez-vous à la référence43. - Appliquez la rotation d’Euler27 pour relier les mesures de la trame de laboratoire à la trame moléculaire.
NOTE : Dans le cas de SDS@2 β-CD, sa symétrie C7 conduit à huit équations indépendantes reliant 8 sorties (trame de laboratoire χ(2)) à 8 entrées (6 hyperpolarisabilités indépendantes β(2), et deux angles : Θ, l’angle d’inclinaison par rapport au plan d’échantillonnage de toutes les feuilles, et φ, la rotation dans le plan de la feuille (Figure 4)). Deux feuillets sont utilisés pour extraire les alignements moléculaires communs des deux feuillets. Les relations entre φ1 et φ2 (angle de rotation dans le plan des deux feuilles) peuvent être extraites des images à fond clair. Dans l’exemple actuel, φ2 = φ1 + 60°. On suppose que toutes les unités moléculaires tuent au même angle, donc Θ1 = Θ2. Il en résulte 11 inconnues (9 inconnues indépendantes, dont 6 hyperpolarisabilités indépendantes β(2), Θ 1 et φ1, et le rapport de couverture relatif entre les feuillets N et les deux angles dépendants, qui sont φ 2 et Θ2) pour 16 connus (8 polarisations de trame de laboratoire par feuille, et deux feuillets). - Reliez le cadre de laboratoire résolu par polarisation χ(2) et l’hyperpolarisabilité du cadre moléculaire β(2) avec un solveur de fonction de réseau neuronal.
NOTA : Un résumé détaillé de cette approche se trouve à la référence27.- Créez un modèle de réseau neuronal en couches en Python44à l’aide de Keras composé d’une structure de nœuds 200-100-50 et d’une fonction d’activation tangente hyperbolique.
- Créez une matrice de 100000 x 11 générée aléatoirement de valeurs de β(2), Θ 1, Θ 2, φ1, φ 2 et N. Calculer le cadre de laboratoire correspondant 16 χ(2), en utilisant l’équation déterminée en 5.2 par les rotations d’Euler.
- Utilisez les valeurs calculées de χ(2) (un total de 100 000 par 16 valeurs) en entrée et apprenez à prédire 11 valeurs (β(2), Θ1, Θ 2, φ1, φ 2 et N) lorsque vous fournissez 16 valeurs de χ(2).
- Une fois formé, utilisez un autre ensemble de 1000 entrées avec les entrées et les sorties pour tester le modèle entraîné. La sortie prédite et la sortie réelle doivent montrer une relation linéaire avec une pente de 1.
- Enfin, fournissez le χ(2) mesuré expérimentalement à partir de deux feuilles (chaque feuille a 8 χ(2) mesurés), et utilisez le modèle entraîné pour prédire l’angle d’inclinaison Θ, ainsi que d’autres propriétés.
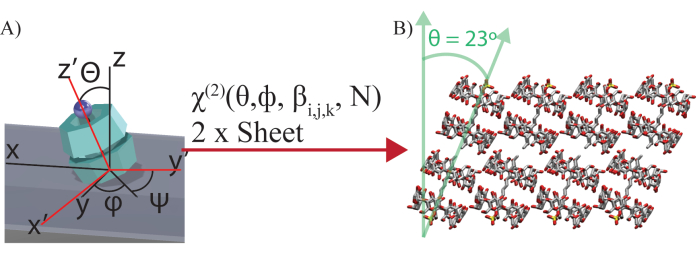
Figure 4 : Illustration de la transformation d’Euler. (A) Illustration de la transformation d’Euler entre la susceptibilité du second ordre des coordonnées de laboratoire (XYZ) χ(2) et l’hyperpolarisabilité des coordonnées moléculaires (xyz) βijk. z-y'-z'' La rotation d’Euler est effectuée sur les coordonnées moléculaires, avec φ comme angle de rotation dans le plan, θ comme angle d’inclinaison et ψ comme angle de torsion. ψ est intégré pour des angles de torsion arbitraires autour de l’axe moléculaire. φ n’est pas intégré car toutes les molécules tournent à un angle spécifique par rapport au cadre du laboratoire pour former les feuilles auto-assemblées. N est la couverture relative de la surface des deux feuilles. (B) Visualisation des sous-unités inclinées formant une feuille déterminée par les résultats du réseau de neurones. Ce chiffre a été modifié à partir de Wagner et al.27. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Access restricted. Please log in or start a trial to view this content.
Résultats
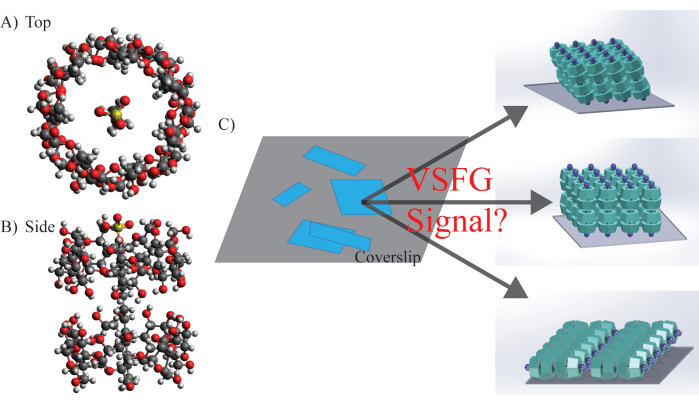
Figure 5 : Structure moléculaire, morphologie et orientation potentielle du SDS@β-CD. (A) Vue de dessus et (B) Vue de côté Structure chimique du SDS@β-CD. (C) Distribution hétérogène représentative de l’échantillon des feuilles de méso-échelle sur le plan de l’échantillonnage. La so...
Access restricted. Please log in or start a trial to view this content.
Discussion
Les étapes les plus critiques vont de 1,42 à 1,44. Il est essentiel de bien aligner l’objectif pour obtenir une résolution spatiale optique. Il est également important de collecter le signal émis, de le relayer et de projeter le faisceau de balayage sous forme de ligne au niveau des fentes d’entrée. Des alignements appropriés garantiraient la meilleure résolution et le meilleur rapport signal/bruit. Pour un échantillon typique, comme SDS@2 β-CD 100 μm par 100 μm de feuilles, une image de bonne résolution...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Le développement de l’instrument est soutenu par la subvention NSF CHE-1828666. ZW, JCW et WX sont soutenus par les National Institutes of Health, National Institute of General Medical Sciences, subvention 1R35GM138092-01. BY est soutenu par l’Association pour la promotion de l’innovation des jeunes de l’Académie chinoise des sciences (CAS, 2021183).
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 1x Camera Por | Thorlabs | WFA4100 | connect a camera to a microscope or optical system |
| 25.0 mm Right-Angle Prism Mirror, Protected Gold | Thorlabs | MRA25-M01 | reflect light and produce retroreflection, redirecting light back along its original path |
| 3” Universal Post Holder-5 Pack | Thorlabs | UPH3-P5 | hold and support posts of various sizes and configurations |
| 30 mm to 60 mm Cage Plate, 4 mm Thick | Thorlabs | LCP4S | convert between a 30 mm cage system and a 60 mm cage system |
| 500 mm Tall Cerna Body with Epi Arm | Thorlabs | CEA1500 | provide the function of enabling top illumination techniques in microscopy |
| 60 mm Cage Mounted Ø50.0 mm Iris | Thorlabs | LCP50S | control the amount of light passing through an optical system |
| 60 mm Cage Mounting Bracket | Thorlabs | LCP01B | mount and position a 60 mm cage system in optical setups |
| Air spaced Etalon | SLS Optics Ltd. | Customized | generate narrow-band 1030 nm light |
| Cage Plate Mounting Bracket | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| CCD | Andor Technologies | Newton | 2D CCD for frequency and spatial resolution |
| Collinear Optical Parametric Amplifier | Light Conversion | Orpheus-One-HP | Tunable MID light generator |
| Copper Chloride | Thermo Fischer Scientific | A16064.30 | Self-assembly component |
| Customized Dichroic Mirror | Newport | Customized | selectively reflects or transmits light based on its wavelength or polarization |
| Ext to M32 Int Adapter | Thorlabs | SM1A34 | provide compatibility and facilitating the connection between components with different thread types |
| Infinity Corrected Refractive Objective | Zeiss | 420150-9900-000 | Refractive Objective |
| Infinity Corrected Schwarzschild Objective | Pike Technologies Inc. | 891-0007 | Reflective objective |
| Laser | Carbide, Light-Conversion | C18212 | Laser source |
| M32x0.75 External to Internal RMS | Thorlabs | M32RMSS | adapt or convert the threading size or type of microscope objectives |
| M32x0.75 External to M27x0.75 Internal Engraving | Thorlabs | M32M27S | adapt or convert the threading size or type of microscope objectives |
| Manual Mid-Height Condenser Focus Module | Thorlabs | ZFM1030 | adjust the focus of an optical element |
| Monochromator | Andor Technologies | Shamrock 500i | Provides frequency resolution for each line scan |
| Motorized module with 1" Travel for Edge-Mounted Arms | Thorlabs | ZFM2020 | control the vertical positon of the imaging objective |
| Nanopositioner | Mad City Labs Inc. | MMP3 | 3D sample stage |
| Resonant Scanner | EOPC | SC-25 | 325Hz resonant beam scanner |
| RGB Color CCD Camera | Thorlabs | DCU224C | Brightfield camera, discontinued but other cameras will work just as well |
| RGB tube lens | Thorlabs | ITL200 | white light collection |
| Right Angle Kinematic Breadboard | Thorlabs | OPX2400 | incorporate a sliding mechanism with two fixed positions |
| Right Angle Kinematic Mirror Mount, 30 mm | Thorlabs | KCB1 | hold and adjust mirrors at a precise angle |
| Right Angle Kinematic Mirror Mount, 60 mm | Thorlabs | KCB2 | hold and adjust mirrors at a precise angle |
| SM2, 60 mm Cage Arm for Cerna Focusing Stage | Thorlabs | CSA2100 | securely mount and position condensers |
| Snap on Cage Cover for 60 mm Cage, 24 in Long, | Thorlabs | C60L24 | enclose and protect the components inside the cage |
| Sodium dodecyl sulfate | Thermo Fischer Scientific | J63394.AK | Self-assembly component |
| Three-Chnnale Controller and Knob Box for 1" Cerna Travel Stages | Thorlabs | MCM3001 | control ZFM2020 |
| Tube lens | Thorlabs | LA1380-AB - N-BK7 | SFG signal collection |
| Visible LED Set | Thorlabs | WFA1010 | provide illumination in imaging setup |
| Whitelight Source | Thorlabs | WFA1010 | Whitelight illumination source for brightfield imaging |
| WPH05M-1030 - Ø1/2" Zero-Order Half-Wave Plate, Ø1" Mount, 1030 nm | Thorlabs | WPH05M-1030 | alter the polarization state of light passing through it |
| WPLQ05M-3500 - Ø1/2" Mounted Low-Order Quarter-Wave Plate, 3.5 µm | Thorlabs | WPLQ05M-3500 | alter the polarization state of light passing through it |
| X axis Long Travel Steel Extended Contact Slide Stages | Optosigma | TSD-65122CUU | positioning stages that offer extended travel in the horizontal (X) direction |
| XT95 4in Rail Carrier | Thorlabs | XT95RC4 | mount and position optical components |
| X-Y Axis Translation Stage w/ 360 deg. Rotation | Thorlabs | XYR1 | precise movement and positioning of objects in two dimensions, along with the ability to rotate the platform |
| XY(1/2") Linear Translator with Central SM1 Thru Hole | Thorlabs | XYT1 | provide precise movement and positioning in two dimensions |
| Yb doped Solid State Laser | Light Conversion | CB3-40W | Seed laser |
| β-Cyclodextrin | Thermo Fischer Scientific | J63161.22 | Self-assembly component |
Références
- Zhu, X. D., Suhr, H., Shen, Y. R. Surface vibrational spectroscopy by infrared-visible sum frequency generation. Physical Review B. 35 (6), 3047-3050 (1987).
- Shen, Y. R. Surface properties probed by second-harmonic and sum-frequency generation. Nature. 337 (6207), 519-525 (1987).
- Li, Y., Shrestha, M., Luo, M., Sit, I., Song, M., Grassian, V. H., Xiong, W. Salting up of proteins at the air/water interface. Langmuir. 35 (43), 13815-13820 (2019).
- Wang, C., Li, Y., Xiong, W. Extracting molecular responses from ultrafast charge dynamics at material interfaces. Journal of Materials Chemistry C. 8 (35), 12062-12067 (2020).
- Nihonyanagi, S., Mondal, J. A., Yamaguchi, S., Tahara, T. Structure and dynamics of interfacial water studied by heterodyne-detected vibrational sum-frequency generation. Annual Review of Physical Chemistry. 64 (1), 579-603 (2013).
- Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast dynamics at water interfaces studied by vibrational sum frequency generation spectroscopy. Chemical Reviews. 117 (16), 10665-10693 (2017).
- Singh, P. C., Nihonyanagi, S., Yamaguchi, S., Tahara, T. Ultrafast vibrational dynamics of water at a charged interface revealed by two-dimensional heterodyne-detected vibrational sum frequency generation. The Journal of Chemical Physics. 137 (9), 094706(2012).
- Jubb, A. M., Hua, W., Allen, H. C. Environmental chemistry at vapor/water interfaces: insights from vibrational sum frequency generation spectroscopy. Annual Review of Physical Chemistry. 63 (1), 107-130 (2012).
- Ishiyama, T., Sato, Y., Morita, A. Interfacial structures and vibrational spectra at liquid/liquid boundaries: molecular dynamics study of water/carbon tetrachloride and water/1,2-dichloroethane interfaces. The Journal of Physical Chemistry C. 116 (40), 21439-21446 (2012).
- Sapi, A., Liu, F., Cai, X., Thompson, C. M., Wang, H., An, K., Krier, J. M., Somorjai, G. A. Comparing the catalytic oxidation of ethanol at the solid-gas and solid-liquid interfaces over size-controlled pt nanoparticles: striking differences in kinetics and mechanism. Nano Letters. 14 (11), 6727-6730 (2014).
- Chen, X., Wang, J., Sniadecki, J. J., Even, M. A., Chen, Z. Probing α-helical and β-sheet structures of peptides at solid/liquid interfaces with SFG. Langmuir. 21 (7), 2662-2664 (2015).
- Dramstad, T. A., Wu, Z., Gretz, G. M., Massari, A. M. Thin films and bulk phases conucleate at the interfaces of pentacene thin films. The Journal of Physical Chemistry C. 125 (30), 16803-16809 (2021).
- Xiang, B., Li, Y., Pham, C. H., Paesani, F., Xiong, W. Ultrafast direct electron transfer at organic semiconductor and metal interfaces. Science Advances. 3 (11), e1701508(2017).
- Livingstone, R. A., Nagata, Y., Bonn, M., Backus, E. H. G. Two types of water at the water-surfactant interface revealed by time-resolved vibrational spectroscopy. Journal of the American Chemical Society. 137 (47), 14912-14919 (2015).
- Wagner, J. C., Hunter, K. M., Paesani, F., Xiong, W. Water capture mechanisms at zeolitic imidazolate framework interfaces. Journal of the American Chemical Society. 143 (50), 21189-21194 (2021).
- Montenegro, A., Dutta, C., Mammetkuliev, M., Shi, H., Hou, B., Bhattacharyya, D., Zhao, B., Cronin, S. B., Benderskii, A. V. Asymmetric response of interfacial water to applied electric fields. Nature. 594 (7861), 62-65 (2021).
- Nihonyanagi, S., Ishiyama, T., Lee, T., Yamaguchi, S., Bonn, M., Morita, A., Tahara, T. Unified molecular view of the air/water interface based on experimental and theoretical χ(2) spectra of an isotopically diluted water surface. Journal of the American Chemical Society. 133 (42), 16875-16880 (2011).
- Shen, Y. R., Ostroverkhov, V. Sum-frequency vibrational spectroscopy on water interfaces: polar orientation of water molecules at interfaces. Chemical Reviews. 106 (4), 1140-1154 (2006).
- Hosseinpour, S., Roeters, S. J., Bonn, M., Peukert, W., Woutersen, S., Weidner, T. Structure and dynamics of interfacial peptides and proteins from vibrational sum-frequency generation spectroscopy. Chemical Reviews. 120 (7), 3420-3465 (2020).
- Wang, H., Xiong, W. Vibrational sum-frequency generation hyperspectral microscopy for molecular self-assembled systems. Annual Review of Physical Chemistry. 72 (1), 279-306 (2021).
- Wang, H. -F., Velarde, L., Gan, W., Fu, L. Quantitative sum-frequency generation vibrational spectroscopy of molecular surfaces and interfaces: lineshape, polarization, and orientation. Annual Review of Physical Chemistry. 66 (1), 189-216 (2015).
- Inoue, K., Ahmed, M., Nihonyanagi, S., Tahara, T. Reorientation-induced relaxation of free oh at the air/water interface revealed by ultrafast heterodyne-detected nonlinear spectroscopy. Nature Communications. 11 (1), 5344(2020).
- Wang, H., Gao, T., Xiong, W. Self-phase-stabilized heterodyne vibrational sum frequency generation microscopy. ACS Photonics. 4 (7), 1839-1845 (2017).
- Wang, H., Xiong, W. Revealing the molecular physics of lattice self-assembly by vibrational hyperspectral imaging. Langmuir. 38 (10), 3017-3031 (2022).
- Raghunathan, V., Han, Y., Korth, O., Ge, N. -H., Potma, E. O. Rapid vibrational imaging with sum frequency generation microscopy. Optics Letters. 36 (19), 3891(2011).
- Wang, H., Wagner, J. C., Chen, W., Wang, C., Xiong, W. Spatially dependent h-bond dynamics at interfaces of water/biomimetic self-assembled lattice materials. Proceedings of the National Academy of Sciences. 117 (38), 23385-23392 (2020).
- Wagner, J. C., Wu, Z., Wang, H., Xiong, W. Imaging orientation of a single molecular hierarchical self-assembled sheet: the combined power of a vibrational sum frequency generation microscopy and neural network. The Journal of Physical Chemistry B. 126 (37), 7192-7201 (2022).
- Han, Y., Hsu, J., Ge, N. -H., Potma, E. O. Polarization-sensitive sum-frequency generation microscopy of collagen fibers. The Journal of Physical Chemistry B. 119 (8), 3356-3365 (2015).
- Chung, C. -Y., Potma, E. O. Biomolecular imaging with coherent nonlinear vibrational microscopy. Annual Review of Physical Chemistry. 64 (1), 77-99 (2013).
- Potma, E. O. Advances in vibrationally resonant sum-frequency generation microscopy. Optics in the Life Sciences Congress. , OSA: Washington, DC, 2017. p NM4C.2 (2017).
- Han, Y., Raghunathan, V., Feng, R. R., Maekawa, H., Chung, C. -Y. Y., Feng, Y., Potma, E. O., Ge, N. -H. H. Mapping molecular orientation with phase sensitive vibrationally resonant sum-frequency generation microscopy. The Journal of Physical Chemistry B. 117 (20), 6149-6156 (2013).
- Hsu, J., Haninnen, A., Ge, N. -H., Potma, E. O. Molecular imaging with sum-frequency generation microscopy. Optics in the Life Sciences. , OSA: Washington, DC, 2015. p NT4C.4 (2015).
- Hanninen, A., Shu, M. W., Potma, E. O. Hyperspectral imaging with laser-scanning sum-frequency generation microscopy. Biomedical Optics Express. 8 (9), 4230(2017).
- Wang, H., Chen, W., Wagner, J. C., Xiong, W. Local ordering of lattice self-assembled SDS@2β-CD materials and adsorbed water revealed by vibrational sum frequency generation microscope. The Journal of Physical Chemistry B. 123 (29), 6212-6221 (2019).
- Cimatu, K., Baldelli, S. Chemical imaging of corrosion: sum frequency generation imaging microscopy of cyanide on gold at the solid−liquid interface. Journal of the American Chemical Society. 130 (25), 8030-8037 (2008).
- Shah, S. A., Baldelli, S. Chemical imaging of surfaces with sum frequency generation vibrational spectroscopy. Accounts of Chemical Research. 53 (6), 1139-1150 (2020).
- Wagner, J. ackson C., Zishan, W. u, Xiong, W. Multimodal nonlinear vibrational hyperspectral imaging. ChemRxiv. , (2023).
- Yan, C., Wagner, J., Wang, C., Ren, J., Lee, C., Wan, Y., Wang, S., Xiong, W. Multi-dimensional widefield infrared-encoded spontaneous emission microscopy: distinguishing chromophores by ultrashort infrared pulses. ChemRxiv. , (2023).
- Lin, Y., Fromel, M., Guo, Y., Guest, R., Choi, J., Li, Y., Kaya, H., Pester, C. W., Kim, S. H. Elucidating interfacial chain conformation of superhydrophilic polymer brushes by vibrational sum frequency generation spectroscopy. Langmuir. 38 (48), 14704-14711 (2022).
- Choi, J., Lee, J., Makarem, M., Huang, S., Kim, S. H. Numerical simulation of vibrational sum frequency generation intensity for non-centrosymmetric domains interspersed in an amorphous matrix: a case study for cellulose in plant cell wall. The Journal of Physical Chemistry B. 126 (35), 6629-6641 (2022).
- Matlab Image Processing Toolbox Hyperspectral Imaging Library. , The Mathworks, Inc., Natick, MA USA. Google Scholar Forthcoming.
- Armstrong, B. H. Spectrum line profiles: the Voigt function. Journal of Quantitative Spectroscopy and Radiative Transfer. 7 (1), 61-88 (1967).
- Wu, Z., Xiong, W. Neumann's principle based eigenvector approach for deriving non-vanishing tensor elements for nonlinear optics. The Journal of Chemical Physics. 157 (13), 134702(2022).
- Chollet, F. Keras Neural Network Library. https://github.com/fchollet/keras accessed Apr 12. , (2021).
- Vicidomini, G., Bianchini, P., Diaspro, A. STED super-resolved microscopy. Nature Methods. 15 (3), 173-182 (2018).
- Xiong, W., Laaser, J. E., Mehlenbacher, R. D., Zanni, M. T. Adding a dimension to the infrared spectra of interfaces using heterodyne detected 2D sum-frequency generation (HD 2D SFG) spectroscopy. Proceedings of the National Academy of Sciences. 108 (52), 20902-20907 (2011).
- Lukas, M., Backus, E. H. G., Bonn, M., Grechko, M. Passively stabilized phase-resolved collinear sfg spectroscopy using a displaced sagnac interferometer. The Journal of Physical Chemistry A. 126 (6), 951-956 (2022).
- Ji, N., Ostroverkhov, V., Chen, C., Shen, Y. Phase-sensitive sum-frequency vibrational spectroscopy and its application to studies of interfacial alkyl chains. Journal of the American Chemical Society. 129 (33), 10056-10057 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon