このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Methods Article
腫瘍微小環境に対する温熱療法の影響を調査するための計算モデリングアプローチ
要約
この記事では、双極子高周波温熱療法システムによって供給される加熱後の間質流体圧力の過渡温度プロファイルと結合時空間変動をシミュレートするプロトコルについて説明します。このプロトコルは、インターベンショナル温熱療法技術に対する腫瘍微小環境を特徴付ける生物物理学的パラメータの応答を評価するために使用できます。
要約
腫瘍微小環境の生物物理学的特性は、正常組織とは大きく異なります。血管性の低下、リンパドレナージの欠如、間質圧の上昇など、さまざまな特徴が、治療薬の腫瘍への浸透を減少させます。腫瘍内の局所温熱療法は、間質液圧などの微小環境特性を変化させる可能性があり、薬物浸透の改善につながる可能性があります。この文脈では、マルチフィジックス計算モデルは、腫瘍微小環境内の生物物理学的パラメータ間の相互作用に関する洞察を提供し、局所温熱療法の生体効果をテストする実験の設計と解釈を導くことができます。
この論文では、電流分布、生体熱伝達、および流体力学を記述する偏微分方程式を結合する計算モデルのための段階的なワークフローについて説明します。主な目的は、バイポーラ無線周波デバイスによってもたらされる温熱療法が腫瘍内の間質液圧に及ぼす影響を研究することです。電流分布、生体熱伝達、および間質流体圧力をリンクする数式のシステムを提示し、熱介入によって誘発される可能性のある間質流体圧力の分布の変化を強調します。
概要
間質液圧 (IFP) の上昇は、固形腫瘍の特徴です1.過透過性血管から間質への体液の漏出は、腫瘍内静脈の圧迫とリンパ管の不在による体液の排出によって不均衡になります1,2,3。固形応力や硬直など、腫瘍微小環境(TME)内で異常な他の生物物理学的パラメータと協調して、IFPの上昇は全身および局所の薬物送達の有効性を損ないます4,5,6。固形腫瘍の間質液圧は、正常組織の1〜3mmHgと比較して、5mmHg(膠芽腫および黒色腫)から30mmHg(腎細胞癌)の範囲です2。高IFPは、腫瘍の縁に向かう流体の流れを増加させる原因となり、間質細胞、浸潤細胞、およびその他の細胞外成分をせん断応力にさらします1,4。機械生物学的変化は、例えば、血管新生、がん細胞の遊走および浸潤をサポートする内皮発芽の増加、トランスフォーミング成長因子β(TGF-β)発現、および間質硬化7,8,9を増加させることにより、免疫抑制性TMEを維持します。
いくつかの研究では、低強度超音波、高強度集束超音波、パルス電界、および温熱療法5,10,11を含む、IFPを減少させることを目的としたエネルギーベースの治療法が検討されています。軽度の温熱療法と呼ばれる40〜43°Cの範囲の温度への加熱は、腫瘍の血液灌流を増加させることが示されており、したがって、血管内血管の拡張および間質液の排出を促進することにより、圧迫された静脈の拡張および血管圧の低下に寄与する可能性がある11,12。最近のいくつかの研究では、温熱療法がIFPを減少させ、その結果、腫瘍内の薬物または造影剤の分布を促進する可能性が示されています13,14。これらの研究では、無治療の対照群と比較して、温熱療法後のT細胞浸潤の増加も示されています13。
in vivo小動物実験からの有望な結果は、TME内の物理的パラメータが物理的介入によってどのように影響を受けるかについての理解を深めるために、計算的アプローチを用いたさらなる研究を動機付けている4,15,16,17。計算モデルの結果は、局所的な加熱(またはその他の外部エネルギー源)とIFPの根底にある因果関係を明らかにするためのin vivo実験研究を補完することができます。これは、カテーテルおよび針ベースの圧力トランスデューサ(通常はポイント測定9、16、18、19)を使用してIFPの空間変動を測定する際の課題を考えると、特に有益です。薬物送達の文脈では、適切な加熱プロトコルと薬物注射の時間枠を定義するために、主要な生物物理学的メカニズムの理解が不可欠であり、効果的な薬物分布の可能性を高めます。IFPを含むがこれに限定されない、TMEの生物物理学的特性の変化に関する定量的情報も、外部刺激に対する免疫学的応答(T細胞浸潤など)の解釈に関する洞察を与える可能性があります。
腫瘍IFPプロファイルへの熱媒介性変化の計算モデリングのためのプロトコルを提示します。具体的には、このプロトコルでは、高周波電流で制御された温熱療法を提供するためのカスタム小動物装置をモデル化する方法、加熱後の過渡温度プロファイルをシミュレートする方法、および流体力学シミュレーションを組み合わせて温熱療法に応答する腫瘍IFPの時空間変動を計算する方法を詳しく説明しています。このモデルは、以前の実験的研究20で皮下腫瘍モデル(McArdle RH7777、ATCC)で使用した実験セットアップの本質的な特徴を反映しています。
図1は、正常組織に囲まれた腫瘍におけるIFPの熱誘起変化を計算するために実装した計算モデルを示しています。腫瘍に挿入された一対の皮下注射針は、500 kHz の高周波電流で加熱を提供するようにモデル化されています。多孔質材料は腫瘍領域で想定され、固相は固体の細胞外マトリックスを表し、液相は間質液を表す2つの相で構成されています。温度の上昇など、外部刺激による圧力変化やマトリックス変形の場合、固体成分と流体成分は再配置されます。これにより、細胞外固体マトリックス16,17,21を通る間質液の移動が引き起こされる。
多孔質弾性理論から、応力テンソル S (Pa)(式[1])は、初期条件に対する固体成分の体積の変化を表す弾性項と、流体成分の静水圧によって誘発される応力を表す多孔質項の組み合わせです。
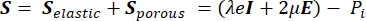 (1)
(1)
ここで、 λ、μ (Pa)はラメパラメータ、 E はひずみテンソル、 e は体積ひずみテンソル、 Pi (Pa)は間質流体圧力(I は単位行列)です。多孔質弾性応力下の固体成分については定常状態が想定されており、応力テンソル成分は直交しています 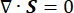 。
。
図2 は、説明された多孔質弾性モデルに実装された数学方程式のシステムと、提示されたマルチフィジックスモデルのコンポーネント間の相互作用を示しています。計算シミュレーションのワークフローには、次のものが含まれます。
電気問題方程式。電気的問題方程式の解は、時間平均化されたRF熱源Q(ジュール加熱)を提供します。この目的のために、マクスウェル方程式の準静的近似を使用して、時間平均電場 E (V / m)の分布を計算します(図2、ブロック1)。
熱問題方程式。ペンネスバイオヒート方程式(図2、ブロック2)の解は、吸収された電磁エネルギーにリンクされた熱源(Q)、組織の熱伝導にリンクされたパッシブ加熱(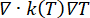 )、および組織血液灌流のヒートシンク効果(cWb(T)(T - Tb)の結果としての温度T(°C)の空間的および時間的変動を提供します)).ヒートシンクの項は、微小血管系を流れる血液と、電磁力が吸収される隣接組織との間の熱交換に近似しています。熱伝達方程式には、多孔質弾性モデルの細胞外マトリックスを通る間質流体の移動によって引き起こされる温度の変化を表す移流項(
)、および組織血液灌流のヒートシンク効果(cWb(T)(T - Tb)の結果としての温度T(°C)の空間的および時間的変動を提供します)).ヒートシンクの項は、微小血管系を流れる血液と、電磁力が吸収される隣接組織との間の熱交換に近似しています。熱伝達方程式には、多孔質弾性モデルの細胞外マトリックスを通る間質流体の移動によって引き起こされる温度の変化を表す移流項(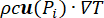 )も含まれています。ただし、この用語は、温度変化の原因となる他のメカニズムと比較して、温度プロファイルにほとんど影響を与えません。
)も含まれています。ただし、この用語は、温度変化の原因となる他のメカニズムと比較して、温度プロファイルにほとんど影響を与えません。
流体力学問題方程式。質量保存方程式(図2、ブロック3)とダーシーの法則(図2、ブロック4)を組み合わせると、流体のソース(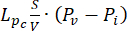 )とシンク(
)とシンク(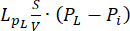 )のバランスから生じる格子間流体圧力Piの空間的および時間的変動が出力として得られます。質量保存方程式の左側にある過渡圧力項
)のバランスから生じる格子間流体圧力Piの空間的および時間的変動が出力として得られます。質量保存方程式の左側にある過渡圧力項 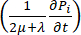 は、多孔質弾性材料内の流体成分と固体成分の再配置を表します。これは、温度の関数としての血管圧Pvの変化によって引き起こされる間質液圧P iの変動によって引き起こされます。
は、多孔質弾性材料内の流体成分と固体成分の再配置を表します。これは、温度の関数としての血管圧Pvの変化によって引き起こされる間質液圧P iの変動によって引き起こされます。
血管圧(Pv)と間質液圧(Pi)の差が、細胞外マトリックスを流れる流体の源です。シンク項は、リンパ管(PL)と間質腔(PI)の間の圧力差に関連しています。正常組織では、リンパ管系内の圧力(~-6-0mmHg)は、間質液圧13よりも最大2倍低い。この圧力差により、リンパ管が血管壁から間質に血管外漏出する過剰な体液を排出する効果が保証されます。ここで提示した腫瘍モデルでは、リンパ系4,16,22の寄与を無視しました。
式(2)から(5)までの数式は、組織および組織血液灌流23,24の電気伝導率および熱伝導率の温度依存性を記述するために使用される。2つの異なる数学的モデルを使用して、正常組織領域と腫瘍組織領域における血液灌流の温度依存性をそれぞれ記述します24,25。このモデルは、血液灌流が温度とともに正常組織のベースラインと比較して最大9倍増加し、腫瘍領域のベースライン値の約2倍しか増加しないことを示しています。どちらのモデルでも、血液灌流の増加は、軽度の温熱療法の範囲(45°C未満)内の温度に制限されます。数式(4)と(5)は、2つの異なるタイプの組織における血液灌流の温度依存性変化の根底にあるメカニズムを完全には説明していないことに言及する価値があります。ただし、これらは、正常組織と比較して腫瘍微小環境を通常特徴付ける限定的な灌流を表すのに役立ちます。
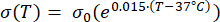 (2)
(2)
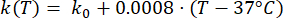 (3)
(3)
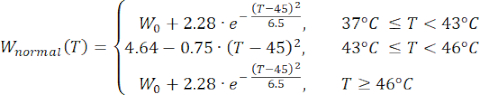 (4)
(4)
 (5)
(5)
 (6)
(6)
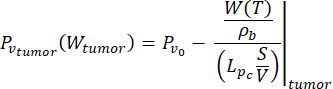 (7)
(7)
この研究では、式(6)と(7)を使用して、正常組織モデルと腫瘍組織モデル26の両方について、血管圧を血液灌流の関数としてモデル化しました。式(4)と(5)から、血流速度は血液灌流と血液密度の比として表すことができます。血流と血管圧の関係は、文献3で十分に確立されています:血流速度と血管系の幾何学的抵抗(または導電率、LP)が血管内の圧力差を決定します。血管圧は、この関係と血液灌流の温度依存モデル(式(4)および(5))を利用して、温度の関数として表すことができます(式(6)および(7))。
計算ワークフローの実装(図2)と組織モデルの温度依存性特性については、次のセクションで詳しく説明します。すべての材料特性とその説明、およびベースライン値(つまり、体温)を 表1に示します。この計算プロトコルの実装に使用されるコンピューターにインストールされたCOMSOL Multiphysicsの詳細については、 材料の表 を参照してください。電気的な問題は、AC/DCモジュールを使用してモデル化されました。バイオヒートトランスファーは、熱伝達物理学を使用してモデル化されました。流体力学の問題は、Mathematics インターフェースを使用してモデル化されました。
プロトコル
1. バイポーラ無線周波数システムのモデルを構築する
- インターフェースを設定するための準備手順
- COMSOL Multiphysics を起動し、Model Wizard をクリックします。
- Space Dimensionとして3Dを選択します。
- AC/DC Physics モジュールを選択 |電界と電流 |電流。
- 熱伝達モジュールの選択 |固体中の熱伝達。
- 数学モジュールの選択 |PDE インターフェース |係数フォームPDE。
- スタディを選択 |時間に依存します。「完了」をクリックします。
- Comsol 作業スペースが表示されたら、次の操作を行います。
- マルチフィジックスの選択 |電磁加熱。このステップでは、電磁電力損失密度が生体熱伝達方程式の熱源として自動的に結合されます。
注: マルチフィジックス が自動的に表示されない場合は、 電磁熱源 を手動で指定します(COMSOLでは 体積損失密度として表示されます)。熱源の追加方法の詳細については、「物理」セクションのステップ 2「熱問題のセットアップ」を参照してください。 - 上部のリボンから[スタディ]を選択します |学習ステップ |周波数トランジェント。
- マルチフィジックスの選択 |電磁加熱。このステップでは、電磁電力損失密度が生体熱伝達方程式の熱源として自動的に結合されます。
- ジオメトリを定義します。上部のリボンから [ジオメトリ]を選択し、次の操作を行います。
- 表 2 にリストされている寸法で 2 つのコーンを定義します。
- コーンを表2に示されている距離(間隔d、エル間)に配置します。これらの 2 つのコーンは、バイポーラ RF システムの構築に使用される 2 本の皮下注射針をモデル化します。
- 前の 2 つのコーンを複製して、針の断熱材をモデル化します。 表 2 で報告されている寸法に従って円錐のサイズを変更します。
- 円柱(高さ、hm、直径 d m)を選択して、z = - 9 mm(x = 0、y = 0)に配置された筋肉の大部分をモデル化します。各ディメンションの値を表 2 に示します。
- 円柱(高さ、 hs、直径 ds)を選択して、z = 4 mm(x = 0、y = 0)に配置されたスキンの薄い層をモデル化します。各ディメンションの値を 表 2 に示します。
- 球体(直径、 dt)を選択して、z = -0.5 mm(x = 0、y = 0)に配置された皮下腫瘍をモデル化します。腫瘍の大きさを 表2に示す。
- プロトコルの次の手順でジオメトリを選択しやすくするために、次のことをお勧めします。
- [ジオメトリ] リボンから、[仮想操作] |複合ドメインを形成します。
- 針の導電性部分に関連するすべてのドメインを選択して、複合ジオメトリを作成します。
- 同じ手順を繰り返して、針断熱材ジオメトリの複合ドメインを作成します。
- 生体組織モデルのプロパティを定義します。
注:次の手順では、式(2)〜(7)で説明される数式を実装する手順について説明します。- [コンポーネント] ノードから、右クリックして [定義] を選択します。
- 「関数」で、「分析」を選択します。
- 関数の名前(k_muscleやsigma_muscleなど)を指定し、式2と一致する数式を入力します。
- 引数として温度(T)を指定します。
- 関数の単位を指定します:電気伝導率の場合はS / m。
- 前の手順を1から3に繰り返して式3を実装し、それに応じてユニットを変更します(つまり、熱伝導率のW /(m・K))。
- 引数の単位を K (ケルビン) (温度) に指定します。プロットパラメータで、関数引数の値の範囲(つまり、温度)を指定します。このプロトコルに従うには、33-100°C(306.15-373.15K)の範囲を使用します。
- 表 1 にリストされている公称値を使用して、各組織モデル (筋肉、皮膚、腫瘍) の電気伝導率 (式 2) と熱伝導率 (式 3) の温度依存関数 (式 2) と熱伝導率 (式 3) を、表 1 から 5 まで繰り返します (正常組織とは筋肉と皮膚の両方を指します)。
- [関数] で [区分的] を選択して方程式 (4) から (7) を実装します。
- 関数 の名前 を指定します。
- 関数の引数として temperature (T) を指定します。
- 各温度間隔の数式を、式 (4) から (7) と一致するように入力します。
- 前のステップ 1 から 3 を繰り返して、 表 1 にリストされている公称値を使用して、各組織モデルの血液灌流と血管圧の温度依存関数を追加します (正常組織は筋肉と皮膚の両方を指します)。
- 材料特性をジオメトリ構成部品に割り当てます。
- コンポーネント ノードから [マテリアル] を選択します。
- ブランク材料には、正常組織、腫瘍組織、血液、PTFE、ステンレス鋼が含まれます。
- 手動選択を有効にし、指定した材料に対応するジオメトリエンティティを選択します。
- 正常組織は、筋肉と皮膚をモデル化する形状に関連付けられています。
- 腫瘍と血液組織は、腫瘍の形状に関連付けられています。
- PTFE材料は、針絶縁体をモデル化する形状に関連付けられています。
- ステンレス鋼材料は、地面とアクティブな針をモデル化する円錐形状に関連付けられています。
- 温度依存性の電気伝導率および熱伝導率23については、選択した関数の名前と、定義ノードに表示される関連する引数(すなわち、T)を入力する。
- 温度に依存しない材料特性については、表1に示すベースライン値27を参照されたい。
注:圧力16,17,26を計算するために多孔質弾性理論に依存しています。次の手順は、多孔質材料の特性を特定のドメインに割り当てる方法を示しています。 - [マテリアル]から[その他のマテリアル]を選択します。多孔質材料。
- Porous Materialを右クリックして、FluidコンポーネントとSolidコンポーネントを選択します。[Fluid ノード] を選択し、[Fluid properties] で [Blood] (前の手順で定義) を選択します。ソリッド ノードを選択し、ソリッド プロパティで 腫瘍 (前の手順で定義) を選択します。Solidノードで、θSとして定義された体積率を指定します(表 1)。
- 手動選択を有効にし、指定した材料に対応するジオメトリエンティティを選択します。このプロトコルに従うには、腫瘍領域のみが多孔質弾性ドメインであると仮定します。
- メッシュ
- メッシュノードで、サイズを選択し、事前定義されたFinerメッシュを選択します。
- メッシュノードの下にFree Tetrahedral機能を追加します。この手順により、重要な領域でメッシュを細分化できます。
注:このモデルでは、腫瘍のエッジと皮下注射針モデルの遠位端を重要な領域として特定しました。 - 対象の形状を選択し、最小のコンポーネント(針の先端など)が少なくとも4つのメッシュ要素(完全なメッシュは1,487,828の要素で構成される)によって離散化されるように、最大要素サイズ(0.25 mm)と最小要素サイズをカスタマイズします。
2. 物理学
- 電気的な問題のセットアップ
注:次の手順では、無線周波熱源(Q)を提供する電界分布(図2、ブロック1)を計算するためのパラメータを設定する方法について説明します。- 「Electric Currents」ノードを右クリックします。
- 図 3A に示す電気的境界条件では、境界として [Terminal] と [Ground] を選択します。
- [ターミナル] で、2 本の針のうちの 1 つの近位端 (上部) を手動で選択します。識別された針が入力電力を提供します。
- [ターミナル] で [電力] を選択し、目的のエネルギー プロトコルに従って値を指定します。このプロトコルに従うには、予備的なex vivo実験20に基づいて、軽度の温熱療法に0.5Wを選択します。
- 「Ground」を選択し、2本目の針の近位面を手動で選択します。この針は、電流の戻り経路の戻り電極として機能します。
- モデルの残りの外部サーフェスに 電気絶縁 を適用します。
- 温度問題のセットアップ
注:次の手順は、温度依存性の血液灌流関数(式4および5)を生体熱伝達方程式に含めて、血流によって引き起こされるヒートシンクをモデル化する方法を示しています。- Solids節点でHeat Transferを選択し、温度の初期値として33°Cを指定します。
- 血流によるヒートシンク効果をモデル化するには、 ソリッドの熱伝達を右クリックし、 熱源 ドメインを追加して、ヒートシンク効果を考慮するジオメトリ( 腫瘍 と 正常 組織)を選択します。 一般ソースを選択 | ヒートシンクの式を入力できる場所をユーザー定義します。
- 図 3B に示す熱境界条件では、Heat Transferを右クリックし、境界条件としてHeat Fluxを追加し、熱流束が適用される外部サーフェスを指定します。流束タイプとして「対流熱流束」(Convective heat flux) を選択します。熱伝達係数には、h = 15 W /(m2 ·K)皮膚と空気との間の自然な熱交換のメカニズムをモデル化する28。外部温度を指定します。T = 20 °C を使用して、実験室環境の周囲温度をモデル化します。
- 流体力学問題のセットアップ
注: 次の手順では、に示されている質量保存方程式を実装する方法について説明します。 図 2 (ブロック3)と、それが温度の変化にどのように関連しているか。- 「Coefficient Form PDE」ノードを選択し、従属変数として「圧力」を指定します。この段階で、単位Pascal(Pa)が自動的に割り当てられます。
注:シミュレーションが計算されると、選択した単位を使用して結果を表示および/またはエクスポートできます。文献との一貫性を保つために、mmHg単位を使用して結果を示します(代表的な結果のセクションを参照)。 - ソース項量として流体コンダクタンスユニット 1/s を指定します。
- 変数(Pi、この研究では 間質液圧 )を識別するための名前を定義します。
- Coefficient Form PDE ノードを右クリックし、Coefficient Form ドメインを選択します。方程式が参照する幾何学的エンティティ (tumor) を指定します。同じ手順を繰り返して、異なるPDEが適用される残りの組織(正常組織)を選択します。
- 腫瘍モデルの場合、質量保存方程式(図2ブロック3)を取得するために、次の係数と項を指定します:腫瘍の拡散係数KI(表1)。減衰係数
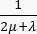 );ソース用語
);ソース用語 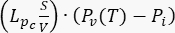 .腫瘍モデルでは、リンパ系の寄与を無視します。他のすべての係数をゼロに設定します。
.腫瘍モデルでは、リンパ系の寄与を無視します。他のすべての係数をゼロに設定します。 - 正常組織モデルでは、質量保存の方程式(図2ブロック3)を取得するために、次の係数と項を指定します:正常組織の拡散係数Ki (表1)。減衰係数
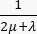 ;ソース用語
;ソース用語 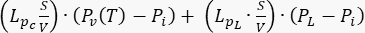 .正常な組織を正常に機能している組織と見なすには、リンパ系の寄与を考慮してください。他のすべての係数をゼロに設定します。
.正常な組織を正常に機能している組織と見なすには、リンパ系の寄与を考慮してください。他のすべての係数をゼロに設定します。 - 電磁熱シミュレーションとのリンクを作成するには、血管圧Pvを温度の関数として表します(血液灌流変数を使用、式6および7を参照)。
- Coefficient Form PDEを右クリックし、Initial Valuesを選択します。幾何学的ドメイン(腫瘍)を選択し、正常組織モデル(正常組織)に対して同じ手順を繰り返します。腫瘍組織と正常組織については、表1に記載されている値に従ってPI0を指定します。
- 図 3C に示す流体力学スタディに関連する境界条件については、Coefficient Form PDE を右クリックし、Dirichlet 境界条件を選択します。正常組織ドメインの外部サーフェスを選択し、正常組織に対応するPi0値を割り当てます(表1)。
- 「Coefficient Form PDE」ノードを選択し、従属変数として「圧力」を指定します。この段階で、単位Pascal(Pa)が自動的に割り当てられます。
3. シミュレーションを実行し、結果を表示します
注:計算前の最後のステップとして、 時間 (手順の期間をシミュレート)と 動作周波数を指定します。
- StudyノードからFrequency-Transientを選択します。
- 時間単位を指定します。
- [Output Times] から [range] (右側) を選択し、開始として 0 秒、ステップとして 5 秒、停止として 900 秒を指定します。
- [Frequency] を 500e3 Hz に設定します。
- [ コンピューティング ] を選択してシミュレーションを実行します。
- 結果を視覚化するには、ノード Results の下の Datasets を選択します。
- 右クリックして 切断面 を選択し、2D分布の可視化に使用する平面を定義します(例:y = 0の zx-plane)。
- 3D ボリューム内の カット ポイント を右クリックして選択し、時間の経過に伴うパラメータの変化を表示します。
- 上部のリボン の結果 から、
- 2Dプロットグループを選択して、上記の手順で特定された平面の1つ上の変数(温度など)の2次元分布を可視化します。
- 1Dプロットグループを選択して、上記の手順で特定したポイントまたは複数のポイントでの1D結果(時間全体の圧力など)を視覚化します。
注: このプロトコルで説明されている設定でシミュレーションを実行する時間は約 2.5 時間です。
結果
腫瘍内の高い間質液圧が均一に分布し、末梢で正常値 (0-3 mmHg) まで低下することが TME の特徴です。 図4 と 図5 は、温度(A)、格子間流体圧力(B)、流体速度(C)の初期条件(t = 0分)を示しています。加熱開始前の初期温度が33°Cのとき、腫瘍内の間質液圧の値は約9mmHgであり、末梢では3mmHgに減少します。これらの値は 、in vivo 実験中に測定された(...
ディスカッション
私たちは、腫瘍の熱および間質流体圧力プロファイルに対するRF-hyperthermiaの影響を研究するために、非定常電気熱シミュレーションと流体力学シミュレーションを組み合わせるための計算モデリングプロトコルを提示します。重要な側面は、温度と血管圧の間に存在する関係を捉えることができる数値ワークフローの構築にあり、それが間質液圧の変化を促進します。
?...
開示事項
著者には、開示すべき利益相反はありません。
謝辞
この研究は、全米科学財団(第2039014号)と国立がん研究所(R37CA269622)からの助成金によって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| COMSOL Multiphysics (v. 6.0) | COMSOL AB, Stockholm, Sweden | Software used to implement the computational workflow described in the protocol | |
| Dell 1.8.0, 11th Gen Intel(R) Core(TM) i7-11850H @ 2.50GHz, 2496 Mhz, 8 Core(s), 16 Logical Processor(s), 32 GB RAM | Dell Inc. | Laptop used to run computational simulations |
参考文献
- Nia, H. T., Munn, L. L., Jain, R. K. Physical traits of cancer. Science. 370 (6516), 546-556 (2020).
- Heldin, C. -. H., Rubin, K., Pietras, K., Östman, A. High interstitial fluid pressure - an obstacle in cancer therapy. Nature Reviews Cancer. 4 (10), 806-813 (2004).
- Jain, R. K. Determinants of tumor blood flow: a review. Cancer Research. 48, 2641-2658 (1988).
- Stylianopoulos, T., Munn, L. L., Jain, R. K. Reengineering the physical microenvironment of tumors to improve drug delivery and efficacy: from mathematical modeling to bench to bedside. Trends in Cancer. 4 (4), 292-319 (2018).
- Sheth, R. A., Hesketh, R., Kong, D. S., Wicky, S., Oklu, R. Barriers to drug delivery in interventional oncology. Journal of Vascular and Interventional Radiology. 24 (8), 1201-1207 (2013).
- Chauhan, V. P., Stylianopoulos, T., Boucher, Y., Jain, R. K. Delivery of molecular and nanoscale medicine to tumors: transport barriers and strategies. Annual Review of Chemical and Biomolecular Engineering. 2 (1), 281-298 (2011).
- Li, R., et al. Interstitial flow promotes macrophage polarization toward an M2 phenotype. Molecular Biology of the Cell. 29 (16), 1927-1940 (2018).
- Stine, C. A., Munson, J. M. Autologous gradient formation under differential interstitial fluid flow environments. Biophysica. 2 (1), 16-33 (2022).
- Provenzano, P. P., et al. Enzymatic targeting of the stroma ablates physical barriers to treatment of pancreatic ductal adenocarcinoma. Cancer Cell. 21 (3), 418-429 (2012).
- Pal, K., Sheth, R. A. Engineering the tumor immune microenvironment through minimally invasive interventions. Cancers. 15 (1), 196 (2022).
- Dunne, M., Regenold, M., Allen, C. Hyperthermia can alter tumor physiology and improve chemo- and radio-therapy efficacy. Advanced Drug Delivery Reviews. 163-164, 98-124 (2020).
- Vaupel, P., et al. From localized mild hyperthermia to improved tumor oxygenation: physiological mechanisms critically involved in oncologic thermo-radio-immunotherapy. Cancers. 15 (5), 1394 (2023).
- Stapleton, S., et al. Radiation and heat improve the delivery and efficacy of nanotherapeutics by modulating intratumoral fluid dynamics. ACS Nano. 12 (8), 7583-7600 (2018).
- Li, Q., Zhou, Y., Zhang, F., McGregor, H., Yang, X. Radiofrequency hyperthermia enhances locally delivered oncolytic immuno-virotherapy for pancreatic adenocarcinoma. CardioVascular and Interventional Radiology. 45 (12), 1812-1821 (2022).
- Mpekris, F., et al. Combining microenvironment normalization strategies to improve cancer immunotherapy. Proceedings of the National Academy of Sciences. 117 (7), 3728-3737 (2020).
- Netti, P. A., Baxter, L. T., Boucher, Y., Skalak, R., Jam, R. K. Time-dependent behavior of interstitial fluid pressure in solid tumors: implications for drug delivery. Cancer Research. 15 (55), 5451-5458 (1995).
- Andreozzi, A., Iasiello, M., Netti, P. A. Effects of pulsating heat source on interstitial fluid transport in tumour tissues. Journal of The Royal Society Interface. 17 (170), 612-626 (2020).
- Leunig, M., Goetz, A. E., Messmer, K. Interstitial fluid pressure in solid tumors following hyperthermia: possible correlation with therapeutic response. Cancer Research. 52, 487-490 (1992).
- Muñoz, N. M., et al. Immune modulation by molecularly targeted photothermal ablation in a mouse model of advanced hepatocellular carcinoma and cirrhosis. Scientific Reports. 12 (1), 14449 (2022).
- Bottiglieri, A., et al. RF-hyperthermia to modulate tumor interstitial fluid pressure: an in vivo pilot study. 38th Annual Society for Thermal Medicine Meeting. , (2023).
- Baxter, L. T., Jain, R. K. Transport of fluid and macromolecules in tumors. I. Role of interstitial pressure and convection. Microvascular Research. 37 (1), 77-104 (1989).
- Stapleton, S., et al. A mathematical model of the enhanced permeability and retention effect for liposome transport in solid tumors. PLoS ONE. 8 (12), 1-10 (2013).
- Rossmann, C., Haemmerich, D. Review of temperature dependence of thermal properties, dielectric properties, and perfusion of biological tissues at hyperthermic and ablation temperatures. Critical Reviews in Biomedical Engineering. 42 (6), 467-492 (2014).
- Song, C. W., Lokshina, A., Rhee, J. G., Patten, M., Levitt, S. H. Implication of blood flow in hyperthermic treatment of tumors. IEEE Transactions on Biomedical Engineering. 31 (1), 9-16 (1984).
- Tompkins, D. T., et al. Temperature-dependent versus constant-rate blood perfusion modelling in ferromagnetic thermoseed hyperthermia: results with a model of the human prostate. International Journal of Hyperthermia. 10 (4), 517-536 (1994).
- Andreozzi, A., Iasiello, M., Netti, P. A. A thermoporoelastic model for fluid transport in tumour tissues. Journal of The Royal Society Interface. 16 (154), 0030-0046 (2019).
- Hasgall, P. A., et al. . IT'IS Database for thermal and electromagnetic parameters of biological tissues. , (2022).
- Cavagnaro, M., et al. Influence of the target tissue size on the shape of ex vivo microwave ablation zones. International Journal of Hyperthermia. 31 (1), 48-57 (2015).
- Munson, J., Shieh, A. Interstitial fluid flow in cancer: implications for disease progression and treatment. Cancer Management and Research. 19 (6), 317-328 (2014).
- Muñoz, N. M., et al. Influence of injection technique, drug formulation and tumor microenvironment on intratumoral immunotherapy delivery and efficacy. Journal for ImmunoTherapy of Cancer. 9 (2), 0018-0027 (2021).
- Swartz, M. A., Lund, A. W. Lymphatic and interstitial flow in the tumour microenvironment: linking mechanobiology with immunity. Nature Reviews Cancer. 12 (3), 210-219 (2012).
- Mehta, A., Oklu, R., Sheth, R. A. Thermal ablative therapies and immune checkpoint modulation: can locoregional approaches effect a systemic response. Gastroenterology Research and Practice. 2016, 1-11 (2016).
- Song, C. W., Park, H., Griffin, R. J. Improvement of tumor oxygenation by mild hyperthermia. Radiation Research. 155 (4), 515-528 (2001).
- Dewhirst, M. W., Oleson, J. R., Kirkpatrick, J., Secomb, T. W. Accurate three-dimensional thermal dosimetry and assessment of physiologic response are essential for optimizing thermoradiotherapy. Cancers. 14 (7), 1701 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved