Method Article
下部双翅目バエ Bradysia(Sciara)coprophilaの実験室維持:新/古い新興モデル生物
要約
この論文では、下部双翅目バエ Bradysia(Sciara)coprophilaの実験室のメンテナンス(交配と摂食を含む)について概説します。
要約
下部双翅目バエ、 Bradysia(Sciara)coprophilaの 実験室のストックは、1世紀以上にわたって維持されてきました。 B. coprophila の実験室維持のためのプロトコルは、ここに提示されています。これらのプロトコルは、 B. coprophila を研究する急速に増加する研究室が、(1)男性の減数分裂Iの単極性紡錘体を含む、そのユニークな生物学的特徴を活用するのに役立ちます。(2)男性減数分裂IIにおけるXダイアドの非分離。(3)母方と父方の同族体を区別するための染色体インプリンティング。(4)生殖細胞系限定(L)染色体;(5)染色体の消失(男性の減数分裂Iの父方染色体;初期胚の1〜2本のX染色体;初期胚の体細胞からのL染色体);(6)母親による性別決定(Y染色体はありません)。(7)幼虫の唾液腺ポリテン染色体のDNAパフ遺伝子座での発達的に調節されたDNA増幅。
近年の B. coprophila ゲノムのシーケンシングとアセンブルの進歩、およびゲノム工学のための形質転換方法論の開発を利用することで、染色体力学のこれらの多くのユニークな特徴を探求することが可能になりました。 研究にB. coprophila を使用する成長中の科学コミュニティは、ハエの交配(息子のみまたは娘のみを持つ母親の表現型マーカー、生化学実験のための大量交配の詳細)、胚のハッチのチェック、幼虫の給餌、およびその飼育に関するその他のコメントについて、ここで説明したプロトコルの恩恵を受けることができます。
概要
生物学的原理を完全に理解するには、生命の樹にまたがる多くの多様な生物の研究が必要です。19世紀 末までは幅広い生物が記載されていたが、20世紀 半ばまでに実験的研究は一握りのモデル生物に限られるようになった。ゲノム時代の到来と、Tree of Life1の全種のゲノム配列決定が目標となった今、私たちは実験室での実験に用いる生物の種類を拡大し、その多様性を享受する立場にあります。このような実験用モデル生物の新規化には、実験室で維持管理できることが前提となります。ここでは、そのような新興の新旧モデル生物を飼育するためのプロトコルについて説明します。
地球上の動物生活の大部分は、昆虫2の4つの超放射線によって占められています。昆虫の中には、約158,000種の双翅目(真のハエ)3があり、約3000種がSciaridae科(黒カビのブヨ)4です。ショウジョウバエは、双翅目バエの中で最も徹底的に研究されています。下半双翅目バエ(Nematocera)、Bradysia(以前はSciaraと呼ばれていた)coprophilaは、2億年前に「高等双翅目」ハエ(Brachycera)であるショウジョウバエから分岐しました。したがって、B. coprophilaは、D. melanogasterとの比較研究において分類学的に有利な位置にあります(図1)。さらに、B. coprophilaは、それ自体が研究に値する多くのユニークな生物学的特徴を持っています5,6,7。これらの特徴の多くは、生物のすべての細胞が同じDNA含有量を持つというDNA恒常性の法則に反しています。B. coprophilaでは、(i)父方のゲノムは、男性の減数分裂Iの単極性紡錘体で排除されます。(ii)男性の減数分裂IIではXダイアドの非分離があります。(iii)生殖細胞系限定の(L)染色体が体細胞から排除されます。(iv)初期胚では、個人の性別に応じて1つまたは2つのX染色体が排除されます。母方と父方の同族体を区別するための染色体インプリンティングは、B. coprophilaで最初に発見され、これらの染色体除去イベントの多くに作用しています。染色体の除去に加えて、DNA恒常性の別のバイパスは、幼虫の唾液腺ポリテン染色体のDNAパフ遺伝子座での発達的に制御された遺伝子座特異的DNA増幅を介して発生します。これらのユニークな特徴の研究には、B.coprophilaの実験室でのメンテナンスが必要です。その畜産の詳細は、そのような研究を容易にするためにここに提示されています。
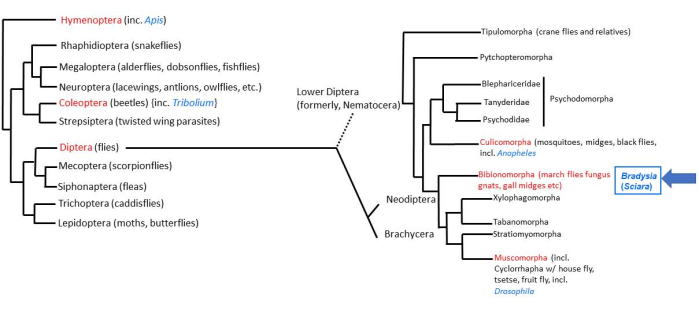
図1: Bradysia(Sciara)coprophilaの系統発生。 一般的なモデル生物は青のフォントで示され、分類学的順序は赤のフォントで示されています。 Bradysia および他のSciarid菌のブヨ、および蚊は低ジプテランバエ(以前はNematocera亜目)ですが、 ショウジョウバ エ種は高二翅目バエ(亜目:Brachysera)です。図の左側の情報は、Misof et al.33からのものです。右側の情報は、Bertone et al.34 と Wiegmann et al.2 からのものです。 この図の拡大版を表示するには、ここをクリックしてください。
以前は、Sciara属は真核生物の中で最も多くの種(700種)を持っていたため、ステファンはそれらを8つ細分化しました。その後、シンは、Sciaridae科をSciarinae亜科(Sciara、Trichosia、Leptosciarellaを含む6属)、Megalosphyinae亜科(Bradysia属を含む)、およびその他の3つのグループ(Pseudolycoriellaを含む)に細分化することを提案しました9。Sciaridaeの系統発生は、近年、いくつかのグループによってさらに研究されています9,10,11。過去数十年にわたって、Sciaridae科の多くの生物の名前が変更されました12。1世紀以上にわたる文献のほとんどは、私たちが研究している生物をSciara coprophilaと呼んでいますが、現在の分類学上の名前はBradysia coprophila(syn. Bradysia tilicolaおよびその他の同義語)10です。それらは世界中で見られ、キノコや他の菌類を食べるため、一般に真菌ブヨとして知られています。それらは、1804年にヨーロッパのMeigen13によって最初に記載され、その後、北アメリカのJohannsen 14,15によって記載されました。コプロフィラ菌はコールドスプリングハーバー研究所で採集され、1900年代初頭にチャールズ・メッツがコロンビア大学の大学院生だったトーマス・ハント・モーガンとともに研究所のストックを確立しました。したがって、現在の株は近親交配の世紀を反映しています。同様に、B. coprophilaの生物学は、Helen Crouse(Barbara McClintockと博士号を取得した)による数十年にわたる細胞遺伝学的研究によってさらに解明されました。
1930年代、Bradysia(Sciara)は、遺伝研究のモデルシステムとしてDrosophila melanogasterと競争しました。その多くのユニークな生物学的特徴にもかかわらず、B. coprophilaは、放射線誘発性の表現型突然変異が遺伝研究に必要であり、B. cophilaがD. melanogasterよりもガンマ線照射に対してわずかに耐性が高いにもかかわらず、後者で達成するのが容易であったため、人気のあるモデル生物としてD. melanogasterに凌駕されました16。ゲノミクスの現代では、これはもはや問題ではありません。近年、B. coprophilaのゲノム配列17,18,19(Urban、Gerbi、Spradling、データは示さず)や形質転換法20,21(Yamamoto and Gerbi、データは示さず)が利用可能になったため、新旧の新興モデルシステムとして活用する機が熟してきたこと、また、この研究に採用する科学者コミュニティが増えていることからも明らかです。この記事では、ラボのメンテナンスの手順について説明します。
B. coprophilaはY染色体を欠いており、子孫の性別は母親によって決定されます。X'(「Xプライム」)染色体を持ち、パラセントリックな反転が長い女性には娘しかいませんが、標準(非反転)X染色体にホモ接合性の女性には息子しかいません5(図2)。X'染色体19の配列情報は入手可能ですが、X'染色体がどのようにして子孫を雌と決定するのかについては、まだ分子メカニズムが解明されていません。男性はX'染色体を持つことはなく、受精後、女性はX'X(X'のヘテロ接合体)またはXXになります。成体のX'X雌は、翅の表現型マーカーによってXX雌と区別できます(図3)。X'Xの女性(娘のみを持つ)は、X'の支配的な波状(W)ウィングマーカーによって認識できます(HoLo2ストックのように)22。あるいは、XXの女性(息子のみを持つ)は、91Sストック23のように、Xの劣性プチ(p)ウィングマーカーで認識できます。この場合、X'Expの女性はフルレングスの(小柄ではない)翼を持ち、娘だけを持ちます。ストック6980は、X染色体上の腫脹(sw)静脈24の劣性マーカーと、X'上の優勢マーカーWavyを運び、クロスの選択のための2つのマーカーを可能にします。Wavyの発現の程度はさまざまで、食品が制限されている過密状態のバイアルや温度が高すぎると弱くなるように見えます。波状の翼の表現型は、幼虫が通常の21°Cではなく冷蔵室(4°-8°C)に保管されている場合、非常に強力です。 劣性プチウィングマーカーは変動せず、非常に簡単に識別できますが、91SストックはHoLo2ストックよりも健康状態が悪いため、使用頻度が低くなります。B. coprophilaの交配スキームをここに示し(図2)、HoLo2、7298、W14株(Supplemental File 1)、91S株(Supplemental File 1)、6980株(Supplemental File 1)、および転座株(Supplemental File 1)について詳細に説明しています。転座ストックはもはや存在しません。これらは、リボソームRNA遺伝子25,26,27を含むXの短腕上のヘテロ染色体(H1、H2、およびH3)の相互転座であった。
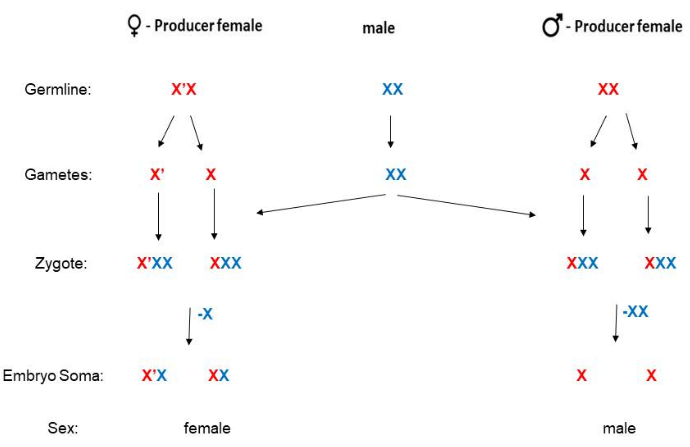
図2: B. coprophilaの交配スキーム。 この生物はY染色体を持っていません(男性の体細胞は単一のXを持っています)。母親は自分の子孫の性別を決定します。XXの母親には息子しかおらず、X'Xの女性には娘しかいません。X'染色体は、X染色体と比較すると、長いパラセントリック反転を持っています。この図では、X染色体(またはX ')染色体の父方または母方の系統は、それぞれ青または赤で示されます。精子は常染色体にとって一倍体ですが、減数分裂IIの非分離のためにX染色体の2つのコピーを持っています。初期胚の体細胞系譜は、父方から派生したXの1つまたは2つのコピーを、それぞれ女性または男性である場合に排除します。 この図の拡大版を表示するには、ここをクリックしてください。

図3: B.coprophilaの翼表現型。 成虫の雌のハエは、さまざまな翼の表現型で示されています:(A)まっすぐな翼(XX)、(B)波状の翼(X'WX)、(C)極端な波状の翼(X'WX)冷たいroo mに幼虫を保存した後にしなびた外観を持つ表現型、 (D)痕跡のような小柄な翼(XpXp)、(E)野生型(XX)で腫れていない静脈のないまっすぐな翼、 (F)翼の上端および/または両翼の先端近くに小さな泡(黒い矢印)が現れる静脈が腫れた直線翼(XswXsw)、(G)片方または両方の翼に水ぶくれ(白い矢印)が発生する腫れの極端な例。男性はX'染色体を欠いているため、波状の翼を持つことはありませんが、91S株または6980株ではそれぞれ小柄または腫れた翼があります。スケールバー = 1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
ストックメンテナンスの目標は、交配の半分が雌の生産母親からの交配であり、半分が雄の生産母親からの交配である交配を行い、次の世代で次の世代の女性と男性の成人の数が等しいようにすることです。ただし、男性のライフサイクルは女性よりも短く、成人男性は成人女性の最大1週間前に出現するため、これには計画も含まれます。自然は、オスの胚が同じ日に交配からメスの幼虫の1〜2日後に幼虫として出現することで、この男女間の非同期性に対応します。しかし、雄と雌の成虫が同時に実験室交配に利用できるようにするために、雌の幼虫の入ったバイアルを室温ではなく室温に置いておくか、雄の幼虫の入ったバイアルをわずかに低い温度(例えば、16°C)に置くことで、雌の発育をいくらか早めることができます。より確実な別のルートは、月曜日に女性生産者の母親と交配を行い、同じ週の金曜日に男性生産者の母親と交配することです。最も簡単なルートは、私たちが採用していることですが、毎週同じ日に女性生産者と男性生産者の母親と交配を行い、連続した週ごとにその日に交配を行うことです。このアプローチでは、1週目の交配から生まれた成体の雌を、2週目の交配から出てきた成体の雄と交配させることができます。
雌 のB. coprophila のライフサイクルは、21°Cで飼育した場合、5週間です(表1)。彼らのライフサイクルの長さは、低温または栄養不足の場合にやや長くなります。オスのB. coprophila のライフサイクルは、メスより0.5-1週間早く蛹になるため、4~4.5週間です。各幼虫のインスターの終わりは、ステロイドホルモンのエクジソンレベルのバーストによって引き起こされるキューティクルの脱落によって特徴付けられます。3つの幼虫の幼虫を持つ D.melanogaster とは異なり、 B.coprophilaは 4つの幼虫の幼虫を持っています。
| 発達段階 | 交配後日数(dpm) | ステージの長さ(日数) |
| 産卵 | 1-2 | |
| 胚 | 1-2 から 7-8 | ~7日間 |
| 幼虫 | ||
| 幼虫のインスター1、2、および3 | 7-8 から 16-19 | ~10 |
| 4番目の幼虫のインスタープレアイスポット | 16-19 から 21-24 | 5 |
| 第4幼虫のインスターアイスポットステージ | 21-24 から 25-28 まで | 4 |
| 蛹 | 25-28 から 30-33 | 5 |
| 大人 | 交配した場合は21°Cで1〜2日生存し、交配しない場合は16°Cで2〜3週間生存します。 | |
表1:21°Cでの雌 のB.coprophila のライフサイクル。
B. coprophila は、15°C〜25°Cの範囲のどこにでも保持でき、低温では開発がゆっくりと進行します。この昆虫は湿気の多い環境(観葉植物やキノコの床の土壌に見られる)を好むので、インキュベーター内に脱イオン水を入れたビーカーを保管しています。 B. coprophila は、蓋がゆるくフィットし、ビーカーの水が入った金属製のパン箱に室温で保管できますが、37°C28でヒートショックに陥り、暑い気候では危険です。マイケル・アッシュバーナー氏らは、在庫管理に必要な時間を短縮するために、 D. melanogaster を寒さの中で保存しようと試みましたが、ほとんど成功しませんでした。対照的に、 B. coprophila の主な利点は、中期の幼虫の入ったバイアルを、月に1回だけ給餌するという最小限の手入れで、冷蔵室(4〜8°C)のオープンシェルフに最大3か月間保存できることです。彼らは蛹の段階までの寒さで非常にゆっくりと成長し、バイアルが21°Cに戻されると肥沃な成体として出現します。 おそらく、これは野生での越冬を模倣しています。この寒さによる発育失速は、中期の B. coprophila 幼虫16のガンマ線照射後に見られるものに匹敵するかもしれませんが、正常な発育進行のために戻れないポイントを過ぎた後期幼虫には発生失速は見られません。
プロトコル
ここで説明するプロトコルは、Charles Metz、Helen Crouse、Susan Gerbiが順番に監督する Bradysia (Sciara)ストックセンターからの100年の経験と、他の人からの意見を表しています。
1.交配クロス
- 直径28mmのガラスバイアルごとに1人の成人女性と2人の成人男性を使用してください。.娘や息子だけを持つ母親の翼の表現型を認識することに100%成功したら、バイアルごとに2匹のメスと2匹のオスを使用して、幼虫/バイアルの数を増やします。女性よりも麻酔から早く目覚める男性を追加する前に、各バイアルに女性を追加します。
注:以下の説明は、CO2があることを前提としています。あるいは、エーテルを使用して成虫のハエを麻酔することもできます。 - エーテルを使用して成虫のハエを麻酔する場合は、折りたたまれた実験室用ワイプ(例:.、キムワイプ)のパッドをCoplinジャーの丸いガラス蓋の内側にテープで固定し、スポイトを使用してボトルからエーテルを移し、実験室のワイプパッドを湿らせます(ただし、飽和しておらず、エーテル液が落ちてハエを溺死させるリスクがあるほど濡れていません)。以下のステップ1.6では、湿らせたエーテルパッドを開いたバイアルの上に~1分間置き、成虫の動きが止まるまで待ちます。成虫を白いセラミックタイルプレート(白いフライパッドの代わりに使用)に移したら、定期的に(ハエの足がけいれんし始めたら)エーテルで湿らせたばかりのパッドをプレート上のハエの上に(触れないように)~1分間保持します。
注意: エーテルは可燃性であるため、冷蔵庫ではなく換気フードに保管する必要があります。 - 腕の届くところに、成人女性のバイアルが入ったトレイ、成人男性のトレイ、2.2%(wt/vol)寒天が入った空のバイアルが入ったトレイを配置します。実験室のベンチに、「女性」または「男性」と母親の翼の表現型を記載したプラカードノートを置き、交配のために選択された大人のバイアルが正しいグループに配置され、一方のグループのすべてのバイアルが男性の子孫のみを持ち、もう一方のグループのすべてのバイアルが女性の子孫を持つようにします。
注意: 成虫が液滴に付着するため、バイアル内に結露液滴が入っていないことを確認してください。バイアルをプラスチックの箱に保管していた場合は、使用前にバイアルを室温の実験台に少なくとも1時間置いて、結露を蒸発させます。 - CO2ガスと解剖顕微鏡用のランプをオンにします。
注:光ファイバーを備えた光源は、熱の放出が少なく、麻酔をかけたハエがより早く目覚めるため、好まれます。 - 大人と一緒にバイアルをゴムパッドで強くたたき、大人がバイアルの底に落ちてプラグを取り外すようにします。CO2 ガンノズルを挿入し、プラグを再度追加します。
- ノズルトリガーを押し下げて、CO2 がバイアルに ~1 分間流れ込み、成人に麻酔をかけます。
- フットペダルに足を乗せて、CO2 がガンノズルではなく白いフライパッドに流れるようにします。ハエが白いフライパッドにいる間、ずっとフットペダルを踏んだままにします(または、ハエの足がけいれんし始めるたびにフットペダルを断続的に押します)。
- ノズルとプラグをバイアルから取り外し、解剖顕微鏡下で白いフライパッドの上にバイアルを反転させます。
- 逆さにしたバイアルの底を顕微鏡に当てて、成虫がバイアルから白いフライパッドに落ちるようにします。
- 最も太った成虫(最近は白い腹部で閉じられた)を選択し、先端の細い鉗子を使用して成虫の中足または後ろ足を優しく持ち上げます。交尾ダンスに使用される前足を傷つけないでください。閉じたばかりで、体が完全に白く、まだ黒くなっていない成虫は、翼が短く、完全に発達しておらず、翼の表現型をスコアリングできないため、使用しないでください。腹部がスリムな成人は、生殖能力が低下していますが、引き続き使用できます。翼が体から垂直に上げられている痩せた大人は死んでいるので使用しないでください。
- 一方、2.2%(wt / vol)寒天でバイアルからプラグを取り出します。成虫と一緒に鉗子を持っている手で、成虫がバイアルの底に落ちるように、バイアルの上部内壁に対して鉗子を強くたたいます。プラグをバイアルに交換します。
- 上記の手順1.5〜1.11を繰り返して、女性の成人が入った各バイアルをセットアップします。絵筆を使用して、未使用のハエを白いフライパッドから親バイアルに戻します。親バイアルのラベルにチェックマークを付けて、嵌合に使用されたことを示します(ただし、必要に応じて再度使用できます)。
- 定期的なストックメンテナンスのために、女性生産者の母親に6〜8本のバイアルを、男性の母親に6〜8本のバイアルを設定します(図4)。バイアルの半分を1つの大人用バイアルの母親(または父親)でセットアップし、新しいバイアルの残りの半分を別の大人用バイアルを使用してセットアップして、遺伝的ボトルネックを最小限に抑えます。
- 時折、誤った分離イベントにより、女性を生産するバイアルで例外的な男性が生まれます。成体の女性の入ったバイアルに例外的なオスがいる場合は、そのオスを取り出してつぶして殺します。可能であれば、そのバイアルからすべての雌を捨て、より多くの成体の雌が閉じて安全に交配に使用できるようになるまで数日待ちます。
注:そのバイアルのメスを交配に使用しないことが望ましいです。なぜなら、彼らは例外的なオスと交配し、肥沃なクロスを産まなかったかもしれないからです。
- 時折、誤った分離イベントにより、女性を生産するバイアルで例外的な男性が生まれます。成体の女性の入ったバイアルに例外的なオスがいる場合は、そのオスを取り出してつぶして殺します。可能であれば、そのバイアルからすべての雌を捨て、より多くの成体の雌が閉じて安全に交配に使用できるようになるまで数日待ちます。
- 成体の雌をすべてのバイアルに加えたら、手順1.5〜1.11を繰り返して、すでに雌のハエが入っている各バイアルに2匹の成体の雄(図4)を追加します。メスがゴムパッドでバイアルを軽くたたき、2人のオスが連続して追加されたときにメスが逃げないようにします。
注:迅速に作業し、成虫のハエを過度に麻酔をかけないでください。 - 各バイアルにラベルを追加し、ストック、交配(雌または雄の子孫)、母親が成体のバイアル#1または#2から来たかどうか、および交配の日付を示します。また、上記の情報をノートブックに入力し、各クロスに設定されたバイアルの数を記入します。
注:トレイ内の男性生産バイアルと女性生産バイアルを分離するためにペーパータオルを追加すると便利です。 - バイアルをカウンタートップに~15分間放置して、成虫が目を覚まして飛び回ることを確認します。彼らが交尾しているかどうかを観察します(目覚めた直後に)、メスとオスが後方を向いている場所(オスのクラスパーがメスの先のとがった産卵管をつかむ)(図4、下)。
注:成体の女性は成体の雄を一度だけ受け入れるので、交配の過程で雄と雌を分離する可能性があり、その雌が再交配しない可能性があるため、交配後にバイアルをぶら動かさないでください。 - 嵌合したバイアルを入れたトレイをインキュベーター(例:21°C)に置きます。トレイにストックの名前(HoLo2など)と5週間サイクルの週(1、2、3、4、または5週)のラベルを付けます。
注:嵌合したばかりのハエが入ったトレイをインキュベーターまたは別のインキュベーターの別の部分に保管して、幼虫が出現するまでバイアルに給餌しないように注意してください(以下で説明します)。
2.大量交配
注:通常、単一の B.コプロフィラ の母親は、彼女のひなに60の子孫を産みます。実験により多くの子孫が必要な場合、上記の一対の交配の代わりに大量交配を行うことができます。大量交配は、標準的な直径28cmのガラスバイアルで行うことができ、母親は翌日に人工産卵と胚収集のために収集されます。ただし、より多くの幼虫が必要な場合は、過密を防ぐために、より大きな表面の瓶で大量交配が行われます。瓶の蓋にいくつかの小さな穴を開けて、幼虫が呼吸するための空気を得ることができるようにします。
- 上記のセクション1の手順に従いますが、先端の細い鉗子を使用して、すべての女性生産者の母親(またはすべての男性生産者の母親)を白いフライパッドの前隅に移動します。10〜15人の麻酔をかけた太った成人女性を使用し、このグループを絵筆でバイアルまたは蓋に小さな穴を開けた瓶に一掃します。
メモ: 手順 2.1 と 2.2 を実行します。肥沃な交配を防ぐ過麻酔を避けるために、大量交配を迅速に行います。 - 20-25人の麻酔をかけた太った成人男性を選択し、先端の細い鉗子で白いフライパッドの前隅に移動します。
- プラグまたは蓋を取り外して、白いフライパッドから成人男性の麻酔をかけたクラスターをペイントブラシで掃引するときに逃げないように、メスと一緒にバイアルまたはジャーをゴムパッドで強くたたきます。
3. 大量交配後の胚採取
- 交配の1日後(24時間)に、ステップ1.5-1.11を実行して成虫のハエ(雌と雄の混合物)に麻酔をかけ、それらを白いフライパッドに移します。
注:成虫が交尾したとき、卵形成はまだ完了しておらず、それが終末減数分裂を引き起こします。成熟した卵子は、卵子が排出されるときに精子に蓄えられた精子によって受精する 29。卵形成の完了には1〜2日かかるため、交配後1日は産卵が誘発されます。 - 先端の細い鉗子で、成虫のメスを翼で拾い上げ、2.2%(wt/vol)の寒天を含む直径100mmのシャーレに置き、翼を寒天に挿入します。白いフライパッド上の各成体女性について、この手順を順番に繰り返します。フライパッドの成体オスを捨てます。
- すべての雌のハエが寒天に突き刺さったら、雌のハエが発作のような動きをするまで、鉗子で頭を優しく絞って産卵を誘発します。または、胸郭をそっと絞ってください。その後、彼女は30〜60分以内に受精卵のクラスターを産みます。水で湿らせた蓋でペトリ皿を覆いますamp蓋への卵の静電引力の蓋への卵の引力を防ぐために。
4. 幼虫の「ハッチ」の確認
- 交尾から1週間後に幼虫の「ハッチ」を確認します。バイアルからプラグを取り外し、解剖顕微鏡を使用して幼虫のスコアを付けます。彼らの黒い顎は開閉を繰り返し、ゆっくりと前進します。幼虫が数匹しかいない場合は、バイアルのラベルに「少数」と書いて、そのバイアルの給餌量を減らすように注意してください。その十字架のあるトレイ内の各バイアルを調べ、ノートブックの幼虫の入ったバイアルの数を、その交配で設定されたバイアルの数の隣の列に入力します。
注:濃い黄色の卵は発生しません。白い卵が発達する可能性が高く、幼虫が出現する1日前に、卵の前端に黒い色素(将来の顎)が発生します。カビの端が黒い球で終わる白いフィラメントのカビを幼虫と間違えないでください-寒天の上を前方に這う幼虫とは異なり、カビは動きません。 - 幼虫の入った各バイアルに少量のストローを(一度だけ)追加して、過剰な湿度を制御し、幼虫の隠れ場所を提供します。
- トレイをインキュベーター(例:21°C)に移動し、前の週の交配交配からの幼虫のトレイを入れ、新しく出現した幼虫をバイアルに給餌し始めます(給餌に関する以下のセクションを参照)。
注:通常、幼虫は死んだ母親の近くに集まり、彼女を食べ始めます。おそらく、これにより酵母が母親の腸から幼虫の腸に移されます。幼虫が出てきた日、またはその後2日以内に給餌を開始できます。注意:給餌が遅れると、幼虫はお互いを食べ合い、バイアルごとに1匹の太った幼虫だけが残ります。 - 週に3日間、まだ幼虫がいなかったバイアルをチェックし続けます。7〜10日後に幼虫が出現しない場合は、バイアルを廃棄するか、バイアルの洗浄のために保管してください。
5. 料理を作る
注:すべての食品成分は無農薬でなければなりません!
- 大さじを使用して、次の材料を体積で測定し、金属鍋またはガラス鍋(8インチx 8インチの金属製ベーキングパンなど)に入れます:オーツ麦ストロー4部(大さじ8)、椎茸粉末2部(大さじ4)、ほうれん草粉末1部(大さじ2)、イラクサ粉末1部(大さじ2)。大さじを使って鍋で材料をよく混ぜます。
注:あるいは、ほうれん草の粉末だけまたはイラクサの粉末をそれぞれ1部の代わりに2部を使用することもできます。 - 鍋をアルミホイルで覆い、オートクレーブで乾式サイクルで20〜30分間。一晩以上室温まで冷まします。
- フライパンからホイルを取り出し、固まった滅菌食品混合物を砕き、大さじで粉砕運動を使用して粉末状の混合物を作成します。
- ビール酵母1部(山盛り大さじ2)を加え、オートクレーブ滅菌した食品混合物によく混ぜます。
注:Brewer's yeastはオートクレーブ処理されていないため、酵母が死滅します。 - 食品混合物を滅菌キャップ付きジャーに移します。
注:大量交配に使用したのと同じタイプの240mLジャーを使用でき、上記のレシピでジャーが満たされます。同様に、同じタイプの滅菌キャップ付きジャーには、ホイルで覆われたパンでオートクレーブされたストローだけを充填する必要があります。
6.給餌
注:幼虫の年齢と量に応じて、与えられる食物の量を調整します。大量交配からの多くの幼虫が入った瓶にたくさんの食べ物を与えます。発生病期分類のために数日間保存されている幼虫を入れたペトリプレートに食べ物を軽く振りかけるだけです。以下に述べる給餌方法は、チャールズ・メッツ 29の研究室で開発され、彼の研究室やヘレン・クラウス、スーザン・ガービなどによって1世紀にわたって成功裏に使用されてきました。
- 手を洗い、よくすすいで石鹸を取り除きます。
注:手袋は、各バイアルに与えられる食物の量を調整するための指の感触を低下させるため、お勧めしません。 - 挽いたストローが入った蓋付きの滅菌瓶と、幼虫が保管されているインキュベーター(例:21°C)に餌が入った滅菌瓶を保管します。瓶から蓋を外し、きれいなボウル(キャンディー皿など)に食べ物を注ぎます。残りの食品が入った瓶の蓋を元に戻します。開いたボウルに食べ物を入れて、金属製またはガラス製の小さなトレイに入れておきます。これにより、ダニや他の昆虫がトレイの壁を這いずり回って食べ物と一緒にボウルに入るのを防ぎます。
- 2本目の指と3本目の指の間(または親指と2本目の指の間)で食べ物を拾います。もう一方の手で、トレイからバイアルを取り出し、プラグを取り外し、指で保持しながら給餌します。幼虫の年齢と数についてバイアルを調べ、食物を互いに保持している2本の指を回転させて、適切な量の食物をバイアルに沈殿させます。新しく出現した幼虫の入ったバイアルには、数粒の食物が必要です。古い幼虫の入ったバイアルには、寒天の上部を覆う薄い食物の層が必要です。
- バイアルに白いカビがある場合は、実験室のワイプにスプレーした70%エタノールを使用して、長い金属プローブ(木製のハンドルなど)を拭き取り、プラグを取り外し、きれいなプローブをバイアルに挿入して寒天の表面のカビを軽くたたきます。カビが多い場合は、プローブを回転させてプローブに型を巻き付け、バイアルから取り出します。幼虫がそこに住んでいるので、寒天の上部を乱さないでください。少量の食物だけを追加し、バイアルのプラグを交換します。プローブを保管する前に、またはプローブを使用して別のバイアルを洗浄する前に、70%エタノールで強化したラボ用ワイプでプローブを拭いてください。
- トレイ内のすべてのバイアルが供給されたら、インキュベーター内のトレイを交換し、ステップ6.3のように次のトレイを取り出して供給します。
- 給餌が完了したら、ボウルから残りの食物を以前に滅菌した瓶に注ぎ、瓶に蓋をしてインキュベーターに保管します。
7.ペトリプレート上の幼虫または蛹の収集
- 幼虫の数が少ない場合は、70%エタノールで拭いた金属プローブまたはスパチュラを使用してバイアル内の寒天の最上層を掘り、一部の幼虫が付着した付着した寒天を、2.2%(wt / vol)寒天で半分満たされた直径100mmの滅菌ペトリ皿に移します。
- 幼虫の数が多い場合は、バイアルの下部にある壁に沿ってへらを挿入して、寒天栓をバイアルから取り出し、空のペトリ皿に面を上にして堆積させます。解剖顕微鏡を使用して寒天プラグの上部にある幼虫を見つけ、先端の細い鉗子で2.2%(wt / vol)寒天を半分充填した直径100mmの滅菌ペトリ皿に移します。
- 解剖顕微鏡を使用して、先端が細い鉗子を持つ幼虫を同じ発生段階のグループに選別します。
注:わずかな発達上の非同期性により、2.2%(wt / vol)寒天のペトリプレート上に選別された幼虫のいくつかの異なるクラスターがあります。 - 小さな食べ物をふりかけ、幼虫の入ったペトリ皿をインキュベーターに入れます。毎日取り外して、解剖顕微鏡で観察し、目的の発達段階を選択します。
注:DNAパフ研究の場合、初期の眼点幼虫は、10x5、12x6、14x7、およびエッジアイ/ドロップジョーステージを経て、これらのステージのそれぞれで~1日経過します30,31。蛹の精巣に減数分裂IおよびII段階を持つために、目が1/4から1/2に色素で満たされている蛹を選択します。
8.幼虫の冷蔵室保管
- バックアップとして、2週間連続の交配から得られた雌の幼虫のバイアル4本と雄の幼虫のバイアル4本を冷蔵室に保管してください。
- バックアップストレージとして、初期の4番目の 幼虫(視力前段階)の幼虫に餌を与え、冷蔵室の棚の開いたトレイに入れます。これらのバイアルを月に一度だけ給餌してください。
- 2〜3か月後に、2週間連続の交配交配から16本のバイアルを寒さから取り出します(これをカレンダーにリマインダーとしてマークします)。インキュベーター(例:21°C)に入れて普通に給餌し、交配に使用するために成虫に成長させます。
- バイアルを冷蔵室から取り出したら、初期の4番目の 幼虫が入った新しいバイアルのセットを冷蔵室に置いて、これらのバイアルがストックのバックアップとして常に利用できるようにします。
注:冷蔵室での保管後の生存率は、さまざまな発達段階について体系的にテストされていませんが、私たちの経験では、初期の4番目の 幼虫の冷蔵保存がうまく機能することが明らかになっています。
9.バイアル洗浄
- 成虫が死亡した後(閉塞後2~3週間)、バイアルをインキュベーターから取り出し、60〜70°Cに1時間置いて、残っている生物を殺します。
- コットンプラグを取り外し、プラスチックの箱に保管します。
- へらを使用して、バイアルから寒天栓を廃棄物缶にこすり落とします。
- バイアルを一晩またはそれ以上の時間を皿皿の水に浸します。
- この目的のためだけに保存された試験管ブラシ(化学薬品や石鹸の入った容器には使用しないでください)を使用し、水道水が流れている状態でバイアルを上下にこすります。洗浄したバイアルを開いた面を下にして金属製のバスケットに入れます。バスケットに洗浄したバイアルを入れます。
注:バイアルに石鹸は絶対に使用しないでください、残留石鹸は B.コプロフィラを殺す可能性があるためです。 - バスケットに金網の蓋を追加し、蓋を所定の位置に保持しながら、バスケットを反転させて、すべてのバイアルを脱イオン水で満たします。蓋を所定の位置に保持したまま、バスケットを反転させて、バイアルから脱イオン水を空にします。脱イオン水すすぎを4回繰り返します。
- 洗浄したバイアルを入れたバスケットをペーパータオルまたはオープンメッシュプラットフォーム(例:.、ラボカート)で一晩以上乾燥させます。.ドライバイアルは引き出しに保管してください。
注:死んだ大人のバイアルは、ダニの蔓延を招く可能性があるため、洗う前に長時間放置しないでください。
10.寒天を注ぐ
- 大きな容器(金属製のバスケットまたは金属製のトレイ)に清潔なバイアルを入れ、各バイアルに綿栓を追加します。バイアルを洗浄したときに古いバイアルから取り出したプラグを再利用し、プラグが劣化してバラバラになり廃棄するまで繰り返し使用します。プラグを差し込んだバイアルで容器を乾燥サイクルで~30分間滅菌し、室温まで冷ましてオートクレーブ容器に保管します。常に2つの容器(1つはアクティブに使用中、もう1つは予備)は、オートクレーブ処理されたプラグバイアルを手元に置いてください。
- 11.0 gの寒天粉末を1 Lの三角フラスコに入れ、500 mLの蒸留水を加えて、~24バイアル(~21 mL/バイアル)を注ぐのに十分な2.2%(wt/vol)の寒天溶液を作ります。フラスコを回して電子レンジに入れます。
注:ここからは、耐熱オートクレーブグローブを使用してフラスコを取り扱います。必要に応じて、同じ2.2%(wt/vol)の寒天溶液をペトリプレート(摘み取った幼虫用)または瓶(大量交配用)に注ぐことができます。 - 電子レンジで1分間加熱し、フラスコを取り外して回転させ、電子レンジに入れ直して、再度1分間電子レンジで加熱します。これを数回繰り返します。
- 電子レンジのガラスドアからフラスコを眺めます。寒天溶液が泡立って沸騰し始めたら、すぐに手動停止ボタンを使用してください。この時点でフラスコを回さないでください(沸騰する可能性があります)オーブンからカウンターに慎重に取り出し、数分間休ませます。
- 滅菌したバイアルからプラグを取り出し、片手で持ちます。もう一方の手で、高さ2.5cm~2.2cmの寒天を滅菌したバイアルに注ぎます。次に、プラグをバイアルに交換します。すべての寒天が注がれるまでこれを繰り返します。
注:バイアルに注がれる寒天が少なすぎると、使用中に乾燥が早くなり、バイアルの壁から収縮します。バイアルに寒天を注ぎすぎると、解剖顕微鏡で幼虫の「赤ちゃんの孵化」をスコアリングするときに最上層に焦点を合わせるのが難しくなります。 - 注がれたバイアルを室温で1〜2日間カウンターに置いて、寒天が硬化し、水分が完全に蒸発するようにします。バイアルを交配に使用するか、しっかりと蓋をしたプラスチックの箱に横向きに横にして保管します。水で湿らせたペーパータオルをバイアルの上に置いてから、蓋を箱に置きます(これにより、寒天が乾燥してバイアルの壁から縮むのを防ぎます)。注がれたバイアルを入れた箱は、室温で数日間、または4°Cの冷蔵庫または冷蔵室で最大2週間保管してください。保管されたバイアルを使用する前に、箱から取り出し、室温で1〜2時間カウンターに置いて、バイアルの内部から結露を蒸発させます(成虫のハエは凝縮液に付着して溺死します)。
11.バイアル用プラグを作る
- 清潔なバイアルを発泡スチロールの50 mL試験管ホルダーに入れます(チューブを無理に押し込んでまっすぐに立ちます)。正方形のチーズクロス(厚さ2〜4層)を切り取り、バイアルの上に置きます。
- 以前に作ったプラグのチーズクロスの切れ端をチーズクロスの上に置き、より厚い層を作成します。チーズクロスの上に綿を置き、バイアルに押し込み、バイアルの上部インチほどをしっかりと満たすようにします。
- チーズクロスの端の上部を一緒に持ち、ひもで結びます。余分なひもと余分なチーズクロスをカットします(ひもを結んだままにするのに十分な尾と、プラグを快適につかむのに十分なチーズクロスを残します)。
注意: プラグがぴったりとフィットするように取り付けます。片手で持ちながら、人差し指と人差し指で引き抜くことができるはずです。バイアルをプラグでつまんで抜けた場合は、緩すぎます。引き抜いたときにポンと音がする場合は、きつすぎる可能性があります。きつすぎる場合、またはプラグに硬くて乾燥した寒天の層がある場合、ハエは窒息する可能性があります。プラグが少し緩すぎるか、バイアルの側面を滑り落ちる場合は、カウンタートップで軽くたたいて、少し幅の広いサイズに押しつぶすことができます。
12.典型的な毎週のスケジュール(効率を最大限に高めるには、リストされている順序でタスクを実行します)
- 月曜日 (~30分)
- 幼虫をバイアルに供給します。
- 寒天をプラグ付きの滅菌清潔なバイアルに注ぎます。
- 水曜日 (~2 h)
- 死んだ大人のバイアルをオーブンに1時間入れ、洗濯のために保管します。
- 幼虫「赤ちゃんハッチ」を確認してください。
- 幼虫をバイアルに供給します。
- 毎週の交配クロスを実行します。
- 必要に応じてその他の職務:必要に応じて予備供給を持つためのプラグ付きのオートクレーブ洗浄バイアル。必要に応じて新しい食べ物を作り、オートクレーブストローを作ります。必要に応じてオートクレーブジャーを食品やわらに使用してください。
- 金曜日 (~30分)
- 幼虫「赤ちゃんハッチ」を確認してください。
- 幼虫をバイアルに供給します。
結果
ここで説明するプロトコルは、 B. coprophilaの飼育に成功したことが証明されています。最近閉鎖された脂肪の成体が交配のために選択されると(図4)、交配の90%以上が受精可能であり、子孫を産むことができます。出生率の成功は、株によって異なります(表2)。ストック7298(ウェーブマーカー付きX'染色体)は、最も健康な株であったが、明らかにゲノム再配列32を生成するDNA可動要素の活性化により、衰退期を経験した。HoLo2株は、7298に由来する健康な株であり、ゲノムの再配列が明らかに安定しており、株センターの親株である7298株に取って代わったようです。HoLo2株は、 B. coprophila のゲノム配列決定に使用されたもので、さまざまな研究室グループで最も広く使用されているものです。最近、HoLo2ハエのCRISPR突然変異導入を使用して、蛍光眼マーカー(山本とGerbi、データは示さず)による形質転換に使用される白眼表現型を持つW14ストックが作成されました。W14株は非常に堅牢です。6980ストック(波状の翼と腫れた静脈マーカー)はやや堅牢性が低く、91Sストック(プチウィングマーカー)はさらに堅牢性が劣ります。
交配が成功すると、胚が得られます(図5)。胚は、7番目 から9番目の 切断分裂で捺印された父方のX染色体の除去を受けます。さらに、生殖細胞系限定のL染色体は、5番目 から6番目の 切断分裂で胚の体細胞系譜から排除されます。胚は幼虫として出現しますが、これも存在する可能性のあるカビと混同しないでください(図6)。眼点(成虫の目への分布)は、4番目の 幼虫の幼虫の後半に現れます(図7)。眼点のサイズは、DNAパフ増幅の開始と進行のための便利な表現型マーカーを提供し、これは自然に発生する発生制御部位特異的な染色体内DNA(遺伝子)増幅の2つの既知の例の1つです。その後、蛹が発達し、目を満たす色素の量が精子形成における減数分裂IおよびIIの発達マーカーとして機能する可能性があります(図8)。

図4:成虫 のB. coprophila ハエの交配。 上段は、HoLo2株の3種類の成虫フライ、波状の翼を持つ雌産みの母体(X'WX成体メス)、まっすぐな翼を持つ雄産の母親(XX匹の成体メス)、直線翼のオス(X0匹の成オス)を示しています。雌のハエの後端にある尖った産卵管と、オスのハエの後端にあるフック型のクラスパーに注意してください。下のパネルは、オスとメスの交尾を示しており、オスのクラスパーがメスの産卵管をつかんでいます。精子は女性の精子に蓄えられ、卵子が外部に排出されるときに受精します。成体の長さは2.0mm(オス)、2.5mm(メス)です。 この図の拡大版を表示するには、ここをクリックしてください。
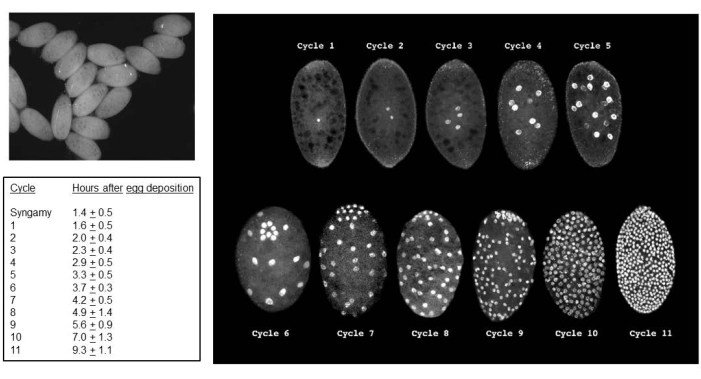
図5: B.coprophila の胚。 左上のパネルは、解剖顕微鏡で標準光を使用した胚の図です。合胞体細胞質の核は黒い点として現れます。右側のパネルは、蛍光顕微鏡を使用して、胚のヨウ化プロピジウム染色された核を視覚化しています。胚の平均長さは200ミクロン、平均幅は150ミクロンです。生殖細胞の核は、サイクル6(胚が前方に傾いた状態)と7-9サイクルで見られるように、胚の後極に集まり、その後、体細胞核が散在します。体細胞系譜におけるL染色体の排除は、切断分裂5または6で発生します。体細胞系譜におけるX染色体の排除は、7番目、8番目、または9番目の 切断分裂で発生します。細胞化は、サイクル11の期間に起こります。左の表は、22°Cでの各分周サイクルの平均時間を示しています。 左側のテーブルと右側のパネルは、de Saint Phalle and Sullivan35の許可を得てアレンジしたものです。 この図の拡大版を表示するには、ここをクリックしてください。
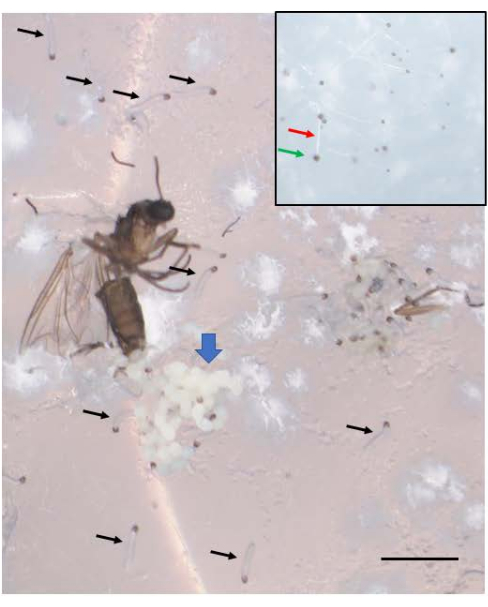
図6: B. coprophila の胚が幼虫として出現する。 産卵後に死亡した成体女性の産卵管の近くに胚の塊(青い太い矢印)が見られます。産卵から1週間後、胚は若い幼虫になり、そのうちのいくつかは黒い矢印で示されています。新しく出現した幼虫は、前端に黒い顎と半透明の体を持っています。それらは寒天表面の上を移動し、動かないカビと混同しないでください。挿入図には、白いフィラメント(赤い矢印)と先端に黒い胞子(緑の矢印)があり、新しく出現した幼虫よりもわずかに小さいカビが見られます。スケールバー = 1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
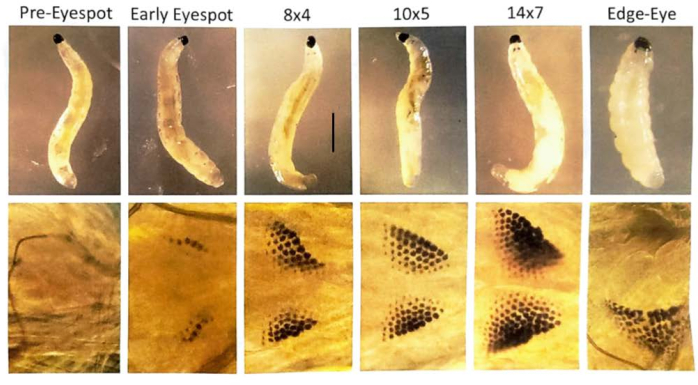
図7: B. coprophila 幼虫の眼点ステージ。 眼点は、幼虫の前方、顎のすぐ後ろに形成され、数が増える色素顆粒で構成されています。アイスポットは、大人の目へのanlageです。上のパネルは、解剖顕微鏡で視覚化された幼虫を示しています。下のパネルは、位相差顕微鏡を使用して眼点を拡大した図で、蒸留水の滴とカバーガラスが上に軽く浮かんでいる顕微鏡スライド上の幼虫を視覚化します。アイスポットステージの命名法は、Gabrusewycz-Garcia30 によるもので、顆粒の数は最長の列(例えば、12)でカウントされ、最も長い列を除いた追加の列の数が記される(例えば、アイスポットステージ12x6の場合は6)。唾液腺ポリテン染色体における部位特異的DNA増幅の開始は、アイスポットステージ10x5で始まり、遺伝子座での転写のバーストおよびDNAパフ31の拡張がある14x7で完了する。その後のエッジアイ/ドロップジョーの段階で、アイスポット顆粒は融合し始め、正中線から横方向に移動します。幼虫の体長が短くなります。さらに、DNAパフはこの段階で凝縮します。21°Cで各眼点ステージを横切るのに約1日かかります。スケールバー = 1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
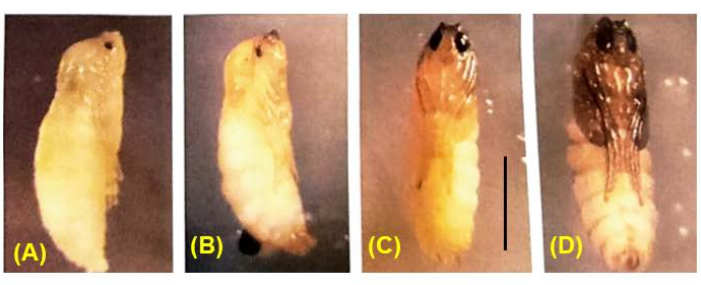
図8: B. coprophila の蛹の発達。 蛹化中、神経系を除くすべての幼虫組織は組織化し、想像椎間板の細胞分裂によって生じる成体組織に置き換えられます。ボディカラーはホワイトからタン、ブラウン、ブラックへと変化します。色素は徐々に蛹の目を埋めます。減数分裂IおよびIIは、色素36で満たされた目の1/4から1/2を持つ雄の蛹に発生します。スケールバー = 1 mm。 この図の拡大版を表示するには、ここをクリックしてください。
| 在庫名 | マーカー | 出生率 | コメント |
| 7298 | 波状(W)ウィング | ~75% | |
| ホロ2 | 波状(W)ウィング | ~90% | 7298から派生 |
| W14 | 波状(W)ウィング。白目 | ~95% | HoLo2から派生 |
| 6980 | 波状(W)ウィング。腫れた(SW)静脈 | ~65% | |
| 91Sの | 弱い波状(W)ウィング。プチ(P)ウィング | ~50% | ウェイビーマーカーは91Sを救うために十字架で導入されました |
表2:Bradysia(Sciara)coprophilaのストック。Gerbi6 の表 1 に、これらのマーカーと、現存しなくなった他のマーカーの一覧を示します。X27のセントロメア端での5つの転座(T1、T23、T29、T32、T70)は、Gerbi6の図8にまとめられていますが、現存していません。
補足ファイル1:HoLo2(および7298とW14)の交差、91Sの交差と救助、6980の交差、転座の交差。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
ここで紹介した B. coprophila の飼育に関するプロトコルは、この生物を研究室で飼育し、そのユニークな生物学的特徴を探求するための実験を行いたいと考えている科学者にとって有用です。 B. coprophila29 を維持するために寒天ベースに振りかけた酵母とキノコ粉末を使用した給餌方法の最初の説明は、メスの研究室で14種類のSciarid Flys5を飼育するために使用されました。その後、イラクサおよび/またはほうれん草の粉末の添加により、 B. coprophila (Gabrusewycz-Garcia、私信)の活力がさらに増加することが観察されました。これらの方法は、現在培養されている Bradysia impatiens や Lycoriella ingenua など、Sciaridae科の関連種の維持に成功しています(Robert Baird、私信)。
他の方法(以下で説明する代替給餌方法など)は 、B. coprophilaを飼育するために試みられてきましたが、ここで説明するプロトコルは、寒天の表面積あたりの幼虫の最も好ましい比率を持つように最適化されており、最も肥沃な脂肪の成虫を取得し、カビの成長を最小限に抑えています。スケールアップするために、上記のプロトコル2で説明したように、ガラスバイアル中で大量交配を行うことができます。あるいは、数匹(2〜4匹)の成体女性を、 ショウジョウバエ を育てるために使用されるフラスコ(使い捨て6オンス= 177.4 mL角底 ショウジョウバエ ポリプロピレンボトル)に2倍の成人男性と一緒に配置することができます。どちらの場合も、研究者は、フラスコにすべての女性生産者またはすべての男性生産者の母親のみが含まれていることを完全に確信している必要があります。
蛹と成虫は食べないので、幼虫だけに餌を与えます。幼虫が蛹に変わった場合は、バイアルに餌を与えないでください(これの兆候は、最初に出現する成虫のハエが現れるときです)。成虫が閉じたら、バイアルを冷たいインキュベーター(利用可能な場合は16°Cなど)に入れます。週に3回(例:月曜日、水曜日、金曜日)給餌し、幼虫が年をとるにつれてバイアルごとに与えられる食物の量を増やします。たっぷりと餌を与えれば、太った肥沃な大人が報われるでしょう。ただし、餌を与えすぎると白いカビが現れ、それはバイアルに堆積する食物の量を減らすための兆候です。さらに、餌を与えすぎると、寒天の上に厚い食物のパッドが発達し、成虫が出現しにくくなります(鉗子でパッドを取り外すことができますが、パッドで幼虫を外に出さないように注意してください-これをまったく行わなくてもよいのが最善です)。幼虫が少ない(「少数」とマークされている)バイアルは、必要な食物が少なくて済みます。餌が少なすぎると、幼虫は餌を求めてバイアルの壁を登ります。栄養不足の幼虫は、繁殖力の低い小さな成虫をもたらします。
代替給餌方法
幼虫に週に3回ではなく、幼虫の段階で1回だけ餌を与えるために、さまざまな方法が試みられてきました。B.コプロフィラはショウジョウバエスタイルの食品では成長しません。ジョン・アーバン(私信)は、寒天にB.コプロフィラ食品を混ぜようとしましたが、カビが生えすぎました。彼は、2つのカビ防止剤(テゴセプトとプロピオン酸)を組み合わせて別々に追加し、いくつかの異なる濃度を試したところ、カビを抑制するレベルでB.coprophilaに対してすべて毒性があることを発見しました。寒天は、B. coprophilaが酸性pH(プロピアン酸と同様)で病気になるため、pH 6-7(中性)である必要があります。あるいは、週3回の給餌をなくすために、針のないヘラまたは注射器を使用して、交尾後1週間後(つまり、幼虫が出現し始める頃)に、各バイアルの寒天の上に濃厚な酵母ペースト(Red Star活性乾燥酵母を少量の蒸留水と混合して湿らせます)を分注しようとしました。
週3回の給餌を避ける別の方法は、各バイアルに菌類の生きた培養物を追加することです。Bath and Sponsler37 は、Sabouraudの培地を使用した傾斜した寒天表面に、 Chaetoconidia 属(最高)または Baplosporangia 属または Xllescheria属の真菌培養物で縞模様を付ける必要があると報告しました。この菌は 、B. coprophila が導入される数日から1週間前に栽培されました。この後、給餌は必要ありませんでした。この方法の変形は、Ellen Rasch(私信)によっても採用されました。私たちの手では、この方法ではバイアルが濡れすぎており、幼虫は溺れてしまいましたが、生きた真菌のバイアルに対して幼虫の数を最適化するために再度試すことができました。
Arthur Forer(私信)は、ツルバエ38と同じようにB.coprophilaを飼育することに成功しています。このアプローチにより、蛹は湿った張り子で育てられました。その後、成虫を交配させ、卵を新鮮で湿った張り子に置きました。得られた幼虫は、ペトリ皿の張り子に乗せられ、週に2回、イラクサの葉の粉末を与えられました。蛹はケージに入れられ、サイクルが繰り返されました。
山下由紀子さん(私信)は、自然界の鉢植えや湿度の高い温室など、自然界で見られる条件を模倣して、B. coprophilaを土壌で飼育しようと試みましたが、成功しませんでした。しかし、湿度が上がるとカビが問題になることがあります。それにもかかわらず、湿った土壌は、湿った土壌でプラスチックの箱にPseudolycoriella(以前はBradysia)の衛生的な幼虫を育てるために成功裏に使用されてきました。それらは分解されたIlex paraguariensisの葉を与えられ、1.2%酵母抽出物、1.4%コーンスターチ、0.8%オートミール粉、1.2%寒天12を幼虫の後期に補われます。同様に、湿った土壌は、砕いたインゲン豆を湿らせたピートモスに置き換えて、シャリドバエ39,40を育てることができます。
ブラディシアの実験室培養を維持するために、さらに他の方法が採用されてきました:(i)酵母と乾燥血液肥料が添加されたオートクレーブされたジャガイモ41;(ii)乾燥血液45を加えることができる肥料42,43,44;(iii)綿パッドと湿らせたペーパータオル付きのプラスチック容器、挽いた大豆46。
ダニ
ダニはショウジョウバエからB.コプロフィラに移すことができます。これを最小限に抑えるには、B. coprophilaをショウジョウバエのストックの近くではなく、別のインキュベーターまたは部屋に保管するのが最善です。さらに、ショウジョウバエを取り扱う前に、その日の早い時間にB.コプロフィラのメンテナンス作業を行ってください。ダニは観葉植物からB.coprophilaに移すこともできるため、植物をB.coprophilaと同じ部屋に保管しないでください。ダニがバイアルに侵入すると、B. coprophilaの体を這う小さな白い球状の生物として見ることができます。ショウジョウバエのダニを破壊する働きをする化学処理は、化学物質がB.コプロフィラを殺すため、B.コプロフィラには使用できません(B.コプロフィラはフェノールなどの有機ガスにも敏感です)。B. coprophila株のダニを駆除する唯一の治療法は、寒天プレート上の胚を手動で収集し、それぞれにダニがいないかどうかを調べ、細い絵筆を使用してそれらを新鮮な寒天バイアルに移すことです。綿入りガーゼプラグと酢酸セルロースフォームフラッグ(ショウジョウバエポリプロピレンバイアルに使用)は、どちらもバイアルへのダニの侵入を防ぐのに役立ちます。
飼育プロトコルの有用性
ここで説明するプロトコルにより、成長を続ける科学者のコミュニティは、 B. coprophila を新旧の新興モデル生物として飼育し、そのユニークな生物学的特徴を研究することができます。新しい研究室グループは、 Bradysia (Sciara)のユニークな生物学的特徴を維持し、調査するために、成長するコミュニティに参加することが奨励されています。
開示事項
著者は、宣言する利益相反を持っていません。
謝辞
飼育プロトコルの微調整にご協力いただいた過去の B. coprophila ストックキーパー(Jacob E. Bliss、Paula Bonazinga、Anne W. Kerrebrock、Ingrid M. Mercer、Heidi S. Smith)および研究関係者(特にRobert Baird、Michael S. Foulk、Donna Kubai、John M. Urban、Yutaka Yamamoto)に感謝します。 B. coprophila のケアに関する最初の指示は、Helen V. Crouse、Natalia Gabrusewycz-Garcia、Reba M. Goodman、Charles W. Metz、およびEllen Raschによって提供されました。山下由紀子さんとアン・W・ケレブロックさん、 Bradysia (Sciara)ストックセンターを引き受けてくださったことに感謝します。図の作成にご協力いただいたBrian Wiegmann氏(図1)、John M. Urban氏(図4 上段)、Laura Ross氏(図4 下段)、Yutaka Yamamoto氏(図5 左面)、門田Leo氏(図7 、 図8)に心より感謝申し上げます。写真撮影と撮影に協力してくれたAva Filis氏とBrown University Multidisciplinary Laboratoryに感謝します。この原稿にコメントをくださったRobert Bairdに感謝します。 私たちの 研究と維持管理は、NIHとNSFの支援を受けており、最近ではNIH GM121455からS.A.G.への支援を受けています。 B. coprophila の詳細については、現在建設中の Bradysia (Sciara)ストックセンターのウェブサイト(https://sites.brown.edu/sciara/ および https://sciara.wi.mit.edu)をご覧ください。
資料
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
参考文献
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved