Method Article
Manutenção laboratorial da Bradisia (Sciara) coprophila da mosca dos dípteros inferiores: um novo / antigo organismo modelo emergente
Neste Artigo
Resumo
Este artigo descreve a manutenção laboratorial (incluindo acasalamento e alimentação) da mosca díptera inferior Bradysia (Sciara) coprophila.
Resumo
Os estoques de laboratório da mosca dos dípteros inferiores, Bradysia (Sciara) coprophila, foram mantidos por mais de um século. Protocolos para manutenção laboratorial de B. coprophila são apresentados aqui. Esses protocolos serão úteis para o número crescente de laboratórios que estudam B. coprophila para aproveitar suas características biológicas únicas, que incluem (1) um fuso monopolar na meiose masculina I; (2) não disjunção da díade X na meiose masculina II; (3) impressão cromossômica para distinguir homólogos maternos de paternos; (4) cromossomos limitados por linha germinativa (L); (5) eliminação cromossômica (cromossomos paternos na meiose masculina I; um a dois cromossomos X em embriões iniciais; cromossomos L do soma em embriões iniciais); (6) determinação do sexo pela mãe (não há cromossomo Y); e (7) amplificação de DNA regulada pelo desenvolvimento nos loci de sopro de DNA em cromossomos politênicos de glândulas salivares larvais.
Agora é possível explorar essas muitas características únicas da mecânica cromossômica usando os recentes avanços no sequenciamento e montagem do genoma de B. coprophila e o desenvolvimento de metodologia de transformação para engenharia genômica. A crescente comunidade científica que usa B. coprophila para pesquisa se beneficiará dos protocolos descritos aqui para o acasalamento das moscas (marcadores fenotípicos para mães que terão apenas filhos ou apenas filhas; detalhes de acasalamento em massa para experimentos bioquímicos), verificação da eclosão do embrião, alimentação de larvas e outros comentários sobre sua criação.
Introdução
Uma compreensão completa dos princípios biológicos requer o estudo de muitos organismos diversos que abrangem a Árvore da Vida. Embora uma ampla gama de organismos tenha sido descrita até o finaldo século 19, em meados doséculo 20 os estudos experimentais tornaram-se restritos a um punhado de menos de uma dúzia de organismos modelo. Com o advento da era genômica e o objetivo de sequenciar genomas de todas as espécies na Árvore da Vida1, estamos agora em posição de expandir os tipos de organismos usados para experimentos de laboratório e colher a vantagem de sua diversidade. Essa expansão de organismos modelo emergentes para experimentos tem um pré-requisito de ser capaz de mantê-los em laboratório. Aqui, os protocolos são descritos para a criação de um desses organismos modelo novos / antigos emergentes.
A maior parte da vida animal na Terra é explicada por quatro super-radiações de Insetos2. Dentro dos insetos, existem cerca de 158.000 espécies de dípteros (moscas verdadeiras)3, com cerca de 3000 espécies na família Sciaridae (mosquitos do fungo negro)4. A mosca-da-fruta Drosophila é a mais estudada das moscas dípteras. A mosca dos dípteros inferiores (Nematocera), Bradysia (anteriormente chamada de Sciara) coprophila, divergiu há 200 milhões de anos da Drosophila, que é uma mosca "dípteros superiores" (Brachycera). Portanto, B. coprophila está em uma posição taxonômica favorável para estudos comparativos com D. melanogaster (Figura 1). Além disso, B. coprophila tem muitas características biológicas únicas que são dignas de estudo por si só 5,6,7. Muitas dessas características desobedecem à regra da constância do DNA, na qual todas as células de um organismo têm o mesmo conteúdo de DNA. Em B. coprophila, (i) o genoma paterno é eliminado em um fuso monopolar na meiose masculina I; (ii) há não disjunção da díade X na meiose masculina II; (iii) os cromossomos (L) limitados pela linha germinativa são eliminados do soma; e (iv) um ou dois cromossomos X são eliminados no embrião inicial, dependendo do sexo do indivíduo. O imprinting cromossômico para distinguir homólogos maternos de paternos foi descoberto pela primeira vez em B. coprophila e está em jogo para muitos desses eventos de eliminação cromossômica. Além da eliminação cromossômica, outro desvio da constância do DNA ocorre por meio da amplificação de DNA específica do locus regulada pelo desenvolvimento nos loci de sopro de DNA nos cromossomos politênicos das glândulas salivares larvais. Estudos dessas características únicas requerem manutenção laboratorial de B. coprophila; detalhes de sua criação são apresentados aqui para facilitar tais estudos.
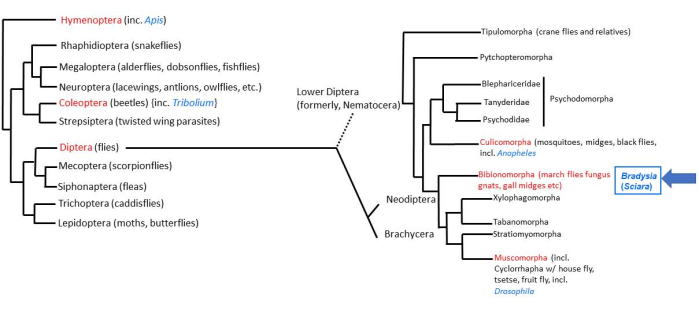
Figura 1: Filogenia de Bradysia (Sciara) coprophila. Organismos modelo populares são indicados em fonte azul e sua ordem taxonômica em fonte vermelha. Bradysia e outros mosquitos do fungo Sciarid, bem como mosquitos, são moscas dípteras inferiores (anteriormente, subordem Nematocera), enquanto as espécies de Drosophila são moscas dípteras superiores (subordem: Brachysera). As informações do lado esquerdo da figura são de Misof et al.33; as informações do lado direito são de Bertone et al.34 e Wiegmann et al.2. Clique aqui para ver uma versão maior desta figura.
Anteriormente, o gênero Sciara tinha o maior número (700) de espécies para qualquer eucarioto, levando Steffan a subdividi-los8. Posteriormente, Shin propôs que a família Sciaridae fosse subdividida na subfamília Sciarinae (com seis gêneros, incluindo Sciara, Trichosia e Leptosciarella), a subfamília Megalosphyinae (incluindo o gênero Bradysia) e três outros grupos (incluindo Pseudolycoriella) 9 . A filogenia dos Sciaridae tem sido estudada por vários grupos nos últimos anos 9,10,11. Nas últimas décadas, os nomes de muitos organismos da família Sciaridae mudaram12. Embora a maior parte da literatura de mais de um século se refira ao organismo que estudamos como Sciara coprophila, seu nome taxonômico atual é agora Bradysia coprophila (syn. Bradysia tilicola e outros sinônimos)10. Eles são encontrados em todo o mundo e são comumente conhecidos como mosquitos de fungos, pois comem cogumelos e outros fungos. Eles foram descritos pela primeira vez em 1804 por Meigen13 na Europa e posteriormente por Johannsen14,15 na América do Norte. B. coprophila foi coletado no Cold Spring Harbor Laboratory e os estoques de laboratório foram estabelecidos por Charles Metz no início de 1900, quando ele era um estudante de pós-graduação na Universidade de Columbia com Thomas Hunt Morgan. Assim, os estoques atuais refletem um século de endogamia. Da mesma forma, a biologia de B. coprophila foi ainda mais elucidada por décadas de estudos citogenéticos por Helen Crouse (que fez seu Ph.D. trabalho com Barbara McClintock).
Na década de 1930, Bradysia (Sciara) competiu com Drosophila melanogaster como um sistema modelo para estudos genéticos. Apesar de suas muitas características biológicas únicas, B. coprophila foi eclipsado por D. melanogaster como um organismo modelo popular, uma vez que mutações fenotípicas induzidas por radiação eram necessárias para estudos genéticos e eram mais fáceis de alcançar neste último, embora B. coprophila seja apenas ligeiramente mais resistente à irradiação gama do que D. melanogaster16. Na era moderna da genômica, isso não é mais uma preocupação. Uma vez que a sequência do genoma 17,18,19 (Urban, Gerbi e Spradling, dados não mostrados) e métodos de transformação20,21 (Yamamoto e Gerbi, dados não mostrados) para B. coprophila tornaram-se recentemente disponíveis, agora é hora de utilizá-lo como um novo / antigo sistema modelo emergente, como visto pela crescente comunidade de cientistas que o adotaram para suas pesquisas. Este artigo descreve os procedimentos para sua manutenção laboratorial.
B. coprophila não possui um cromossomo Y e o sexo da prole é determinado pela mãe. As mulheres que têm o cromossomo X '("X-prime") com uma longa inversão paracêntrica terão apenas filhas, enquanto as mulheres que são homozigóticas para o cromossomo X padrão (não invertido) terão apenas filhos5 (Figura 2). As informações da sequência estão disponíveis para o cromossomo X '19, mas o mecanismo molecular ainda precisa ser elucidado sobre como o cromossomo X 'determina que a prole será do sexo feminino. Os machos nunca têm o cromossomo X ', e após a fertilização, as fêmeas são X'X (heterozigoto para o X') ou XX. As fêmeas X'X adultas podem ser distinguidas das fêmeas XX por marcadores fenotípicos na asa (Figura 3). As fêmeas X'X (que terão apenas filhas) podem ser reconhecidas pelo marcador de asa ondulado (W) dominante no X' (como no estoque HoLo2)22. Alternativamente, as fêmeas XX (que terão apenas filhos) podem ser reconhecidas pelo marcador de asa recessivo petite (p) no X como na coronha 91S23. Nesse caso, as fêmeas X'Xp terão asas de comprimento total (não pequenas) e terão apenas filhas. O estoque 6980 carrega um marcador recessivo no cromossomo X para veias inchadas (sw)24, bem como o marcador dominante Wavy no X ', permitindo dois marcadores para seleção de cruzamentos. O grau de expressão de Wavy pode variar e parece mais fraco em frascos superlotados onde a comida é limitante ou se a temperatura ficar muito quente. O fenótipo da asa ondulada é excepcionalmente forte se as larvas forem mantidas na câmara fria (4 ° -8 ° C) em vez dos habituais 21 ° C. Embora o marcador recessivo de asa pequena não seja variável e seja muito fácil de identificar, os estoques 91S são usados com menos frequência, pois são menos saudáveis do que o estoque HoLo2. Os esquemas de acasalamento de B. coprophila são apresentados aqui (Figura 2) e descritos em detalhes para os estoques HoLo2, 7298 e W14 (Arquivo Suplementar 1), o estoque 91S (Arquivo Suplementar 1), o estoque 6980 (Arquivo Suplementar 1) e os estoques de translocação (Arquivo Suplementar 1). Os estoques de translocação não existem mais; eram translocações recíprocas de heterocromômeros (H1, H2 e H3) no braço curto do X que contém os genes do RNA ribossômico 25,26,27.
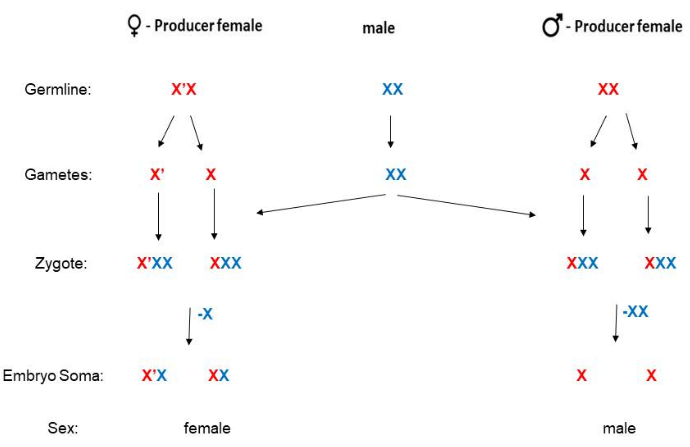
Figura 2: Esquema de acasalamento para B. coprophila. Este organismo não possui cromossomo Y (o soma masculino tem um único X); as mães determinam o sexo de seus filhos. As mães XX têm apenas filhos e as mulheres X'X têm apenas filhas. O cromossomo X' tem uma longa inversão paracêntrica quando comparado ao cromossomo X. A linhagem paterna ou materna do cromossomo X (ou X') é denotada por azul ou vermelho, respectivamente, nesta figura. Os espermatozoides são haplóides para os autossomos, mas têm duas cópias do cromossomo X devido à não disjunção na meiose II. A linhagem somática dos primeiros embriões elimina uma ou duas cópias do X derivado do pai se forem fêmeas ou machos, respectivamente. Clique aqui para ver uma versão maior desta figura.

Figura 3: Fenótipos de asa de B. coprophila. As moscas fêmeas adultas são mostradas com vários fenótipos de asas: (A) asa reta (XX), (B) asa ondulada (X'WX), (C) fenótipo extremo de asa ondulada (X'WX) que tem uma aparência enrugada após armazenar larvas no room frio, (D) asa pequena (XpXp) que é vestigial, (E) asa reta com tipo selvagem (XX) e veias não inchadas, (F) asa reta com veias inchadas (XswXsw) onde pequenas bolhas (setas pretas) aparecem na borda superior da asa e/ou perto da ponta de ambas as asas, (G) exemplo extremo de inchado onde ocorre uma bolha (seta branca) em uma ou ambas as asas. Os machos não têm o cromossomo X 'e, portanto, nunca terão asas onduladas, mas têm asas pequenas ou inchadas no estoque 91S ou 6980, respectivamente. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
O objetivo na manutenção de estoque é realizar cruzamentos onde metade dos cruzamentos são de mães produtoras de fêmeas e metade dos cruzamentos de mães produtoras de machos para ter um número igual de adultos fêmeas e machos na próxima geração para cruzamentos subsequentes. No entanto, isso também envolve planejamento, uma vez que o ciclo de vida dos machos é mais curto do que para as fêmeas e os machos adultos emergem até uma semana antes das fêmeas adultas. A natureza acomoda essa assincronia entre os sexos, fazendo com que os embriões masculinos surjam como larvas 1-2 dias após as larvas femininas de um cruzamento na mesma data. No entanto, para garantir que adultos machos e fêmeas estejam disponíveis ao mesmo tempo para cruzamentos de laboratório, o desenvolvimento das fêmeas pode ser um pouco acelerado deixando frascos com larvas femininas em temperatura ambiente em vez de a 21 ° C ou colocando frascos com larvas masculinas em temperaturas ligeiramente mais frias (por exemplo, 16 ° C). Outra rota mais infalível é fazer cruzamentos com mães produtoras na segunda-feira e cruzamentos com mães produtoras na sexta-feira da mesma semana. O caminho mais fácil, que é o que empregamos, é realizar cruzamentos com mães produtoras e produtoras no mesmo dia da semana e realizar cruzamentos nesse dia em cada semana consecutiva. Nessa abordagem, as fêmeas adultas de um cruzamento na semana 1 podem ser acasaladas com machos adultos que emergiram de um cruzamento na semana 2.
O ciclo de vida da fêmea de B. coprophila é de 5 semanas quando criada a 21 °C (Tabela 1). A duração de seu ciclo de vida é um pouco mais longa em temperaturas mais baixas ou se estiverem subalimentados. O ciclo de vida do macho B. coprophila é de ~ 4-4,5 semanas, uma vez que eles se transformam em pupas 0,5-1 semana antes das fêmeas. O final de cada ínstar larval é marcado pela descamação da cutícula, que é desencadeada por uma explosão no nível do hormônio esteróide ecdisona. Ao contrário de D. melanogaster, que tem três instares larvais, B. coprophila tem quatro instares larvais.
| Estágio de desenvolvimento | Dias após o acasalamento (dpm) | Duração do estágio (dias) |
| Ovo posto | 1-2 | |
| Embrião | 1-2 até 7-8 | ~ 7 dias |
| Larva | ||
| Instares larvais 1, 2 e 3 | 7-8 até 16-19 | ~ 10 |
| 4º pré-olho de ínstar larval | 16-19 até 21-24 | 5 |
| 4º estágio de mancha ocular de ínstar larval | 21-24 até 25-28 | 4 |
| Pupa | 25-28 até 30-33 | 5 |
| Adulto | vive 1-2 dias a 21 °C se acasalado ou vive 2-3 semanas a 16 °C se não acasalado. | |
Tabela 1: Ciclo de vida da fêmea de B. coprophila a 21 °C.
B. coprophila pode ser mantida em qualquer lugar na faixa de 15 ° C-25 ° C, com o desenvolvimento progredindo mais lentamente em temperaturas mais baixas. Este inseto prefere um ambiente úmido (sendo encontrado no solo de plantas domésticas ou canteiros de cogumelos), por isso mantemos um copo com água deionizada na incubadora. B. coprophila pode ser mantida em temperatura ambiente em uma caixa de pão de metal com uma tampa frouxa e contendo um copo de água, mas entra em choque térmico a 37 ° C28, o que é um perigo em climas quentes. Michael Ashburner e outros tentaram, com pouco sucesso, armazenar D. melanogaster no frio para reduzir o tempo necessário para a manutenção do estoque. Em contraste, uma grande vantagem de B. coprophila é que os frascos com larvas de estágio intermediário podem ser armazenados por até 3 meses em uma prateleira aberta na câmara fria (4-8 ° C) com o mínimo de cuidado de alimentar apenas uma vez por mês. Eles se desenvolvem extremamente lentamente no frio até o estágio de pupa e emergirão como adultos férteis quando os frascos forem trazidos de volta a 21 ° C. Presumivelmente, isso imita o inverno na natureza. Essa paralisação do desenvolvimento induzida pelo frio pode ser comparável à observada após a irradiação gama de larvas16 de B. coprophila em estágio intermediário, mas a paralisação do desenvolvimento não é observada em larvas em estágio avançado que passaram do ponto de não retorno para sua progressão normal do desenvolvimento.
Protocolo
Os protocolos descritos aqui representam um século de experiência dos centros de estoque Bradysia (Sciara) supervisionados sequencialmente por Charles Metz, Helen Crouse e Susan Gerbi, bem como contribuições de outros.
1. Cruzamentos de acoplamento
- Use uma fêmea adulta e dois machos adultos por frasco de vidro de 28 mm de diâmetro. Uma vez que 100% de sucesso seja alcançado no reconhecimento de fenótipos de asas para mães que terão apenas filhas ou filhos, use duas fêmeas e dois machos por frasco para aumentar o número de larvas / frasco. Adicione as fêmeas a cada frasco antes de adicionar os machos que acordam mais rápido da anestesia do que as fêmeas.
NOTA: A descrição abaixo presume que você tem CO2; Alternativamente, o éter pode ser usado para anestesiar as moscas adultas. - Se estiver usando éter para anestesiar as moscas adultas, cole uma almofada de lenços de laboratório dobrados (por exemplo, kimwipes) no interior de uma tampa de vidro redonda de um frasco de Coplin e use um conta-gotas para transferir um pouco de éter da garrafa para umedecer o lenço umedecido de laboratório (mas não saturado e tão úmido que o líquido de éter cairá e correrá o risco de afogar as moscas). Para a etapa 1.6 abaixo, coloque a almofada de éter umedecida em cima do frasco aberto por ~ 1 min até que os adultos parem de se mover. Uma vez que os adultos tenham sido transferidos para uma placa de cerâmica branca (usada em vez da almofada de mosca branca), periodicamente (quando as pernas das moscas começarem a se contorcer) segure a almofada que foi recém-umedecida com éter sobre (sem tocar) as moscas na placa por ~ 1 min.
CUIDADO: O éter é inflamável e deve ser armazenado em um exaustor e não na geladeira. - Disponha ao alcance do braço uma bandeja com frascos de fêmeas adultas, uma bandeja com machos adultos e uma bandeja de frascos vazios contendo 2,2% (peso / vol) de ágar. Na bancada do laboratório, coloque notas de cartaz informando "fêmea" ou "macho" e o fenótipo da asa da mãe para que o frasco com adultos selecionados para o cruzamento seja colocado no grupo correto, onde todos os frascos de um grupo terão apenas progênie masculina e todos os frascos do outro grupo terão apenas progênie feminina.
NOTA: Certifique-se de que não há gotículas de condensação dentro do frasco, pois os adultos grudam nas gotículas. Se os frascos foram armazenados em uma caixa de plástico, coloque-os em uma bancada de laboratório em temperatura ambiente por pelo menos 1 h antes de usar para permitir que a condensação evapore. - Ligue o gás CO2 e a lâmpada para o microscópio de dissecação.
NOTA: Uma fonte de luz com fibra óptica é preferida, pois emite menos calor, o que faz com que as moscas anestesiadas acordem mais rápido. - Bata vigorosamente no frasco com adultos em uma almofada de borracha para que os adultos caiam no fundo do frasco e remova o plugue; insira o bico da pistola de CO2 e adicione de volta o plugue.
- Pressione o gatilho do bico para que o CO2 flua para o frasco por ~ 1 min para anestesiar os adultos.
- Coloque um pé no pedal para que o CO2 flua para a almofada branca em vez do bico da pistola. Mantenha o pedal pressionado durante todo o tempo em que as moscas estiverem na almofada branca (ou então pressione intermitentemente o pedal sempre que as pernas das moscas começarem a se contorcer).
- Remova o bico e o plugue do frasco e inverta o frasco sobre uma almofada branca sob um microscópio de dissecação.
- Bata o fundo do frasco invertido contra o microscópio para que os adultos caiam do frasco para a almofada branca.
- Selecione os adultos mais gordos (recentemente fechados com abdômen branco) e use uma pinça de ponta fina para pegar suavemente o adulto pela perna média ou traseira. Não machuque as patas dianteiras que são usadas para a dança de acasalamento. Não use adultos que acabaram de fechar e cujos corpos são totalmente brancos e ainda não pretos, porque suas asas serão curtas e não totalmente desenvolvidas, de modo que o fenótipo da asa não possa ser pontuado. Adultos com abdômen mais fino ainda podem ser usados, embora tenham fertilidade reduzida. Não use adultos magros cujas asas são levantadas verticalmente para longe do corpo, pois estão mortos.
- Com a outra mão, remova o plugue do frasco com ágar 2,2% (peso / vol). Com a mão segurando a pinça com o adulto, bata vigorosamente a pinça contra a parede superior interna do frasco para que o adulto caia no fundo do frasco. Recoloque o plugue no frasco.
- Repita as etapas 1.5 a 1.11 acima para configurar cada frasco contendo fêmeas adultas. Use um pincel para varrer as moscas não utilizadas da almofada branca de volta para o frasco original. Coloque uma marca de seleção no rótulo do frasco para injetáveis para indicar que ele foi usado para acasalamento (embora possa ser usado novamente, se necessário).
- Para manutenção de estoque de rotina, configure 6-8 frascos com mães produtoras e 6-8 frascos de mães produtoras (Figura 4). Configure metade dos frascos com mães (ou pais) de um frasco para adultos e a outra metade dos novos frascos usando um frasco para adultos diferente para minimizar gargalos genéticos.
- Ocasionalmente, um evento de segregação incorreta produzirá um macho excepcional em frascos de produção feminina. Se um frasco com fêmeas adultas tiver um macho excepcional, remova e esmague para matar esse macho. Se possível, descarte todas as fêmeas desse frasco e espere alguns dias até que mais fêmeas adultas se aproximem e possam ser usadas com segurança para cruzamentos.
NOTA: É preferível não usar as fêmeas nesse frasco para cruzamentos porque elas podem ter acasalado com o macho excepcional e não produzir um cruzamento fértil.
- Ocasionalmente, um evento de segregação incorreta produzirá um macho excepcional em frascos de produção feminina. Se um frasco com fêmeas adultas tiver um macho excepcional, remova e esmague para matar esse macho. Se possível, descarte todas as fêmeas desse frasco e espere alguns dias até que mais fêmeas adultas se aproximem e possam ser usadas com segurança para cruzamentos.
- Uma vez que as fêmeas adultas tenham sido adicionadas a todos os frascos, repita as etapas 1.5-1.11 para adicionar dois machos adultos (Figura 4) a cada frasco que já contém moscas fêmeas. Bata o frasco com as fêmeas em uma almofada de borracha para que elas não escapem quando os dois machos forem adicionados sequencialmente.
NOTA: Trabalhe rapidamente e não anestesie demais as moscas adultas, pois isso as matará. - Adicione um rótulo a cada frasco informando o estoque, o cruzamento (para progênie feminina ou masculina), se a mãe veio do frasco adulto # 1 ou # 2 e a data do acasalamento. Insira também as informações acima em um caderno e indique o número de frascos configurados para cada cruz.
NOTA: É conveniente adicionar uma toalha de papel para separar os frascos de produção masculina dos frascos de produção feminina na bandeja. - Deixe os frascos intactos na bancada por ~ 15 min para ter certeza de que os adultos acordam e voam. Observe se eles estão acasalando (logo após acordarem) onde a fêmea e o macho estão orientados de posterior para posterior (o clasper macho agarrará o ovipositor pontiagudo da fêmea) (Figura 4, abaixo).
NOTA: Uma fêmea adulta aceitará um macho adulto apenas uma vez, portanto, não empurre os frascos após o acasalamento, pois isso pode separar o macho da fêmea durante o processo de acasalamento e essa fêmea não acasalará novamente. - Coloque a bandeja com frascos para injetáveis acoplados na incubadora (por exemplo, 21 °C). Rotule a bandeja com o nome do caldo (por exemplo, HoLo2) e a semana do ciclo de 5 semanas (semanas 1, 2, 3, 4 ou 5).
NOTA: Mantenha a bandeja com moscas recém-acasaladas em uma parte separada da incubadora ou outra incubadora como um lembrete para não alimentar os frascos até que as larvas tenham emergido (descrito abaixo).
2. Acasalamento em massa
NOTA: Normalmente, uma mãe solteira de B. coprophila terá 60 filhotes em sua ninhada. Quando um número maior de descendentes é necessário para experimentos, um acasalamento em massa pode ser feito em vez do acasalamento de par único descrito acima. O acasalamento em massa pode ser feito nos frascos de vidro padrão de 28 cm de diâmetro, quando as mães serão coletadas um dia depois para postura induzida e coleta de embriões. No entanto, se for necessário um número maior de larvas, o acasalamento em massa é feito em um frasco com uma superfície maior para evitar a superlotação. Faça vários pequenos orifícios na tampa do frasco para que as larvas possam respirar um pouco.
- Siga as etapas acima na seção 1, mas use uma pinça de ponta fina para mover todas as mães produtoras (ou todas as mães produtoras masculinas) para um canto frontal da almofada branca. Use 10-15 fêmeas adultas gordas anestesiadas e varra este grupo com um pincel para dentro do frasco ou frasco com pequenos orifícios na tampa.
NOTA: Execute as etapas 2.1 e 2.2. rapidamente para o acasalamento em massa para evitar o excesso de anestesia que evitaria cruzamentos férteis. - Selecione 20-25 machos adultos gordos anestesiados e mova-os com uma pinça de ponta fina para o canto frontal da almofada branca.
- Bata vigorosamente no frasco ou frasco com as fêmeas em uma almofada de borracha para que elas não escapem quando o plugue ou a tampa forem removidos para varrer o aglomerado anestesiado de machos adultos da almofada branca usando um pincel.
3. Coleta de embriões após o acasalamento em massa
- Um dia (24 h) após o acasalamento, execute as etapas 1.5-1.11 para anestesiar as moscas adultas (mistura de fêmeas e machos) e transferi-las para uma almofada de mosca branca.
NOTA: A oogênese ainda não está concluída quando as moscas adultas acasalam, o que desencadeia a meiose final; Os óvulos maduros são fertilizados pelo espermatozóide armazenado na espermateca quando os óvulos são liberados 29. A conclusão da oogênese pode levar de 1 a 2 dias, e é por isso que 1 dia é permitido após o acasalamento antes que a postura dos ovos seja induzida. - Com uma pinça de ponta fina, pegue uma fêmea adulta pelas asas e coloque-a em uma placa de Petri de 100 mm de diâmetro contendo 2,2% (peso / vol) de ágar, com suas asas inseridas no ágar. Repita esta etapa sequencialmente para cada fêmea adulta na almofada branca. Descarte os machos adultos na almofada de mosca.
- Uma vez que todas as moscas fêmeas estejam empaladas no ágar, induza a postura de ovos apertando suavemente a cabeça com uma pinça até que a mosca fêmea tenha movimentos semelhantes a convulsões. Como alternativa, aperte suavemente o tórax dela. Ela então colocará um cacho de ovos fertilizados dentro de 30-60 minutos. Cubra a placa de Petri com a tampa umedecida com um pano de laboratório umedecido com água para evitar a atração eletrostática dos ovos para a tampa.
4. Verificando a "eclosão" das larvas
- Verifique se há "eclosão" de larvas 1 semana após o acasalamento; Remova o tampão do frasco e use um microscópio de dissecação para marcar as larvas. Sua mandíbula preta abrirá e fechará repetidamente e eles avançarão lentamente. Se houver apenas algumas larvas, escreva "poucas" no rótulo do frasco, como um lembrete para alimentar menos o frasco. Examine cada frasco na bandeja com essa cruz e insira o número de frascos com larvas no caderno em uma coluna ao lado do número de frascos que foram configurados nesse acasalamento.
NOTA: Ovos amarelos profundos não se desenvolverão. É provável que os ovos brancos se desenvolvam e 1 dia antes do surgimento das larvas, o pigmento preto (a futura mandíbula) se desenvolverá na extremidade anterior do ovo. Não confunda o mofo com um filamento branco terminando em uma esfera preta em sua extremidade com larvas - o mofo não se move, ao contrário das larvas que rastejam para a frente no ágar. - Adicione um pouco de palha (apenas uma vez) a cada frasco com larvas para controlar o excesso de umidade e fornecer um esconderijo de cobertura para as larvas.
- Mova a bandeja para a incubadora (por exemplo, 21 ° C) com bandejas de larvas de cruzamentos de acasalamento de semanas anteriores e comece a alimentar os frascos com larvas recém-emergidas (consulte a seção abaixo sobre alimentação).
NOTA: Geralmente, as larvas estarão em um aglomerado perto de sua mãe morta e começarão a comê-la; presumivelmente, isso transfere o fermento do intestino da mãe para o intestino das larvas. Você pode começar a se alimentar no dia em que as larvas emergem ou dentro de 2 dias depois. CUIDADO: Se a alimentação for atrasada, as larvas se comerão, restando apenas uma larva gorda por frasco! - Continue a verificar os frascos que ainda não tinham larvas por 3 dias por semana. Se nenhuma larva tiver surgido após 7 a 10 dias, descarte o frasco ou guarde-o para lavagem do frasco.
5. Fazendo a comida
NOTA: Todos os ingredientes alimentares devem ser livres de pesticidas!
- Use uma colher de sopa para medir os seguintes ingredientes por volume e deposite-os em uma assadeira de metal ou vidro (por exemplo, uma assadeira de metal de 8 polegadas x 8 polegadas): 4 partes de palha de aveia (8 colheres de sopa), 2 partes de cogumelo Shitake em pó (4 colheres de sopa), 1 parte de espinafre em pó (2 colheres de sopa), 1 parte de urtiga em pó (2 colheres de sopa). Use a colher de sopa para misturar bem os ingredientes na panela.
NOTA: Alternativamente, 2 partes de apenas espinafre em pó ou apenas urtiga em pó podem ser usadas em vez de 1 parte de cada. - Cubra a panela com papel alumínio e autoclave em ciclo seco por 20-30 min. Deixe esfriar até a temperatura ambiente durante a noite ou mais.
- Retire o papel alumínio da panela e quebre a mistura de alimentos esterilizados endurecidos, usando um movimento de moagem com a colher de sopa para criar uma mistura em pó.
- Adicione 1 parte (2 colheres de sopa cheias) de levedura de cerveja e misture bem na mistura de alimentos autoclavada.
NOTA: A levedura de cerveja não é autoclavada, pois isso mataria a levedura. - Transfira a mistura de alimentos para um frasco com tampa estéril.
NOTA: O mesmo tipo de frasco de 240 mL usado para acasalamento em massa pode ser usado, e a receita acima encherá o frasco. Da mesma forma, o mesmo tipo de frasco com tampa esterilizada deve ser preenchido apenas com palha que foi autoclavada em uma panela coberta com papel alumínio.
6. Alimentação
NOTA: Ajuste a quantidade de alimento fornecida de acordo com a idade e a quantidade de larvas. Dê muita comida para potes com muitas larvas de um acasalamento em massa. Dê apenas uma leve pitada de comida às placas de Petri com larvas que estão sendo armazenadas por alguns dias para estadiamento do desenvolvimento. O método de alimentação descrito abaixo foi desenvolvido no laboratório de Charles Metz 29 e tem sido usado por seu laboratório e por Helen Crouse, Susan Gerbi e outros com sucesso por um século.
- Lave as mãos e enxágue bem para remover o sabão.
NOTA: As luvas não são recomendadas, pois diminuem a sensação dos dedos para regular a quantidade de comida dada a cada frasco. - Armazene um frasco estéril tampado com palha moída e um frasco estéril com alimentos na incubadora (por exemplo, 21 ° C) onde as larvas são mantidas. Retire a tampa do frasco e despeje um pouco de comida em uma tigela limpa (por exemplo, um prato de doces) para facilitar o acesso; Recoloque a tampa do frasco que contém os alimentos restantes. Mantenha a tigela aberta com os alimentos em uma bandeja pequena de metal ou vidro; Isso inibirá que ácaros ou outros insetos rastejem pela parede da bandeja para entrar na tigela com comida.
- Pegue um pouco de comida entre o segundo e o terceiro dedos (ou entre o polegar e o segundo dedo). Com a outra mão, retire um frasco da bandeja e remova o plugue, segurando-o com os dedos durante a alimentação. Examine o frasco para verificar a idade e o número de larvas e deposite a quantidade adequada de alimento no frasco girando os dois dedos segurando o alimento um contra o outro. Frascos com larvas recém-emergidas precisam apenas de alguns grãos de comida. Frascos com larvas mais velhas devem ter uma fina camada de alimento cobrindo a parte superior do ágar.
- Se houver mofo branco no frasco, use etanol a 70% pulverizado em um lenço de laboratório para limpar uma sonda de metal longa (por exemplo, com cabo de madeira), remova o plugue e insira a sonda limpa no frasco para bater no molde na superfície do ágar. Se houver muito mofo, gire a sonda para enrolar o molde ao redor da sonda para removê-la do frasco. Não perturbe o topo do ágar, pois as larvas vivem lá; Adicione apenas uma pequena quantidade de comida e substitua o plugue no frasco. Limpe a sonda com um pano de laboratório umedecido com etanol a 70% antes de armazenar a sonda ou usá-la para limpar outro frasco.
- Depois que todos os frascos para injetáveis em uma bandeja tiverem sido alimentados, recoloque a bandeja na incubadora e remova a próxima bandeja para alimentação como na etapa 6.3.
- Após a conclusão da alimentação, despeje o alimento restante da tigela no frasco previamente esterilizado, tampe o frasco e guarde-o na incubadora.
7. Coleta de larvas ou pupas em placas de Petri
- Para um pequeno número de larvas, use uma sonda de metal ou espátula que tenha sido limpa com etanol a 70% para cavar a camada superior de ágar em um frasco para transferir o ágar aderente com algumas larvas para uma placa de Petri estéril de 100 mm de diâmetro cheia até a metade com ágar 2,2% (peso / vol).
- Para um número maior de larvas, insira uma espátula ao longo da parede na parte inferior do frasco para retirar o tampão de ágar do frasco e deposite-o com a face voltada para cima em uma placa de Petri vazia. Use um microscópio de dissecação para encontrar as larvas no topo do tampão de ágar e transfira-as com pinças de ponta fina para uma placa de Petri estéril de 100 mm de diâmetro cheia até a metade com ágar 2,2% (peso / vol).
- Use um microscópio de dissecação para classificar as larvas com pinças de ponta fina em grupos do mesmo estágio de desenvolvimento.
NOTA: Devido à ligeira assincronia de desenvolvimento, haverá vários grupos diferentes de larvas selecionadas na placa de Petri com ágar 2,2% (peso / vol). - Adicione uma pequena pitada de comida e coloque a placa de Petri com larvas na incubadora. Remova-o diariamente para observação com o microscópio de dissecação para seleção do estágio de desenvolvimento desejado.
NOTA: Para estudos de sopro de DNA, as larvas de manchas oculares iniciais passam pelos estágios 10x5, 12x6, 14x7 e olho de borda / mandíbula caída com ~ 1 dia em cada um desses estágios 30,31. Escolha pupas cujos olhos sejam 1/4 a 1/2 preenchidos com pigmento para ter os estágios de meiose I e II nos testículos da pupa.
8. Armazenamento de larvas em câmara fria
- Como backup, mantenha na câmara fria cerca de quatro frascos de larvas femininas e quatro frascos de larvas masculinas de 2 semanas consecutivas de cruzamentos.
- Para o armazenamento de backup, alimente as larvas que estão no início do4º ínstar (estágio pré-mancha ocular) e coloque-as em uma bandeja aberta em uma prateleira na câmara fria; alimente esses frascos apenas uma vez por mês.
- Remova os 16 frascos das 2 semanas consecutivas de cruzamentos de acasalamento do frio após 2-3 meses (marque isso em um calendário como um lembrete); coloque-os em uma incubadora (por exemplo, 21 ° C) para alimentá-los normalmente e deixe-os se tornarem adultos para usar em cruzamentos.
- Quando os frascos forem removidos da câmara fria, coloque um novo conjunto de frascos com larvas de4º ínstar na câmara fria para que esses frascos estejam sempre disponíveis como backup para estoques.
NOTA: A viabilidade após o armazenamento em câmara fria não foi testada sistematicamente para diferentes estágios de desenvolvimento, mas nossa experiência revela que o armazenamento refrigerado de larvas de4º ínstar inicial funciona bem.
9. Lavagem do frasco
- Após a morte dos adultos (~ 2-3 semanas após a eclosão), remova os frascos da incubadora e coloque-os a 60-70 ° C por 1 hora para matar quaisquer organismos restantes.
- Remova os plugues de algodão e guarde-os em uma caixa de plástico.
- Use uma espátula para raspar o tampão de ágar do frasco para dentro de uma lata de lixo.
- Mergulhe os frascos durante a noite ou mais submersos em água em uma panela.
- Use uma escova de tubo de ensaio guardada apenas para esse fim (nunca usada para recipientes com produtos químicos nem com sabão) e esfregue para cima e para baixo no frasco sob água corrente da torneira. Coloque o frasco limpo com o lado aberto para baixo em uma cesta de metal. Encha a cesta com frascos limpos.
NOTA: Nunca use sabão nos frascos, pois qualquer resíduo de sabão pode matar B. coprophila. - Adicione uma tampa de malha de arame à cesta e, enquanto segura a tampa no lugar, inverta a cesta para encher todos os frascos com água deionizada. Enquanto ainda segura a tampa no lugar, inverta a cesta para esvaziar a água deionizada dos frascos. Repita os enxágues com água deionizada 4x.
- Coloque as cestas com frascos limpos em toalhas de papel ou uma plataforma de malha aberta (por exemplo, carrinho de laboratório) para secar durante a noite ou por mais tempo. Guarde os frascos secos em uma gaveta.
NOTA: Não deixe os frascos com adultos mortos permanecerem muito tempo antes de lavá-los, pois isso pode causar uma infestação de ácaros.
10. Derramando ágar
- Encha um recipiente grande (cesta de metal ou bandeja de metal) com frascos limpos e adicione um tampão de algodão a cada frasco. Reutilize os plugues retirados de frascos antigos quando os frascos foram lavados e use os plugues repetidamente até que se degradem e se desfaçam e devam ser descartados. Esterilize o recipiente com os frascos tampados em um ciclo seco por ~ 30 min e deixe-os esfriar até a temperatura ambiente para armazená-los no recipiente da autoclave. Mantenha sempre dois recipientes (um ativamente em uso e outro sobressalente) com frascos autoclavados à mão.
- Coloque 11,0 g de pó de ágar em um frasco Erlenmeyer de 1 L e adicione 500 mL de água destilada para fazer uma solução de ágar a 2,2% (peso / vol) suficiente para derramar ~ 24 frascos (~ 21 mL / frasco). Agite o frasco e coloque-o em um forno de micro-ondas.
NOTA: A partir daqui, use uma luva de autoclave resistente ao calor para manusear o frasco. A mesma solução de ágar 2,2% (peso / vol) pode ser despejada em placas de Petri (para larvas escolhidas) ou potes (para acasalamentos em massa), se necessário. - Microondas por 1 min, remova o frasco para girá-lo, recoloque-o no forno de micro-ondas e leve ao microondas novamente por 1 min. Repita isso várias vezes.
- Observe o frasco através da porta de vidro do forno de micro-ondas. Quando a solução de ágar começar a espumar e ferver, use imediatamente o botão de parada manual. Não gire o frasco neste momento (pode transbordar), retire-o cuidadosamente do forno para a bancada e deixe descansar por alguns minutos.
- Remova o plugue de um frasco esterilizado e segure-o com uma mão; Use a outra mão para despejar ~ 2,5 cm de altura de ágar 2,2% no frasco esterilizado. Em seguida, recoloque o plugue no frasco. Repita isso até que todo o ágar tenha sido derramado.
NOTA: Se for derramado muito pouco ágar no frasco, este secará mais rapidamente durante a utilização e encolherá das paredes do frasco. Se muito ágar for derramado no frasco, é difícil focar na camada superior ao marcar a "eclosão do bebê" das larvas com um microscópio de dissecação. - Deixe os frascos derramados permanecerem no balcão em temperatura ambiente por 1-2 dias para que o ágar endureça e a umidade evapore completamente. Use os frascos para cruzes de acoplamento ou guarde-os deitados de lado em uma caixa de plástico com tampa bem ajustada; Coloque uma toalha de papel umedecida com água em cima dos frascos antes de colocar a tampa na caixa (isso evitará que o ágar-ágar seque e encolha da parede do frasco). Armazene a caixa com frascos para injetáveis derramados em temperatura ambiente por alguns dias ou em uma geladeira ou câmara fria a 4 ° C por até 2 semanas. Antes de usar os frascos armazenados, retire-os da caixa e deixe-os no balcão em temperatura ambiente por uma ou duas horas para permitir que a condensação evapore de dentro dos frascos (as moscas adultas grudariam no condensado e se afogariam).
11. Fazendo plugues para frascos
- Coloque um frasco limpo em um suporte de tubo de ensaio de isopor de 50 mL (force o tubo para que fique reto). Corte um quadrado de gaze (2-4 camadas de espessura) e coloque-o em cima do frasco.
- Coloque pedaços de gaze de plugues feitos anteriormente em cima da gaze para criar uma camada mais espessa. Coloque o algodão em cima da gaze e pressione o frasco, certificando-se de encher bem a parte superior do frasco.
- Segure a parte superior das pontas da gaze e amarre-a com barbante. Corte o excesso de barbante e o excesso de gaze (deixe pontas suficientes do barbante para mantê-lo amarrado e gaze suficiente para segurar confortavelmente o plugue).
NOTA: Encaixe os plugues de forma que fiquem firmes. Você deve ser capaz de puxá-los para fora com o indicador e o indicador enquanto os segura com uma mão. Se você pegar o frasco pelo plugue e ele cair, ele está muito solto. Se fizer um som alto de estalo quando puxado para fora, pode estar muito apertado. Se estiver muito apertado ou se o tampão tiver uma camada de ágar duro e seco, as moscas podem sufocar. Se o plugue estiver um pouco solto demais ou escorregando pelas laterais do frasco, ele pode ser batido na bancada para esmagá-lo em um tamanho um pouco maior.
12. Cronograma semanal típico (para maior eficiência, execute as tarefas na ordem listada)
- Segunda-feira (~ 30 min)
- Alimente os frascos com larvas.
- Despeje o ágar em frascos limpos estéreis com plugues.
- Quarta-feira (~2 h)
- Coloque os frascos com adultos mortos no forno por 1 h e guarde para lavar.
- Verifique se há larvas "baby-hatch".
- Alimente os frascos com larvas.
- Realize cruzamentos semanais de acasalamento.
- Outras tarefas conforme necessário: autoclave frascos limpos com plugues para ter um suprimento de reserva conforme necessário; fazer novos alimentos e canudos de autoclave conforme necessário; frascos de autoclave conforme necessário para alimentos e palha.
- Sexta-feira (~ 30 min)
- Verifique se há larvas "baby-hatch".
- Alimente os frascos com larvas.
Resultados
Os protocolos descritos aqui levaram a um sucesso comprovado na criação de B. coprophila. Quando adultos gordos recém-fechados são escolhidos para o acasalamento (Figura 4), mais de 90% dos cruzamentos podem ser férteis e produzir descendentes. O sucesso da fertilidade varia de acordo com as diferentes ações (Tabela 2). O estoque 7298 (cromossomo X 'com marcador ondulado) foi o mais saudável dos estoques, mas passou por um período de declínio, aparentemente devido à ativação de elementos móveis de DNA criando rearranjos do genoma32. O estoque de HoLo2 representa uma cepa saudável derivada de 7298, onde aparentemente os rearranjos do genoma se estabilizaram e substituiu o estoque parental de 7298 no centro de estoque. O estoque HoLo2 é o que foi usado para sequenciar o genoma de B. coprophila e é o mais amplamente utilizado por vários grupos de laboratório. Recentemente, a mutagênese CRISPR de moscas HoLo2 foi usada para criar o estoque W14 com um fenótipo de olho branco para ser usado para transformação com marcadores oculares fluorescentes (Yamamoto e Gerbi, dados não mostrados). A cepa W14 é excepcionalmente robusta. A coronha 6980 (marcadores de asa ondulada e veia inchada) é um pouco menos robusta e a coronha 91S (marcador de asa pequena) é ainda menos robusta.
Cruzamentos bem-sucedidos resultam em embriões (Figura 5). Os embriões sofrem a eliminação dos cromossomos X paternos impressos na7ª a9ª divisão de clivagem. Além disso, os cromossomos L limitados pela linha germinativa são eliminados da linhagem somática em embriões na5ª a6ª divisão de clivagem. Os embriões emergem como larvas, que não devem ser confundidas com fungos que também podem estar presentes (Figura 6). As manchas oculares (semelhantes aos olhos adultos) aparecem na segunda metade do4º ínstar larval (Figura 7). O tamanho das manchas oculares fornece um marcador fenotípico conveniente para o início e progressão da amplificação do DNA puff, que é um dos dois únicos exemplos conhecidos de amplificação de DNA intracromossômico (gene) específica do local regulada naturalmente regulada pelo desenvolvimento. Posteriormente, as pupas se desenvolvem, e a quantidade de pigmento que preenche seus olhos pode servir como um marcador de desenvolvimento para meiose I e II na espermatogênese (Figura 8) com seus comportamentos cromossômicos únicos nessas divisões.

Figura 4: Acasalamento de moscas adultas de B. coprophila . O painel superior mostra os três tipos de moscas adultas no estoque HoLo2: mães produtoras de fêmeas com asas onduladas (X'WX fêmeas adultas), mães produtoras de machos com asas retas (XX fêmeas adultas) e machos com asas retas (X0 machos adultos). Observe o ovipositor pontiagudo na extremidade posterior das moscas fêmeas e o clasper em forma de gancho na extremidade posterior das moscas machos. O painel inferior mostra um macho e uma fêmea acasalando, onde o macho agarrou o ovipositor da fêmea. O esperma será armazenado na espermateca da fêmea e fertilizará os óvulos à medida que forem descarregados para o exterior. O comprimento dos adultos é de 2,0 mm (machos), 2,5 mm (fêmeas). Clique aqui para ver uma versão maior desta figura.
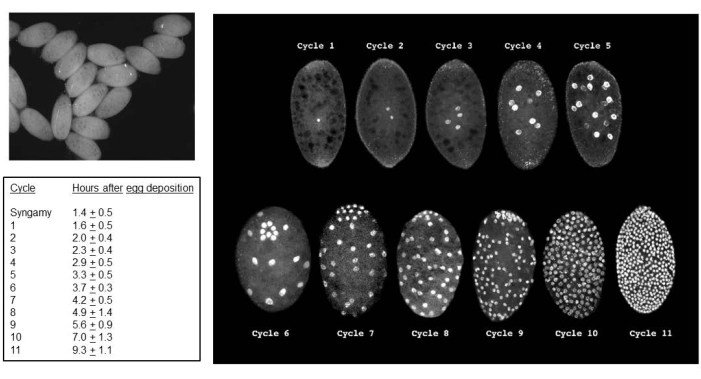
Figura 5: Embriões de B. coprophila . O painel superior esquerdo é uma visão de embriões usando luz padrão em um microscópio de dissecação; Os núcleos no citoplasma sincicial aparecem como pontos pretos. O painel à direita usa microscopia de fluorescência para visualizar os núcleos de embriões corados com iodeto de propídio. Os embriões têm um comprimento médio de 200 mícrons e uma largura média de 150 mícrons. Os núcleos das células germinativas se agrupam no pólo posterior do embrião, como visto nos ciclos 6 (embrião inclinado para frente) e 7-9, após os quais são intercalados com núcleos somáticos. A eliminação do cromossomo L na linhagem somática ocorre na divisão de clivagem 5 ou 6; A eliminação do cromossomo X na linhagem somática ocorre na7ª,8ª ou9ª divisão de clivagem. A celularização ocorre durante a interfase do ciclo 11. O quadro à esquerda mostra o tempo médio de cada ciclo de divisão a 22 °C. A tabela à esquerda e o painel à direita são adaptados com permissão de de Saint Phalle e Sullivan35. Clique aqui para ver uma versão maior desta figura.
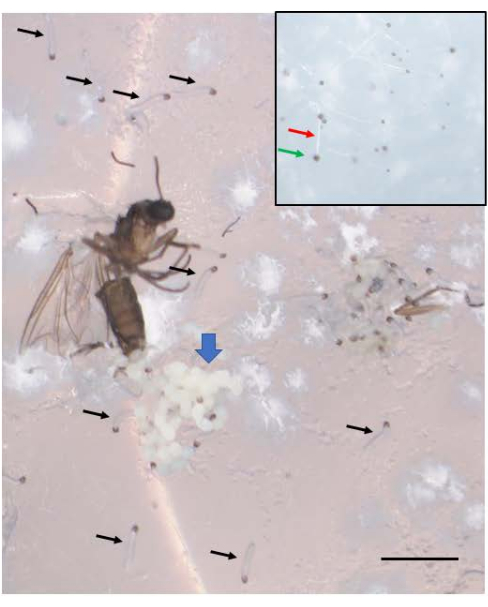
Figura 6: Embriões de B. coprophila emergem como larvas. Um aglomerado de embriões (seta azul grossa) é visto perto do ovipositor da fêmea adulta que morreu após a postura dos ovos. Uma semana após a postura dos ovos, os embriões tornam-se larvas jovens, várias das quais são indicadas pelas setas pretas. As larvas recém-emergidas têm uma mandíbula preta na extremidade anterior e um corpo translúcido. Eles se movem sobre a superfície do ágar e não devem ser confundidos com mofo que não se move. A inserção mostra algum mofo, com um filamento branco (seta vermelha) e um esporo preto na ponta (seta verde), e é ligeiramente menor do que as larvas recém-emergidas. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
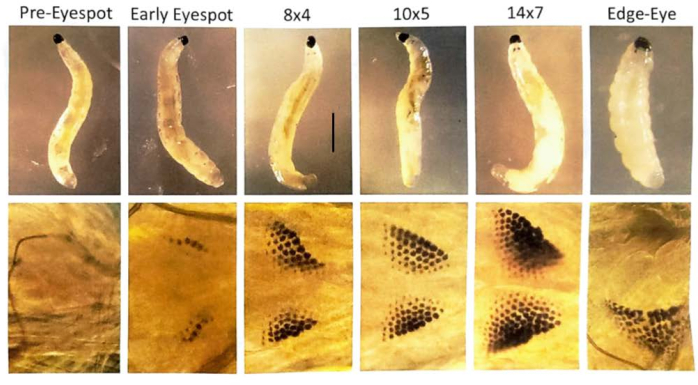
Figura 7: Estágios de manchas oculares de larvas de B. coprophila . As manchas oculares se formam na parte anterior da larva, logo atrás da mandíbula, e são compostas de grânulos de pigmento que aumentam em número. As manchas oculares são a anlage para o olho adulto. O painel superior mostra larvas que foram visualizadas com um microscópio de dissecação; O painel inferior é uma visão ampliada das manchas oculares usando um microscópio de contraste de fase para visualizar uma larva em uma lâmina de microscópio com uma gota de água destilada e uma lamínula flutuando levemente no topo. A nomenclatura dos estágios da mancha ocular está de acordo com Gabrusewycz-Garcia30 , onde o número de grânulos é contado na linha mais longa (por exemplo, 12) e o número de linhas adicionais, excluindo a linha mais longa, é anotado (por exemplo, 6 para o estágio da mancha ocular 12x6). O início da amplificação do DNA específico do local nos cromossomos politênicos da glândula salivar começa no estágio da mancha ocular 10x5 e é concluído em 14x7 quando há uma explosão de transcrição no locus e expansão dos inchaços de DNA31. No estágio subsequente de borda-olho/mandíbula caída, os grânulos da mancha ocular começam a se fundir e se movem lateralmente para longe da linha média; O comprimento do corpo larval diminui. Além disso, os sopros de DNA se condensam neste estágio. Demora cerca de um dia a 21 °C para atravessar cada estágio da mancha ocular. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
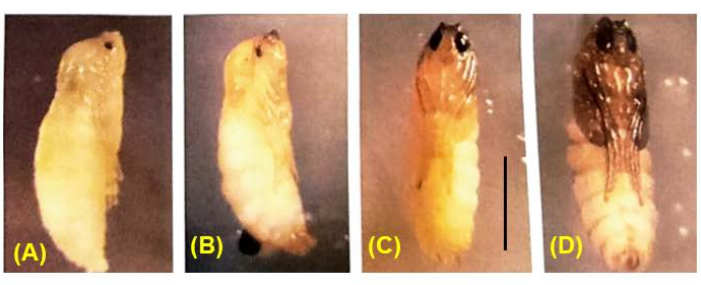
Figura 8: Desenvolvimento de pupas de B. coprophila . Durante a pupação, todos os tecidos larvais histolisam, exceto o sistema nervoso, e são substituídos por tecidos adultos que surgem por divisões celulares dos discos imaginários. A cor do corpo muda de branco para castanho, marrom para preto. O pigmento preenche gradualmente o olho da pupa; meiose I e II ocorrem em pupas masculinas com olhos 1/4 a 1/2 preenchidos com pigmento36. Barra de escala = 1 mm. Clique aqui para ver uma versão maior desta figura.
| Nome do estoque | Marcadores | Taxa de fecundidade | Comentários |
| 7298 | Asa ondulada (W) | ~ 75% | |
| HoLo2 | Asa ondulada (W) | ~ 90% | Derivado de 7298 |
| W14 | Asa ondulada (W); Olhos brancos | ~ 95% | derivado de HoLo2 |
| 6980 | Asa ondulada (W); veias inchadas (sw) | ~ 65% | |
| 91S | asa ondulada fraca (W); Asas pequenas (P) | ~50% | o marcador ondulado foi introduzido em uma cruz para resgatar 91S |
Tabela 2: Estoques de Bradysia (Sciara) coprophila. A Tabela 1 de Gerbi6 lista esses marcadores e outros que não existem mais. Cinco translocações (T1, T23, T29, T32, T70) na extremidade do centrômero do X27 estão resumidas na Figura 8 do Gerbi6 , mas não existem mais.
Arquivo Suplementar 1: Cruzamentos HoLo2 (e 7298 e W14), cruzamento e resgate 91S, cruzamento 6980, cruzamentos de translocação. Clique aqui para baixar este arquivo.
Discussão
Os protocolos aqui apresentados para o manejo de B. coprophila serão úteis para cientistas que desejam criar este organismo em seus laboratórios para experimentos para aprofundar suas características biológicas únicas. A descrição inicial do método de alimentação usando fermento e pó de cogumelo polvilhado sobre uma base de ágar para manter B. coprophila29 foi usada no laboratório de Metz para criar 14 espécies diferentes de moscas Sciarid5. Posteriormente, observou-se que a adição de urtiga e/ou espinafre em pó aumentou ainda mais a vitalidade de B. coprophila (Gabrusewycz-Garcia, comunicação pessoal). Esses métodos têm sido bem-sucedidos para a manutenção de espécies relacionadas dentro da família Sciaridae, incluindo Bradysia impatiens e Lycoriella ingenua que estão atualmente em cultura (Robert Baird, comunicação pessoal).
Outros métodos (como os métodos alternativos de alimentação descritos abaixo) foram tentados para criar B. coprophila, mas os protocolos descritos aqui foram otimizados para ter a proporção mais favorável de larvas por área de superfície de ágar para obter os adultos gordos mais férteis e minimizar o crescimento de mofo. Para aumentar a escala, o acasalamento em massa pode ser feito em frascos de vidro, conforme descrito no protocolo 2 acima. Alternativamente, algumas (2-4) fêmeas adultas podem ser colocadas junto com o dobro de machos adultos em um frasco como o usado para criar Drosophila (frasco descartável de polipropileno Drosophila de 6 onças = 177,4 mL de fundo quadrado). Em ambos os casos, o investigador deve ter plena certeza de que o balão contém apenas todas as mães produtoras ou produtoras masculinas.
Alimente apenas as larvas, pois as pupas e os adultos não comem. Não alimente o frasco se as larvas se transformarem em pupas (um sinal disso é quando as primeiras moscas adultas que emergem cedo aparecem). Assim que os adultos fecharem, coloque os frascos para injetáveis numa incubadora mais fresca (por exemplo, 16 °C), se disponível, pois isso permitirá que os adultos vivam mais tempo. Alimente três vezes por semana (por exemplo, segunda, quarta, sexta-feira), aumentando a quantidade de comida dada por frasco à medida que as larvas envelhecem. Alimente-se generosamente e você será recompensado com adultos férteis e gordos. No entanto, se você se alimentar demais, aparecerá mofo branco e isso é um sinal para reduzir a quantidade de comida que você está depositando em um frasco. Além disso, se você se alimentar demais, uma almofada grossa de comida se desenvolverá em cima do ágar e dificultará a saída dos adultos (você pode remover a almofada com uma pinça, mas tome cuidado para não retirar as larvas com a almofada - é melhor não ter que fazer isso). Frascos com poucas larvas (marcados como "poucas") precisam de menos comida. Se você se alimentar muito pouco, as larvas escalarão as paredes do frasco em busca de comida. Larvas subnutridas resultam em adultos pequenos que são menos férteis.
Métodos alternativos de alimentação
Uma variedade de métodos foi tentada para alimentar as larvas apenas uma vez durante o estágio larval, em vez de 3 vezes por semana. B. coprophila não crescerá em alimentos ao estilo Drosophila . John Urban (comunicação pessoal) tentou misturar comida de B. coprophila com o ágar, mas muito mofo cresceu. Ele descobriu que a adição de dois inibidores de mofo (tegosept e ácido propiônico) em combinação e separadamente, tentando várias concentrações diferentes, era tóxica para B. coprophila em níveis que inibem o mofo. O ágar deve ter pH 6-7 (neutro), pois B. coprophila adoece em um pH ácido (como acontece com o ácido propiânico). Alternativamente, para evitar a alimentação três vezes por semana, ele tentou usar uma espátula ou seringa sem agulha para dispensar uma pasta de fermento espessa (fermento seco ativo Red Star misturado com um pouco de água destilada para umedecê-lo) como um bocado em cima do ágar em cada frasco uma semana após o acasalamento (ou seja, na hora em que as larvas começarão a emergir).
Outro método para evitar a alimentação três vezes por semana é adicionar uma cultura viva de fungos a cada frasco. Bath e Sponsler37 relataram que uma superfície de ágar inclinada com meio de Sabouraud deve ser listrada com uma cultura fúngica dos gêneros Chaetoconidia (melhor) ou então Baplosporangia ou Xllescheria. O fungo foi cultivado vários dias a uma semana antes da introdução de B. coprophila . Nenhuma alimentação foi necessária depois disso. Uma variante desse método também foi empregada por Ellen Rasch (comunicação pessoal). Em nossas mãos, os frascos estavam muito úmidos com esse método e as larvas se afogaram, mas poderia ser tentado novamente para otimizar o número de larvas em relação aos frascos com fungos vivos.
Arthur Forer (comunicação pessoal) teve algum sucesso na criação de B. coprophila da mesma forma que as moscas-guindaste38. Com essa abordagem, as pupas foram criadas em papel machê úmido. Posteriormente, os adultos foram acasalados e os ovos foram depositados em papel machê úmido fresco. As larvas resultantes foram mantidas em papel machê em placas de Petri e alimentadas com folhas de urtiga em pó duas vezes por semana. As pupas foram colocadas em uma gaiola para repetir o ciclo.
Yukiko Yamashita (comunicação pessoal) tentou, sem sucesso, criar B. coprophila no solo, imitando as condições em que são encontradas na natureza em vasos de plantas e estufas com alta umidade. No entanto, o mofo pode se tornar um problema quando o nível de umidade é aumentado. No entanto, o solo úmido tem sido usado com sucesso para criar larvas de Pseudolycoriella (anteriormente Bradysia) hygida em caixas plásticas com solo úmido; eles são alimentados com folhas decompostas de Ilex paraguariensis, suplementadas no final da vida larval com 1,2% de extrato de levedura, 1,4% de amido de milho, 0,8% de farinha de aveia, 1,2% de ágar12. Da mesma forma, o solo úmido pode ser substituído por turfa úmida com feijão triturado para criar moscas Sciarid39,40.
Ainda outros métodos foram empregados para manter culturas de laboratório de Bradysia: (i) batata autoclavada à qual fermento e fertilizante de sangue seco são adicionados41; (ii) estrume42,43,44 ao qual pode ser adicionado sangue seco45; (iii) recipientes plásticos com almofadas de algodão e toalhas de papel umedecidas com soja moída46.
Ácaros
Os ácaros podem ser transferidos de Drosophila para B. coprophila. Para minimizar isso, é melhor manter B. coprophila em uma incubadora ou sala separada, não perto dos estoques de Drosophila . Além disso, faça qualquer trabalho de manutenção de B. coprophila no início do dia antes de manusear a Drosophila. Os ácaros também podem ser transferidos para B. coprophila de plantas domésticas, portanto, não mantenha as plantas na mesma sala que B. coprophila. Se os ácaros invadirem os frascos, eles podem ser vistos como pequenos organismos esféricos brancos rastejando no corpo de B. coprophila. Tratamentos químicos que trabalham para destruir ácaros em Drosophila não podem ser usados para B. coprophila , pois os produtos químicos matam B. coprophila (B. coprophila também é sensível a vapores orgânicos, como fenol). O único tratamento para livrar os estoques de ácaros de B. coprophila é coletar manualmente os embriões em uma placa de ágar, examinar cada um quanto à ausência de ácaros e, em seguida, transferi-los para frascos de ágar fresco usando um pincel fino. Tampões de gaze com enchimento de algodão e flugs de espuma de acetato de celulose (como usados para frascos de polipropileno de Drosophila ) ajudam a evitar a entrada de ácaros nos frascos.
Utilidade dos protocolos de manejo
Os protocolos descritos aqui permitirão que a crescente comunidade de cientistas crie B. coprophila como um novo / antigo organismo modelo emergente para estudar suas características biológicas únicas. Novos grupos de laboratório são incentivados a se juntar à crescente comunidade para manter e investigar as características biológicas únicas da Bradisia (Sciara).
Divulgações
O autor não tem conflitos de interesse a declarar.
Agradecimentos
Agradecimentos especiais aos criadores de estoque anteriores de B. coprophila (Jacob E. Bliss, Paula Bonazinga, Anne W. Kerrebrock, Ingrid M. Mercer, Heidi S. Smith) e pessoal de pesquisa (especialmente Robert Baird, Michael S. Foulk, Donna Kubai, John M. Urban, Yutaka Yamamoto) por ajustar os protocolos de manejo. As instruções iniciais sobre os cuidados com B. coprophila foram fornecidas por Helen V. Crouse, Natalia Gabrusewycz-Garcia, Reba M. Goodman, Charles W. Metz e Ellen Rasch. Com gratidão a Yukiko Yamashita e Anne W. Kerrebrock por assumirem o centro de estoque Bradysia (Sciara). Muito agradecimento às seguintes pessoas por sua útil preparação de figuras: Brian Wiegmann (Figura 1), John M. Urban (Figura 4 painel superior), Laura Ross (Figura 4 painel inferior), Yutaka Yamamoto (Figura 5 painel esquerdo), Leo Kadota (Figura 7 e Figura 8). Muito obrigado a Ava Filiss e ao Laboratório Multidisciplinar da Brown University por sua ajuda com fotografia e filmagem. Obrigado a Robert Baird pelos comentários sobre este manuscrito. Nossa pesquisa e manutenção de B. coprophila foram apoiadas pelo NIH e NSF, incluindo o apoio mais recente do NIH GM121455 ao S.A.G. Mais detalhes sobre B. coprophila estão disponíveis nos sites do Bradysia (Sciara) Stock Center (https://sites.brown.edu/sciara/ e https://sciara.wi.mit.edu) que estão sendo construídos.
Materiais
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
Referências
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados