Method Article
Alt Dipteran Sineği Bradysia (Sciara) coprophila'nın Laboratuvar Bakımı: Yeni/Eski Ortaya Çıkan Bir Model Organizma
Bu Makalede
Özet
Bu makale, alt dipteran sineği Bradysia (Sciara) coprophila'nın laboratuvar bakımını (çiftleşme ve besleme dahil) özetlemektedir.
Özet
Alt dipteran sineği Bradysia (Sciara) coprophila'nın laboratuvar stokları bir asırdan fazla bir süredir korunmaktadır. B. coprophila'nın laboratuvar bakımı için protokoller burada sunulmuştur. Bu protokoller, B. coprophila'yı inceleyen ve hızla artan sayıda laboratuvar için, (1) erkek mayoz I'de monopolar bir iğ; (2) erkek mayoz II'de X dyad'ın ayrılmaması; (3) anne homologlarını baba homologlarından ayırt etmek için kromozom baskısı; (4) germ hattı sınırlı (L) kromozomlar; (5) kromozom eliminasyonu (erkek mayoz I'de baba kromozomları; erken embriyolarda bir ila iki X kromozomu; Erken embriyolarda soma'dan L kromozomları); (6) anne tarafından cinsiyet belirleme (Y kromozomu yoktur); ve (7) larva tükürük bezi politen kromozomlarındaki DNA puff lokuslarında gelişimsel olarak düzenlenmiş DNA amplifikasyonu.
Kromozom mekaniğinin bu birçok benzersiz özelliğini, B. coprophila genomunun dizilenmesi ve birleştirilmesindeki son gelişmeleri ve genomik mühendislik için dönüşüm metodolojisinin geliştirilmesini kullanarak keşfetmek artık mümkün. Araştırma için B. coprophila'yı kullanan büyüyen bilim topluluğu, sineklerin çiftleşmesi için burada açıklanan protokollerden (sadece oğulları veya sadece kızları olacak anneler için fenotipik belirteçler; biyokimyasal deneyler için toplu çiftleşmenin detayları), embriyo yumurtadan çıkmayı kontrol etmek, larvaları beslemek ve yetiştiriciliği hakkındaki diğer yorumlardan faydalanacaktır.
Giriş
Biyolojik ilkelerin tam olarak anlaşılması, Hayat Ağacı'nı kapsayan birçok farklı organizmanın incelenmesini gerektirir. 19.yüzyılın sonlarına kadar geniş bir organizma yelpazesi tanımlanmış olsa da, 20.yüzyılın ortalarında deneysel çalışmalar bir düzineden az model organizma ile sınırlı hale geldi. Genomik çağın ortaya çıkması ve Hayat Ağacı1'deki tüm türlerin genomlarını dizileme hedefiyle, artık laboratuvar deneyleri için kullanılan organizma türlerini genişletebilecek ve çeşitliliklerinin avantajlarından yararlanabilecek bir konumdayız. Deneyler için ortaya çıkan model organizmaların bu şekilde genişlemesi, onları laboratuvarda tutabilmenin bir ön koşuluna sahiptir. Burada, ortaya çıkan böyle bir yeni/eski model organizmanın yetiştirilmesi için protokoller açıklanmaktadır.
Dünyadaki hayvan yaşamının çoğunluğu, Böcekler2'nin dört süper radyasyonu ile açıklanmaktadır. Böcekler içinde yaklaşık 158.000 Diptera türü (gerçek sinekler)3, Sciaridae (kara mantar sivrisinekleri) familyasında yaklaşık 3000 tür vardır4. Meyve sineği Drosophila, Dipteran sineklerinin en kapsamlı şekilde çalışılanıdır. Alt Dipteran sineği (Nematocera), Bradysia (daha önce Sciara olarak adlandırılıyordu) coprophila, 200 milyon yıl önce "yüksek Dipteran" sineği (Brachycera) olan Drosophila'dan ayrıldı. Bu nedenle, B. coprophila, D. melanogaster ile karşılaştırmalı çalışmalar için uygun bir taksonomik konumdadır (Şekil 1). Dahası, B. coprophila'nın kendi başlarına incelenmeye değer birçok benzersiz biyolojik özelliği vardır 5,6,7. Bu özelliklerin çoğu, bir organizmanın tüm hücrelerinin aynı DNA içeriğine sahip olduğu DNA sabitliği kuralına uymaz. B. coprophila'da, (i) baba genomu, erkek mayoz I'de monopolar bir iğ üzerinde elimine edilir; (ii) erkek mayoz II'de X dyad'ın ayrılmaması vardır; (iii) germ hattı sınırlı (L) kromozomlar soma dan elimine edilir; ve (iv) bireyin cinsiyetine bağlı olarak erken embriyoda bir veya iki X kromozomu elimine edilir. Anne homologlarını baba homologlarından ayırt etmek için kromozom baskısı ilk olarak B. coprophila'da keşfedilmiştir ve bu kromozom eliminasyon olaylarının çoğu için rol oynamaktadır. Kromozom eliminasyonuna ek olarak, larva tükürük bezi politen kromozomlarındaki DNA puff lokuslarında gelişimsel olarak düzenlenmiş, lokusa özgü DNA amplifikasyonu yoluyla DNA sabitliğinin başka bir atlaması meydana gelir. Bu benzersiz özelliklerin incelenmesi, B. coprophila'nın laboratuvar bakımını gerektirir; Bu tür çalışmaları kolaylaştırmak için yetiştiriciliğinin detayları burada sunulmuştur.
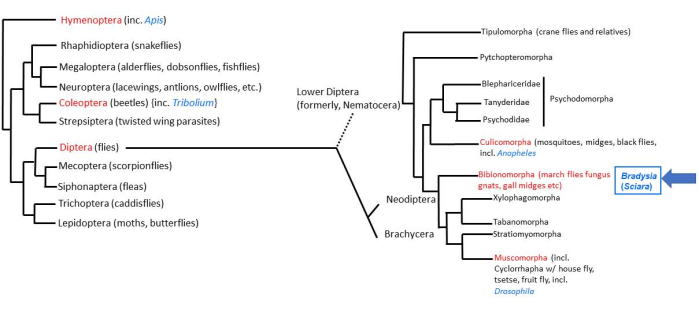
Resim 1: Bradysia (Sciara) coprophila'nın filogenisi. Popüler model organizmalar mavi yazı tipiyle ve taksonomik sıraları kırmızı yazı tipiyle belirtilmiştir. Bradysia ve diğer Sciarid mantar sivrisinekleri ve sivrisinekler daha düşük dipteran sineklerdir (eski adıyla Nematocera), Drosophila türleri ise daha yüksek dipteran sineklerdir (alt takım: Brachysera). Şeklin sol tarafında yer alan bilgiler Misof ve ark.33'ten alınmıştır; Sağ taraftaki bilgiler Bertone ve ark.34 ve Wiegmann ve ark.2'den alınmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Daha önce, Sciara cinsi herhangi bir ökaryot için en fazla sayıda (700) türe sahipti ve Steffan'ın bunları8'e bölmesine neden oldu. Daha sonra Shin, Sciaridae ailesinin Sciarinae alt familyasına (Sciara, Trichosia ve Leptosciarella dahil olmak üzere altı cinsle), alt aile Megalosphyinae'ye (Bradysia cinsi dahil) ve diğer üç gruba (Pseudolycoriella dahil) ayrılmasını önerdi9. Sciaridae'nin filogenisi, son yıllarda birkaç grup tarafından daha fazla incelenmiştir 9,10,11. Son birkaç on yılda, Sciaridae ailesindeki birçok organizmanın adı12 değişti. Bir asırdan fazla bir süredir devam eden literatürün çoğu, üzerinde çalıştığımız organizmaya Sciara coprophila olarak atıfta bulunsa da, mevcut taksonomik adı artık Bradysia coprophila'dır (syn. Bradysia tilicola ve diğer eşanlamlılar)10. Dünya çapında bulunurlar ve mantar ve diğer mantarları yedikleri için yaygın olarak mantar sivrisinekleri olarak bilinirler. İlk olarak 1804'te Avrupa'da Meigen13 ve daha sonra Kuzey Amerika'da Johannsen 14,15 tarafından tanımlandılar. B. coprophila, Cold Spring Harbor Laboratuvarı'nda toplanmış ve laboratuvar stokları Charles Metz tarafından 1900'lerin başında Columbia Üniversitesi'nde Thomas Hunt Morgan ile yüksek lisans öğrencisi iken kurulmuştur. Bu nedenle, mevcut stoklar bir asırlık akraba evliliğini yansıtıyor. Benzer şekilde, B. coprophila'nın biyolojisi, Helen Crouse (doktorasını Barbara McClintock ile yapan) tarafından onlarca yıllık sitogenetik çalışmalarla daha da aydınlatıldı.
1930'larda Bradysia (Sciara), genetik çalışmalar için model bir sistem olarak Drosophila melanogaster ile rekabet etti. Birçok benzersiz biyolojik özelliğine rağmen, B. coprophila, genetik çalışmalar için radyasyona bağlı fenotipik mutasyonlara ihtiyaç duyulduğundan ve B. coprophila'nın gama ışınlamasına D. melanogaster16'dan sadece biraz daha dirençli olmasına rağmen, ikincisinde elde edilmesi daha kolay olduğundan, popüler bir model organizma olarak D. melanogaster tarafından gölgede bırakıldı. Modern genomik çağında, bu artık bir endişe kaynağı değil. B. coprophila için genom dizisi 17,18,19 (Urban, Gerbi ve Spradling, veriler gösterilmemiştir) ve dönüşüm yöntemleri 20,21 (Yamamoto ve Gerbi, veriler gösterilmemiştir) yakın zamanda kullanıma sunulduğundan, araştırmaları için onu benimseyen büyüyen bilim adamları topluluğu tarafından görüldüğü gibi, onu yeni/eski ortaya çıkan bir model sistem olarak kullanmanın zamanı gelmiştir. Bu makale, laboratuvar bakımı için prosedürleri açıklamaktadır.
B. coprophila'nın bir Y kromozomu yoktur ve yavruların cinsiyeti anne tarafından belirlenir. Uzun parasentrik bir inversiyona sahip X' ("X-prime") kromozomuna sahip dişilerin sadece kızları olurken, standart (ters çevrilmemiş) X kromozomu için homozigot olan dişilerin sadece oğullarıolacaktır 5 (Şekil 2). X' kromozomu19 için dizi bilgisi mevcuttur, ancak X' kromozomunun yavruların dişi olacağını nasıl belirlediği konusunda moleküler mekanizma hala açıklığa kavuşturulmayı beklemektedir. Erkekler hiçbir zaman X' kromozomuna sahip değildir ve döllenmeden sonra dişiler X'X (X' için heterozigot) veya XX'dir. Yetişkin X'X dişileri, kanattaki fenotipik belirteçler ile XX dişilerden ayırt edilebilir (Şekil 3). X'X dişileri (sadece kızları olacak), X' üzerindeki baskın Dalgalı (W) kanat işaretçisi tarafından tanınabilir (HoLo2 stoğunda olduğu gibi)22. Alternatif olarak, XX dişiler (sadece oğulları olacak), 91S stoğu23'te olduğu gibi X üzerindeki çekinik minyon (p) kanat işaretleyicisi ile tanınabilir. Bu durumda, X'Xp dişileri tam uzunlukta (minyon değil) kanatlara sahip olacak ve sadece kızları olacaktır. Stok 6980, şişmiş (sw) damarlar24 için X kromozomu üzerinde resesif bir işaretleyici ve ayrıca X' üzerindeki baskın işaretleyici Wavy'yi taşır ve haçlar için seçim için iki işaretleyiciye izin verir. Wavy'nin ekspresyon derecesi değişebilir ve yiyeceklerin sınırlandığı veya sıcaklığın çok ısındığı aşırı kalabalık şişelerde daha zayıf görünebilir. Larvalar normal 21 °C yerine soğuk odada (4 °-8 ° C) tutulursa, Dalgalı kanat fenotipi son derece güçlüdür. Resesif minyon kanat markörü değişken olmamasına ve tanımlanması çok kolay olmasına rağmen, 91S stokları HoLo2 stoğuna göre daha az sağlıklı oldukları için daha az sıklıkla kullanılır. B. coprophila çiftleşme şemaları burada sunulmuştur (Şekil 2) ve HoLo2, 7298 ve W14 stokları (Ek Dosya 1), 91S stoku (Ek Dosya 1), 6980 stoku (Ek Dosya 1) ve translokasyon stokları (Ek Dosya 1) için ayrıntılı olarak açıklanmıştır. Translokasyon stokları artık mevcut değil; ribozomal RNA genlerini 25,26,27 içeren X'in kısa kolundaki heterokromomerlerin (H1, H2 ve H3) karşılıklı translokasyonlarıydı.
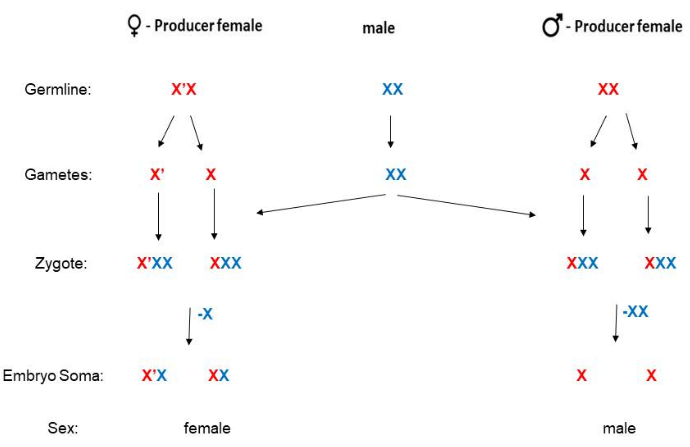
Şekil 2: B. coprophila için çiftleşme şeması. Bu organizmanın Y kromozomu yoktur (erkek soma'nın tek bir X'i vardır); Anneler yavrularının cinsiyetini belirler. XX annenin sadece oğlu var ve X'X dişisinin sadece kızı var. X' kromozomu, X kromozomu ile karşılaştırıldığında uzun bir parasentrik inversiyona sahiptir. X (veya X') kromozomunun baba veya anne soyu, bu şekilde sırasıyla mavi veya kırmızı ile gösterilir. Sperm, otozomlar için haploittir, ancak mayoz II'deki ayrılmama nedeniyle X kromozomunun iki kopyasına sahiptir. Erken embriyoların somatik soyu, sırasıyla dişi veya erkek olacaksa, baba tarafından türetilmiş X'in bir veya iki kopyasını ortadan kaldırır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: B. coprophila'nın kanat fenotipleri. Ergin dişi sinekler çeşitli kanat fenotipleri ile gösterilmiştir: (A) düz kanat (XX), (B) Dalgalı kanat (X'WX), (C) larvaları soğuk room'da depoladıktan sonra buruşuk bir görünüme sahip olan aşırı Dalgalı kanat (X'WX) fenotipi, (D) körelmiş benzeri minyon kanat (XpXp), (E) vahşi tip (XX) ve şişmiş damarlara sahip düz kanat, (F) kanadın üst kenarında ve/veya her iki kanadın ucunun yakınında küçük kabarcıkların (siyah oklar) göründüğü şişmiş damarlı düz kanat (XswXsw), (G) bir veya her iki kanatta bir kabarcık (beyaz ok) meydana gelen aşırı şişlik örneği. Erkekler X' kromozomundan yoksundur ve bu nedenle asla Dalgalı kanatlara sahip olmayacaklardır, ancak sırasıyla 91S stoğunda veya 6980 stoğunda minyon veya şişmiş kanatları vardır. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Stok bakımında amaç, haçların yarısının dişi üreten annelerden ve haçların yarısının erkek üreten annelerden geldiği çaprazlamaları gerçekleştirmek ve sonraki çaprazlamalar için bir sonraki nesilde eşit sayıda dişi ve erkek yetişkine sahip olmaktır. Bununla birlikte, bu aynı zamanda planlamayı da içerir, çünkü erkekler için yaşam döngüsü kadınlardan daha kısadır ve yetişkin erkekler yetişkin dişilerden bir hafta öncesine kadar ortaya çıkar. Doğa, cinsiyetler arasındaki bu eşzamansızlığa, erkek embriyoların aynı tarihte dişi larvalardan 1-2 gün sonra larva olarak ortaya çıkmasını sağlayarak uyum sağlar. Bununla birlikte, laboratuvar çaprazlamaları için erkek ve dişi yetişkinlerin aynı anda mevcut olmasını sağlamak için, dişi larvaların bulunduğu şişeleri 21 ° C yerine oda sıcaklığında bırakarak veya erkek larvaların bulunduğu şişeleri biraz daha düşük sıcaklıklarda (örneğin, 16 ° C) yerleştirerek dişi gelişimi biraz hızlandırılabilir. Daha kusursuz olan bir başka rota da pazartesi günü kadın üretici annelerle melez yapmak ve aynı haftanın cuma günü erkek üretici annelerle melez yapmaktır. Uyguladığımız en kolay yol, her hafta aynı gün kadın yapımcı ve erkek yapımcı annelerle melezleme yapmak ve ardışık her hafta o gün melezleme yapmaktır. Bu yaklaşımda, 1. haftada bir çaprazlamadan gelen yetişkin dişiler, 2. haftada bir çaprazlamadan çıkan yetişkin erkeklerle çiftleştirilebilir.
Dişi B. coprophila'nın yaşam döngüsü 21 °C'de yetiştirildiğinde 5 haftadır (Tablo 1). Yaşam döngülerinin uzunluğu, daha düşük sıcaklıklarda veya yetersiz beslendiklerinde biraz daha uzundur. Erkek B. coprophila'nın yaşam döngüsü, dişilerden 0.5-1 hafta önce pupa oldukları için ~ 4-4.5 haftadır. Her larva girişinin sonu, steroid hormonu ekdison seviyesindeki bir patlama ile tetiklenen kütikülün dökülmesi ile işaretlenir. Üç larva instarı olan D. melanogaster'in aksine, B. coprophila'nın dört larva instarı vardır.
| Gelişim Aşaması | Çiftleşmeden sonraki gün sayısı (dpm) | Aşama uzunluğu (gün) |
| Yumurta koydu | 1-2 | |
| Embriyo | 1-2 ila 7-8 | ~7 gün |
| Larva | ||
| Larva 1, 2 ve 3'ü içerir | 7-8 ila 16-19 | ~10 |
| 4. larva instar ön göz lekesi | 16-19 ila 21-24 | 5 |
| 4. Larva Instar Göz Lekesi Aşaması | 21-24 ila 25-28 | 4 |
| Pupa | 25-28 ila 30-33 | 5 |
| Yetişkin | Çiftleşirse 21 °C'de 1-2 gün, çiftleşmemişse 16 °C'de 2-3 hafta yaşar. | |
Tablo 1: Dişi B. coprophila'nın 21 °C'deki yaşam döngüsü.
B. coprophila , 15 °C-25 °C aralığında herhangi bir yerde tutulabilir ve gelişme daha düşük sıcaklıklarda daha yavaş ilerler. Bu böcek nemli bir ortamı tercih eder (ev bitkilerinin veya mantar yataklarının toprağında bulunur), bu nedenle inkübatörde deiyonize su içeren bir beher tutarız. B. coprophila , oda sıcaklığında, gevşek oturan bir kapağı olan ve bir bardak su içeren metal bir ekmek kutusunda saklanabilir, ancak sıcak iklimlerde bir tehlike olan 37 °C'de 28 ısı şokuna girerler. Michael Ashburner ve diğerleri, stok tutma için gereken süreyi azaltmak için D. melanogaster'i soğukta saklamaya çalıştılar. Buna karşılık, B. coprophila'nın önemli bir avantajı, orta evre larvaları olan şişelerin, ayda sadece bir kez beslenmeye özen gösterilerek soğuk odada (4-8 ° C) açık bir rafta 3 aya kadar saklanabilmesidir. Soğukta pupa aşamasına kadar son derece yavaş gelişirler ve şişeler 21 °C'ye geri getirildiğinde verimli yetişkinler olarak ortaya çıkarlar. Muhtemelen, bu onların vahşi doğada kışlamalarını taklit eder. Bu soğuğa bağlı gelişimsel duraklama, orta evre B. coprophila larvaları16'nın gama ışınlamasından sonra görülenle karşılaştırılabilir, ancak normal gelişimsel ilerlemeleri için geri dönüşü olmayan noktayı geçen geç evre larvalarda gelişimsel duraklama görülmez.
Protokol
Burada açıklanan protokoller, Charles Metz, Helen Crouse ve Susan Gerbi tarafından sırayla denetlenen Bradysia (Sciara) stok merkezlerinden ve diğerlerinden gelen girdilerden elde edilen bir asırlık deneyimi temsil etmektedir.
1. Çiftleşme haçları
- 28 mm çapında cam şişe başına bir yetişkin dişi ve iki yetişkin erkek kullanın. Sadece kızları veya oğulları olacak anneler için kanat fenotiplerini tanımada% 100 başarı elde edildiğinde, larva / flakon sayısını artırmak için flakon başına iki dişi ve iki erkek kullanın. Anesteziden dişilere göre daha hızlı uyanan erkekleri eklemeden önce her şişeye dişiler ekleyin.
NOT: Aşağıdaki açıklama, CO2'ye sahip olduğunuzu varsayar; Alternatif olarak, yetişkin sinekleri uyuşturmak için eter kullanılabilir. - Yetişkin sinekleri uyuşturmak için eter kullanıyorsanız, bir Coplin kavanozunun yuvarlak cam kapağının içine katlanmış laboratuvar mendillerinden oluşan bir ped (örneğin, kimmendiller) bantlayın ve laboratuvar mendil pedini nemlendirmek için şişeden bir miktar eter aktarmak için bir damlalık kullanın (ancak doymuş ve o kadar ıslak değil ki eter sıvısı düşecek ve sinekleri boğma riski taşıyacaktır). Aşağıdaki adım 1.6 için, nemlendirilmiş eter pedini yetişkinler hareket etmeyi bırakana kadar ~ 1 dakika boyunca açılan şişenin üzerine yerleştirin. Yetişkinler beyaz bir seramik karo plakaya (beyaz sineklik yerine kullanılır) aktarıldıktan sonra, periyodik olarak (sineklerin bacakları seğirmeye başladığında) taze eterle nemlendirilmiş pedi tabağın üzerindeki sineklerin üzerine (dokunmadan) ~ 1 dakika tutun.
DİKKAT: Eter yanıcıdır ve buzdolabında değil, havalandırma davlumbazında saklanmalıdır. - Yetişkin dişi şişeleri olan bir tepsi, yetişkin erkeklerin bulunduğu bir tepsi ve %2,2 (ağırlıkça/hacim) agar içeren boş şişelerden oluşan bir tepsiyi kol mesafesinde yerleştirin. Laboratuvar tezgahına, "dişi" veya "erkek" ve annenin kanat fenotipini belirten afiş notları yerleştirin, böylece haç için seçilen yetişkinlerin bulunduğu şişe, bir gruptaki tüm şişelerin sadece erkek döllere sahip olacağı ve diğer gruptaki tüm şişelerin sadece dişi döllere sahip olacağı doğru gruba yerleştirilecektir.
NOT: Yetişkinler damlacıklara yapışacağı için şişenin içinde yoğuşma damlacıkları olmadığından emin olun. Şişeler plastik bir kutuda saklandıysa, yoğuşmanın buharlaşmasını sağlamak için şişeleri kullanmadan önce en az 1 saat oda sıcaklığında bir laboratuvar tezgahına koyun. - CO2 gazını ve diseksiyon mikroskobu lambasını açın.
NOT: Daha az ısı yaydığı için fiber optikli bir ışık kaynağı tercih edilir, bu da uyuşturulmuş sineklerin daha hızlı uyanmasına neden olur. - Şişelere yetişkinlerle birlikte lastik bir ped üzerinde kuvvetlice vurun, böylece yetişkinler şişenin dibine düşer ve tapayı çıkarın; CO2 tabanca memesini takın ve tapayı geri takın.
- Meme tetiğine basın, böylece CO2 yetişkinleri uyuşturmak için ~ 1 dakika boyunca şişeye akar.
- Ayağınızı ayak pedalına koyun, böylece CO2 tabanca nozulu yerine beyaz sineklik üzerine akacaktır. Sineklerin beyaz sinek pedi üzerinde olduğu süre boyunca ayak pedalını basılı tutun (veya sineklerin bacakları seğirmeye başladığında aralıklı olarak ayak pedalına basın).
- Memeyi ve tapayı flakondan çıkarın ve flakonu diseksiyon mikroskobu altında beyaz bir sineklik üzerinde ters çevirin.
- Ters çevrilmiş şişenin altını mikroskoba vurun, böylece yetişkinler şişeden beyaz sineklik üzerine düşer.
- En şişman yetişkinleri seçin (yakın zamanda beyaz karınlarla kapatılmış) ve yetişkini orta veya arka bacağından nazikçe almak için ince uçlu forseps kullanın. Çiftleşme dansı için kullanılan ön bacaklara zarar vermeyin. Yeni kapanmış ve vücutları tamamen beyaz olan ve henüz siyaha dönmemiş yetişkinleri kullanmayın çünkü kanatları kısa olacak ve tam olarak gelişmemiş olacak şekilde kanat fenotipi puanlanamaz. Daha ince karınlı yetişkinler, doğurganlığı azalmış olsa da hala kullanılabilir. Ölü oldukları için kanatları vücutlarından dikey olarak kaldırılmış sıska yetişkinleri kullanmayın.
- Öte yandan, %2,2 (ağırlıkça/hacim) agar içeren flakondan fişi çıkarın. Forsepsleri yetişkinle birlikte tutan elle, forsepsleri şişenin üst iç duvarına kuvvetlice vurun, böylece yetişkin şişenin dibine düşer. Fişi şişeye yerleştirin.
- Dişi yetişkinleri içeren her bir şişeyi ayarlamak için yukarıdaki 1.5-1.11 adımlarını tekrarlayın. Kullanılmayan sinekleri beyaz sinek pedinden ana şişelerine geri süpürmek için bir boya fırçası kullanın. Çiftleşme için kullanıldığını belirtmek için ana şişenin etiketine bir onay işareti koyun (ancak gerekirse tekrar kullanılabilir).
- Rutin stok bakımı için, kadın üretici annelerle 6-8 şişe ve erkek üretici annelerle 6-8 şişe kurun (Şekil 4). Genetik darboğazları en aza indirmek için şişelerin yarısını bir yetişkin şişeden annelerle (veya babalarla) ve yeni şişelerin diğer yarısını farklı bir yetişkin şişesi kullanarak ayarlayın.
- Bazen, bir yanlış ayrışma olayı, dişi üreten şişelerde istisnai bir erkek üretecektir. Yetişkin dişileri olan bir şişenin istisnai bir erkeği varsa, o erkeği öldürmek için çıkarın ve ezin. Mümkünse, tüm dişileri o şişeden atın ve daha fazla yetişkin dişi kapanana ve haçlar için güvenle kullanılabilene kadar birkaç gün bekleyin.
NOT: Bu şişedeki dişilerin melezleme için kullanılmaması tercih edilir, çünkü istisnai erkekle çiftleşmiş olabilirler ve verimli bir melez üretmeyebilirler.
- Bazen, bir yanlış ayrışma olayı, dişi üreten şişelerde istisnai bir erkek üretecektir. Yetişkin dişileri olan bir şişenin istisnai bir erkeği varsa, o erkeği öldürmek için çıkarın ve ezin. Mümkünse, tüm dişileri o şişeden atın ve daha fazla yetişkin dişi kapanana ve haçlar için güvenle kullanılabilene kadar birkaç gün bekleyin.
- Yetişkin dişiler tüm şişelere eklendikten sonra, halihazırda dişi sinekler içeren her şişeye iki yetişkin erkek (Şekil 4) eklemek için 1.5-1.11 adımlarını tekrarlayın. Dişilerle birlikte şişeyi lastik bir ped üzerine hafifçe vurun, böylece iki erkek sırayla eklendiğinde kaçmazlar.
NOT: Hızlı çalışın ve yetişkin sinekleri aşırı uyuşturmayın çünkü bu onları öldürür. - Her şişeye stoğu, haçı (dişi veya erkek döl için), annenin yetişkin şişesi #1 veya #2'den gelip gelmediğini ve çiftleşme tarihini belirten bir etiket ekleyin. Ayrıca yukarıdaki bilgileri bir not defterine girin ve her bir çaprazlama için ayarlanan şişe sayısını belirtin.
NOT: Tepsideki erkek üreten şişeleri dişi üreten şişelerden ayırmak için bir kağıt havlu eklemek uygundur. - Yetişkinlerin uyandığından ve etrafta uçtuğundan emin olmak için şişeleri ~ 15 dakika boyunca tezgahın üzerinde rahatsız edilmeden bırakın. Dişi ve erkeğin arkaya doğru yönlendirildiği yerde (uyandıktan çok kısa bir süre sonra) çiftleşip çiftleşmediklerini gözlemleyin (erkek toka, dişinin sivri yumurtlayıcısını tutacaktır) (Şekil 4, alt).
NOT: Yetişkin bir dişi, yetişkin bir erkeği sadece bir kez kabul edecektir, bu nedenle çiftleşmeden sonra şişeleri itmeyin, çünkü bu, çiftleşme sürecinde erkeği dişiden ayırabilir ve dişi yeniden çiftleşmez. - Eşleştirilmiş şişelerin bulunduğu tepsiyi inkübatöre yerleştirin (örn. 21 °C). Tepsiyi stokun adıyla (örneğin, HoLo2) ve 5 haftalık döngünün haftasıyla (1, 2, 3, 4 veya 5. haftalar) etiketleyin.
NOT: Larvalar ortaya çıkana kadar şişeleri beslememeyi hatırlatmak için yeni çiftleşmiş sineklerin bulunduğu tepsiyi kuluçka makinesinin veya başka bir kuluçka makinesinin ayrı bir bölümünde saklayın (aşağıda açıklanmıştır).
2. Toplu çiftleşme
NOT: Tipik olarak, tek bir B. coprophila annesinin kuluçkasında 60 yavru olacaktır. Deneyler için daha fazla sayıda yavru gerektiğinde, yukarıda açıklanan tek çift çiftleşme yerine toplu bir çiftleştirme yapılabilir. Toplu çiftleştirme, annelerin indüklenmiş yumurtlama ve embriyo toplama için bir gün sonra toplanacağı standart 28 cm çapındaki cam şişelerde yapılabilir. Bununla birlikte, daha fazla sayıda larvaya ihtiyaç duyulursa, aşırı kalabalıklaşmayı önlemek için toplu çiftleşme daha geniş bir yüzeye sahip bir kavanozda yapılır. Larvaların nefes alabilmesi için kavanozun kapağına birkaç küçük delik açın.
- Bölüm 1'deki yukarıdaki adımları izleyin, ancak tüm kadın üretici anneleri (veya tüm erkek üretici anneleri) beyaz sinekliğin ön köşesine taşımak için ince uçlu forseps kullanın. 10-15 anestezi uygulanmış şişman yetişkin dişi kullanın ve bu grubu bir boya fırçası ile kapakta küçük delikler açılmış flakon veya kavanozun içine süpürün.
NOT: 2.1 ve 2.2 adımlarını gerçekleştirin. fertil melezleri önleyecek aşırı anesteziden kaçınmak için toplu çiftleşme için hızlı. - 20-25 anestezi uygulanmış şişman yetişkin erkek seçin ve onları ince uçlu forseps ile beyaz sinekliğin ön köşesine taşıyın.
- Dişilerle birlikte şişeyi veya kavanozu bir lastik ped üzerine kuvvetlice vurun, böylece tıkaç veya kapak çıkarıldığında anestezi uygulanmış yetişkin erkek kümesini bir boya fırçası kullanarak beyaz sineklikten süpürmek için kaçmazlar.
3. Toplu çiftleşmeden sonra embriyo toplama
- Çiftleşmeden bir gün (24 saat) sonra, yetişkin sinekleri (dişi ve erkek karışımı) uyuşturmak için 1.5-1.11 adımlarını uygulayın ve onları beyaz bir sinek pedine aktarın.
NOT: Yetişkin sinekler çiftleştiğinde oogenez henüz tamamlanmamıştır, bu da mayoz bölünmeyi tetikler; Olgun yumurtalar, yumurtalar boşaltıldığında spermatheca'da depolanan sperm tarafından döllenir 29. Oogenezin tamamlanması 1-2 gün sürebilir, bu nedenle çiftleşmeden sonra yumurtlama indüklenmeden önce 1 güne izin verilir. - İnce uçlu forsepslerle, yetişkin bir dişiyi kanatlarından alın ve kanatları agarın içine yerleştirilmiş olarak %2,2 (ağırlıkça/hacim) agar içeren 100 mm çapında bir Petri kabına yerleştirin. Bu adımı, beyaz sineklik üzerindeki her yetişkin dişi için sırayla tekrarlayın. Yetişkin erkekleri sinekliğin üzerine atın.
- Tüm dişi sinekler agarın üzerine saplandıktan sonra, dişi sinek nöbet benzeri hareketler yapana kadar başını forseps ile hafifçe sıkarak yumurtlamaya neden olun. Alternatif olarak, göğsünü hafifçe sıkın. Daha sonra 30-60 dakika içinde bir küme döllenmiş yumurta bırakacaktır. Yumurtaların kapağa elektrostatik çekimini önlemek için Petri kabını suyla nemlendirilmiş bir laboratuvar mendili ile nemlendirilmiş kapağıyla kapatın.
4. Larvaların "yumurtadan çıkmasının" kontrol edilmesi
- Çiftleşmeden 1 hafta sonra larvaların "yumurtadan çıktığını" kontrol edin; Fişi şişeden çıkarın ve larvaları puanlamak için bir diseksiyon mikroskobu kullanın. Siyah çeneleri tekrar tekrar açılıp kapanacak ve yavaşça ileri doğru hareket edeceklerdir. Sadece birkaç larva varsa, bu şişeyi daha az beslemek için bir hatırlatma olarak şişe etiketine "birkaç" yazın. Tepsideki her bir şişeyi bu haçla inceleyin ve not defterindeki larvaların bulunduğu şişelerin sayısını, o çiftleşmede kurulan şişelerin sayısının yanındaki bir sütuna girin.
NOT: Koyu sarı yumurtalar gelişmeyecektir. Beyaz yumurtaların gelişmesi muhtemeldir ve larvaların ortaya çıkmasından 1 gün önce, yumurtanın ön ucunda siyah pigment (gelecekteki çene) gelişecektir. Larvalar için ucunda siyah bir küre ile biten beyaz bir filament ile küfü karıştırmayın - agar üzerinde ileri doğru sürünen larvaların aksine küf hareket etmeyecektir. - Aşırı nemi kontrol etmek ve larvalar için bir saklanma yeri sağlamak için larvaların bulunduğu her şişeye küçük bir parça saman (sadece bir kez) ekleyin.
- Tepsiyi kuluçka makinesine (örn. 21 °C) önceki haftaların çiftleşme çaprazlamalarından larva tepsileri ile taşıyın ve şişeleri yeni çıkan larvalarla beslemeye başlayın (besleme ile ilgili aşağıdaki bölüme bakın).
NOT: Genellikle larvalar ölü annelerinin yanında bir küme halinde olacak ve onu yemeye başlayacaklardır; Muhtemelen bu, mayayı annenin bağırsağından larvaların bağırsağına aktarır. Larvaların çıktığı gün veya daha sonraki 2 gün içinde beslenmeye başlayabilirsiniz. DİKKAT: Beslenme gecikirse, larvalar birbirini yer ve flakon başına sadece bir yağ larvası kalır! - Haftada 3 gün boyunca henüz larvaları olmayan şişeleri kontrol etmeye devam edin. 7-10 gün sonra larva ortaya çıkmazsa, şişeyi atın veya şişeyi yıkamak için saklayın.
5. Yemeğin yapılması
NOT: Tüm gıda bileşenleri pestisit içermemelidir!
- Aşağıdaki malzemeleri hacimce ölçmek için bir çorba kaşığı kullanın ve bunları metal veya cam bir tavaya (örneğin, 8 inç x 8 inç metal fırın tepsisi) koyun: 4 kısım yulaf samanı (8 yemek kaşığı), 2 kısım Shitake mantarı tozu (4 yemek kaşığı), 1 kısım ıspanak tozu (2 yemek kaşığı), 1 kısım ısırgan otu tozu (2 yemek kaşığı). Malzemeleri tavada iyice karıştırmak için yemek kaşığını kullanın.
NOT: Alternatif olarak, her birinden 1 kısım yerine 2 kısım sadece ıspanak tozu veya sadece ısırgan otu tozu kullanılabilir. - Tavayı alüminyum folyo ile örtün ve 20-30 dakika kuru bir döngüde otoklavlayın. Gece boyunca veya daha uzun süre oda sıcaklığına soğumaya bırakın.
- Folyoyu tavadan çıkarın ve toz halinde bir karışım oluşturmak için yemek kaşığı ile öğütme hareketi kullanarak topaklanmış sterilize edilmiş gıda karışımını parçalayın.
- 1 kısım (2 tepeleme yemek kaşığı) bira mayası ekleyin ve otoklavlanmış gıda karışımına iyice karıştırın.
NOT: Bira mayası, mayayı öldüreceği için otoklavlanmamıştır. - Yiyecek karışımını steril kapaklı bir kavanoza aktarın.
NOT: Toplu çiftleşme için kullanılanla aynı tip 240 mL'lik kavanoz kullanılabilir ve yukarıdaki tarif kavanozu dolduracaktır. Benzer şekilde, aynı tip sterilize edilmiş kapaklı kavanoz, folyo kaplı bir tavada otoklavlanmış sadece samanla doldurulmalıdır.
6. Besleme
NOT: Verilen mama miktarını larvaların yaşına ve miktarına göre ayarlayınız. Toplu çiftleşmeden çok sayıda larva içeren kavanozlara çok fazla yiyecek verin. Gelişimsel evreleme için birkaç gün boyunca saklanan larvaların bulunduğu Petri plakalarına sadece hafif bir tutam yiyecek verin. Aşağıda açıklanan besleme yöntemi Charles Metz 29'un laboratuvarında geliştirildi ve laboratuvarı ve Helen Crouse, Susan Gerbi ve diğerleri tarafından bir yüzyıl boyunca başarıyla kullanıldı.
- Ellerinizi yıkayın ve sabunu çıkarmak için iyice durulayın.
NOT: Eldivenler, her bir şişeye verilen yiyecek miktarını düzenlemek için parmaklarınızın hissini azalttığı için önerilmez. - Larvaların tutulduğu inkübatörde (örn. 21 °C) öğütülmüş saman ile kapaklı steril bir kavanoz ve yiyecek içeren steril bir kavanoz saklayın. Kapağı kavanozdan çıkarın ve daha kolay erişim için temiz bir kaseye (örneğin bir şeker tabağı) biraz yiyecek dökün; Kalan yiyeceğin bulunduğu kavanozun kapağını değiştirin. Açık kaseyi yiyeceklerle birlikte metal veya cam küçük bir tepside saklayın; Bu, akarların veya diğer böceklerin tepsinin duvarının üzerinden sürünerek kaseye yiyecekle girmesini engelleyecektir.
- İkinci ve üçüncü parmaklar arasında (veya başparmak ve ikinci parmak arasında) biraz yiyecek alın. Diğer elinizle, tepsiden bir şişe çıkarın ve beslerken parmaklarınızla tutarak tapayı çıkarın. Şişeyi larvaların yaşı ve sayısı açısından inceleyin ve yiyeceği tutan iki parmağınızı birbirine karşı döndürerek uygun miktarda yiyeceği şişeye bırakın. Yeni ortaya çıkan larvalara sahip şişeler sadece birkaç tane yiyeceğe ihtiyaç duyar. Daha yaşlı larvalara sahip şişeler, agarın üstünü kaplayan ince bir yiyecek tabakasına sahip olmalıdır.
- Şişede beyaz küf varsa, uzun bir metal probu (örneğin tahta bir saplı) silerek temizlemek için bir laboratuvar mendili üzerine püskürtülen% 70 etanol kullanın, tapayı çıkarın ve küfü agarın yüzeyindeki küfü hafifçe vurmak için temiz probu şişeye yerleştirin. Çok fazla küf varsa, kalıbı şişeden çıkarmak için probun etrafına sarmak için probu döndürün. Larvalar orada yaşadığı için agarın tepesini rahatsız etmeyin; Sadece az miktarda yiyecek ekleyin ve şişedeki tapayı değiştirin. Probu saklamadan veya başka bir şişeyi temizlemek için kullanmadan önce probu %70 etanol ile nemlendirilmiş bir laboratuvar mendiliyle silerek temizleyin.
- Bir tepsideki tüm şişeler beslendikten sonra, tepsiyi inkübatöre yerleştirin ve adım 6.3'teki gibi beslemek için bir sonraki tepsiyi çıkarın.
- Besleme tamamlandıktan sonra, kaseden kalan yiyeceği önceden sterilize edilmiş kavanoza dökün, kavanozu kapatın ve inkübatörde saklayın.
7. Petri plakalarında larva veya pupaların toplanması
- Az sayıda larva için, bir flakondaki agarın üst katmanına kazmak için %70 etanol ile silinmiş metal bir prob veya spatula kullanın ve yapışan agarı bazı larvalarla birlikte yarı yarıya %2,2 (ağırlıkça/hacim) agar ile doldurulmuş 100 mm çapında steril bir Petri kabına aktarın.
- Daha fazla sayıda larva için, agar tapasını şişeden çıkarmak için şişenin altındaki duvar boyunca bir spatula yerleştirin ve yüzü yukarı bakacak şekilde boş bir Petri kabına koyun. Agar tıkacının üst kısmındaki larvaları bulmak için bir diseksiyon mikroskobu kullanın ve bunları ince uçlu forseps ile yarısı %2,2 (ağırlıkça/hacim) agar ile doldurulmuş 100 mm çapında steril bir Petri kabına aktarın.
- İnce uçlu forsepsli larvaları aynı gelişim aşamasındaki gruplara ayırmak için bir diseksiyon mikroskobu kullanın.
NOT: Hafif gelişimsel asenkroni nedeniyle, Petri plakasında %2,2 (ağırlıkça/hacim) agar ile birkaç farklı sıralanmış larva kümesi olacaktır. - Küçük bir tutam yiyecek ekleyin ve larvalarla birlikte Petri kabını kuluçka makinesine yerleştirin. İstenen gelişim aşamasının seçimi için diseksiyon mikroskobu ile gözlem yapmak üzere günlük olarak çıkarın.
NOT: DNA puff çalışmaları için, erken göz lekesi larvaları 10x5, 12x6, 14x7 ve kenar göz/damla çene aşamalarından geçer ve bu aşamaların her birinde ~ 1 gün 30,31 olur. Pupa testislerinde mayoz I ve II evrelerinin olması için gözleri 1/4 ila 1/2 pigmentle dolu olan pupaları seçin.
8. Larvaların soğuk oda depolaması
- Yedek olarak, soğuk odada art arda 2 haftalık çaprazlamadan yaklaşık dört şişe dişi larva ve dört şişe erkek larva bulundurun.
- Yedek depolama için, 4.instarın başlarında (göz lekesi öncesi aşama) olan larvaları besleyin ve soğuk odada bir rafta açık bir tepsiye koyun; Bu şişeleri ayda sadece bir kez besleyin.
- 16 şişeyi 2-3 ay sonra soğuktan art arda 2 haftalık çiftleşme haçlarından çıkarın (bunu bir hatırlatma olarak bir takvimde işaretleyin); Onları normal şekilde beslemek için bir kuluçka makinesine (örneğin, 21 °C) yerleştirin ve melezleme için kullanmak üzere yetişkin hale gelmelerine izin verin.
- Şişeler soğuk odadan çıkarıldığında, soğuk odaya erken 4. instar larvaları ile taze bir şişe seti koyun, böylece bu şişeler her zaman stoklar için yedek olarak mevcut olur.
NOT: Soğuk oda depolamasından sonra canlılık, farklı gelişim aşamaları için sistematik olarak test edilmemiştir, ancak deneyimlerimiz, erken 4. instar larvalarının soğuk hava deposunun iyi çalıştığını göstermektedir.
9. Flakon yıkama
- Yetişkinler öldükten sonra (eklosiyondan ~ 2-3 hafta sonra), şişeleri inkübatörden çıkarın ve kalan organizmaları öldürmek için 1 saat boyunca 60-70 ° C'ye koyun.
- Pamuk tapaları çıkarın ve plastik bir kutuda saklayın.
- Agar tapasını flakondan bir atık tenekesine kazımak için bir spatula kullanın.
- Şişeleri gece boyunca veya daha uzun süre bir tencerede suya batırın.
- Sadece bu amaç için kaydedilmiş bir test tüpü fırçası kullanın (asla kimyasal veya sabun içeren kaplar için kullanmayın) ve akan musluk suyu altında şişede yukarı ve aşağı ovalayın. Temizlenmiş şişeyi açık tarafı aşağı bakacak şekilde metal bir sepete yerleştirin. Sepeti temizlenmiş şişelerle doldurun.
NOT: Şişelerde asla sabun kullanmayın, çünkü herhangi bir kalıntı sabun B. coprophila'yı öldürebilir. - Sepete bir tel örgü kapak ekleyin ve kapağı yerinde tutarken, tüm şişeleri deiyonize su ile doldurmak için sepeti ters çevirin. Kapağı hala yerinde tutarken, deiyonize suyu şişelerden boşaltmak için sepeti ters çevirin. Deiyonize su ile durulama işlemini 4 kez tekrarlayın.
- Temizlenmiş şişelerin bulunduğu sepetleri gece boyunca veya daha uzun süre kuruması için kağıt havluların veya açık bir ağ platformunun (örn. laboratuvar arabası) üzerine yerleştirin. Kuru şişeleri bir çekmecede saklayın.
NOT: Akar istilasına davetiye çıkarabileceğinden, ölü yetişkinlerin bulunduğu şişelerin yıkanmadan önce çok uzun süre kalmasına izin vermeyin.
10. Agar dökme
- Büyük bir kabı (metal sepet veya metal tepsi) temiz şişelerle doldurun ve her şişeye bir pamuk tapa ekleyin. Şişeler yıkandığında eski şişelerden alınan tapaları tekrar kullanın ve tapaları bozulup parçalanana ve atılmaları gerekene kadar tekrar tekrar kullanın. Kabı tıkalı şişelerle kuru bir döngüde ~ 30 dakika sterilize edin ve otoklav kabında saklamak için oda sıcaklığına soğumaya bırakın. Her zaman elinizde otoklavlanmış tıkalı şişeler bulunan iki kap (biri aktif olarak kullanımda ve biri yedek) bulundurun.
- 11.0 g agar tozunu 1 L Erlenmeyer şişesine koyun ve ~ 24 şişe (~ 21 mL / şişe) dökmek için yeterli% 2.2 (ağırlıkça / hacim) agar çözeltisi yapmak için 500 mL damıtılmış su ekleyin. Şişeyi döndürün ve bir mikrodalga fırına koyun.
NOT: Bundan sonra, şişeyi tutmak için ısıya dayanıklı bir otoklav eldiveni kullanın. Aynı %2.2 (ağırlıkça/hacimce) agar çözeltisi, gerekirse Petri plakalarına (toplanmış larvalar için) veya kavanozlara (toplu çiftleşmeler için) dökülebilir. - 1 dakika mikrodalgada pişirin, döndürmek için şişeyi çıkarın, mikrodalga fırına koyun ve tekrar 1 dakika mikrodalgada pişirin. Bunu birkaç kez tekrarlayın.
- Mikrodalga fırının cam kapısından şişeyi izleyin. Agar çözeltisi köpürmeye ve kaynamaya başladığında, hemen manuel durdurma düğmesini kullanın. Bu noktada matarayı döndürmeyin (taşabilir) ve dikkatlice fırından tezgaha çıkarın ve birkaç dakika dinlendirin.
- Fişi sterilize edilmiş bir şişeden çıkarın ve bir elinizle tutun; Diğer elinizi kullanarak ~ 2,5 cm yüksekliğinde% 2,2 agarı sterilize edilmiş şişeye dökün. Ardından, fişi şişeye yerleştirin. Tüm agar dökülene kadar bunu tekrarlayın.
NOT: Şişeye çok az agar dökülürse, kullanım sırasında daha çabuk kurur ve şişenin duvarlarından uzaklaşır. Şişeye çok fazla agar dökülürse, larvaların "bebek yumurtalığını" diseksiyon mikroskobu ile puanlarken üst tabakaya odaklanmak zordur. - Dökülen şişelerin oda sıcaklığında 1-2 gün tezgahta kalmasına izin verin, böylece agar sertleşir ve nem tamamen buharlaşır. Şişeleri çiftleşme haçları için kullanın veya sıkıca kapanan bir kapaklı plastik bir kutuda yan yatacak şekilde saklayın; Kapağı kutunun üzerine yerleştirmeden önce şişelerin üzerine suyla nemlendirilmiş bir kağıt havlu yerleştirin (bu, agarın kurumasını ve şişenin duvarından uzaklaşmasını önleyecektir). Dökülen şişelerle birlikte kutuyu oda sıcaklığında birkaç gün veya 4 °C'lik bir buzdolabında veya soğuk odada 2 haftaya kadar saklayın. Saklanan şişeleri kullanmadan önce, bunları kutudan çıkarın ve yoğuşmanın şişelerin içinden buharlaşmasını sağlamak için bir veya iki saat oda sıcaklığında tezgahta bırakın (yetişkin sinekler yoğuşmaya yapışır ve boğulur).
11. Şişeler için tapa yapmak
- Strafor 50 mL'lik bir test tüpü tutucusuna temiz bir şişe yerleştirin (tüpü dik duracak şekilde içeri zorlayın). Bir kare tülbent kesin (2-4 kat kalınlığında) ve şişenin üzerine yerleştirin.
- Daha kalın bir tabaka oluşturmak için daha önce yapılmış tapalardan gelen tülbent parçalarını tülbentin üzerine yerleştirin. Tülbentin üzerine pamuğu yerleştirin ve şişenin üst kısmını sıkıca doldurduğunuzdan emin olarak şişeye bastırın.
- Tülbentin uçlarının üst kısmını bir arada tutun ve ip ile bağlayın. Fazla ipi ve fazla tülbenti kesin (ipin bağlı kalması için yeterli kuyruğu ve tapayı rahatça kavramak için yeterli tülbent bırakın).
NOT: Fişleri tam oturacak şekilde takın. Onları bir elinizde tutarken işaret parmağınız ve işaret parmağınızla dışarı çekebilmelisiniz. Şişeyi fişinden tutarsanız ve düşerse, çok gevşektir. Dışarı çekildiğinde yüksek bir patlama sesi çıkarıyorsa, çok sıkı olabilir. Çok sıkıysa veya tapanın üzerinde sert, kuru bir agar tabakası varsa, sinekler boğulabilir. Tapa biraz fazla gevşekse veya şişenin kenarlarından aşağı kayıyorsa, biraz daha geniş bir boyuta sıkıştırmak için tezgahın üzerine vurulabilir.
12. Tipik haftalık program (en yüksek verimlilik için görevleri listelenen sırayla gerçekleştirin)
- Pazartesi (~30 dk)
- Şişeleri larvalarla besleyin.
- Agar'ı tapalı steril temiz şişelere dökün.
- Çarşamba (~2 saat)
- Ölü yetişkinlerin bulunduğu şişeleri 1 saat fırına koyun ve yıkamak için saklayın.
- Larva "bebek yumurtası" olup olmadığını kontrol edin.
- Şişeleri larvalarla besleyin.
- Haftalık çiftleşme haçları gerçekleştirin.
- Gerektiği gibi diğer görevler: gerektiğinde yedek bir beslemeye sahip olmak için tapalarla temiz şişeleri otoklavlayın; gerektiği gibi yeni yiyecek ve otoklav samanı yapın; Yiyecek ve saman için gerektiği gibi kavanozları otoklavlayın.
- Cuma (~30 dk)
- Larva "bebek yumurtası" olup olmadığını kontrol edin.
- Şişeleri larvalarla besleyin.
Sonuçlar
Burada açıklanan protokoller, B. coprophila'nın yetiştirilmesinde kanıtlanmış başarıya yol açmıştır. Çiftleşme için yakın zamanda kapatılmış şişman yetişkinler seçildiğinde (Şekil 4), melezlerin %90'ından fazlası verimli olabilir ve yavru verebilir. Doğurganlık başarısı farklı stoklara göre değişir (Tablo 2). Stok 7298 (Dalgalı işaretleyicili X' kromozomu) stokların en sağlıklısıydı, ancak görünüşe göre genom yeniden düzenlemelerini yaratan DNA mobil elementlerinin aktivasyonu nedeniyle bir düşüş döneminden geçti32. HoLo2 stoğu, görünüşe göre genom yeniden düzenlemelerinin stabilize olduğu 7298'den türetilen sağlıklı bir suşu temsil eder ve stok merkezindeki ebeveyn 7298 stoğunun yerini almıştır. HoLo2 stoğu, B. coprophila genomunu dizilemek için kullanılan ve çeşitli laboratuvar grupları tarafından en yaygın olarak kullanılan stoktur. Son zamanlarda, HoLo2 sineklerinin CRISPR mutajenezi, floresan göz işaretleyicileri ile transformasyon için kullanılacak beyaz göz fenotipine sahip W14 stoğunu oluşturmak için kullanılmıştır (Yamamoto ve Gerbi, veriler gösterilmemiştir). W14 türü son derece sağlamdır. 6980 dipçiği (Dalgalı kanat ve şişmiş damar işaretleyicileri) biraz daha az sağlamdır ve 91S dipçiği (minyon kanat işaretleyicisi) daha da az sağlamdır.
Başarılı çaprazlamalar embriyolarla sonuçlanır (Şekil 5). Embriyolar, 7. ila 9. bölünme bölümünde damgalanmış paternal X kromozomlarının elimine edilir. Ek olarak, germ hattı sınırlı L kromozomları, 5. ila 6. bölünme bölünmesinde embriyolarda somatik soydan elimine edilir. Embriyolar larva olarak ortaya çıkar ve bu da mevcut olabilecek küf ile karıştırılmamalıdır (Şekil 6). Göz lekeleri (erişkin gözlere göre) 4. larva girişinin ikinci yarısında ortaya çıkar (Şekil 7). Göz lekelerinin boyutu, doğal olarak meydana gelen gelişimsel olarak düzenlenmiş bölgeye özgü intrakromozomal DNA (gen) amplifikasyonunun bilinen iki örneğinden biri olan DNA puff amplifikasyonunun başlangıcı ve ilerlemesi için uygun bir fenotipik belirteç sağlar. Daha sonra pupalar gelişir ve gözlerini dolduran pigment miktarı, bu bölünmelerdeki benzersiz kromozom davranışları ile spermatogenezde mayoz I ve II için gelişimsel bir belirteç görevi görebilir (Şekil 8).

Şekil 4: Ergin B. coprophila sineklerinin çiftleşmesi. Üst panel, HoLo2 stoğundaki üç tür yetişkin sineği gösterir: Dalgalı kanatlı dişi üreten anneler (X'WX yetişkin dişiler), düz kanatlı erkek üreten anneler (XX yetişkin dişiler) ve düz kanatlı erkekler (X0 yetişkin erkek). Dişi sineklerin arka ucundaki sivri yumurtlayıcıya ve erkek sineklerin arka ucundaki kanca şeklindeki tokaya dikkat edin. Alt panel, erkek tokanın dişinin yumurtlayıcısını yakaladığı bir erkek ve dişi çiftleşmesini gösterir. Sperm, dişinin spermatekasında depolanacak ve yumurtaları dışarıya atılırken dölleyecektir. Yetişkinlerin uzunluğu 2,0 mm (erkekler), 2,5 mm'dir (dişi). Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
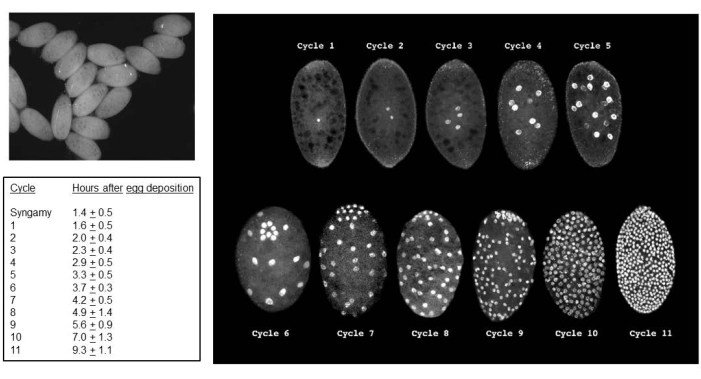
Şekil 5: B. coprophila embriyoları. Sol üst panel, diseksiyon mikroskobunda standart ışık kullanılarak embriyoların bir görünümüdür; Sinsityal sitoplazmadaki çekirdekler siyah noktalar olarak görünür. Sağdaki panel, embriyoların propidyum iyodür lekeli çekirdeklerini görselleştirmek için floresan mikroskobu kullanır. Embriyoların ortalama uzunluğu 200 mikron, genişliği ise ortalama 150 mikrondur. Germ hücrelerinin çekirdekleri, 6 (embriyo öne eğik) ve 7-9 döngülerinde görüldüğü gibi embriyonun arka kutbunda kümelenir ve daha sonra somatik çekirdeklerle serpiştirilir. Somatik soyda L kromozomu eliminasyonu, bölünme bölümü 5 veya 6'da meydana gelir; Somatik soyda X kromozomu eliminasyonu 7., 8. veya 9. bölünme bölünmesinde gerçekleşir. Hücreselleşme, döngü 11'in interfazı sırasında meydana gelir. Soldaki tablo, 22 °C'de her bir bölme döngüsü için ortalama süreyi göstermektedir. Soldaki masa ve sağdaki panel, de Saint Phalle ve Sullivan35'in izniyle uyarlanmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
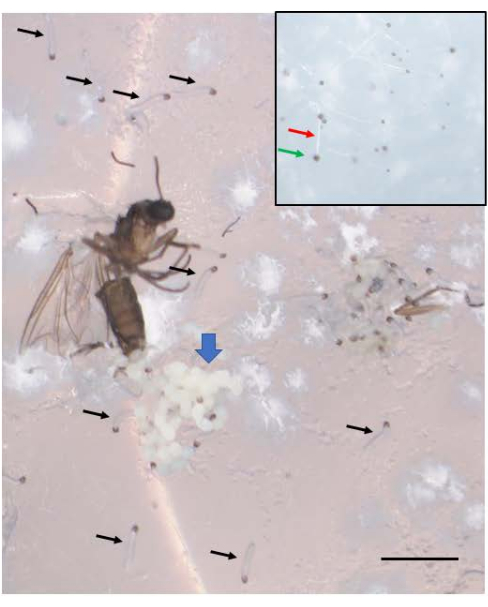
Şekil 6: B. coprophila embriyoları larva olarak ortaya çıkar. Yumurtlamadan sonra ölen yetişkin dişinin yumurtlamasının yakınında bir embriyo kümesi (mavi kalın ok) görülür. Yumurtlamadan bir hafta sonra, embriyolar, birçoğu siyah oklarla gösterilen genç larvalar haline gelir. Yeni çıkan larvaların ön ucunda siyah bir çeneye ve yarı saydam bir gövdeye sahiptir. Agar yüzeyinin üstünde hareket ederler ve hareket etmeyen küf ile karıştırılmamalıdırlar. İç kısım, beyaz bir filament (kırmızı ok) ve ucunda siyah bir spor (yeşil ok) ile bir miktar küf gösterir ve yeni ortaya çıkan larvalardan çok az daha küçüktür. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
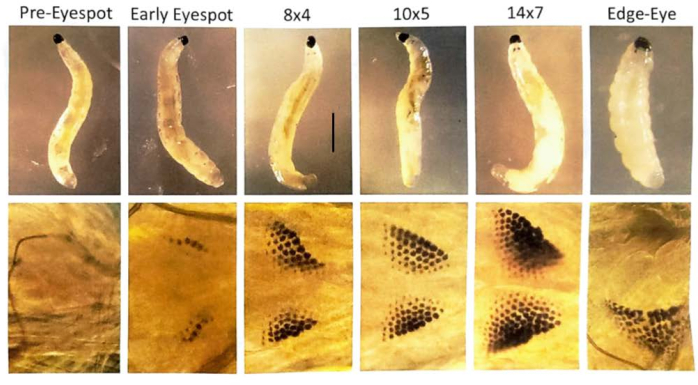
Şekil 7: B. coprophila larvalarının göz lekesi evreleri. Göz lekeleri larvanın ön kısmında, çenenin hemen arkasında oluşur ve sayıları artan pigment granüllerinden oluşur. Göz lekeleri yetişkin gözü için bir anlayıştır. Üst panel, diseksiyon mikroskobu ile görüntülenen larvaları gösterir; Alt panel, bir damla damıtılmış su ve üstte hafifçe yüzen bir lamel ile bir mikroskop lamı üzerinde bir larvayı görselleştirmek için bir faz kontrast mikroskobu kullanılarak göz lekelerinin büyütülmüş bir görünümüdür. Göz noktası aşamalarının isimlendirilmesi, Gabrusewycz-Garcia30'a göredir, burada granül sayısı en uzun sırada sayılır (örneğin, 12) ve en uzun sıra hariç ek sıra sayısı not edilir (örneğin, göz noktası aşaması 12x6 için 6). Tükürük bezi politen kromozomlarında bölgeye özgü DNA amplifikasyonunun başlatılması 10x5 göz lekesi aşamasında başlar ve lokusta bir transkripsiyon patlaması ve DNA puffs'ın31 genişlemesi olduğunda 14x7'de tamamlanır. Sonraki kenar göz/düşük çene aşamasında, göz noktası granülleri birleşmeye başlar ve orta hattan yanal olarak uzaklaşırlar; Larva gövdesinin uzunluğu kısalır. Ayrıca, DNA ponponları bu aşamada yoğunlaşır. Her bir göz noktası aşamasını geçmek 21 ° C'de yaklaşık bir gün sürer. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
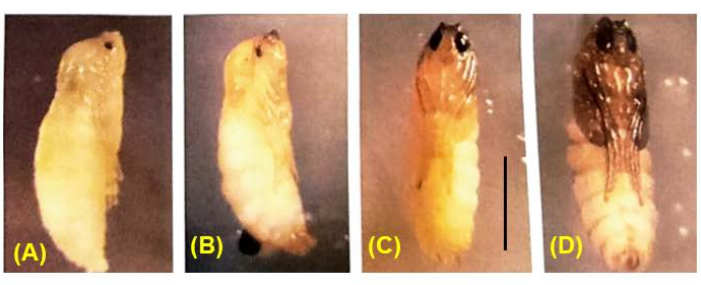
Şekil 8: B. coprophila pupae'nin gelişimi. Yavrulama sırasında, sinir sistemi dışındaki tüm larva dokuları histolize olur ve hayali disklerin hücre bölünmeleri ile ortaya çıkan yetişkin dokularla değiştirilir. Gövde rengi beyazdan ten rengine, kahverengiden siyaha değişir. Pigment yavaş yavaş pupa gözünde dolar; mayoz I ve II, pigment36 ile dolu gözleri 1/4 ila 1/2 olan erkek pupalarda meydana gelir. Ölçek çubuğu = 1 mm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Stok adı | İşaretleyiciler | Doğurganlık oranı | Yorum |
| 7298 | Dalgalı (W) kanat | ~%75 | |
| HoLo2 | Dalgalı (W) kanat | ~%90 | 7298'den türetilmiştir |
| W14 Serisi | Dalgalı (W) kanat; Beyaz gözler | ~%95 | HoLo2'den türetilmiştir |
| 6980 | Dalgalı (W) kanat; Şişmiş (SW) damarlar | ~%65 | |
| 91'LI YILLAR | zayıf Dalgalı (W) kanat; Minyon (P) kanatlar | ~%50 | Dalgalı işaretleyici, 91S'yi kurtarmak için bir haç şeklinde tanıtıldı |
Tablo 2: Bradysia (Sciara) coprophila stokları. Gerbi6'nın Tablo 1'i bu belirteçleri ve artık mevcut olmayan diğerlerini listeler. X27'nin sentromer ucundaki beş translokasyon (T1, T23, T29, T32, T70) Gerbi6'nın Şekil 8'inde özetlenmiştir, ancak artık mevcut değildir.
Ek Dosya 1: HoLo2 (ve 7298 ve W14) çaprazları, 91S çaprazlama ve kurtarma, 6980 çapraz, translokasyon çaprazları. Bu dosyayı indirmek için lütfen buraya tıklayın.
Tartışmalar
B. coprophila'nın yetiştirilmesi için burada sunulan protokoller, bu organizmayı benzersiz biyolojik özelliklerini araştırmak için deneyler için laboratuvarlarında yetiştirmek isteyen bilim adamları için faydalı olacaktır. B. coprophila29'u korumak için bir agar tabanına serpilen maya ve mantar tozu kullanılarak yapılan besleme yönteminin ilk açıklaması, Metz laboratuvarında 14 farklı Sciarid sineğitürünü 5 yetiştirmek için kullanıldı. Daha sonra, ısırgan otu ve/veya ıspanak tozu ilavesinin B. coprophila'nın canlılığını daha da arttırdığı gözlenmiştir (Gabrusewycz-Garcia, kişisel iletişim). Bu yöntemler, şu anda kültürde olan Bradysia impatiens ve Lycoriella ingenua dahil olmak üzere Sciaridae familyasındaki ilgili türlerin bakımı için başarılı olmuştur (Robert Baird, kişisel iletişim).
B . coprophila'yı yetiştirmek için diğer yöntemler (aşağıda açıklanan alternatif besleme yöntemleri gibi) denenmiştir, ancak burada açıklanan protokoller, en verimli yağ yetişkinlerini elde etmek ve küf büyümesini en aza indirmek için agarın yüzey alanı başına en uygun larva oranına sahip olacak şekilde optimize edilmiştir. Ölçeği büyütmek için, yukarıdaki protokol 2'de açıklandığı gibi cam şişelerde toplu çiftleşme yapılabilir. Alternatif olarak, birkaç (2-4) yetişkin dişi, Drosophila'yı yetiştirmek için kullanılana benzer bir şişeye iki kat daha fazla yetişkin erkekle birlikte yerleştirilebilir (tek kullanımlık 6 oz. = 177.4 mL kare tabanlı Drosophila polipropilen şişe). Her iki durumda da, araştırmacı, şişenin yalnızca tüm kadın üretici veya tüm erkek üretici anneleri içerdiğinden tamamen emin olmalıdır.
Pupa ve yetişkinler yemek yemediği için sadece larvaları besleyin. Larvalar pupaya dönüşmüşse şişeyi beslemeyin (bunun bir işareti, erken ortaya çıkan ilk yetişkin sineklerin ortaya çıkmasıdır). Yetişkinler kapandıktan sonra, şişeleri varsa daha soğuk bir inkübatöre (örneğin, 16 ° C) koyun, çünkü bu yetişkinlerin daha uzun yaşamasını sağlayacaktır. Haftada üç kez (örneğin, Pazartesi, Çarşamba, Cuma) besleyin, larvalar yaşlandıkça flakon başına verilen yiyecek miktarını artırın. Cömertçe besleyin ve yağlı verimli yetişkinlerle ödüllendirileceksiniz. Bununla birlikte, çok fazla beslerseniz, beyaz küf ortaya çıkar ve bu, bir şişeye bıraktığınız yiyecek miktarını azaltmanın bir işaretidir. Ayrıca, çok fazla beslerseniz, agarın üstünde kalın bir yiyecek pedi gelişecek ve yetişkinlerin ortaya çıkmasını zorlaştıracaktır (pedi bir forseps ile çıkarabilirsiniz, ancak larvaları ped ile çıkarmamaya dikkat edin - bunu hiç yapmak zorunda kalmamak en iyisidir). Az sayıda larva içeren şişeler ("az" olarak işaretlenmiş) daha az yiyeceğe ihtiyaç duyar. Çok az beslerseniz, larvalar yiyecek aramak için şişenin duvarlarına tırmanır. Yetersiz beslenen larvalar, daha az verimli olan küçük yetişkinlere neden olur.
Alternatif besleme yöntemleri
Larvaları haftada 3 kez yerine larva döneminde sadece bir kez beslemek için çeşitli yöntemler denenmiştir. B. coprophila , Drosophila tarzı yiyeceklerde büyümez. John Urban (kişisel iletişim) B. coprophila yemeğini agar ile karıştırmayı denedi, ancak çok fazla küf büyüdü. İki küf inhibitörünün (tegosept ve propiyonik asit) kombinasyon halinde ve ayrı ayrı eklenmesinin, birkaç farklı konsantrasyonun denenmesinin, küfü inhibe eden seviyelerde B. coprophila için toksik olduğunu buldu. Agar, B. coprophila'nın asidik bir pH'da (propianik asitte olduğu gibi) hastalandığı için pH 6-7 (nötr) olmalıdır. Alternatif olarak, haftada üç kez beslenmeyi önlemek için, çiftleşmeden bir hafta sonra (yani, larvaların çıkmaya başlayacağı zaman) her şişede agarın üzerine bir parça olarak kalın bir maya macunu (nemlendirmek için biraz damıtılmış su ile karıştırılmış Kırmızı Yıldız aktif kuru maya) dağıtmak için iğnesiz bir spatula veya şırınga kullanmayı denedi.
Haftada üç kez beslenmeyi önlemenin bir başka yolu, her şişeye canlı bir mantar kültürü eklemektir. Bath ve Sponsler37 , Sabouraud besiyeri ile eğimli bir agar yüzeyinin, Chaetoconidia (en iyi) veya Baplosporangia veya Xllescheria cinslerinin bir mantar kültürü ile çizilmesi gerektiğini bildirdi. Mantar, B. coprophila'nın tanıtılmasından birkaç gün ila bir hafta önce büyütüldü. Bundan sonra beslenmeye gerek yoktu. Bu yöntemin bir çeşidi Ellen Rasch (kişisel iletişim) tarafından da kullanılmıştır. Elimizde bu yöntemle şişeler çok ıslaktı ve larvalar boğuldu, ancak canlı mantarlı şişelere göre larva sayısını optimize etmek için tekrar denenebilirdi.
Arthur Forer (kişisel iletişim), B. coprophila'yı turna sinekleriyle aynı şekilde yetiştirmede bazı başarılar elde etmiştir38. Bu yaklaşımla, pupalar nemli kartonpiyer üzerinde yetiştirildi. Daha sonra yetişkinler çiftleştirildi ve yumurtalar taze nemli kartonpiyer üzerine bırakıldı. Elde edilen larvalar petri kaplarında kartonpiyer üzerinde tutuldu ve haftada iki kez toz ısırgan otu yaprakları ile beslendi. Pupalar, döngüyü tekrarlamak için bir kafese konuldu.
Yukiko Yamashita (kişisel iletişim), B. coprophila'yı toprakta yetiştirmeyi başardı ve doğada bulundukları saksı bitkilerinde ve yüksek nemli seralarda bulundukları koşulları taklit etti. Bununla birlikte, nem seviyesi yükseldiğinde küf bir sorun haline gelebilir. Bununla birlikte, nemli toprak, nemli topraklı plastik kutularda Pseudolycoriella (daha önce Bradysia) hygida larvalarını yetiştirmek için başarıyla kullanılmıştır; ayrışmış Ilex paraguariensis yaprakları ile beslenirler, geç larva yaşamında %1.2 maya özütü, %1.4 mısır nişastası, %0.8 yulaf unu unu, %1.2 agar12 ile desteklenirler. Benzer şekilde, nemli toprak, Sciarid sineklerini yükseltmek için ezilmiş barbunya fasulyesi ile nemli turba yosunu ile değiştirilebilir39,40.
Bradysia'nın laboratuvar kültürlerini korumak için başka yöntemler de kullanılmıştır: (i) maya ve kurutulmuş kan gübresinin eklendiği otoklavlanmış patates41; (ii) kurutulmuş kanın eklenebileceğigübre 42,43,44 45; (iii) pamuklu pedli plastik kaplar ve öğütülmüş soya fasulyesi ile nemlendirilmiş kağıt havlular46.
Mites
Akarlar Drosophila'dan B. coprophila'ya aktarılabilir. Bunu en aza indirmek için, B. coprophila'yı Drosophila stoklarına yakın olmayan ayrı bir kuluçka makinesinde veya odada tutmak en iyisidir. Ayrıca, Drosophila'yı kullanmadan önce günün erken saatlerinde herhangi bir B. coprophila bakım çalışması yapın. Akarlar ayrıca ev bitkilerinden B. coprophila'ya da aktarılabilir, bu nedenle bitkileri B. coprophila ile aynı odada tutmayın. Akarlar şişeleri istila ederse, B. coprophila'nın vücudunda sürünen küçük beyaz küresel organizmalar olarak görülebilirler. Drosophila'daki akarları yok etmek için çalışan kimyasal işlemler, kimyasallar B. coprophila'yı öldürdüğü için B. coprophila için kullanılamaz (B. coprophila ayrıca fenol gibi organik dumanlara karşı hassastır). B. coprophila akar stoklarından kurtulmanın tek tedavisi, embriyoları bir agar plakası üzerinde manuel olarak toplamak, her birini akarların yokluğu açısından incelemek ve daha sonra ince bir boya fırçası kullanarak taze agar şişelerine aktarmaktır. Pamuk dolgulu gazlı bezler ve selüloz asetat köpük flugları (Drosophila polipropilen şişeleri için kullanıldığı gibi), akarların şişelere girmesini önlemeye yardımcı olur.
Hayvancılık protokollerinin kullanışlılığı
Burada açıklanan protokoller, büyüyen bilim adamları topluluğunun, benzersiz biyolojik özelliklerini incelemek için B. coprophila'yı yeni / eski ortaya çıkan bir model organizma olarak desteklemesini sağlayacaktır. Yeni laboratuvar grupları, Bradysia'nın (Sciara) benzersiz biyolojik özelliklerini korumak ve araştırmak için büyüyen topluluğa katılmaya teşvik edilir.
Açıklamalar
Yazarın beyan edeceği herhangi bir çıkar çatışması yoktur.
Teşekkürler
Önceki B. coprophila stok sahiplerine (Jacob E. Bliss, Paula Bonazinga, Anne W. Kerrebrock, Ingrid M. Mercer, Heidi S. Smith) ve araştırma personeline (özellikle Robert Baird, Michael S. Foulk, Donna Kubai, John M. Urban, Yutaka Yamamoto) hayvancılık protokollerinde ince ayar yaptıkları için özel teşekkürler. B. coprophila'nın bakımı ile ilgili ilk talimatlar Helen V. Crouse, Natalia Gabrusewycz-Garcia, Reba M. Goodman, Charles W. Metz ve Ellen Rasch tarafından sağlandı. Bradysia (Sciara) stok merkezini üstlendikleri için Yukiko Yamashita ve Anne W. Kerrebrock'a minnettarız. Figürlerin hazırlanmasına yardımcı oldukları için aşağıdaki kişilere çok teşekkür ederiz: Brian Wiegmann (Şekil 1), John M. Urban (Şekil 4 üst panel), Laura Ross (Şekil 4 alt panel), Yutaka Yamamoto (Şekil 5 sol panel), Leo Kadota (Şekil 7 ve Şekil 8). Ava Filiss ve Brown Üniversitesi Multidisipliner Laboratuvarı'na fotoğrafçılık ve film çekimi konusundaki yardımları için çok teşekkürler. Bu el yazması hakkındaki yorumları için Robert Baird'e teşekkürler. B. coprophila ile ilgili araştırma ve bakımımız, NIH GM121455'dan S.A.G.'ye en son destek de dahil olmak üzere NIH ve NSF tarafından desteklenmiştir. B. coprophila hakkında daha fazla ayrıntı, şu anda inşa edilmekte olan Bradysia (Sciara) Stok Merkezi web sitelerinde (https://sites.brown.edu/sciara/ ve https://sciara.wi.mit.edu) mevcuttur.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
Referanslar
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır