Method Article
免疫適格マウスを気管内に接種するための寒天ビーズ包埋 型マイコバクテリウム膿瘍 の調製
* これらの著者は同等に貢献しました
要約
マウスは一般に 、マイコバクテリウム・アブセッサスによる感染に耐性があり、肺感染症に対する切望されている抗生物質の発見と開発を複雑にしています。ここでは、免疫コンピテントマウスにおいて持続的な感染をもたらすことが示された接種物調製法と気管内感染法について述べる。
要約
好ましくは肺に感染する環境病原体である Mycobacterium abscessusによる慢性感染の堅牢なマウスモデルが切実に必要とされています。1年にわたる多剤併用療法は、患者の治癒率が約50%と許容できないほど低いため、より優れた抗菌薬を開発するための予測的前臨床ツールが必要です。しかし、免疫適格マウスは一般に 、膿瘍菌による肺感染に対して抵抗性を示します。免疫担当マウスにおける M.abcessus による持続的な感染を確立するための多数の試みが文献で報告されています。これらの中で、寒天ビーズ包埋細菌を気管内経路でC57BL/6マウスに接種する方法が最も有望であることが証明されています。このアプローチの主な制限は、再現性のあるサイズと細菌数の寒天ビーズの調製と、それに続く気管内接種に関連する技術的な課題です。ここでは、まず、最適な直径と再現性のある細菌負荷の M.膿瘍をロードした寒天ビーズを送達する最適化されたプロトコールについて詳しく説明します。次に、接種装置の表面への付着によるビーズや細菌の損失を回避し、寒天に埋め込まれた M.abscessusの再現性のある肺沈着を達成するために最適化された、気管内接種の詳細なプロトコルを提供します。その目的は、実装の容易さと優れたラボ間の再現性を確保することです。
概要
Mycobacterium abscessus(Mab)肺疾患の治療選択肢は限られており、経口、非経口、および時折吸入する抗生物質による1年間の多剤併用レジメンが含まれますが、そのほとんどは最適な殺菌活性を欠いており、重大な毒性と関連しています1,2,3,4,5 .より短く、より安全で、より効果的な治療が緊急に必要とされています。マイコバクテリア感染症のマウスモデルは、効果的な薬物と薬物レジメンの発見と最適化に役立ってきました6,7。しかし、Mab感染症に対する抗生物質の前臨床評価は、マウスにおける進行性および持続的な肺感染症の確立が困難であるため、困難であることが証明されています8,9。
免疫適格マウス系統にMabを感染させると、主に一過性のコロニー形成とそれに続く病原体の急速な除去がもたらされます10,11。臨床的に観察される慢性感染を達成するために、アガロースまたは寒天などの固定化剤は、免疫適格マウス12,13,14において、緑膿菌またはインフルエンザ菌などの日和見病原体の持続性および免疫病理学的応答を促進するために使用されてきた。このモデルは、免疫適格なC57BL/6Nマウス15,16,17,18において、Mab ATCC 19977によって慢性呼吸器感染症を達成するために最近適応されました。この方法は、気管内接種後最大45日間、~1 ×10 4〜1 ×10 6コロニー形成単位(CFU)による持続感染を誘発し、感染マウスにおける慢性感染の発生率は90%〜100%19であり、崩壊する寒天ビーズの周囲に組織化された肉芽腫が形成された18。Mabをビーズに埋め込むと、自然免疫系による急速なクリアランスから保護され、細菌を充填したビーズが免疫細胞の動員の焦点を構成し、肉芽腫の形成と慢性感染の確立につながるようです18。寒天/アガロースビーズは、炎症反応を誘発するのが比較的不活性な生体材料です。さらに、ビーズはゆっくりと崩壊し、異物アレルギー反応や誘発性線維症の問題を回避します。マイクロスプレー装置の有無にかかわらず気管内感染は、接種物の肺への効果的な沈着を確実にし8,20,21、静脈内または鼻腔内接種よりも臨床的曝露および感染をよりよく再現する。
したがって、このモデルには多くの利点があります。ただし、技術的な性質のいくつかの課題、すなわち、(i)再現性のあるビーズサイズの達成、(ii)再現性のあるビーズ細菌負荷の取得、および(iii)接種の一貫した気管内送達の確保にも伴います。ここでは、これらの目的を確実に達成し、ラボ間の再現性を確保するための詳細なプロトコルを提供します。
プロトコル
すべての動物実験は、メリーランド州ベセスダのNIAID(NIH)の施設動物管理および使用委員会の承認を得て、国立衛生研究所の実験動物のケアと使用に関するガイドに従って実施されました。すべての手続きは、動物施設管理委員会によって承認されています。 膿瘍菌 に関するすべての研究は、バイオセーフティ封じ込めレベル2の実験室で実施されました。
1. M. abscessus inoculumを埋め込んだ寒天ビーズの調製
- 1.5 mLの光学濃度(OD600)1(分光光度計を使用)の培養物を200 mLのMiddlebrook 7H9培地に接種し、0.05%(v / v)Tween 80、0.5%(v / v)グリセロール、および10%(v / v)ミドルブルックアルブミン-デキストロース-カタラーゼ濃縮(ADC)を添加して、M. abscessus ATCC 19977の前培養液を調製します。
- 培養物をローラーボトルで37°Cで24時間インキュベートし、中間対数期(OD600 = 0.4-0.6)に達するまでインキュベートします。
- 1.2 gのトリプシン性大豆ブロス(TSB)を40 mLの超純水に懸濁し、0.6 gのDifco Agarを最終濃度1.5%まで加えます。
- 重質鉱物油60mLを500 mLの三角フラスコに移し、鉱油とトリプシン大豆寒天培地(TSA)の両方を121°Cで15分間滅菌した後、オーブンで50°Cで平衡化します。
- 培養物1mLをサンプリングし、OD600を測定します。
- 細胞を3700 g で4°Cで15分間遠心分離して回収します。 細胞を1x Dulbecco's Phosphate-Buffered Saline(DPBS)の4 mLに再懸濁して、OD600 が約30になるようにします。
- 3 mLの細菌懸濁液と、50°Cで予め平衡化した27 mLの溶融TSAを50 mLの遠心チューブで混合します。ボルテックスまたはピペッティングにより迅速に混合します。
- バクテリアと寒天の混合物(30 mL)を60 mLの鉱油に注意深く注ぎ、フラスコを二次容器に入れます。マグネチックスターリングバーを使用して、50°Cに設定されたマグネチックスターラーで混合物を中速(420rpm)で回転するようにすばやく設定します。油と寒天の混合物に目に見える渦が形成されることを確認します。室温(RT)で6分間撹拌します。
- 二次容器に氷を入れて混合物を冷却し、35分間攪拌を続けます。
- 攪拌を止め、寒天ビーズスラリーを20分間休ませます(必要に応じて氷を補充します)。
- スラリー混合物を2本の50 mL遠心分離チューブに移し、1容量のDPBSで10回洗浄して、油分と遊離細菌(最初の5サイクルで3700 g、6分、4°C)を除去します。
- 寒天ビーズ懸濁液を3回目の洗浄で1つのチューブにまとめます。最初の5回の洗浄サイクルでは、血清ピペットを使用してビーズを穏やかに再懸濁します。
- その後の5回の洗浄サイクルでは、2000 g を5分間、続いて1000 g をそれぞれ4分、3分、2分、2分で遠心分離パラメータを使用します。
- 寒天ビーズをDPBSに再懸濁し、最終容量の40 mLまで戻し、125 mLの滅菌ボトルに移し、120 mLのDPBSを加えて4倍に希釈します。
- 懸濁液を200μmのセルストレーナーに通します。
- ストレーナを滅菌済みの50mL遠心分離チューブに取り付けます。次に、ストレーナーにサンプル材料を追加し、ビーズ懸濁液をろ過します。
- ろ過プロセスを容易にするために、セルストレーナー、漏斗、コネクターリング、および50 mLチューブをユニットに組み合わせます。ファンネル、セルストレーナー、コネクターリング、50mLチューブの順にパーツを組み立て、コネクターリングに取り付けた30mLシリンジのピストンをゆっくりと引っ張ります。
- 必要に応じて、ストレーナーを反対側からDPBSですすぎ、残っている大きなビーズを洗い流します。希釈した懸濁液を1000gで2分間回転させるか、ビーズを重力で沈殿させて濃縮します。収穫後、寒天ビーズを4°Cで最大1週間保存します。実験の各バッチには、新鮮な調製が推奨されます。
- ビーズ懸濁液5μLをスライドガラスにピペットで固定し、カバースリップで覆い、10×対物レンズを備えた光学顕微鏡または蛍光顕微鏡を使用して、いくつかのランダムな位置で画像を撮影します。画像を保存し、ImageJ(希望のサイズ範囲:200 ± 50 μm)でビーズ径を測定します。
2. 寒天ビーズ埋設M. abscessus inoculumの滴定
- ビーズ懸濁液1 mLをMチューブに加え、あらかじめ定義されたプログラムRNA.02.01にセットされた解離器を使用して、ビーズに埋め込まれた細菌を無菌的にホモジナイズして遊離させます。
- ホモジネート100μLを100μL取り、1:10〜10〜5 希釈×段階希釈します。10%オレイン酸-アルブミン-デキストロース-カタラーゼ(OADC)と2%グリセロールを添加した7H10寒天上に希釈液を広げます。インキュベーションの3〜5日後にCFUを列挙します。
- 必要に応じて接種力価を調整します。例えば、各マウスが1 × 105 CFUを含むビーズ懸濁液を100 μLのマウスに投与した場合、1 × 106 CFU/mLを含む合計2 mL懸濁液を調製し、シリンジでの損失を考慮するために~25%を加えたものを準備します。
3. シリンジとニードルによるビードディスペンスの試験
注意: 次の手順は、ビーズがシリンジまたは針の表面に付着しないようにするために含まれていました。プラスチック表面への付着によるビーズの損失を防ぐためには、ガラス製シリンジと24Gの金属製供給針を使用することが重要であることがわかりました。
- 1.25 mLの滅菌Tween、80〜500 mLの滅菌PBSを添加してPBSTを調製します。
- 供給針を通過する寒天ビーズの試験のために900μLのPBSTを5つのMチューブに加え、900μLのPBSTを2mLの滅菌チューブに添加して、各プッシュスルーサンプルの-2〜-6希釈液を調製します。
- 以前に調製した寒天ビーズに埋め込まれた M.abscessus をP1000ピペットを使用して混合し、すべてのビーズが均一に分散していることを確認します。
- 24 Gの金属製供給針をガラスシリンジに取り付け、寒天ビーズ懸濁液を吸引し、気泡の形成を防ぎます。
- シリンジが気泡なしでいっぱいになったら、クリップ間にスペースを空けて、シリンジのプランジャーにナイロンクリップまたはストッパーを置きます。ストッパーにより、50-100μLの正確な分注が可能です。プランジャーに沿って最大6つのクリップを取り付けることができます。
- 100 μLのビーズをMチューブにそれぞれの順序で分注(「プッシュスルー」)します。
- 5つのプッシュスルーを採取したら、凍結臓器からのRNA調製に適しており、細胞生存率に影響を与えることなくビーズから M. abscessus を効果的に放出することがわかった、RNA.02.01設定に調整された組織解離器を使用してビーズを均質化します。
- -1 から -6 の範囲のホモジネートに対して段階希釈を行います。OADCを添加した7H11寒天プレートに希釈液をプレートします。5日後にCFUをカウントします。
4. マウスの気管内接種
- 6〜8週齢のCD-1マウスを準備します。
- イソフルランエアロゾル曝露システムを使用して、前述のように1〜5%の流量でマウスを鎮静させる1。
- 3次元(3D)プリントされた傾斜スタンド(カスタム設計および製造)を使用してマウスを拘束します。スタンド中央のロッドには縫合糸が付いており、マウスを切歯で垂直に支え、マウスを頭を上げて腹側横臥位にします。
- 寒天ビーズを埋め込んだガラスシリンジに金属製の24G動物給餌針を取り付けます 。シリンジのプランジャーにナイロンクリップまたはストッパーを取り付けて、各マウスに50μLの接種物を感染させます。
- 鎮静剤を投与したマウスを縫合糸に拘束したら、綿棒アプリケーターを使用して舌を口の横に移動します。
- マウスの口の後ろを視覚化して、口の奥の白い部分を明確に識別し、マウスの気管をターゲットにします。
- 金属製の強制針をマウスの上に垂直に傾け、気管の上部に挿入します。喉頭蓋を通過する際にわずかな抵抗があるかもしれません。
- 強制針を気管にスライドさせ、ナイロンクリップまたはストッパーを取り外し、寒天ビーズを埋め込んだ M.abscessusを50μL分注します。
- マウスを5分間休ませ、手順4.2〜4.8を2回繰り返します。2段階の接種手順の目的は、肺内の全接種物の再現性のある深部沈着を確保することです。
- 感染を24時間進行させた後、マウスを安楽死させて肺に細菌の沈着を列挙します。
結果
ビードサイズと負担
寒天ビーズとその細菌負荷を可視化するために、mCherry赤色蛍光タンパク質をMab型ATCC19977株の構成的Hsp60プロモーターの下で発現させ、上記のようにこの株を寒天ビーズに包埋した。 図1A は、ビーズサイズの範囲を示しています(スケールバー=200μm)。 図1B は、6つの独立したビーズ調製物の負担を示しており、説明した手順の再現性を示しています。
シリンジのプッシュスルーのめっきと気管内接種後の細菌移植
気管内接種は2つのステップで最適化されました。CFU/mL は、ガラスシリンジを通過する前と後に接種物に列挙され、ビーズがシリンジと接続されたチューブを通過するときにビーズや細菌の損失が発生しないようにしました。 表 1 に、2 つの独立したビーズ調製物(試験 1 および 2)の初期細菌力価と、1 回のシリンジ負荷から「プッシュスルー」サンプルの 100 mL あたりに回収された CFU の数を示します。ビーズやバクテリアの損失を避けるために、金属管に接続されたガラスシリンジが必要です。寒天ビーズはプラスチック表面に付着する傾向があります。
ビーズ調製物中の経時的なCFU列挙は、ビーズの細菌負荷が4°Cで1週間安定しており、2週間ごとに細菌負荷が~2倍減少し、肺沈着が損なわれないことを示しました。次に、5〜8匹のマウスのグループに3つの独立したビーズ製剤を感染させ、気管内接種の手順の再現性をテストしました。 表2 は、マウス当たりの肺CFUの数を、記載されているように感染後24時間で列挙したものである。
最後に、感染のオペレーター間の再現性を、それぞれ異なるオペレーターによって行われた10匹のCD-1マウスの3つのグループに感染させることによって評価しました。感染後 24 時間で列挙された肺 CFU を 図 2 に示します。

図1:ビーズサイズを評価し、 M. abscessus の細菌負荷を視覚化および定量化するためのパイロット実験。 (A) M. abscessus ATCC 19977株を含有する寒天ビーズで、構成的hsp60プロモーターの下でmCherry赤色蛍光タンパク質を発現するように操作されたもの。5μlのビーズ懸濁液をスライドガラス上に広げ、カメラ(10倍対物レンズ)を搭載した蛍光顕微鏡でイメージングしました。各赤い点は蛍光性細菌細胞であり、直径が70~250μmの範囲の寒天ビーズで囲まれています。(B)6つの個々のビーズ調製物の細菌負荷(CFU/mL)は、メソッドの再現性を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
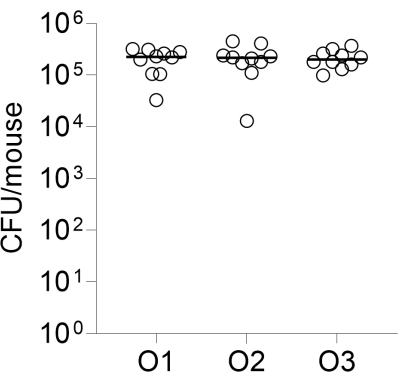
図2:感染のオペレーター間の再現性。 10匹のCD-1雌マウスのグループを、同じビーズ調製物を用いて、記載されたように3人の独立したオペレーターによって気管内に感染させた。感染後 24 時間で列挙された肺 CFU が示されています。O1、O2、O3: 演算子 1、2、3。 この図の拡大版を表示するには、ここをクリックしてください。
| CFU/100 μL | ||
| ビーズの準備 | トライアル 1 | トライアル 2 |
| 1.13E+05 | 2.40E+05 | |
| シリンジプッシュスルーサンプル | ||
| 1 | 1.14E+05 | 5.10 E+05 |
| 2 | 1.36E+05 | 4.10E+05 |
| 3 | 9.30E+04 | 3.90E+05 |
| 4 | 9.80E+04 | 3.60E+05 |
| 5 | 1.14E+05 | |
| 平均 | 1.11E+05 | 4.18E+05 |
| SDの | 1.69E+04 (15%) | 6.50E+04 (16%) |
表1:ガラスシリンジと金属供給針を通過した後の100μLサンプルあたりのコロニー形成単位(CFU)。
| トライアル 1 | トライアル 2 | トライアル3 | |||
| マウス ID | 肺CFU/マウス | マウス ID | 肺CFU/マウス | マウス ID | 肺CFU/マウス |
| M-1 | 6.50E+03 | M-6 | 2.20E+05 | M-11 | 6.80E+04 |
| M-2 | 1.10E+04 | M-7 | 2.70E+05 | M-12 | 1.70E+05 |
| M-3 | 1.40E+04 | M-8 | 8.10E+04 | M-13 | 2.10E+05 |
| M-4 | 3.20E+03 | M-9 | 1.40E+05 | M-14 | 4.40E+04 |
| M-5 | 4.50E+03 | M-10 | 1.30E+05 | M-15 | 7.50E+04 |
| M-16 | 1.01E+05 | ||||
| M-17 | 7.00E+04 | ||||
| M-18 | 5.80E+03 | ||||
| 平均 | 7.84E+03 | 平均 | 1.68E+05 | 平均 | 9.30E+04 |
| SDの | 4.54E+03 (58%) | SDの | 7.57E+04 (45%) | SDの | 6.67E+04 (72%) |
表2:接種後24時間でのマウス肺への寒天ビーズ埋め込み M.abscessus の移植
ディスカッション
寒天ビーズ中の細菌が均一に分布するようにするには、溶融した寒天-細菌混合物を油相に添加する前に均一に懸濁することが重要です。油と寒天の体積比は、ビーズのサイズを制御する上で重要です。油と寒天の比率が高いほど、より小さな寒天ビーズが形成されます。寒天菌懸濁液を油相と混合する場合、温度制御が重要です。油と寒天の混合物は、乳化と液滴の形成を可能にするのに十分なほど暖かくなければなりませんが、バクテリアに害を与えないほど十分に冷たくなければなりません。室温以下に冷却しながら連続的に攪拌すると、寒天液滴が形成されて固化します。
攪拌板の適切な校正、攪拌子のサイズ、フラスコの形状とサイズは、均一な渦の重要な決定要因です。フラスコの中央に配置された攪拌棒は、対称的な渦を作り出し、均一な混合を保証します。攪拌子が中心からずれていると、渦が不安定になり、不規則な形状のビーズが発生し、ビーズに気泡が混入する可能性があります。攪拌子の位置のリアルタイム監視と調整が推奨されます。フラスコの容量は、油と寒天の混合物の容量に比例する必要があります。500 mLフラスコは、90 mLの油-寒天混合物を回転させ、目に見える渦を生成するのに理想的です。大型のフラスコを使用する場合は、油と寒天の混合物の体積、攪拌機のサイズ、渦速度を調整して、効果的な混合と安定した渦のバランスをとることが重要です。プロセス中およびビーズ調製全体で一貫したボルテックス速度を維持することは、バッチ間の再現性にとって重要です。
寒天ビーズの調製プロセス、特にボルテックス速度と油-寒天比は、16,22からわずかな変更を加えて適応されます。回転する渦内のせん断力は、本質的に異なるサイズのビーズを生成します。このサイズのばらつきを最小限に抑えるために、ビーズの回収ステップは、いくつかの洗浄ステップを導入することによって変更され、遠心分離の速度と時間を減らす勾配を採用して、小さなサイズのビーズ(および遊離細菌)の除去を確実にしました。マイクロメッシュフィルターを使用して、目的のサイズのビーズを濃縮し、より大きなビーズとランダムな合体によって形成された可能性のあるビーズを効果的にフィルタリングしました。マウスの気管内接種のためにビーズスラリーがシリンジと接続されたチューブを通過するときにビーズや細菌の損失を避けるためには、ガラスシリンジ、24G金属供給針、および金属接続チューブを使用することが重要です。
この方法の主な制限は、再現性のあるビーズ負荷と肺移植を達成するためのビーズ調製と気管内接種の技術的な複雑さです。細部への注意とトラブルシューティングの能力が必要です。さらに、このモデルは、標準治療の抗生物質とMab患者に投与される最も頻繁な抗生物質の組み合わせの有効性をテストすることにより、完全に検証されていません。
現在、慢性マブ感染症のマウスモデルは、モデル9で患者における単剤および薬剤の組み合わせの有効性を合理的に予測できるほどには検証されていません。寒天ビーズ包埋C57BL/6マウスシステムは、抗菌治療の有効性をテストするために利用されています15,19,23。寒天ビーズ包埋C57BL/6マウスシステムに最も近い代替手段は、デキサメタゾン免疫抑制に依存して持続的な慢性感染を達成するC3HeB/FeJマウスモデルです24,25。ここに記載されているプロトコルの利点は、(i)完全に免疫適格で最も手頃な価格のC57BL/6マウスを使用できること、(ii)十分に特徴付けられたタイプのATCC 19977株で生産的で慢性的な感染を得ることができること、および(iii)化学的に誘導された免疫抑制要件がなく、毎日のデキサメタゾン注射の必要性を回避し、それにより潜在的な薬物間相互作用および肺免疫病理への影響を回避することである。
新薬候補や薬剤レジメンを評価するための慢性マブ感染症の検証済みマウスモデルが不足していることを考えると8,9、ここで説明する技術は、この分野を前進させ、前臨床有効性データの予測値を改善し、持続的な治癒を提供する可能性が最も高い薬剤レジメンの優先順位付けを支援し、マブ肺疾患の創薬と開発を全体的に加速する可能性を秘めています。この方法は他の肺病原体にも適用でき、緑膿菌やインフルエンザ菌に対して確立された実績があります。ここで説明するプロトコルの主な目的は、実装の容易さと優れたラボ間の再現性を確保するために、十分な詳細と推奨事項を提供することです。
開示事項
著者は、利益相反がないことを宣言します
謝辞
この研究は、嚢胞性線維症財団、賞DICK24XX0、TDおよびVDに、およびNIH-NIAIDからTDおよびVDにR01-AI132374が資金提供されました。
資料
| Name | Company | Catalog Number | Comments |
| 125-mL bottle | Corning | 8388 | Sterile |
| 3 x 3 Tube Holding Rack | Fisher | 5972-0030PK | Disinfected prior to use |
| 3D Printed Mouse Stand | Transworld Marketing | custom designed and produced | Disinfected prior to use |
| 48-well dilution Plate | Celltreat | 229192 | Sterile |
| 50-mL centrifuge tubes | Greiner Bio-One | 227261 | Sterile |
| Anesethia Machine | E-Z Systems | EZ-AF9000 SYSTEM | n/a |
| Avanti J-15R | Beckman Coulter | B99517 | Centrifuge |
| Barrier Pipette Tips in Lift-off Lid Rack 1000G | Thermo Scientific ART | 21-236-2A | Sterile |
| Biohazard bag | Fisherbrand | 22-044561 | |
| Connector Ring | pluriSelect | 41-50000-03 | |
| Cotton-Tipped Applicators | Puritan | 22-029-571 | Sterile |
| Disposable Inoculation Loops Yellow Sterile 100 in ziplock bag | Cole-Parmer Essentials | 03-391-562 | Sterile |
| Disposable Poly-Lined Towel Drape | Dynarex | 19-310-671 | Sterile |
| Dulbecco's Phosphate-Buffered Saline | Thomas Scientific | 21-031-CM | Sterile |
| Funnel | pluriSelect | 42-50000 | Sterile |
| GE Ultrospec 10 | Sigma-Aldrich | GE80211630 | Spectrophotometer |
| Gentlemacs Tissue Dissociator | Miltenyi Biotec | 130-096-427 | Not heat activated |
| Hamilton Syringe | Hamilton | 80801 | Disinfected prior to use |
| Heavy Mineral Oil | Sigma-Aldrich | 330760-1L | Sterile |
| Isoflurane solution 250 ml bottle | Covetrus | 29405 | Skin Corrosion/Irritation: Category 2, Serious Eye Damage/Eye Irritation: Category 2A, Specific target organ systemic toxicity (single exposure): Category 3 May cause drowsiness and dizziness, Causes serious eye irritation, Causes skin irritation. Do not inhale, use in well ventilated area. |
| M Tubes (gentleMACS) | Miltenyi Biotec | 130-096-335 | Sterile |
| Magnetic stirrer MR Hei-Connect | Heidolph | 505-40000-13-1 | |
| Magnetic stirring bar | Thomas Scientific | 1181L08 | Sterile |
| Mechanical Pipet 100–1000 µL | Gilson PIPETMAN L | FA10006M | Disinfected prior to use |
| Mechanical Pipet 20–200 µL | Gilson PIPETMAN L | FA10003MG | Disinfected prior to use |
| Metal Animal Feeding Needle 24 G | Braintree Scientific | N-VP 24G-1S | Must be sterilized (autoclaved) |
| Middlebrook 7H10 Agar | Sigma-Aldrich | M0303-500G | Sterilized (autoclaved) |
| Middlebrook 7H11 Agar | Thermo Fisher | R4554002 | Sterilized (autoclaved) |
| Middlebrook 7H9 medium | Beckton Dickinson | 271310 | Sterilized (autoclaved) |
| Mouse Stand Parts | TriMech Solutions | SRV-AMS-FDM | Disinfected prior to use |
| Nonabsorbable Silk Suture | Fisher Scientific | 18020-50 | n/a |
| OADC Liquid Enrichment for use with Middlebrook Media 500 ml | Thermo Scientific Remel | R450605 | Sterile |
| PBS (10x), pH 7.4 Sterile Filtered 500 mL | Gibco | 70-011-044 | Sterile |
| Peroxiguard Wipes | Peroxigard | 29221 | n/a |
| Petri Dishes with Clear Lid Round 100mmx 15mm | Fisherbrand | FB0875712 | Sterile |
| PluriStrainer 200 mm | pluriSelect | 43-50200-03 | Sterile; cell strainer |
| Roller bottles | Corning | 430165 | Sterile |
| Serological pipette | Corning | 4489 | Sterile |
| Spectrophotometer cuvettes 1.5 mL | Fisher Scientific | 14955127 | Sterilized (autoclaved) |
| Syringe stoppers or clips (nylon) | Trimech | SRV-AMS-MJF | Disinfected prior to use |
| Tryptic Soy Broth | Sigma-Aldrich | T8907-500G | Sterile |
| Tween 80 | Fisher | 170793 | Filter sterilized |
| Wide Bore Filtered Pipette Tips Lift-off Lid Rack 200G | Thermo Scientific ART | 21-236-1A | Sterile |
参考文献
- Dartois, V., Dick, T. Drug development challenges in nontuberculous mycobacterial lung disease: Tb to the rescue. J Exp Med. 219 (6), e20220445(2022).
- Martiniano, S. L., Nick, J. A., Daley, C. L. Nontuberculous mycobacterial infections in cystic fibrosis. Clin Chest Med. 43 (4), 697-716 (2022).
- Maurer, F. P., et al. Lack of antimicrobial bactericidal activity in mycobacterium abscessus. Antimicrob Agents Chemother. 58 (7), 3828-3836 (2014).
- Wu, M. L., Aziz, D. B., Dartois, V., Dick, T. Ntm drug discovery: Status, gaps and the way forward. Drug Discov Today. 23 (8), 1502-1519 (2018).
- Egorova, A., Jackson, M., Gavrilyuk, V., Makarov, V. Pipeline of anti-mycobacterium abscessus small molecules: Repurposable drugs and promising novel chemical entities. Med Res Rev. 41 (4), 2350-2387 (2021).
- Nuermberger, E. Using animal models to develop new treatments for tuberculosis. Semin Respir Crit Care Med. 29 (5), 542-551 (2008).
- Nuermberger, E. L. Preclinical efficacy testing of new drug candidates. Microbiol Spectr. 5 (3), (2017).
- Nicola, F., Cirillo, D. M., Lore, N. I. Preclinical murine models to study lung infection with mycobacterium abscessus complex. Tuberculosis (Edinb). 138, 102301(2023).
- Dartois, V., et al. Preclinical murine models for the testing of antimicrobials against mycobacterium abscessus pulmonary infections: Current practices and recommendations. Tuberculosis (Edinb). 147, 102503(2024).
- Obregon-Henao, A., et al. Susceptibility of mycobacterium abscessus to antimycobacterial drugs in preclinical models. Antimicrob Agents Chemother. 59 (11), 6904-6912 (2015).
- Lerat, I., et al. In vivo evaluation of antibiotic activity against mycobacterium abscessus. J Infect Dis. 209 (6), 905-912 (2014).
- Saliu, F., et al. Chronic infection by nontypeable haemophilus influenzae fuels airway inflammation. ERJ Open Res. 7 (1), (2021).
- Rodgers, A. M., et al. Biologically relevant murine models of chronic pseudomonas aeruginosa respiratory infection. Pathogens. 12 (8), 1053(2023).
- Hoover, J. L., et al. A robust pneumonia model in immunocompetent rodents to evaluate antibacterial efficacy against s. Pneumoniae, h. Influenzae, k. Pneumoniae, p. Aeruginosa or a. Baumannii. J Vis Exp. (119), e55068(2017).
- Lore, N. I., et al. The aminoglycoside-modifying enzyme eis2 represents a new potential in vivo target for reducing antimicrobial drug resistance in mycobacterium abscessus complex. Eur Respir J. 60 (6), 2201541(2022).
- Riva, C., et al. A new model of chronic mycobacterium abscessus lung infection in immunocompetent mice. Int J Mol Sci. 21 (18), 6590(2020).
- Chang, V., Phillips, P. P. J., Imperial, M. Z., Nahid, P., Savic, R. M. A comparison of clinical development pathways to advance tuberculosis regimen development. BMC Infect Dis. 22 (1), 920(2022).
- Yang, S. J., et al. Pathological granuloma fibrosis induced by agar-embedded mycobacterium abscessus in c57bl/6jnarl mice. Front Immunol. 14, 1277745(2023).
- Poerio, N., et al. Combined host- and pathogen-directed therapy for the control of mycobacterium abscessus infection. Microbiol Spectr. 10 (1), e0254621(2022).
- Pearce, C., et al. Inhaled tigecycline is effective against mycobacterium abscessus in vitro and in vivo. J Antimicrob Chemother. 75 (7), 1889-1894 (2020).
- De Groote, M. A., et al. Gm-csf knockout mice for preclinical testing of agents with antimicrobial activity against mycobacterium abscessus. J Antimicrob Chemother. 69 (4), 1057-1064 (2014).
- Facchini, M., De Fino, I., Riva, C., Bragonzi, A. Long term chronic pseudomonas aeruginosa airway infection in mice. J Vis Exp. (85), e51019(2014).
- Degiacomi, G., et al. The novel drug candidate vomg kills mycobacterium abscessus and other pathogens by inhibiting cell division. Int J Antimicrob Agents. 64 (4), 107278(2024).
- Rimal, B., et al. T405, a new penem, exhibits in vivo efficacy against m. Abscessus and synergy with beta-lactams imipenem and cefditoren. Antimicrob Agents Chemother. 66 (6), e0053622(2022).
- Maggioncalda, E. C., Story-Roller, E., Ammerman, N. C., Nuermberger, E. L., Lamichhane, G. Progressive mycobacterium abscessus lung infection in c3heb/fej mice associated with corticosteroid administration. bioRxiv. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved