Method Article
Préparation de Mycobacterium abscessus enrobé de perle de gélose pour inoculer des souris immunocompétentes par voie intratrachéale
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Les souris sont généralement résistantes aux infections par Mycobacterium abscessus, ce qui complique la découverte et le développement d’antibiotiques indispensables contre les infections pulmonaires. Ici, nous décrivons une méthode de préparation d’inoculum et d’infection intratrachéale qui s’est avérée entraîner une infection durable chez les souris immunocompétentes.
Résumé
Des modèles murins robustes d’infection chronique à Mycobacterium abscessus, un agent pathogène environnemental qui infecte de préférence les poumons, sont absolument nécessaires. Les polythérapies d’un an permettent d’obtenir des taux de guérison inacceptablement faibles chez les patients, environ 50 %, d’où la nécessité d’outils précliniques prédictifs pour développer de meilleurs antibiotiques. Cependant, les souris immunocompétentes sont généralement résistantes à l’infection pulmonaire par M. abscessus. De nombreuses tentatives d’établissement d’une infection soutenue par M. abscessus chez des souris immunocompétentes ont été signalées dans la littérature. Parmi celles-ci, les méthodes reposant sur des bactéries enrobées de billes de gélose inoculées à des souris C57BL/6 par voie intratrachéale se sont avérées les plus prometteuses. La principale limite de cette approche est le défi technique associé à la préparation de billes de gélose de taille et de nombre bactérien reproductibles, suivie d’une inoculation intratrachéale. Ici, nous fournissons d’abord une description détaillée d’un protocole optimisé qui délivre des billes de gélose chargées de M. abscessus de diamètre optimal et de charge bactérienne reproductible. Ensuite, nous fournissons un protocole détaillé d’inoculation intratrachéale, optimisé pour éviter les pertes de billes et de bactéries dues à l’adhérence aux surfaces des dispositifs d’inoculation et pour obtenir un dépôt pulmonaire reproductible de M. abscessus inclus dans la gélose. L’objectif est d’assurer une facilité de mise en œuvre et une excellente reproductibilité d’un laboratoire à l’autre.
Introduction
Les options de traitement de la maladie pulmonaire à Mycobacterium abscessus (Mab) sont limitées et impliquent des schémas thérapeutiques multiples d’un an avec des antibiotiques oraux, parentéraux et occasionnellement inhalés, dont la plupart n’ont pas d’activité bactéricide optimale et sont associés à une toxicité significative 1,2,3,4,5 . Des traitements plus courts, plus sûrs et plus efficaces sont nécessaires de toute urgence. Des modèles murins d’infections mycobactériennes ont joué un rôle déterminant dans la découverte et l’optimisation de médicaments et de schémas thérapeutiques efficaces 6,7. Cependant, l’évaluation préclinique des antibiotiques contre les infections à Mab s’est avérée difficile en raison de la difficulté d’établir des infections pulmonaires progressives et durables chez la souris 8,9.
L’infection de souches de souris immunocompétentes par des anticorps monoclonaux entraîne en grande partie une colonisation transitoire suivie d’une élimination rapide de l’agent pathogène10,11. Pour obtenir une infection chronique telle qu’observée cliniquement, des agents immobilisants tels que l’agarose ou la gélose ont été utilisés pour favoriser la persistance et les réponses immunopathologiques à des agents pathogènes opportunistes tels que Pseudomonas aeruginosa ou Haemophilus influenza chez des souris immunocompétentes 12,13,14. Ce modèle a récemment été adapté pour réaliser une infection respiratoire chronique par Mab ATCC 19977 chez des souris immunocompétentes C57BL/6N 15,16,17,18. La méthode a induit une infection persistante jusqu’à 45 jours après l’inoculation intratrachéale avec ~1 × 104 à 1 × 106 unités formant colonies (UFC), avec une incidence d’infection chronique chez les souris infectées de 90 % à 100 %19 et la formation de granulomes organisés autour de la bille de gélose en désintégration18. Il semble que l’incorporation de Mab dans les billes protège de l’élimination rapide par le système immunitaire inné et que les billes chargées de bactéries constituent des foyers pour le recrutement des cellules immunitaires conduisant à la formation de granulomes et à l’établissement d’une infection chronique18. Les billes d’agar-agarose constituent un biomatériau relativement inerte qui induit des réponses inflammatoires minimales. De plus, les billes se désintègrent lentement, évitant ainsi les problèmes de réactions allergiques aux corps étrangers ou de fibrose induite. L’infection intratrachéale avec ou sans dispositif de micropulvérisation assure un dépôt efficace de l’inoculum dans les poumons 8,20,21 et reproduit l’exposition clinique et l’infection mieux que l’inoculation intraveineuse ou intranasale.
Le modèle offre donc de nombreux avantages. Cependant, il s’accompagne également de quelques défis de nature technique, à savoir (i) obtenir une taille de bille reproductible, (ii) obtenir une charge bactérienne de bille reproductible et (iii) assurer une administration intratrachéale cohérente de l’inoculum. Ici, nous fournissons des protocoles détaillés pour atteindre ces objectifs de manière fiable et assurer la reproductibilité d’un laboratoire à l’autre.
Protocole
Toutes les études sur les animaux ont été réalisées conformément au Guide pour le soin et l’utilisation des animaux de laboratoire des National Institutes of Health, avec l’approbation du Comité institutionnel de soin et d’utilisation des animaux du NIAID (NIH), Bethesda, MD. Toutes les procédures ont été approuvées par le Comité institutionnel de protection et d’utilisation des animaux. Toutes les études portant sur M. abscessus ont été réalisées dans un laboratoire de niveau de confinement de biosécurité 2.
1. Préparation de l’inoculum de M. abscessus incrusté dans la gélose
- Préparez une pré-culture de M. abscessus ATCC 19977 en inoculant 1,5 mL de densité optique (OD600) 1 culture (à l’aide d’un spectrophotomètre) dans 200 mL de milieu Middlebrook 7H9 complété par 0,05 % (v/v) de Tween 80, 0,5 % (v/v) de glycérol et 10 % (v/v) d’enrichissement en albumine-dextrose-catalase (ADC).
- Incuber les cultures dans un flacon rouleau à 37 °C pendant 24 h jusqu’à ce qu’elles atteignent la phase mi-log (DO600 = 0,4-0,6).
- Mettre en suspension 1,2 g de bouillon de soja tryptique (BST) dans 40 ml d’eau ultrapure et ajouter 0,6 g de gélose Difco à une concentration finale de 1,5 %.
- Transférez 60 ml d’huile minérale lourde dans un erlenmeyer de 500 ml et stérilisez l’huile minérale et la gélose tryptique de soja (TSA) à 121 °C pendant 15 min, puis équilibrez à 50 °C dans un four.
- Prélever 1 mL de la culture et mesurer la DO600.
- Récolter les cellules par centrifugation à 3700 g pendant 15 min à 4 °C. Remettre les cellules en suspension dans 4 mL de 1 solution saline tamponnée au phosphate de Dulbecco (DPBS) pour atteindre une DO600 d’environ 30.
- Mélanger 3 mL de suspension bactérienne avec 27 mL de TSA fondu pré-équilibré à 50 °C dans un tube à centrifuger de 50 mL. Mélanger rapidement par vortex ou pipetage.
- Versez délicatement le mélange bactérien-gélose (30 ml) dans 60 ml d’huile minérale et placez le ballon dans un récipient secondaire. Réglez rapidement le mélange pour qu’il tourne à vitesse moyenne (420 tr/min) sur un agitateur magnétique réglé à 50 °C, à l’aide d’une barre d’agitation magnétique. Assurez-vous qu’un vortex visible se forme dans le mélange huile-gélose. Remuez pendant 6 min à température ambiante (RT).
- Refroidissez le mélange en plaçant de la glace dans le récipient secondaire et continuez à remuer pendant 35 min.
- Arrêtez de remuer et laissez reposer la bouillie de perles d’agar-bémol pendant 20 min (remplissez la glace si nécessaire).
- Transférez le mélange de boue dans deux tubes à centrifuger de 50 mL et lavez-le 10 fois avec un volume de DPBS pour éliminer l’huile et les bactéries libres (3700 g, 6 min, 4 °C, pour les 5 premiers cycles).
- Combinez les suspensions de billes d’agar dans un seul tube au troisième lavage. Pendant les 5 premiers cycles de lavage, utilisez une pipette sérologique pour remettre doucement les billes en suspension.
- Pour les 5 cycles de lavage suivants, utilisez les paramètres de centrifugation suivants : 2000 g pendant 5 min, suivis de 1000 g pendant 4, 3, 2 et 2 min, respectivement.
- Remettre les billes de gélose en suspension dans le DPBS jusqu’à un volume final de 40 ml, transférer dans une bouteille stérile de 125 ml et diluer 4 fois en ajoutant 120 ml de DPBS.
- Passez la suspension dans une crépine de 200 μm.
- Fixez la passoire à un tube à centrifuger stérile de 50 ml. Ensuite, ajoutez l’échantillon de matériau sur la crépine et filtrez la suspension de bille.
- Pour faciliter le processus de filtration, combinez une crépine à cellules, un entonnoir, un anneau de connexion et un tube de 50 ml dans une unité. Assemblez les pièces dans l’ordre de l’entonnoir, de la crépine de cellule, de l’anneau de connexion et du tube de 50 ml, et tirez lentement le piston d’une seringue de 30 ml fixée à l’anneau de connexion.
- Si nécessaire, rincez la passoire du côté opposé avec du DPBS pour éliminer les grosses billes retenues. Concentrez la suspension diluée en tournant à 1000 g pendant 2 min ou en laissant les billes se déposer par gravité. Après la récolte, conservez les billes de gélose à 4 °C jusqu’à 1 semaine. Une préparation fraîche est recommandée pour chaque lot d’expériences.
- Pipetez 5 μL de la suspension de la bille sur une lame de verre, couvrez-la d’une lamelle et prenez des images à quelques positions aléatoires à l’aide d’un microscope à lumière ou à fluorescence avec une lentille d’objectif de 10×. Enregistrez les images et mesurez le diamètre du cordon avec ImageJ (plage de taille souhaitée : 200 ± 50 μm).
2. Titrage de l’inoculum de M. abscessus incrusté dans une perle de gélose
- Ajouter 1 mL de suspension de billes dans un tube M et homogénéiser de manière aseptique pour libérer les bactéries incrustées dans les billes à l’aide d’un dissociateur réglé sur le programme prédéfini RNA.02.01.
- Prélever 100 μL de l’homogénat et diluer en série 1:10 à 1 × dilution 10-5 . Répartir les dilutions sur de la gélose 7H10 complétée par 10 % d’acide oléique-albumine-dextrose-catalase (OADC) et 2 % de glycérol. Dénombrer l’UFC après 3 à 5 jours d’incubation.
- Ajustez le titre d’inoculum au besoin. Par exemple, si chaque souris reçoit 100 μL de suspension de billes contenant 1 × 105 UFC pour 10 souris, un total de 2 ml de suspension contenant 1 × 106 UFC/ml est préparé plus ~25 % pour tenir compte des pertes dans les seringues.
3. Test de distribution des billes à travers la seringue et l’aiguille
REMARQUE : Les étapes suivantes ont été incluses pour s’assurer que les billes n’adhèrent pas aux surfaces de la seringue ou de l’aiguille. Il a été constaté qu’il est important d’utiliser une seringue en verre et une aiguille d’alimentation en métal de 24 G pour éviter la perte de billes due à l’adhérence aux surfaces en plastique.
- Préparez le PBST en ajoutant 1,25 mL de Tween stérile 80 à 500 mL de PBS stérile.
- Ajouter 900 μL de PBST dans cinq tubes M pour tester les billes de gélose passant à travers l’aiguille d’alimentation, ainsi que 900 μL de PBST dans des tubes stériles de 2 mL pour préparer -2 à -6 dilutions de chaque échantillon à poussée.
- Mélangez les billes de gélose incrustées de M. abscessus préparées précédemment à l’aide d’une pipette P1000 pour vous assurer que toutes les billes sont uniformément dispersées.
- Fixez une aiguille d’alimentation métallique de 24 G à la seringue en verre et aspirez la suspension de la bille de gélose en veillant à éviter la formation de bulles d’air.
- Une fois que la seringue est pleine sans bulles d’air, placez des clips ou des bouchons en nylon sur le piston de la seringue, sans espace entre les clips. Les bouchons permettent une distribution précise de 50 à 100 μL. Il est possible de monter jusqu’à 6 clips le long du piston.
- Versez 100 μL de billes (« push-through ») dans les tubes M dans leur ordre respectif.
- Une fois que 5 poussées ont été prélevées, homogénéiser les billes à l’aide du dissociateur tissulaire ajusté au réglage RNA.02.01, adéquat pour la préparation d’ARN à partir d’organes congelés et qui s’est avéré libérer efficacement M. abscessus des billes sans affecter la viabilité cellulaire.
- Effectuer une dilution en série pour les homogénats dans la plage de -1 à -6. Plaquez les dilutions sur des plaques de gélose 7H11 complétées par de l’OADC. Comptez les UFC après 5 jours.
4. Inoculation intratrachéale de souris
- Préparez des souris CD-1 âgées de 6 à 8 semaines.
- Sédatez les souris à l’aide d’un système d’exposition aux aérosols d’isoflurane, à un débit de 1 à 5 %, comme décrit précédemment1.
- Retenez les souris à l’aide d’un support incliné imprimé en trois dimensions (3D) (conçu et produit sur mesure). La tige au centre du support a un cordon de suture qui maintient la souris verticalement par ses incisives, plaçant la souris en position couchée ventrale avec la tête relevée.
- Fixez une aiguille d’alimentation animale en métal de 24 g à une seringue en verre remplie de perles de gélose incrustées de M. abscessus. Placez des clips ou des bouchons en nylon sur le piston de la seringue pour infecter chaque souris avec 50 μL d’inoculum.
- Une fois que la souris sous sédation est retenue sur la piqûre de suture, déplacez la langue sur le côté de la bouche à l’aide d’un coton-tige.
- Visualisez l’arrière de la bouche de la souris pour identifier clairement la section blanche à l’arrière de la bouche et ciblez la trachée de la souris.
- Inclinez l’aiguille de gavage métallique verticalement au-dessus de la souris et insérez-la en haut de la trachée. Il peut y avoir une légère résistance lors du passage à travers l’épiglotte.
- Faites glisser l’aiguille de gavage dans la trachée, retirez l’agrafe ou le bouchon en nylon et distribuez 50 μL de M. abscessus incrusté de perle de gélose.
- Laissez la souris reposer pendant 5 minutes et répétez les étapes 4.2 à 4.8 une deuxième fois. Le but d’une procédure d’inoculation en deux étapes est d’assurer un dépôt reproductible et profond de l’inoculum complet dans le poumon.
- Laissez l’infection progresser pendant 24 heures, après quoi la souris est euthanasiée pour énumérer le dépôt bactérien dans les poumons.
Résultats
Taille et charge des billes
Pour visualiser les billes de gélose et leur charge bactérienne, la protéine fluorescente rouge mCherry a été exprimée sous le promoteur constitutif Hsp60 dans la souche de type Mab ATCC 19977 et a intégré cette souche dans des billes de gélose comme décrit ci-dessus. La figure 1A montre la gamme de taille des billes (barre d’échelle = 200 μm). La figure 1B montre la charge de 6 préparations de billes indépendantes, démontrant la reproductibilité de la procédure telle que décrite.
Placage de poussée de seringue et implantation bactérienne après inoculation intratrachéale
L’inoculation intratrachéale a été optimisée en deux étapes. Les UFC/mL ont été dénombrées dans l’inoculum avant et après le passage dans la seringue en verre afin de s’assurer qu’aucune perte de billes ou de bactéries n’était subie lors du passage des billes dans la seringue et le tube connecté. Le tableau 1 montre le titre bactérien initial de deux préparations de billes indépendantes (essais 1 et 2) et le nombre d’UFC récupérées par 100 mL d’échantillons « poussés » à partir d’une seule charge de seringue. Pour éviter les pertes de billes et de bactéries, une seringue en verre reliée à un tube métallique est nécessaire. Les billes d’agar ont tendance à adhérer aux surfaces en plastique.
Le dénombrement de l’UFC au fil du temps dans la préparation des billes a montré que la charge bactérienne des billes est restée stable à 4 °C pendant 1 semaine, avec une perte de ~2 fois la charge bactérienne par 2 semaines et un dépôt pulmonaire non altéré. Ensuite, des groupes de 5 à 8 souris ont été infectés avec trois préparations de billes indépendantes pour tester la reproductibilité de la procédure d’inoculation intratrachéale. Le tableau 2 montre le nombre d’UFC pulmonaires par souris, dénombré 24 heures après l’infection, comme décrit.
Enfin, la reproductibilité inter-opérateurs de l’infection a été évaluée en infectant trois groupes de 10 souris CD-1, chacun effectué par un opérateur différent. Les UFC pulmonaires dénombrées 24 h après l’infection sont illustrées à la figure 2.

Figure 1 : Expérience pilote pour évaluer la taille des billes, visualiser et quantifier la charge bactérienne de M. abscessus. (A) Perles d’agar contenant la souche ATCC 19977 de M. abscessus, modifiées pour exprimer la protéine fluorescente rouge mCherry sous le promoteur constitutif hsp60. Cinq μl de suspension de billes ont été étalés sur une lame de verre et imagés à l’aide d’un microscope à fluorescence équipé d’une caméra (objectif 10x). Chaque point rouge est une cellule bactérienne fluorescente, enfermée dans des billes de gélose d’un diamètre variant de ~70 à 250 μm. (B) Charge bactérienne, en UFC/mL, de 6 préparations de billes individuelles montrant la reproductibilité de la méthode. Veuillez cliquer ici pour voir une version agrandie de cette figure.
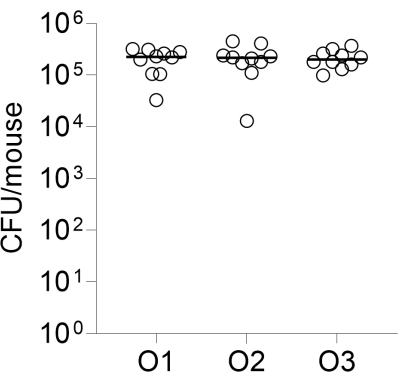
Figure 2 : Reproductibilité inter-opérateurs de l’infection. Des groupes de 10 souris femelles CD-1 ont été infectés par voie intratrachéale par trois opérateurs indépendants comme décrit, en utilisant la même préparation de billes. Les UFC pulmonaires dénombrées 24 h après l’infection sont présentées. O1, O2, O3 : opérateurs 1, 2 et 3. Veuillez cliquer ici pour voir une version agrandie de cette figure.
| UFC/100 μL | ||
| Préparation des billes | Essai 1 | Essai 2 |
| 1.13E+05 | 2.40E+05 | |
| Échantillon de seringue à pression | ||
| 1 | 1.14E+05 | 5.10E+05 |
| 2 | 1.36E+05 | 4.10E+05 |
| 3 | 9.30E+04 | 3,90 E+05 |
| 4 | 9.80E+04 | 3,60 E+05 |
| 5 | 1.14E+05 | |
| Moyenne | 1.11E+05 | 4.18E+05 |
| SD | 1,69E+04 (15 %) | 6,50E+04 (16 %) |
Tableau 1 : Unités formant colonies (UFC) par échantillon de 100 μL après passage à travers la seringue en verre et l’aiguille d’alimentation métallique.
| Essai 1 | Essai 2 | Essai 3 | |||
| ID de souris | UFC pulmonaire/souris | ID de souris | UFC pulmonaire/souris | ID de souris | UFC pulmonaire/souris |
| M-1 | 6.50E+03 | M-6 | 2.20E+05 | M-11 | 6.80E+04 |
| M-2 | 1.10E+04 | M-7 | 2.70E+05 | M-12 | 1.70E+05 |
| M-3 | 1.40E+04 | M-8 | 8.10E+04 | M-13 | 2.10E+05 |
| M-4 | 3,20 E+03 | M-9 | 1.40E+05 | M-14 | 4.40E+04 |
| M-5 | 4.50E+03 | M-10 | 1.30E+05 | M-15 | 7.50E+04 |
| M-16 | 1.01E+05 | ||||
| M-17 | 7.00E+04 | ||||
| M-18 | 5.80E+03 | ||||
| Moyenne | 7.84E+03 | Moyenne | 1.68E+05 | Moyenne | 9.30E+04 |
| SD | 4,54E+03 (58 %) | SD | 7,57E+04 (45 %) | SD | 6,67E+04 (72 %) |
Tableau 2 : Implantation de M. abscessus incrusté de gélose dans les poumons de souris 24h après l’inoculation
Discussion
Pour assurer la répartition uniforme des bactéries dans les billes de gélose, il est important de suspendre uniformément le mélange agar-bactéries fondu avant de l’ajouter à la phase huileuse. Le rapport volumique huile/gélose-bactérie est essentiel pour contrôler la taille des billes. Un rapport huile/gélose plus élevé conduit à la formation de billes de gélose plus petites. Lors du mélange de la suspension d’agar-bactéries avec la phase huileuse, le contrôle de la température est essentiel. Le mélange huile-gélose doit être suffisamment chaud pour permettre l’émulsification et la formation de gouttelettes, mais suffisamment froid pour ne pas nuire aux bactéries. L’agitation continue tout en refroidissant le mélange à température ambiante ou inférieure permet aux gouttelettes d’agar de se former et de se solidifier.
Un bon calibrage de la plaque d’agitation, la taille de la barre d’agitation, ainsi que la forme et la taille du ballon sont des déterminants importants d’un vortex uniforme. Une barre d’agitation positionnée au centre du ballon crée un vortex symétrique, assurant un mélange uniforme. Une barre d’agitation décentrée peut entraîner un vortex instable, entraînant des billes de forme irrégulière et l’introduction de bulles d’air dans les billes. Il est recommandé de surveiller et d’ajuster en temps réel la position de la barre d’agitation. Le volume de la fiole doit être proportionnel au volume du mélange huile-gélose. Une fiole de 500 mL est idéale pour faire tourner un mélange d’huile et de gélose de 90 mL, produisant un vortex visible. Lors de l’utilisation de flacons plus grands, il est important d’ajuster le volume du mélange huile-agar, la taille de l’agitateur et la vitesse de vortex pour obtenir un équilibre entre un mélange efficace et un vortex stable. Le maintien d’une vitesse de vortex constante pendant le processus et entre les préparations de cordons est essentiel pour la reproductibilité d’un lot à l’autre.
Le processus de préparation des billes d’agar, en particulier la vitesse de vortex et le rapport huile-agar, sont adaptés de16,22, avec des modifications mineures. Les forces de cisaillement à l’intérieur du vortex en rotation produisent intrinsèquement des billes de différentes tailles. Pour minimiser cette variabilité de taille, l’étape de récolte des billes a été modifiée en introduisant plusieurs étapes de lavage, en utilisant un gradient de vitesse et de temps de centrifugation décroissants pour assurer l’élimination des billes de petite taille (et des bactéries libres). Un filtre à micro-mailles a été utilisé pour enrichir les billes de la taille souhaitée, filtrant efficacement les perles plus grosses et celles qui peuvent s’être formées par coalescence aléatoire. Pour éviter les pertes de billes ou de bactéries lors du passage de la boue de billes à travers la seringue et le tube connecté pour l’inoculation intratrachéale de la souris, il est essentiel d’utiliser une seringue en verre, des aiguilles d’alimentation métalliques de 24 G et un tube connecté en métal.
La principale limitation de la méthode est la complexité technique de la préparation des billes et de l’inoculation intratrachéale pour obtenir une charge de billes reproductible et une implantation pulmonaire. Le souci du détail et la capacité de dépanner sont requis. De plus, le modèle n’a pas été entièrement validé par les tests d’efficacité des antibiotiques standard et des combinaisons d’antibiotiques les plus fréquemment administrées aux patients atteints de Mab.
À l’heure actuelle, aucun modèle murin d’infection chronique à Mab n’a été validé dans la mesure où l’efficacité d’agents uniques et de combinaisons de médicaments chez les patients peut être raisonnablement prédite par le modèle9. Le système de souris C57BL/6 intégré dans une bille de gélose a été exploité pour tester l’efficacité des traitements antimicrobiens 15,19,23. L’alternative la plus proche du système murin C57BL/6 intégré à la gélose est le modèle murin C3HeB/FeJ, qui repose sur l’immunosuppression de la dexaméthasone pour obtenir une infection chronique durable24,25. Les avantages du protocole décrit ici sont les suivants : (i) il est possible d’utiliser des souris C57BL/6 entièrement immunocompétentes et les plus abordables, (ii) d’obtenir une infection productive et chronique avec la souche type bien caractérisée ATCC 19977, et (iii) il n’y a pas d’exigence d’immunosuppression induite chimiquement, ce qui permet d’éviter la nécessité d’injections quotidiennes de dexaméthasone, évitant ainsi les interactions médicamenteuses potentielles et l’impact sur l’immunopathologie pulmonaire.
Étant donné l’absence de modèles murins validés d’infection chronique à Mabpour évaluer de nouveaux candidats médicaments et régimes médicamenteux 8,9, la technique décrite ici a le potentiel de faire avancer le domaine, d’améliorer la valeur prédictive des données d’efficacité précliniques, d’aider à prioriser les schémas thérapeutiques ayant le plus fort potentiel de fournir un traitement durable et, dans l’ensemble, d’accélérer la découverte et le développement de médicaments pour la maladie pulmonaire à Mab. La méthode peut être appliquée à d’autres agents pathogènes pulmonaires et a fait ses preuves pour P. aeruginosa ou Haemophilus influenza. L’objectif principal du protocole décrit ici est de fournir suffisamment de détails et de recommandations pour assurer une facilité de mise en œuvre et une excellente reproductibilité d’un laboratoire à l’autre.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts
Remerciements
Ce travail a été financé par la Fondation de la fibrose kystique, bourse DICK24XX0, à TD et VD, et R01-AI132374 NIH-NIAID à TD et VD.
matériels
| Name | Company | Catalog Number | Comments |
| 125-mL bottle | Corning | 8388 | Sterile |
| 3 x 3 Tube Holding Rack | Fisher | 5972-0030PK | Disinfected prior to use |
| 3D Printed Mouse Stand | Transworld Marketing | custom designed and produced | Disinfected prior to use |
| 48-well dilution Plate | Celltreat | 229192 | Sterile |
| 50-mL centrifuge tubes | Greiner Bio-One | 227261 | Sterile |
| Anesethia Machine | E-Z Systems | EZ-AF9000 SYSTEM | n/a |
| Avanti J-15R | Beckman Coulter | B99517 | Centrifuge |
| Barrier Pipette Tips in Lift-off Lid Rack 1000G | Thermo Scientific ART | 21-236-2A | Sterile |
| Biohazard bag | Fisherbrand | 22-044561 | |
| Connector Ring | pluriSelect | 41-50000-03 | |
| Cotton-Tipped Applicators | Puritan | 22-029-571 | Sterile |
| Disposable Inoculation Loops Yellow Sterile 100 in ziplock bag | Cole-Parmer Essentials | 03-391-562 | Sterile |
| Disposable Poly-Lined Towel Drape | Dynarex | 19-310-671 | Sterile |
| Dulbecco's Phosphate-Buffered Saline | Thomas Scientific | 21-031-CM | Sterile |
| Funnel | pluriSelect | 42-50000 | Sterile |
| GE Ultrospec 10 | Sigma-Aldrich | GE80211630 | Spectrophotometer |
| Gentlemacs Tissue Dissociator | Miltenyi Biotec | 130-096-427 | Not heat activated |
| Hamilton Syringe | Hamilton | 80801 | Disinfected prior to use |
| Heavy Mineral Oil | Sigma-Aldrich | 330760-1L | Sterile |
| Isoflurane solution 250 ml bottle | Covetrus | 29405 | Skin Corrosion/Irritation: Category 2, Serious Eye Damage/Eye Irritation: Category 2A, Specific target organ systemic toxicity (single exposure): Category 3 May cause drowsiness and dizziness, Causes serious eye irritation, Causes skin irritation. Do not inhale, use in well ventilated area. |
| M Tubes (gentleMACS) | Miltenyi Biotec | 130-096-335 | Sterile |
| Magnetic stirrer MR Hei-Connect | Heidolph | 505-40000-13-1 | |
| Magnetic stirring bar | Thomas Scientific | 1181L08 | Sterile |
| Mechanical Pipet 100–1000 µL | Gilson PIPETMAN L | FA10006M | Disinfected prior to use |
| Mechanical Pipet 20–200 µL | Gilson PIPETMAN L | FA10003MG | Disinfected prior to use |
| Metal Animal Feeding Needle 24 G | Braintree Scientific | N-VP 24G-1S | Must be sterilized (autoclaved) |
| Middlebrook 7H10 Agar | Sigma-Aldrich | M0303-500G | Sterilized (autoclaved) |
| Middlebrook 7H11 Agar | Thermo Fisher | R4554002 | Sterilized (autoclaved) |
| Middlebrook 7H9 medium | Beckton Dickinson | 271310 | Sterilized (autoclaved) |
| Mouse Stand Parts | TriMech Solutions | SRV-AMS-FDM | Disinfected prior to use |
| Nonabsorbable Silk Suture | Fisher Scientific | 18020-50 | n/a |
| OADC Liquid Enrichment for use with Middlebrook Media 500 ml | Thermo Scientific Remel | R450605 | Sterile |
| PBS (10x), pH 7.4 Sterile Filtered 500 mL | Gibco | 70-011-044 | Sterile |
| Peroxiguard Wipes | Peroxigard | 29221 | n/a |
| Petri Dishes with Clear Lid Round 100mmx 15mm | Fisherbrand | FB0875712 | Sterile |
| PluriStrainer 200 mm | pluriSelect | 43-50200-03 | Sterile; cell strainer |
| Roller bottles | Corning | 430165 | Sterile |
| Serological pipette | Corning | 4489 | Sterile |
| Spectrophotometer cuvettes 1.5 mL | Fisher Scientific | 14955127 | Sterilized (autoclaved) |
| Syringe stoppers or clips (nylon) | Trimech | SRV-AMS-MJF | Disinfected prior to use |
| Tryptic Soy Broth | Sigma-Aldrich | T8907-500G | Sterile |
| Tween 80 | Fisher | 170793 | Filter sterilized |
| Wide Bore Filtered Pipette Tips Lift-off Lid Rack 200G | Thermo Scientific ART | 21-236-1A | Sterile |
Références
- Dartois, V., Dick, T. Drug development challenges in nontuberculous mycobacterial lung disease: Tb to the rescue. J Exp Med. 219 (6), e20220445(2022).
- Martiniano, S. L., Nick, J. A., Daley, C. L. Nontuberculous mycobacterial infections in cystic fibrosis. Clin Chest Med. 43 (4), 697-716 (2022).
- Maurer, F. P., et al. Lack of antimicrobial bactericidal activity in mycobacterium abscessus. Antimicrob Agents Chemother. 58 (7), 3828-3836 (2014).
- Wu, M. L., Aziz, D. B., Dartois, V., Dick, T. Ntm drug discovery: Status, gaps and the way forward. Drug Discov Today. 23 (8), 1502-1519 (2018).
- Egorova, A., Jackson, M., Gavrilyuk, V., Makarov, V. Pipeline of anti-mycobacterium abscessus small molecules: Repurposable drugs and promising novel chemical entities. Med Res Rev. 41 (4), 2350-2387 (2021).
- Nuermberger, E. Using animal models to develop new treatments for tuberculosis. Semin Respir Crit Care Med. 29 (5), 542-551 (2008).
- Nuermberger, E. L. Preclinical efficacy testing of new drug candidates. Microbiol Spectr. 5 (3), (2017).
- Nicola, F., Cirillo, D. M., Lore, N. I. Preclinical murine models to study lung infection with mycobacterium abscessus complex. Tuberculosis (Edinb). 138, 102301(2023).
- Dartois, V., et al. Preclinical murine models for the testing of antimicrobials against mycobacterium abscessus pulmonary infections: Current practices and recommendations. Tuberculosis (Edinb). 147, 102503(2024).
- Obregon-Henao, A., et al. Susceptibility of mycobacterium abscessus to antimycobacterial drugs in preclinical models. Antimicrob Agents Chemother. 59 (11), 6904-6912 (2015).
- Lerat, I., et al. In vivo evaluation of antibiotic activity against mycobacterium abscessus. J Infect Dis. 209 (6), 905-912 (2014).
- Saliu, F., et al. Chronic infection by nontypeable haemophilus influenzae fuels airway inflammation. ERJ Open Res. 7 (1), (2021).
- Rodgers, A. M., et al. Biologically relevant murine models of chronic pseudomonas aeruginosa respiratory infection. Pathogens. 12 (8), 1053(2023).
- Hoover, J. L., et al. A robust pneumonia model in immunocompetent rodents to evaluate antibacterial efficacy against s. Pneumoniae, h. Influenzae, k. Pneumoniae, p. Aeruginosa or a. Baumannii. J Vis Exp. (119), e55068(2017).
- Lore, N. I., et al. The aminoglycoside-modifying enzyme eis2 represents a new potential in vivo target for reducing antimicrobial drug resistance in mycobacterium abscessus complex. Eur Respir J. 60 (6), 2201541(2022).
- Riva, C., et al. A new model of chronic mycobacterium abscessus lung infection in immunocompetent mice. Int J Mol Sci. 21 (18), 6590(2020).
- Chang, V., Phillips, P. P. J., Imperial, M. Z., Nahid, P., Savic, R. M. A comparison of clinical development pathways to advance tuberculosis regimen development. BMC Infect Dis. 22 (1), 920(2022).
- Yang, S. J., et al. Pathological granuloma fibrosis induced by agar-embedded mycobacterium abscessus in c57bl/6jnarl mice. Front Immunol. 14, 1277745(2023).
- Poerio, N., et al. Combined host- and pathogen-directed therapy for the control of mycobacterium abscessus infection. Microbiol Spectr. 10 (1), e0254621(2022).
- Pearce, C., et al. Inhaled tigecycline is effective against mycobacterium abscessus in vitro and in vivo. J Antimicrob Chemother. 75 (7), 1889-1894 (2020).
- De Groote, M. A., et al. Gm-csf knockout mice for preclinical testing of agents with antimicrobial activity against mycobacterium abscessus. J Antimicrob Chemother. 69 (4), 1057-1064 (2014).
- Facchini, M., De Fino, I., Riva, C., Bragonzi, A. Long term chronic pseudomonas aeruginosa airway infection in mice. J Vis Exp. (85), e51019(2014).
- Degiacomi, G., et al. The novel drug candidate vomg kills mycobacterium abscessus and other pathogens by inhibiting cell division. Int J Antimicrob Agents. 64 (4), 107278(2024).
- Rimal, B., et al. T405, a new penem, exhibits in vivo efficacy against m. Abscessus and synergy with beta-lactams imipenem and cefditoren. Antimicrob Agents Chemother. 66 (6), e0053622(2022).
- Maggioncalda, E. C., Story-Roller, E., Ammerman, N. C., Nuermberger, E. L., Lamichhane, G. Progressive mycobacterium abscessus lung infection in c3heb/fej mice associated with corticosteroid administration. bioRxiv. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon