Method Article
Preparação de Mycobacterium abscessus embebido em grânulo de ágar para inocular camundongos imunocompetentes por via intratraqueal
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Os camundongos são geralmente resistentes a infecções por Mycobacterium abscessus, o que complica a descoberta e o desenvolvimento de antibióticos muito necessários contra infecções pulmonares. Aqui, descrevemos um método de preparação de inóculo e infecção intratraqueal que demonstrou fornecer infecção sustentada em camundongos imunocompetentes.
Resumo
Modelos robustos de camundongos de infecção crônica por Mycobacterium abscessus, um patógeno ambiental que infecta preferencialmente os pulmões, são extremamente necessários. As terapias multidrogas de um ano oferecem taxas de cura inaceitavelmente baixas em pacientes, cerca de 50%, daí a necessidade de ferramentas pré-clínicas preditivas para desenvolver melhores antibióticos. No entanto, camundongos imunocompetentes são geralmente resistentes à infecção pulmonar por M. abscessus. Numerosas tentativas de estabelecer uma infecção sustentada por M. abscessus em camundongos imunocompetentes foram relatadas na literatura. Entre estes, os métodos baseados em bactérias embebidas em contas de ágar inoculadas em camundongos C57BL / 6 por via intratraqueal provaram ser os mais promissores. A principal limitação dessa abordagem é o desafio técnico associado à preparação de esferas de ágar de tamanho e número bacteriano reprodutíveis, seguida de inoculação intratraqueal. Aqui, primeiro fornecemos uma descrição detalhada de um protocolo otimizado que fornece grânulos de ágar carregados com M. abscessus de diâmetro ideal e carga bacteriana reprodutível. Em seguida, fornecemos um protocolo detalhado de inoculação intratraqueal, otimizado para evitar perdas de grânulos e bactérias devido à aderência às superfícies dos dispositivos de inoculação e para obter deposição pulmonar reprodutível de M. abscessus embebido em ágar. O objetivo é garantir facilidade de implementação e excelente reprodutibilidade de laboratório para laboratório.
Introdução
As opções de tratamento para a doença pulmonar por Mycobacterium abscessus (Mab) são limitadas e envolvem esquemas multimedicamentosos de um ano com antibióticos orais, parenterais e ocasionalmente inalatórios, a maioria dos quais carece de atividade bactericida ideal e está associada a toxicidade significativa 1,2,3,4,5 . Terapias mais curtas, seguras e eficazes são urgentemente necessárias. Modelos de camundongos de infecções micobacterianas têm sido fundamentais na descoberta e otimização de medicamentos e regimes de medicamentos eficazes 6,7. No entanto, a avaliação pré-clínica de antibióticos contra infecções por Mab tem se mostrado desafiadora devido à dificuldade de estabelecer infecções pulmonares progressivas e sustentadas em camundongos 8,9.
A infecção de cepas de camundongos imunocompetentes com Mab resulta em grande parte em colonização transitória seguida de rápida eliminação do patógeno10,11. Para alcançar a infecção crônica observada clinicamente, agentes imobilizadores como agarose ou ágar têm sido usados para promover a persistência e respostas imunopatológicas a patógenos oportunistas como Pseudomonas aeruginosa ou Haemophilus influenza em camundongos imunocompetentes 12,13,14. Este modelo foi recentemente adaptado para alcançar infecção respiratória crônica por Mab ATCC 19977 em camundongos C57BL/6N imunocompetentes 15,16,17,18. O método induziu infecção persistente por até 45 dias após a inoculação intratraqueal com ~1 × 104 a 1 × 106 unidades formadoras de colônias (UFC), com incidência de infecção crônica entre camundongos infectados de 90%-100%19 e formação de granulomas organizados ao redor do grânulo de ágar em desintegração18. Parece que a incorporação de Mab em grânulos protege da rápida depuração pelo sistema imunológico inato e que grânulos carregados de bactérias constituem focos para o recrutamento de células imunes, levando à formação de granulomas e ao estabelecimento de infecção crônica18. As esferas de ágar / agarose constituem um biomaterial relativamente inerte que induz respostas inflamatórias mínimas. Além disso, as esferas se desintegram lentamente, evitando problemas de reações alérgicas a corpos estranhos ou fibrose induzida. A infecção intratraqueal com ou sem dispositivo de micropulverização garante a deposição efetiva do inóculo nos pulmões 8,20,21 e reproduz a exposição clínica e a infecção melhor do que a inoculação intravenosa ou intranasal.
O modelo, portanto, oferece muitas vantagens. No entanto, também vem com alguns desafios de natureza técnica, a saber (i) alcançar o tamanho do grânulo reprodutível, (ii) obter carga bacteriana do grânulo reprodutível e (iii) garantir a entrega intratraqueal consistente do inóculo. Aqui, fornecemos protocolos detalhados para atingir esses objetivos de forma confiável e garantir a reprodutibilidade de laboratório para laboratório.
Protocolo
Todos os estudos em animais foram realizados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório dos Institutos Nacionais de Saúde com a aprovação do Comitê Institucional de Cuidados e Uso de Animais do NIAID (NIH), Bethesda, MD. Todos os procedimentos foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais. Todos os estudos envolvendo M. abscessus foram realizados em laboratório com nível de contenção de biossegurança 2.
1. Preparação do inóculo de M. abscessus embebido em grânulo de ágar
- Prepare uma pré-cultura de M. abscessus ATCC 19977 inoculando 1,5 mL de cultura de densidade óptica (OD600) 1 (usando um espectrofotômetro) em 200 mL de meio Middlebrook 7H9 suplementado com 0,05% (v / v) Tween 80, 0,5% (v / v) glicerol e 10% (v / v) de enriquecimento de albumina-dextrose-catalase Middlebrook (ADC).
- Incubar as culturas em uma garrafa de rolo a 37 ° C por 24 h até atingir a fase intermediária (OD600 = 0,4-0,6).
- Suspenda 1,2 g de Caldo de Soja Tríptico (TSB) em 40 mL de água ultrapura e adicione 0,6 g de Ágar Difco até uma concentração final de 1,5%.
- Transfira 60 mL de óleo mineral pesado para um frasco Erlenmeyer de 500 mL e esterilize o óleo mineral e o ágar soja tríptica (TSA) a 121 ° C por 15 min e, em seguida, equilibre a 50 ° C em um forno.
- Amostra de 1 mL da cultura e meça o OD600.
- Colher células por centrifugação a 3700 g durante 15 min a 4 °C. Ressuspenda as células em 4 mL de 1x solução salina tamponada com fosfato (DPBS) de Dulbecco para atingir um OD600 de aproximadamente 30.
- Misture 3 mL de suspensão bacteriana com 27 mL de TSA fundido pré-equilibrado a 50 ° C em um tubo de centrífuga de 50 mL. Misture rapidamente por vórtice ou pipetagem.
- Despeje cuidadosamente a mistura de bactéria-ágar (30 mL) em 60 mL de óleo mineral e coloque o frasco em um recipiente secundário. Regular rapidamente a mistura para centrifugar a velocidade média (420 rpm) num agitador magnético regulado para 50 °C, utilizando uma barra de agitação magnética. Certifique-se de que um vórtice visível se forma na mistura óleo-ágar. Mexa por 6 min em temperatura ambiente (RT).
- Resfrie a mistura colocando gelo no recipiente secundário e continue mexendo por 35 min.
- Pare de mexer e deixe a pasta de ágar descansar por 20 min (reabasteça o gelo conforme necessário).
- Transfira a mistura de pasta para dois tubos de centrifugação de 50 mL e lave 10 vezes com um volume de DPBS para remover o óleo e as bactérias livres (3700 g, 6 min, 4 °C, nos primeiros 5 ciclos).
- Combine as suspensões de contas de ágar em um tubo na terceira lavagem. Durante os primeiros 5 ciclos de lavagem, use uma pipeta sorológica para ressuspender suavemente as contas.
- Para os 5 ciclos de lavagem subsequentes, use os seguintes parâmetros de centrifugação: 2000 g por 5 min, seguidos de 1000 g por 4, 3, 2 e 2 min, respectivamente.
- Ressuspenda as esferas de ágar em DPBS até um volume final de 40 mL, transfira para um frasco estéril de 125 mL e dilua 4x adicionando 120 mL de DPBS.
- Passe a suspensão por um filtro de células de 200 μm.
- Conecte o filtro a um tubo de centrífuga estéril de 50 mL. Em seguida, adicione material de amostra ao filtro e filtre a suspensão do cordão.
- Para facilitar o processo de filtração, combine um filtro de células, um funil, um anel conector e um tubo de 50 mL em uma unidade. Monte as peças na ordem do funil, filtro de célula, anel conector e tubo de 50 mL e puxe lentamente o pistão de uma seringa de 30 mL presa ao anel conector.
- Se necessário, enxágue o filtro do lado oposto com DPBS para lavar quaisquer contas maiores retidas. Concentrar a suspensão diluída centrifugando a 1000 g durante 2 min ou deixando assentar as esferas por gravidade. Após a colheita, conservar as esferas de ágar-ágar a 4 °C durante um período máximo de 1 semana. Recomenda-se uma nova preparação para cada lote de experimentos.
- Pipete 5 μL da suspensão do cordão em uma lâmina de vidro, cubra-a com uma lamínula e tire imagens em algumas posições aleatórias usando um microscópio de luz ou fluorescência com uma lente objetiva de 10×. Salve as imagens e meça o diâmetro do cordão com ImageJ (faixa de tamanho desejada: 200 ± 50 μm).
2. Titulação do inóculo de M. abscessus embebido em grânulo de ágar
- Adicione 1 mL da suspensão do grânulo em um tubo M e homogeneize assepticamente para liberar bactérias embutidas nos grânulos usando um dissociador definido para o programa pré-definido RNA.02.01.
- Pegue 100 μL do homogeneizado e dilua em série 1:10 a 1 × diluição 10-5 . Diluições espalhadas em ágar 7H10 suplementado com 10% de ácido oleico-albumina-dextrose-catalase (OADC) e 2% de glicerol. Enumerar UFC após 3 a 5 dias de incubação.
- Ajuste o título de inóculo conforme necessário. Por exemplo, se cada camundongo receber 100 μL de suspensão de esferas contendo 1 × 105 UFC para 10 camundongos, um total de 2 mL de suspensão contendo 1 × 106 UFC / mL é preparado mais ~ 25% para contabilizar as perdas nas seringas.
3. Teste de dispensação de esferas através da seringa e agulha
NOTA: As etapas a seguir foram incluídas para garantir que as esferas não adiram às superfícies da seringa ou agulha. Verificou-se que é importante usar uma seringa de vidro e uma agulha de alimentação de metal 24 G para evitar a perda de grânulos devido à aderência às superfícies plásticas.
- Prepare o PBST adicionando 1,25 mL de Tween estéril 80 a 500 mL de PBS estéril.
- Adicione 900 μL de PBST em cinco tubos M para testar as esferas de ágar que passam pela agulha de alimentação, bem como 900 μL de PBST em tubos estéreis de 2 mL para preparar diluições de -2 a -6 de cada amostra push-through.
- Misture o M . abscessus embebido em grânulo de ágar preparado anteriormente usando uma pipeta P1000 para garantir que todos os grânulos estejam uniformemente dispersos.
- Encaixe uma agulha de alimentação metálica de 24 G na seringa de vidro e aspire a suspensão do grânulo de ágar, certificando-se de evitar a formação de bolhas de ar.
- Quando a seringa estiver cheia sem bolhas de ar, coloque clipes ou rolhas de náilon no êmbolo da seringa, sem espaço entre os clipes. As rolhas permitem uma distribuição precisa de 50-100 μL. É possível encaixar até 6 clipes ao longo do êmbolo.
- Dispense 100 μL de grânulos ("push-through") nos tubos M em sua respectiva ordem.
- Uma vez que 5 push-throughs tenham sido coletados, homogeneizar os grânulos usando o dissociador de tecido ajustado para a configuração RNA.02.01, adequado para a preparação de RNA de órgãos congelados e que liberou efetivamente M. abscessus dos grânulos sem afetar a viabilidade celular.
- Efectuar uma diluição em série para os homogeneizados no intervalo de -1 a -6. Plaquear as diluições em placas de ágar 7H11 suplementadas com OADC. Conte a UFC após 5 dias.
4. Inoculação intratraqueal de camundongos
- Prepare camundongos CD-1 de 6 a 8 semanas de idade.
- Sedar os camundongos usando um sistema de exposição a aerossóis de isoflurano, a uma taxa de fluxo de 1-5%, conforme descrito anteriormente1.
- Contenha os mouses usando um suporte inclinado impresso tridimensional (3-D) (projetado e produzido sob medida). A haste no centro do suporte tem uma corda de sutura que segura o rato verticalmente por seus incisivos, colocando o rato em uma posição ventral reclinada com a cabeça levantada.
- Anexe uma agulha de alimentação animal de metal 24 G a uma seringa de vidro cheia de contas de ágar M. abscessus. Coloque clipes ou rolhas de náilon no êmbolo da seringa para infectar cada camundongo com 50 μL de inóculo.
- Uma vez que o camundongo sedado esteja preso na picada de sutura, mova a língua para o lado da boca usando um aplicador de cotonete.
- Visualize a parte de trás da boca do rato para identificar claramente a seção branca na parte de trás da boca e mirar na traqueia do rato.
- Incline a agulha de gavagem de metal verticalmente acima do mouse e insira-a na parte superior da traqueia. Pode haver uma ligeira resistência ao passar pela epiglote.
- Deslize a agulha de gavagem para baixo na traqueia, remova o clipe ou rolha de náilon e dispense 50 μL de M. abscessus embebido em grânulo de ágar.
- Deixe o mouse descansar por 5 minutos e repita as etapas 4.2 a 4.8 uma segunda vez. O objetivo de um procedimento de inoculação em duas etapas é garantir a deposição reprodutível e profunda do inóculo completo no pulmão.
- Deixe a infecção progredir por 24 horas, após o que o camundongo é sacrificado para enumerar a deposição bacteriana nos pulmões.
Resultados
Tamanho e carga do grânulo
Para visualizar as esferas de ágar e sua carga bacteriana, a proteína fluorescente vermelha mCherry foi expressa sob o promotor constitutivo Hsp60 na cepa do tipo Mab ATCC 19977 e incorporou essa cepa em esferas de ágar conforme descrito acima. A Figura 1A mostra a faixa de tamanho do cordão (barra de escala = 200 μm). A Figura 1B mostra a carga de 6 preparações de esferas independentes, demonstrando a reprodutibilidade do procedimento conforme descrito.
Plaqueamento de seringa push-through e implantação bacteriana após inoculação intratraqueal
A inoculação intratraqueal foi otimizada em duas etapas. As UFC/mL foram enumeradas no inóculo antes e depois de passar pela seringa de vidro para garantir que nenhuma perda bacteriana ou de grânulos ocorresse à medida que as grânulos passavam pela seringa e pelo tubo conectado. A Tabela 1 mostra o título bacteriano inicial de duas preparações de esferas independentes (ensaios 1 e 2) e o número de UFC recuperado por 100 mL de amostras 'empurradas' de uma única carga de seringa. Para evitar perdas de esferas e bactérias, é necessária uma seringa de vidro conectada a um tubo de metal. As contas de ágar tendem a aderir a superfícies plásticas.
A enumeração de UFC ao longo do tempo na preparação do grânulo mostrou que a carga bacteriana dos grânulos permaneceu estável a 4 ° C por 1 semana, com uma perda de ~ 2 vezes da carga bacteriana por 2 semanas e deposição pulmonar não prejudicada. Em seguida, grupos de 5 a 8 camundongos foram infectados com três preparações independentes de esferas para testar a reprodutibilidade do procedimento de inoculação intratraqueal. A Tabela 2 mostra o número de UFC pulmonares por camundongo, enumerado 24 h após a infecção, conforme descrito.
Por fim, a reprodutibilidade interoperador da infecção foi avaliada infectando três grupos de 10 camundongos CD-1, cada um realizado por um operador diferente. As UFC pulmonares enumeradas 24 h após a infecção são mostradas na Figura 2.

Figura 1: Experimento piloto para avaliar o tamanho do grânulo, visualizar e quantificar a carga bacteriana de M. abscessus . (A) Grânulos de ágar contendo a cepa M. abscessus ATCC 19977, projetados para expressar a proteína fluorescente vermelha mCherry sob o promotor constitutivo hsp60. Cinco μl de suspensão de esferas foram espalhados em uma lâmina de vidro e fotografados com um microscópio de fluorescência equipado com uma câmera (objetiva de 10x). Cada ponto vermelho é uma célula bacteriana fluorescente, encerrada em esferas de ágar de diâmetros que variam de ~ 70-250 μm. (B) Carga bacteriana, em UFC / mL, de 6 preparações individuais de esferas mostrando a reprodutibilidade do método. Clique aqui para ver uma versão maior desta figura.
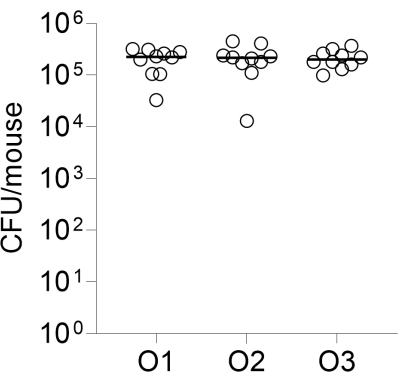
Figura 2: Reprodutibilidade interoperador da infecção. Grupos de 10 camundongos fêmeas CD-1 foram infectados por via intratraqueal por três operadores independentes, conforme descrito, usando a mesma preparação de contas. As UFC pulmonares enumeradas 24 h após a infecção são mostradas. O1, O2, O3: operadores 1, 2 e 3. Clique aqui para ver uma versão maior desta figura.
| UFC/100 μL | ||
| Preparação do grânulo | Julgamento 1 | Julgamento 2 |
| 1.13E+05 | 2.40E+05 | |
| Amostra de passagem de seringa | ||
| 1 | 1.14E+05 | 5.10E+05 |
| 2 | 1.36E+05 | 4.10E+05 |
| 3 | 9.30E+04 | 3.90E+05 |
| 4 | 9.80E+04 | 3.60E+05 |
| 5 | 1.14E+05 | |
| Média | 1.11E+05 | 4.18E+05 |
| SD | 1,69E+04 (% 15%) | 6.50E+04 (% 16) |
Tabela 1: Unidades formadoras de colônias (UFC) por amostra de 100 μL após passar pela seringa de vidro e agulha de alimentação de metal.
| Julgamento 1 | Julgamento 2 | Julgamento 3 | |||
| Mouse ID | UFC pulmonar/camundongo | Mouse ID | UFC pulmonar/camundongo | Mouse ID | UFC pulmonar/camundongo |
| M-1 | 6.50E+03 | M-6 | 2.20E+05 | M-11 | 6.80E+04 |
| M-2 | 1.10E+04 | M-7 | 2.70E+05 | M-12 | 1.70E+05 |
| M-3 | 1.40E+04 | M-8 | 8.10E+04 | M-13 | 2.10E+05 |
| M-4 | 3.20E+03 | M-9 | 1.40E+05 | M-14 | 4.40E+04 |
| M-5 | 4.50E+03 | M-10 | 1.30E+05 | M-15 | 7.50E+04 |
| M-16 | 1.01E+05 | ||||
| M-17 | 7.00E+04 | ||||
| M-18 | 5.80E+03 | ||||
| Média | 7.84E+03 | Média | 1.68E+05 | Média | 9.30E+04 |
| SD | 4.54E+03 (58%) | SD | 7.57E+04 (45%) | SD | 6.67E+04 (72%) |
Tabela 2: Implantação de M. abscessus embebido em grânulo de ágar em pulmões de camundongos 24h após a inoculação
Discussão
Para garantir a distribuição uniforme de bactérias nas esferas de ágar, é importante suspender uniformemente a mistura de ágar-bactérias derretida antes de adicioná-la à fase oleosa. A relação entre o volume de óleo e ágar-bactéria é crítica no controle do tamanho do grânulo. Uma proporção mais alta de óleo para ágar leva à formação de grânulos de ágar menores. Ao misturar a suspensão de ágar-bactérias com a fase oleosa, o controle de temperatura é crítico. A mistura de óleo-ágar deve ser quente o suficiente para permitir a emulsificação e a formação de gotículas, mas fria o suficiente para não prejudicar as bactérias. A agitação contínua enquanto resfria a mistura à temperatura ambiente ou abaixo permite que as gotículas de ágar se formem e solidifiquem.
A calibração adequada da placa de agitação, o tamanho da barra de agitação e a forma e tamanho do frasco são determinantes importantes de um vórtice uniforme. Uma barra de agitação posicionada no centro do frasco cria um vórtice simétrico, garantindo uma mistura uniforme. Uma barra de agitação descentralizada pode levar a um vórtice instável, resultando em grânulos de formato irregular e na introdução de bolhas de ar nos grânulos. Recomenda-se o monitoramento e ajuste em tempo real da posição da barra de agitação. O volume do balão deve ser proporcional ao volume da mistura óleo-ágar. Um balão de 500 mL é ideal para girar uma mistura de óleo-ágar de 90 mL, produzindo um vórtice visível. Ao usar frascos maiores, é importante ajustar o volume da mistura óleo-ágar, o tamanho do agitador e a velocidade do vórtice para obter um equilíbrio entre mistura eficaz e vórtice estável. Manter uma velocidade de vórtice consistente durante o processo e nas preparações de grânulos é fundamental para a reprodutibilidade de lote para lote.
O processo de preparação do grânulo de ágar, especificamente a velocidade de vórtice e a relação óleo-ágar, são adaptados de16,22, com pequenas modificações. As forças de cisalhamento dentro do vórtice giratório produzem inerentemente esferas de diferentes tamanhos. Para minimizar essa variabilidade de tamanho, a etapa de colheita do grânulo foi modificada com a introdução de várias etapas de lavagem, empregando um gradiente de velocidade e tempo de centrifugação decrescentes para garantir a remoção de grânulos de tamanho pequeno (e bactérias livres). Um filtro de micro-malha foi empregado para enriquecer as esferas do tamanho desejado, filtrando efetivamente as esferas maiores e aquelas que podem ter se formado por meio de coalescência aleatória. Para evitar perdas bacterianas ou de esferas à medida que a pasta de esferas passa pela seringa e pelo tubo conectado para inoculação intratraqueal do camundongo, é fundamental usar uma seringa de vidro, agulhas de alimentação de metal 24 G e um tubo conectado por metal.
A principal limitação do método é a complexidade técnica da preparação do grânulo e da inoculação intratraqueal para obter carga reprodutível do grânulo e implantação pulmonar. É necessária atenção aos detalhes e a capacidade de solucionar problemas. Além disso, o modelo não foi totalmente validado testando a eficácia dos antibióticos padrão e das combinações de antibióticos mais frequentes administradas a pacientes com Mab.
Atualmente, nenhum modelo de camundongo de infecção crônica por Mab foi validado na medida em que a eficácia de agentes únicos e combinações de medicamentos em pacientes pode ser razoavelmente prevista pelo modelo9. O sistema de camundongo C57BL / 6 embebido em contas de ágar foi explorado para testar a eficácia de tratamentos antimicrobianos 15,19,23. A alternativa mais próxima ao sistema de camundongo C57BL / 6 embebido em contas de ágar é o modelo de camundongo C3HeB / FeJ, que depende da imunossupressão da dexametasona para alcançar uma infecção crônica durável24,25. As vantagens do protocolo aqui descrito são que (i) camundongos C57BL/6 totalmente imunocompetentes e mais acessíveis podem ser usados, (ii) uma infecção produtiva e crônica pode ser obtida com a cepa tipo bem caracterizada ATCC 19977 e (iii) não há necessidade de imunossupressão quimicamente induzida, contornando a necessidade de injeções diárias de dexametasona, evitando assim potenciais interações medicamentosas e impacto na imunopatologia pulmonar.
Dada a falta de modelos de camundongos validados de infecção crônica por Mab para avaliar novos candidatos a medicamentos e regimes de medicamentos 8,9, a técnica descrita aqui tem o potencial de avançar no campo, melhorar o valor preditivo dos dados de eficácia pré-clínica, ajudar a priorizar regimes de medicamentos com o maior potencial para fornecer cura durável e, em geral, acelerar a descoberta e o desenvolvimento de medicamentos para a doença pulmonar Mab. O método pode ser aplicado a outros patógenos pulmonares e tem um histórico estabelecido para P. aeruginosa ou Haemophilus influenza. O principal objetivo do protocolo descrito aqui é fornecer detalhes e recomendações suficientes para garantir a facilidade de implementação e excelente reprodutibilidade de laboratório para laboratório.
Divulgações
Os autores declaram não haver conflito de interesses
Agradecimentos
Este trabalho foi financiado pela Cystic Fibrosis Foundation, prêmio DICK24XX0, para TD e VD, e R01-AI132374 do NIH-NIAID para TD e VD.
Materiais
| Name | Company | Catalog Number | Comments |
| 125-mL bottle | Corning | 8388 | Sterile |
| 3 x 3 Tube Holding Rack | Fisher | 5972-0030PK | Disinfected prior to use |
| 3D Printed Mouse Stand | Transworld Marketing | custom designed and produced | Disinfected prior to use |
| 48-well dilution Plate | Celltreat | 229192 | Sterile |
| 50-mL centrifuge tubes | Greiner Bio-One | 227261 | Sterile |
| Anesethia Machine | E-Z Systems | EZ-AF9000 SYSTEM | n/a |
| Avanti J-15R | Beckman Coulter | B99517 | Centrifuge |
| Barrier Pipette Tips in Lift-off Lid Rack 1000G | Thermo Scientific ART | 21-236-2A | Sterile |
| Biohazard bag | Fisherbrand | 22-044561 | |
| Connector Ring | pluriSelect | 41-50000-03 | |
| Cotton-Tipped Applicators | Puritan | 22-029-571 | Sterile |
| Disposable Inoculation Loops Yellow Sterile 100 in ziplock bag | Cole-Parmer Essentials | 03-391-562 | Sterile |
| Disposable Poly-Lined Towel Drape | Dynarex | 19-310-671 | Sterile |
| Dulbecco's Phosphate-Buffered Saline | Thomas Scientific | 21-031-CM | Sterile |
| Funnel | pluriSelect | 42-50000 | Sterile |
| GE Ultrospec 10 | Sigma-Aldrich | GE80211630 | Spectrophotometer |
| Gentlemacs Tissue Dissociator | Miltenyi Biotec | 130-096-427 | Not heat activated |
| Hamilton Syringe | Hamilton | 80801 | Disinfected prior to use |
| Heavy Mineral Oil | Sigma-Aldrich | 330760-1L | Sterile |
| Isoflurane solution 250 ml bottle | Covetrus | 29405 | Skin Corrosion/Irritation: Category 2, Serious Eye Damage/Eye Irritation: Category 2A, Specific target organ systemic toxicity (single exposure): Category 3 May cause drowsiness and dizziness, Causes serious eye irritation, Causes skin irritation. Do not inhale, use in well ventilated area. |
| M Tubes (gentleMACS) | Miltenyi Biotec | 130-096-335 | Sterile |
| Magnetic stirrer MR Hei-Connect | Heidolph | 505-40000-13-1 | |
| Magnetic stirring bar | Thomas Scientific | 1181L08 | Sterile |
| Mechanical Pipet 100–1000 µL | Gilson PIPETMAN L | FA10006M | Disinfected prior to use |
| Mechanical Pipet 20–200 µL | Gilson PIPETMAN L | FA10003MG | Disinfected prior to use |
| Metal Animal Feeding Needle 24 G | Braintree Scientific | N-VP 24G-1S | Must be sterilized (autoclaved) |
| Middlebrook 7H10 Agar | Sigma-Aldrich | M0303-500G | Sterilized (autoclaved) |
| Middlebrook 7H11 Agar | Thermo Fisher | R4554002 | Sterilized (autoclaved) |
| Middlebrook 7H9 medium | Beckton Dickinson | 271310 | Sterilized (autoclaved) |
| Mouse Stand Parts | TriMech Solutions | SRV-AMS-FDM | Disinfected prior to use |
| Nonabsorbable Silk Suture | Fisher Scientific | 18020-50 | n/a |
| OADC Liquid Enrichment for use with Middlebrook Media 500 ml | Thermo Scientific Remel | R450605 | Sterile |
| PBS (10x), pH 7.4 Sterile Filtered 500 mL | Gibco | 70-011-044 | Sterile |
| Peroxiguard Wipes | Peroxigard | 29221 | n/a |
| Petri Dishes with Clear Lid Round 100mmx 15mm | Fisherbrand | FB0875712 | Sterile |
| PluriStrainer 200 mm | pluriSelect | 43-50200-03 | Sterile; cell strainer |
| Roller bottles | Corning | 430165 | Sterile |
| Serological pipette | Corning | 4489 | Sterile |
| Spectrophotometer cuvettes 1.5 mL | Fisher Scientific | 14955127 | Sterilized (autoclaved) |
| Syringe stoppers or clips (nylon) | Trimech | SRV-AMS-MJF | Disinfected prior to use |
| Tryptic Soy Broth | Sigma-Aldrich | T8907-500G | Sterile |
| Tween 80 | Fisher | 170793 | Filter sterilized |
| Wide Bore Filtered Pipette Tips Lift-off Lid Rack 200G | Thermo Scientific ART | 21-236-1A | Sterile |
Referências
- Dartois, V., Dick, T. Drug development challenges in nontuberculous mycobacterial lung disease: Tb to the rescue. J Exp Med. 219 (6), e20220445(2022).
- Martiniano, S. L., Nick, J. A., Daley, C. L. Nontuberculous mycobacterial infections in cystic fibrosis. Clin Chest Med. 43 (4), 697-716 (2022).
- Maurer, F. P., et al. Lack of antimicrobial bactericidal activity in mycobacterium abscessus. Antimicrob Agents Chemother. 58 (7), 3828-3836 (2014).
- Wu, M. L., Aziz, D. B., Dartois, V., Dick, T. Ntm drug discovery: Status, gaps and the way forward. Drug Discov Today. 23 (8), 1502-1519 (2018).
- Egorova, A., Jackson, M., Gavrilyuk, V., Makarov, V. Pipeline of anti-mycobacterium abscessus small molecules: Repurposable drugs and promising novel chemical entities. Med Res Rev. 41 (4), 2350-2387 (2021).
- Nuermberger, E. Using animal models to develop new treatments for tuberculosis. Semin Respir Crit Care Med. 29 (5), 542-551 (2008).
- Nuermberger, E. L. Preclinical efficacy testing of new drug candidates. Microbiol Spectr. 5 (3), (2017).
- Nicola, F., Cirillo, D. M., Lore, N. I. Preclinical murine models to study lung infection with mycobacterium abscessus complex. Tuberculosis (Edinb). 138, 102301(2023).
- Dartois, V., et al. Preclinical murine models for the testing of antimicrobials against mycobacterium abscessus pulmonary infections: Current practices and recommendations. Tuberculosis (Edinb). 147, 102503(2024).
- Obregon-Henao, A., et al. Susceptibility of mycobacterium abscessus to antimycobacterial drugs in preclinical models. Antimicrob Agents Chemother. 59 (11), 6904-6912 (2015).
- Lerat, I., et al. In vivo evaluation of antibiotic activity against mycobacterium abscessus. J Infect Dis. 209 (6), 905-912 (2014).
- Saliu, F., et al. Chronic infection by nontypeable haemophilus influenzae fuels airway inflammation. ERJ Open Res. 7 (1), (2021).
- Rodgers, A. M., et al. Biologically relevant murine models of chronic pseudomonas aeruginosa respiratory infection. Pathogens. 12 (8), 1053(2023).
- Hoover, J. L., et al. A robust pneumonia model in immunocompetent rodents to evaluate antibacterial efficacy against s. Pneumoniae, h. Influenzae, k. Pneumoniae, p. Aeruginosa or a. Baumannii. J Vis Exp. (119), e55068(2017).
- Lore, N. I., et al. The aminoglycoside-modifying enzyme eis2 represents a new potential in vivo target for reducing antimicrobial drug resistance in mycobacterium abscessus complex. Eur Respir J. 60 (6), 2201541(2022).
- Riva, C., et al. A new model of chronic mycobacterium abscessus lung infection in immunocompetent mice. Int J Mol Sci. 21 (18), 6590(2020).
- Chang, V., Phillips, P. P. J., Imperial, M. Z., Nahid, P., Savic, R. M. A comparison of clinical development pathways to advance tuberculosis regimen development. BMC Infect Dis. 22 (1), 920(2022).
- Yang, S. J., et al. Pathological granuloma fibrosis induced by agar-embedded mycobacterium abscessus in c57bl/6jnarl mice. Front Immunol. 14, 1277745(2023).
- Poerio, N., et al. Combined host- and pathogen-directed therapy for the control of mycobacterium abscessus infection. Microbiol Spectr. 10 (1), e0254621(2022).
- Pearce, C., et al. Inhaled tigecycline is effective against mycobacterium abscessus in vitro and in vivo. J Antimicrob Chemother. 75 (7), 1889-1894 (2020).
- De Groote, M. A., et al. Gm-csf knockout mice for preclinical testing of agents with antimicrobial activity against mycobacterium abscessus. J Antimicrob Chemother. 69 (4), 1057-1064 (2014).
- Facchini, M., De Fino, I., Riva, C., Bragonzi, A. Long term chronic pseudomonas aeruginosa airway infection in mice. J Vis Exp. (85), e51019(2014).
- Degiacomi, G., et al. The novel drug candidate vomg kills mycobacterium abscessus and other pathogens by inhibiting cell division. Int J Antimicrob Agents. 64 (4), 107278(2024).
- Rimal, B., et al. T405, a new penem, exhibits in vivo efficacy against m. Abscessus and synergy with beta-lactams imipenem and cefditoren. Antimicrob Agents Chemother. 66 (6), e0053622(2022).
- Maggioncalda, E. C., Story-Roller, E., Ammerman, N. C., Nuermberger, E. L., Lamichhane, G. Progressive mycobacterium abscessus lung infection in c3heb/fej mice associated with corticosteroid administration. bioRxiv. , (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados