錯体化学
概要
ソース: 博士ニール エイブラムスの研究室-環境科学および林業のニューヨーク州立大学
遷移金属は、どこでもお風呂を電気めっきするビタミン剤から見つかった。遷移金属はまた多くの塗料に顔料を作り、すべての鉱物の構成します。通常、遷移金属では、彼らは容易に酸化し、または電子を失うし、電子ドナー配位子と呼ばれるに囲まれているので、陽イオンのフォームが見つかりました。これらの配位子かフォーム イオンではなく共有結合金属センター、彼らとして座標結合-共有知られているボンドの 3 番目のタイプに取るではなく。配位子と金属の座標結合-共有結合は動的、配位子を継続的に交換し、金属の中心の周りの再調整です。別のもの上の配位子が優先的に結合金属と配位子の両方の id が決まります。また、色と磁気特性は、また形成される複合体の種類により。錯体を形成するさまざまな機器やツールを使用して分析します。この実験は非常に多くの複合体が可能な理由を探るし、分光 (色と化学) メソッドを使用して、フォームの調整の複合体の種類を識別できます。
原則
配位錯体
錯体がある少なくとも 1 つの金属錯体、金属センターが含まれていますし、配位子の電子寄付に囲まれています。これは複雑なイオンとして知られています。ポリマー分子の調整の複合体を形成する錯イオンの電荷のバランスをとる。配位錯体は水溶性で、対イオンと金属イオン複合体が解離です。金属イオンと配位子多原子イオンのように振る舞うし、分離を行います。
錯イオンの幾何学は、平面、四面体、八面体、直線、正方形を含む標準的な原子価殻電子対反発理論 (VSEPR) ジオメトリを取ります。八面体の複雑なイオンは、最も一般的な形状です。結晶場理論エネルギー dの間で分割を説明します-軌道遷移金属イオンや VSEPR ジオメトリ。図形とdの向きによって影響されますエネルギー分裂-軌道のローブ。
配位子と分光化学系列
配位子は債券、または添付ファイルの数によって分類される、彼らは金属センターで行うことができます。単一の添付ファイルは、単座型 (1 歯) と呼ばれます。2 つの添付ファイルは、リガンドは二座と呼ばれる (2 歯) と 3 つの添付ファイルが三座として知られています。配位子は金属センター座標結合-共有結合を形成するための電子密度を寄付します。充電するか、中性配位子があります。配位子は強いまたは弱い分光化学系列によるとに分類されます。
(弱い)私は- < Br- < Cl- < SCN- < F- < ああ- < ox2 -< 小野- < H2O < NCS- < EDTA4 - < NH3 < アン <2- < CN- (強い)
分割軌道
6 配位子の正八面体の複合体を形成する金属センター アプローチ、5 d 軌道縮退は 3 つの低エネルギー縮退 t2 g軌道と 2 つのエネルギーの高い縮退電子g軌道に分割します。T2 gおよび eg軌道間に、剥片の距離は、分光化学系列によると配位子の強さによって決まります。
フントの規則が適用されます、電子は、一度に軌道 1 つを埋める t2 gおよび eg軌道の分裂の大きさに従って入力します。分割が小さい場合電子は、ペアリングする前に単独ですべての軌道が埋めるされます。これは不対電子の数を最大化、高スピンと呼びます。同様に、強力なフィールドの原因大きい t2 geg分割: 電子ペア t2 g高エネルギー eg軌道を充填する前に設定します。これは不対電子の数を最小限に抑え、低スピンと呼びます。電子のペアのドライブが、エネルギー (またはサイズ) によって軌道分裂の電子対のエネルギーと比較して適用されます。ペアリングのエネルギーが eg軌道に移動のエネルギーと比較して高い場合は、電子が高スピンです。ペアリングのエネルギーが高い eg軌道に移動のエネルギーに比べて低い場合、電子が低スピンです。
電子が低 t2 g状態から金属の中心の高い eg状態に移動する距離は、複合体が吸収する電磁波のエネルギーを決定します。そのエネルギーは、可視領域 (400-700 nm, 1.77 eV-3.1 eV)、複雑な一般的に色にあります。弱い磁場配位子 (私は- → オハイオ州-) 小剥片を引き起こすし、複合体は、緑色で表示される低エネルギー光 (すなわち赤) を吸収します。強力な磁場配位子 (EDTA → CN-) (すなわち青紫) 高エネルギーの光を吸収して赤黄色の表示色で。強いとアンモニアのような分光化学系列に弱いは、配位子との錯体は、どちらか弱いまたは強いフィールドのジオメトリを採用できます。
色配位子の関係は、「分光シリーズ」という名前の理論的根拠です。ペアと不対電子の数は、金属錯体における反磁性常磁性の特性も生じ.
4 つの配位子は金属の中心座標、正方形平面または四面体複合体のいずれかが発生する可能性が。四面体錯体における軌道のエネルギーが eg t2 gよりもエネルギーが低く正八面体錯体に比べて反転です。これは調整の配位子に関して d 軌道の向きです。正方形平面錯体における軌道エネルギーを dyzと縮退とエネルギー (dz2より低い)、dxy、最低 dxz最後に最高のエネルギーのいくつかの違いがあります dx2-y2軌道。
構造と色
軌道分裂の距離は、配位子の強さと異なりますので同じ金属センターと調整の複合体はさまざまな色に基づいて調整の配位子を持つことができます。たとえば、Ni (H2O)62 +の水溶液は薄緑色が、Ni (NH3)62 +は、深い青。色は t2 geg軌道間のエネルギーの変化から発生します。NH3は H2O 有機配位子と金属の中心から転置し同様、互いから離れてさらに軌道をプッシュする強いフィールド リガンドです。さらに色、この実験では配位錯体の配位子の影響を学びます。
手順
1. ニッケルの複合体および色
- Ni (H2O)62 +複雑な (図 1 a)
- ニーソ4水の適切な量を溶解することにより、Ni (H2O)62 + 1 M 溶液を準備します。
- さらに 1 M 溶液 70 mL を 1,000 mL の脱イオン水に追加することによって Ni (H2O)62 +ソリューションを希釈します。
- Ni (H2O)62 + 7 400 mL ビーカーの中に分割します。
- 水溶液中のニッケル ソリューションは、水が弱いフィールド リガンドので色が黄緑にかかります。
- 吸光度スペクトルは赤の波長が吸収されれば、反対、緑、観察されるを正当化することを示します。
- Ni (NH3)62 +複雑な (図 1 b)
- ビーカーと攪拌を 5 M アンモニア水ソリューションを追加します。
- ソリューションは、ソリューションが吸収オレンジ色の光は赤い光よりも高いエネルギーを示す深い青の色。
- 吸光度スペクトルは、黄色の波長が吸収されれば、反対側、青が観測されるを正当化することを示します。
- アンモニア水、t2 gおよび eg軌道間の分割を高めるよりも強いフィールド リガンドであり。
- Ni(en)32 +複雑な (図 1 c)
- 水性 Ni (H2O)62 +複雑な 30% エチレンジアミン (en) ソリューションを追加し、かき混ぜます。
- 徐々 に解決策光から青に青に紫にエチレンジアミン分子が徐々 に最終的にフォーム Ni(en)3 +金属中心座標として。
- エチレンジアミンは水またはアンモニアよりも強い配位子、二座。紫の色は、ソリューションが吸収を示す黄色のライト オレンジや赤の光よりも高いエネルギーであります。
- 吸光度スペクトルは、黄色の波長が吸収されれば、反対、紫色が観察を正当化することを示します。
- Ni(dmg)22 +複雑な (図 1 d)
- Dimethylgloxine (dmg) は、多数の金属をキレート二座配位子。2Ni(dmg)2 +正方形平面ジオメトリを持っているので、2 つだけ dmg 分子が金属センターごと必要です。
- 水性複合体に 1 %dmg を追加します。
- 固体ピンク/レッドの沈殿物を形作る、不溶性 Ni(dmg)22 +複雑です。
- 複合体の可視透過率スペクトルは不可能ですが、赤い色は緑色の光が吸収されていることを示します。緑、黄色、オレンジと赤よりも高いエネルギーです。
- Ni(CN)42-複雑な (図 1e)
- シアン化物イオン (CN-) はまたニッケル (II) 錯体の平面を形成する非常に強力なフィールドのリガンドが単座。
- 1 M KCN 溶液を追加します。
- 黄色 Ni(CN)42-複雑なフォームすぐ。
- 注: シアン化物塩での作業は、細心の注意を行う必要があります。酸の添加はシアン化物ガスの形成にあります。
- 金属と π 背面金属から配位子を結合するリガンドから σ 結合があるので、シアン化物は他の配位子のどれよりも強い配位子です。黄色の色は、ソリューションが吸収を示します青色光は、エネルギーの緑、黄色、オレンジ、赤よりも高い。
- 吸光度スペクトルは、黄色の波長が吸収されれば、反対、紫色が観察を正当化することを示します。
2 配位子の強さ
- 分光化学系列によるといくつかの配位子が他のものより強いフィールド中心の金属イオンの d 軌道の分裂の大きさに対応します。
- 強いフィールド配位子を交換弱いフィールド有機配位子のソリューションです。
- ニッケルの硫酸塩の水溶液の光が表示されます緑のため Ni (H2O)62 +複雑なフォーム。
- 順番に攪拌しながらニッケル含有溶液にアンモニア、エチレンジアミン、ジメチルグリオキシム、シアン化物のソリューションを追加します。
- 各付加の後で前の色が消え、新しい色が表示されます。
- 色の変化は、配位子の強さによって駆動される新しい調整の複合体の形成を示します。これらは、各反作用のための平衡定数によって定量することができます。
Ni (H2O)62 +(aq) + 6 NH3 (aq) → Ni (NH3)62 + (aq) + 6 H2[ok]eq = 1.2 × 109
Ni (NH3)62 + (aq) + 3 en(aq) → Ni(en)32 + (aq) + 6 NH3 (aq) Keq = 1.1 × 109
Ni(en)32 + (aq) + 2 Hdmg(aq) → Ni(dmg)2 (s) 3 en(aq) + 2 H+ (aq) Keq 1.35 x 10 =5
Ni(dmg)2 (s) + 4 CN- (aq) - → Ni(CN)4-2 (aq) + 2 dmg- (aq) Keq 6.3 x 10 =7 - 各反応の平衡定数が非常に大きい (> 1)、反応がすべて製品の駆動であることを示します。
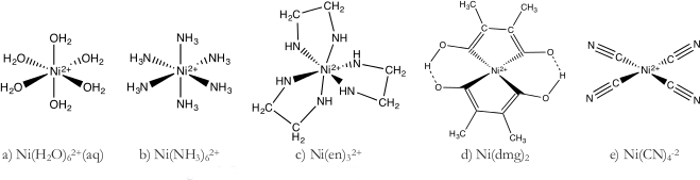
図 1。E はニッケル (II) 錯体の構造。
申請書と概要
人々 に顔料から遷移金属は、化学、生物学、地質学、工学の分野で発見されます。さまざまな化学状態下での遷移金属の挙動を理解することは、監視色または磁気的挙動のような単純なことができます。ほぼすべての 3 d (4番目の行) の遷移金属は重要な生理機能と、すべてのケースでこれらの金属はフォーム錯体配位子によってバインドされます。たとえば、鉄はすべての脊椎動物の酸素の輸送に不可欠です。ヘモグロビン、複雑なタンパク質には、Fe2 +それぞれの中心で 4 つのヘム サブユニットが含まれています。ヘモグロビン、Fe2 +はキレート tetradentate リングとヒスチジン残基、それに正方形ピラミッド (5 面)。酸素が存在する場合、サブユニットは正八面体になります。O2は強磁場配位子大きい d 軌道 t2 geg分割、低スピンを引き起こすと考えられています。比較的高エネルギーの光は、明るい赤色が現れる (幹線) 酸素を作る青い光が吸収されるので、eg状態に電子を促進するために必要です。対照的に、脱酸素化 (静脈) が小さい d 軌道分裂と低エネルギー赤い光を吸収すると、暗い、紫色赤表示される脱酸素化血を作るします。同じ点で一酸化炭素 CO、強磁場配位子、酸素を転置します。それは血に強いフィールド分割により明るい赤い外観を与えます。血液中の O2 CO の優遇バインディング頻繁致命的です。
錯体化学の別のアプリケーションは、塗料と顔料です。多くの顔料は単純な金属酸化物、プルシャン ブルーやフタロシアニン青のような他の色が d 軌道関数 (図 2) の分割から生じる錯体です。プロイセン青、鉄は高スピン鉄 (III) 錯体を複雑な Fe(CN)63-を作成する六つのシアン化リガンドに囲まれて。Tetradentate フタロシアニン分子に囲まれた中心部の銅 (II) イオンと別の化合物、フタロシアニン青は平面です。
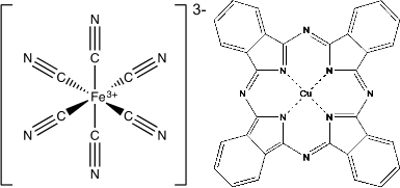
図 2。プルシアン ブルー、鉄を中心とした調整の複合体、フタロシアニン青、銅を中心とした調整の複合体。
周辺の配位子と金属イオン センターと充電のバランスがイオン錯体があります。リガンドは、単座または 2-4 添付ファイルをサイトとキレートをすることができます。配位子は金属の d 軌道を分割する配位子の相対強度を分類する分光化学系列にも分類されます。色と磁気特性は金属と、配位子によって異なります。大きい d 軌道分裂高いエネルギーの軌道に電子を促進するために大きなエネルギーを必要とし、高エネルギー光 (短波長) を吸収します。これらは低スピン錯体であり、対電子の最大数があります。対照的に、小さな d 軌道分裂弱いフィールドとして知られている低エネルギーの光を吸収するし、不対電子の最大数は。料金とバインドされた配位子と金属イオンのアイデンティティ錯体の観察された色と磁気特性の両方を定義します。
参考文献
- Shakhashiri, B. Z.; G. E. Dirreen, G. E; Juergens, F. Color, Solubility, and Complex Ion Equilibria of Nickel (II) Species in Aqueous Solution. J. Chem. Ed. 52 (12), 900-901 (1980).
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
錯体化学
General Chemistry
91.7K 閲覧数

共通の実験室ガラス製品と用途
General Chemistry
658.3K 閲覧数

・濃度
General Chemistry
275.1K 閲覧数

固体と液体の密度を決定します。
General Chemistry
556.8K 閲覧数

水溶液の質量パーセントの組成を決定します。
General Chemistry
383.8K 閲覧数

経験式を決定します。
General Chemistry
183.7K 閲覧数

イオン性化合物の溶解度ルールの決定
General Chemistry
141.6K 閲覧数

PH メーターを使用してください。
General Chemistry
346.7K 閲覧数

滴定の概要
General Chemistry
425.4K 閲覧数

理想気体法律
General Chemistry
79.0K 閲覧数

平衡定数の吸光光度定量
General Chemistry
158.7K 閲覧数

ル Châtelier の原理
General Chemistry
265.8K 閲覧数

未知の化合物を決定するための凝固点降下
General Chemistry
160.8K 閲覧数

率の法律および反作用の順序を決定します。
General Chemistry
196.3K 閲覧数

エンタルピーの示差走査熱量測定の変更を使用してください。
General Chemistry
44.7K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved