滴定の概要
概要
ソース: 博士イー姉タンの研究室-科学技術研究庁
滴定は、定量的識別された試料の未知濃度を決定するために使用する一般的な手法です。1-4ボリュームの測定容量分析とも呼ばれますがそれは滴定で非常に重要です。彼らを悪用する反応の種類に基づいて滴定の多くの種類があります。最も一般的な種類は、酸塩基滴定や酸化還元滴定です。5-11
典型的な滴定プロセスの標準溶液をビュレットで滴定液が三角フラスコで未知濃度の試料と反応するため徐々 に適用されます。酸塩基滴定、pH 指示薬は、滴定の終点を示す試料溶液中通常追加されます。12 pH インジケーターを追加するではなく pH も監視できます滴定プロセス中に pH メーターを使用して、エンドポイントは pH 滴定曲線からグラフィカルに決定されます。エンドポイントで記録された滴定液の体積は、反応の化学量論に基づく試料の濃度を計算する使用できます。
酸塩基滴定をこのビデオで提示して、滴定すると、標準化された水酸化ナトリウム溶液、試料は国内酢。酢は、料理の薬味や調味料として頻繁に使用される酸性の液体です。酢は主に酢酸 (CH3COOH) と水で構成されています。商業酢の酢酸含量が大きく異なることができ、この実験の目的は、滴定法による商業酢の酢酸含量を決定することです。
原則
酢の酢酸の決定は、酸塩基滴定方法の原則に基づいています。水酸化ナトリウムと CH3COOH の反応は、式 1のとおりです。
CH3COOH(aq) + 水酸化ナトリウム(aq) → H2O(l) + NaCH3CO2(aq) (1)
標準化された NaOH 水溶液は、終了点に到達するまで徐々 に濃度未知の酢酸と酢に追加されます。酸塩基滴定で pH は追加試薬量の関数としてプロットできます。酸・塩基、溶液中の化学量論組成の同量がある点、曲線の変曲点は、当量点と呼ばれます。ほとんどの酸と塩基は、無色、当量点で発生している目に見える反応がないです。当量点に到達したときを観察するには、pH インジケーターが追加されます。エンドポイントは、当量点が pH 指示薬の色が変化するポイントではありません。適切な pH インジケーターを選択すると、終了点は可能な限り滴定の当量点の近くにすることが重要です。
この反応の終了時点では、共役基本 NaCH3CO2は若干基本です。フェノールフタレイン インジケーターが作業 ph 8.3-10.0 の酸性溶液 pH 8.2 上記マゼンタで無色であります。したがって、フェノールフタレインは、それは無色からこの状態でピンクに変わります最寄りのインジケーターです。実験を実行すると、pH 指示薬自体が通常の弱酸基と反応するので pH 指示薬の濃度を低く維持することをお勧めします。
終点に追加された標準化された NaOH 溶液の量は、上記の同等化の化学量論に基づく酢酸のモル濃度を計算するし使用できます。この実験で滴定すると水酸化ナトリウムは強いアルカリと試料の酢酸は弱い酸。
実験を実行する前に、水酸化ナトリウムの吸放湿の性質を考慮することが重要です。このプロパティには、フタル酸水素カリウム (会社 khc の株式8H4O4) など安定した一次標準と標準化にそのソリューションが必要です。NaOH 溶液の正確なモル濃度は、標準化した後正確に決定することができます。標準プライマリ酸と水酸化ナトリウムとの反応は、式 2のとおりです。
会社 khc の株式8H4O4(aq) + 水酸化ナトリウム(aq) → H2O(l) + NaKC8H4O4(aq) (2)
詳細なステップバイ ステップの滴定のプロトコルは、次のセクションで示されます。
手順
1. カリウム Hydrogenphthalate (会社 khc の株式8H4O4) と NaOH の標準化
- まず、滴定液、水酸化ナトリウムを標準化する必要があります。脱イオン水 100 mL に水酸化ナトリウム ペレットの約 4 g を溶解することにより在庫 NaOH 溶液を準備します。水酸化ナトリウムが皮膚に腐食性である有害化学物質、刺激剤目、注意して、皮膚や眼との接触を避けるために適切な個人保護用具 (PPE) を着用することに注意してください。
- 1:10 を作る株式水酸化ナトリウム溶液 25 mL を 500 mL のボトルに追加することによって水酸化ナトリウム溶液の希釈。水酸化ナトリウムは二酸化炭素を吸収します。ゆで、脱イオン水、オーブン乾燥のボトルを使用し、迅速に、ボトルのキャップにすることによってこれを防ぐことが重要です。ソリューションを作るまで 250 mL の脱イオン水と混ぜてシェイク。
- 主な標準的な酸、会社 khc の株式8H4O の4 110 ° C 乾燥オーブンで 4 時間で 4-5 g の乾燥 1 時間デシケータ中の固形物を冷却します。
- 乾燥会社 khc の株式8H4O4 250 mL の脱イオン水で約 4 g を溶解します。質量を記録正確に。会社 khc の株式8H4O4溶液のモル濃度を計算します。
- 清潔で乾燥した三角フラスコに会社 khc の株式8H4O4の 25 の mL のピペットします。フェノールフタレインの 2 滴を追加し、よく混ぜて軽く旋回します。フェノールフタレインは毒性、刺激性、皮膚や眼との接触を避けるように用心深い。
- 50 mL ビュレットと洗剤と水で徹底的に漏斗をきれい。水をビュレットをフラッシュし、脱イオン水で 3 倍をすすいでください。水酸化ナトリウムが全体の内側の表面を濡らすことを確かめる x 希釈 NaOH 溶液 3 をビュレットの洗浄し、ドレインの先端を通して廃棄物。クランプで、ringstand にビュレットの洗浄をマウントし、それが垂直に立っていることを確認します。
- 希釈した NaOH 溶液できれいなビュレットを埋めます。それは、希釈した NaOH の量はいないゼロのマークで正確にする必要がありますが、スケール内で、少なくとも 1 つの滴定のために十分にする必要があります注意してください。気泡はボリュームの読み取りの精度に影響を与えます。空気泡のビュレットを入念にチェックし、優しくそれらをフリーでオープンさせる流れと同時に中の空気を解放する試薬の数 mL の活栓をビュレットをタップします。この最初のボリューム 10 s. レコードの後、メニスカスの下を表示することによってボリュームを読み取り。読書の有効数字に注意を払います。ML で小数点以下 2 桁に値を記録します。
- フタル酸水素カリウム (会社 khc の株式8H4O4) ビュレットの下でを含む三角フラスコを置き、ビュレットの高さを正しく調整します。ゆっくりとバルブ、およびその他のフラスコを旋回を調整して流量を制御する 1 つの手を使用して 1-2 mL ずつに NaOH 溶液を追加して会社 khc の株式8H4O4ソリューションを滴定しなさい。
- エンドポイントが近くに滴定液で滴を追加を開始します。ソリューションがかすかな、永続的なピンク色に変わったら、エンドポイントは達されます。ビュレットに希釈した NaOH の最終巻を記録します。
- 一貫性のあるデータを得るため、少なくともさらに 2 回の滴定を繰り返します。希釈した NaOH 溶液のモル濃度を計算します。
2. 酢標準化された水酸化ナトリウム溶液の滴定
- 水酸化ナトリウム溶液は今標準化し、酢を分析する、滴定液として使用できます。酢の刺激的な香りを減らすためには、希釈、1:10 でテストする酢の溶液 10 mL を 100 mL の容量に配給。
- (VAとして注意) 清潔で乾燥のエルレンマイヤー フラスコに試料の 25 の mL のピペットします。フェノールフタレインの 2 滴を追加します。
- プロシージャの最初の部分から標準化された NaOH 溶液をビュレットを埋めます。滴定液 (V1) の最初のボリュームを記録します。
- 徐々 に酢に標準化された NaOH 溶液を追加します。滴定液の体積が期待値に近づくときは、滴定液で滴を追加する活栓を調整します。片方の手でフラスコを旋回し、活栓を終了する準備がもう一方の手を続けます。検体のソリューションは、薄いピンク色に変わったら、一度色がフェードするかどうかを参照してくださいに数秒間旋回します。色が解決しない場合、滴定終点に達する。滴定液 (V1') の最終巻を記録します。ソリューション色フェードする場合、は、滴定液の 1 つ以上のドロップを追加します。洗浄ボトルを使用してビュレットの下部の先端を洗います。収集洗浄混合物と時計の色を試料溶液の変更します。終点まで滴定を続けます。必要な試薬の量を記録 (Vt1 = V1' V1)。
- 0.1 mL 互いの内にある 3 つの一致値の少なくとも 2 倍まで滴定を取得 (Vt2および Vt3) を繰り返します。
- 3 つの異なる滴定で得られた 3 つの値を使用して滴定液量の平均値を計算する: Vt = (Vt1 + Vt2 + Vt3)/3。酢の酢酸のモル濃度は、方程式 3を使用してこのように計算できます。
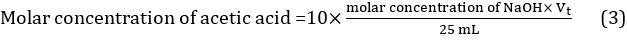
結果
| ユニット | トライアル 1 | トライアル 2 | トライアル 3 | |||
| 希釈酢酸 (VA) のボリューム | mL | 25.00 | ||||
| 水酸化ナトリウム (NaOHc) のモル濃度 | mol/L | 0.09928 | ||||
| NaOH の初期のビュレットの読書 | mL | 0.10 | 0. 05 | 1.20 | ||
| NaOH の最終的なビュレットの読書 | mL | 18.75 | 18.60 | 19.80 | ||
| 調剤 NaOH の量 | mL | 18.65 | 18.55 | 18.60 | ||
| NaOH 調剤 (Vt) の平均容積 | mL | 18.60 | ||||
表 1。滴定結果。
サンプル計算:
KC8H5O4の質量 4.0754 g =
KC8H5O4モル質量 204.22 g/mol =
KC8H5O4 25.00 mL 標準溶液中のモルの数 =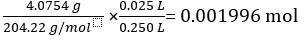
2 の同等化に従って
希釈した NaOH 溶液の濃度 =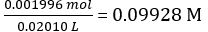
調剤 NaOH のモル水酸化ナトリウム × 平均量調剤 NaOH の濃度を = = 0.09928 mol/L × 18.60 mL = 1.847 × 10-3モル
1 の同等化に従って
CH325.00 mL 希釈酢の COOH の付加モル数 = 1.847 × 10-3モル
希釈酢の濃度 =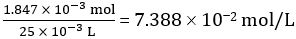
したがって原液の酢の濃度 = 10 × 7.388 102 mol/L = 0.7388 mol/L
上記の手順は、計算の手順を説明するために表示されます。我々 は単に 1 つのステップで原液の酢の濃度を取得する方程式 3 を適用できます。
したがって 1.000 L 原液の酢には、CH3COOH の 0.7388 mol が含まれています。
CH3COOH の量 =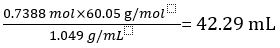
酢のボリューム % = 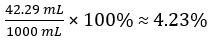
申請書と概要
滴定現在化学研究に頻繁に適用されている重要な化学的方法であります。たとえば、サンプルのアミンまたはヒドロキシルの値を決定する酸基盤の滴定が適用されます。アミン価は、KOH アミン含有サンプルの 1 グラムに相当のミリグラム数として定義されます。水酸基価を決定するには、KOH で滴定し、無水酢酸を使用、試料はまずアセチル化します。島のミリグラムの質量は、サンプルの 1 グラム中の水酸基に対応します。13別の例はウィンクラー テストでは、特定の種類の酸化還元滴定水質調査のための水の溶存酸素の濃度を決定するために使用します。溶存酸素は、ヨード、ヨウ化カリウムと反応する硫酸マンガン (II) の使用が減少します。リリースされたヨウ素は酸素含有量に直接比例して、酸素濃度は、澱粉の指標を用いたチオ硫酸ヨウ素滴定によって決定されます。14
基本的な化学の研究アプリケーション、ほか滴定も採用されている産業と毎日の使用で。バイオディーゼル燃料業界では通常望ましくない石鹸を作るために反応する遊離脂肪酸を削除する最初廃棄物の植物油 (WVO) を中和する必要があります。WVO の部分はバッチの残りの部分が正しく中和することができるので、サンプルの酸性度を決定するために塩基滴定します。15ベネディクトの法、尿中グルコース濃度の定量のためのテストは、医療の滴定の重要性を示す別の例です。この滴定で銅イオンが還元され銅イオン糖によるエンドポイントを示す、白い沈殿物を形成するチオシアン酸カリウムと反応しています。16
参考文献
- Llc, B. Titration: Ph Indicator, Thermometric Titration, Nonaqueous Titration, Equivalence Point, Acid-Base Titration, Amperometric Titration. General Books LLC, (2010).
- Jacobsen, J. J., Jetzer, K. H., Patani, N., Zweerink, G. & Zimmerman, J. Titration Techniques. J. Chem. Educ. 72, 612, doi:10.1021/ed072p612 (1995).
- Harris, D. C. Quantitative Chemical Analysis. 8th edn, W. H. Freeman, (2010).
- Mattock, G., Taylor, G. R. & Paul, M. A. pH Measurement and Titration. J. Electrochem. Soc. 110, 31C, doi:10.1149/1.2425702 (1963).
- De Levie, R. Aqueous Acid-base Equilibria and Titrations. Oxford University Press, (1999).
- Cannan, R. K. The Acid-Base Titration of Proteins. Chem. Rev. 30, 395-412, doi:10.1021/cr60097a005 (1942).
- Michalowski, T. & Lesiak, A. Acid-Base Titration Curves in Disproportionating Redox Systems. J. Chem. Educ. 71, 632, doi:10.1021/ed071p632 (1994).
- Waser, J. Acid-base Titration and Distribution Curves. J. Chem. Educ. 44, 274, doi:10.1021/ed044p274 (1967).
- Gorbikova, E. A., Vuorilehto, K., Wikström, M. & Verkhovsky, M. I. Redox Titration of All Electron Carriers of Cytochrome c Oxidase by Fourier Transform Infrared Spectroscopy. Biochemistry 45, 5641-5649, doi:10.1021/bi060257v (2006).
- Silverstein, T., Cheng, L. & Allen, J. F. Redox Titration of Multiple Protein Phosphorylations in Pea Chloroplast Thylakoids. Biochim. Biophys. Acta (BBA)-Bioenerg. 1183, 215-220, doi:10.1016/0005-2728(93)90022-8 (1993).
- Lenghor, N., Jakmunee, J., Vilen, M., Sara, R., Christian, G. D. & Grudpan, K. Sequential Injection Redox or Acid-Base Titration for Determination of Ascorbic Acid or Acetic Acid. Talanta 58, 1139-1144, doi:10.1016/S0039-9140(02)00444-7 (2002).
- Mitchell, P., Moyle, J. & Smith, L. Bromthymol Blue as a pH Indicator in Mitochondrial Suspensions. Eur. J. Biochem. 4, 9-19, doi:10.1111/j.1432-1033.1968.tb00166.x (1968).
- Perkins, E. G. Analyses of Fats, Oils and Derivatives. AOCS press, (1993).
- Spellman, F. R. Handbook of Water and Wastewater Treatment Plant Operations. 2 edn, CRC Press, (2009).
- Purcella, G. Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press, (2007).
- Nigam. Lab Manual Of Biochemistry. Tata McGraw-Hill Education (2007).
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
滴定の概要
General Chemistry
423.3K 閲覧数

共通の実験室ガラス製品と用途
General Chemistry
653.2K 閲覧数

・濃度
General Chemistry
273.0K 閲覧数

固体と液体の密度を決定します。
General Chemistry
554.7K 閲覧数

水溶液の質量パーセントの組成を決定します。
General Chemistry
383.0K 閲覧数

経験式を決定します。
General Chemistry
179.9K 閲覧数

イオン性化合物の溶解度ルールの決定
General Chemistry
141.1K 閲覧数

PH メーターを使用してください。
General Chemistry
344.2K 閲覧数

理想気体法律
General Chemistry
78.1K 閲覧数

平衡定数の吸光光度定量
General Chemistry
158.2K 閲覧数

ル Châtelier の原理
General Chemistry
263.9K 閲覧数

未知の化合物を決定するための凝固点降下
General Chemistry
160.4K 閲覧数

率の法律および反作用の順序を決定します。
General Chemistry
195.7K 閲覧数

エンタルピーの示差走査熱量測定の変更を使用してください。
General Chemistry
44.4K 閲覧数

錯体化学
General Chemistry
91.2K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved