6.12 : 반응 엔탈피
Hess의 법칙은 반응제 및 제품의 형성의 해당 엔탈피를 사용할 수 있는 경우 어떤 반응의 엔탈피 변화를 결정하는 데 사용할 수 있습니다. 주요 반응은 단계적 반응으로 나눌 수 있습니다 : (i) 반응체의 분해는 그들의 성분 요소로, 엔탈피 변화가 반응제의 형성의 엔탈피의 네거티브에 비례하는, -ΔHf°(reactants), (ii) 원소의 재조합(1단계에서 얻어진) 이어서 제품을 제공하기 위해, 제품의 형성의 엔탈피에 비례하는 엔탈피 변화와 함께, ΔHf°(제품). 전체 반응의 표준 엔탈피 변화는 따라서 동일하다 : (ii) 모든 제품의 형성의 표준 엔탈피의 합계 플러스 (i) 반응제의 형성의 표준 엔탈피의 네거티브의 합계, ∑ 나타내는 다음 방정식에 의해 주어진 바와 같이, ∑ "의 합"과 n 스토이치메트릭지오 계수에 대한 의미.
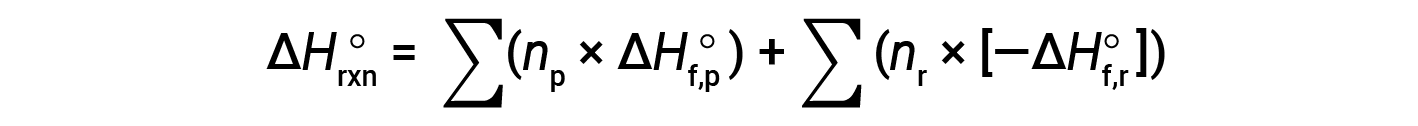
방정식은 일반적으로 다음과 같이 작성할 약간 재배열됩니다.
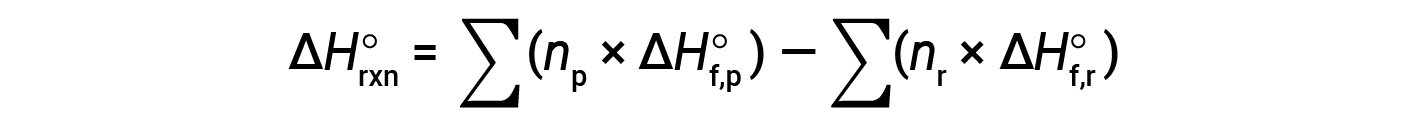
다음 예제에서는 이 방정식이 유효한 이유와 이 방정식을 사용하여 반응에 대한 표준 엔탈피 변경을 계산하는 방법을 자세히 보여 줄 수 있습니다.

여기서, 헤스의 법칙과 반응제 및 제품에 대한 형성 값의 열의 특별한 형태가 사용된다: ΔHf° (HNO3)= -206.64 kJ /mol; ΔHf° (NO) = +90.2 kJ/mol; ΔHf° (NO2)= +33 kJ/mol; ΔHf° (H2O) = -285.8 kJ /mol.


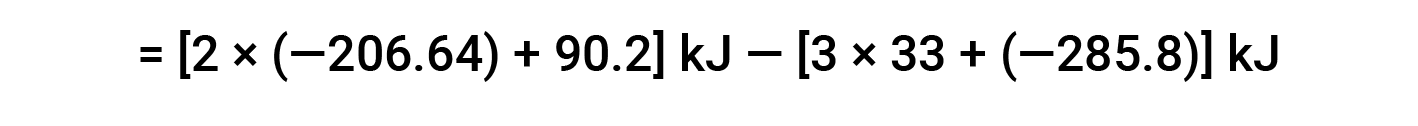
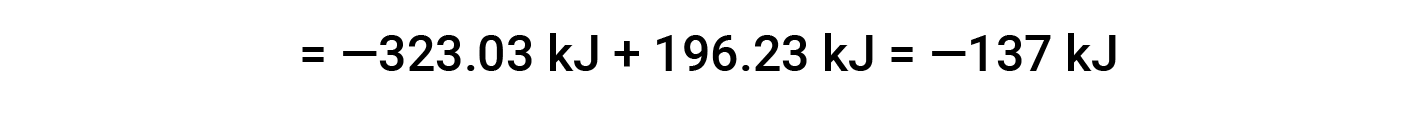
장에서 6:

Now Playing
6.12 : 반응 엔탈피
열화학
31.4K Views

6.1 : 에너지 기초
열화학
36.9K Views

6.2 : 열역학 제1법칙
열화학
31.4K Views

6.3 : 내부에너지
열화학
28.7K Views

6.4 : 열의 수량화
열화학
53.8K Views

6.5 : 일의 수량화
열화학
19.0K Views

6.6 : 엔탈피
열화학
34.7K Views

6.7 : 열화학 반응식
열화학
28.2K Views

6.8 : 일정 압력 열 계량법
열화학
84.6K Views

6.9 : 일정 부피 열 계량법
열화학
26.8K Views

6.10 : 헤스의 법칙
열화학
44.4K Views

6.11 : 표준 생성 엔탈피
열화학
41.0K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유