7.14 : 쌓음 원리와 훈트 규칙
특정 원자에 대한 전자 구성을 결정하기 위해 원자 수의 순서로 구조를 구축할 수 있습니다. 수소로 시작하여 주기적인 테이블의 기간을 가로질러 계속, 우리는 핵에 한 번에 하나의 양성자와 하나의 전자를 적절한 서브쉘에 추가하여 모든 요소의 전자 구성을 설명합니다. 이 절차는 독일어 단어 aufbau에서 aufbau 원칙이라고합니다 ("구축"). 추가된 각 전자는 파울리 배제 원칙에 따라 허용된 양자 수에 의해 부과되는 제한에 따라 사용 가능한 가장 낮은 에너지의 서브셸을 차지합니다. 전자는 저에너지 서브쉘이 용량으로 채워진 후에만 고에너지 서브쉘에 들어갑니다. 도 1은 원자 궤도에 대한 충진 순서를 기억하는 전통적인 방법을 보여 줍니다.
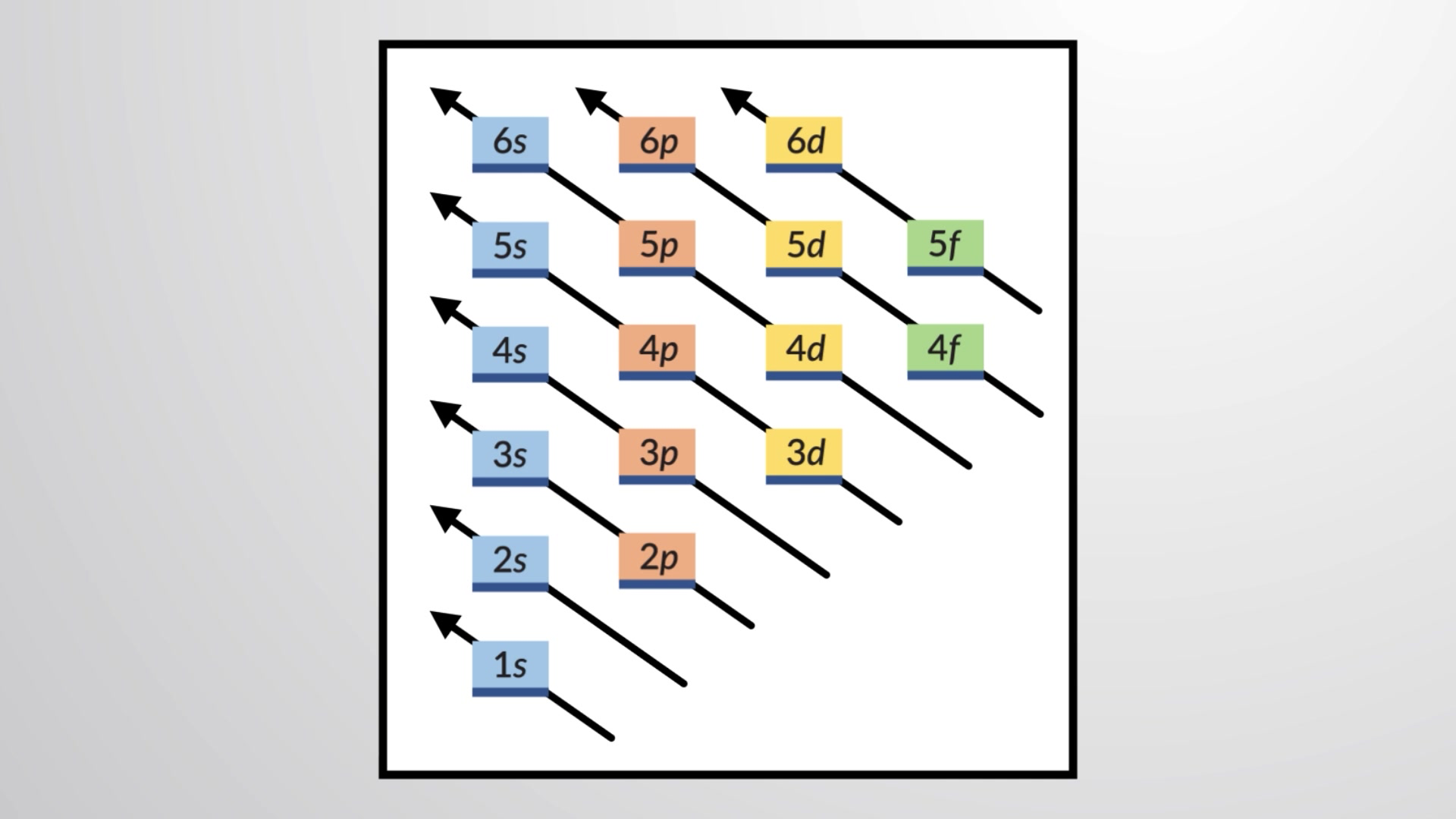
그림 1 이 다이어그램은 원자 궤도의 에너지 순서를 묘사하며 지상 상태 전자 구성을 도출하는 데 유용합니다.
원자 번호 6이 있는 요소인 탄소용 전자 구성을 작성하는 것이 좋습니다. 4개의 전자가1s와 2의 궤도를 채웁니다. 나머지 두 전자는 2p 서브쉘을 차지합니다. 우리는 지금 2p 궤도 중 하나를 채우고 전자를 페어링하거나 전자를 두 개의 서로 다른, 그러나 퇴화, p 궤도에서 짝을 이루는 떠나는 선택의 여지가 있습니다. 궤도는 Hund의 규칙에 의해 설명된 대로 채워져 있습니다: 퇴화 궤도 세트 내의 전자를 가진 원자에 대한 가장 낮은 에너지 구성은 짝이 없는 전자의 최대 수를 갖는 것입니다. 따라서, 탄소 2p 궤도에서 두 전자는 동일한 n, l, ms양자 번호를 가지며 ml 양자 번호(Pauli 제외 원칙에 따라)가 다릅니다. 탄소에 대한 궤도 다이어그램은 전자 구성1s2 2s2 1p2입니다.

질소(원자번호 7)는1s 및2s 서브쉘을 채우고 Hund의 규칙에 따라3개의 2 p 궤도 각각에 하나의 전자를 가지고 있습니다. 이 세 전자는 짝을 이루는 스핀을 가지고 있습니다. 산소(원자번호 8)는2p 궤도 중 하나에서 전자 쌍을 가지고 있으며(전자는 반대 회전을 가한다) 및 다른 두 개의 전자각각에 단일 전자가 있다. 불소(원자번호 9)는 페어링되지 않은 전자를 함유하는2p 궤도가 하나뿐이다. 고귀한 가스 네온(원자번호 10)의 모든 전자가 페어링되고, n=1 및 n=2 포탄의 모든 궤도가 채워져 있다.
장에서 7:

Now Playing
7.14 : 쌓음 원리와 훈트 규칙
원자의 전자 구조
43.5K Views

7.1 : 빛의 파장
원자의 전자 구조
48.0K Views

7.2 : 전자기파 스펙트럼
원자의 전자 구조
52.3K Views

7.3 : 간섭과 회절
원자의 전자 구조
30.4K Views

7.4 : 광전효과
원자의 전자 구조
29.1K Views

7.5 : 보어 모델
원자의 전자 구조
49.7K Views

7.6 : 방출 스펙트럼
원자의 전자 구조
49.3K Views

7.7 : 드브로이 파장
원자의 전자 구조
25.2K Views

7.8 : 불확정성 원리
원자의 전자 구조
22.9K Views

7.9 : 원자의 양자역학 모델
원자의 전자 구조
41.6K Views

7.10 : 양자수
원자의 전자 구조
34.1K Views

7.11 : 원자 궤도(오비탈)
원자의 전자 구조
32.9K Views

7.12 : 파울리의 배타원리
원자의 전자 구조
33.6K Views

7.13 : 원자 궤도(오비탈)의 에너지
원자의 전자 구조
23.6K Views

7.15 : 다전자 원자의 원자 배치
원자의 전자 구조
37.7K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유