기체 반응을 위한 동질적인 평형
가스상 반응의 경우, 평형 상수는 반응제 및 제품의 어금니농도(Kc)또는 부분 압력(Kp)의관점에서 발현될 수 있다. 이 두 K 값 간의 관계는 단순히 이상적인 가스 방정식과 어금니정의 정의에서 파생될 수 있습니다. 이상적인 가스 방정식에 따르면:
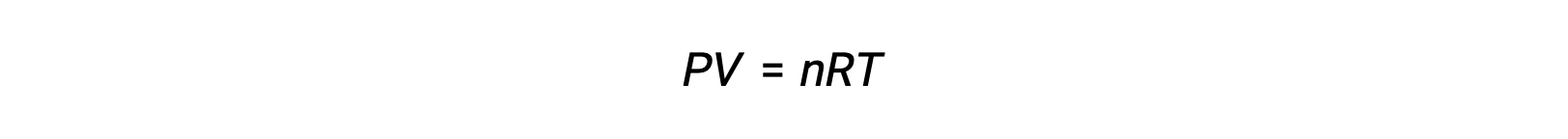
어금니 농도 또는 어모는 볼륨으로 나눈 두더지의 수에 의해 주어집니다:
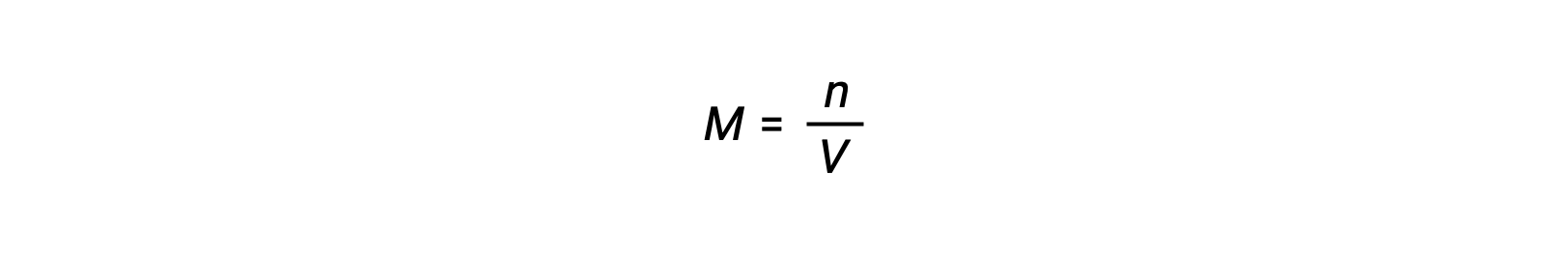
따라서
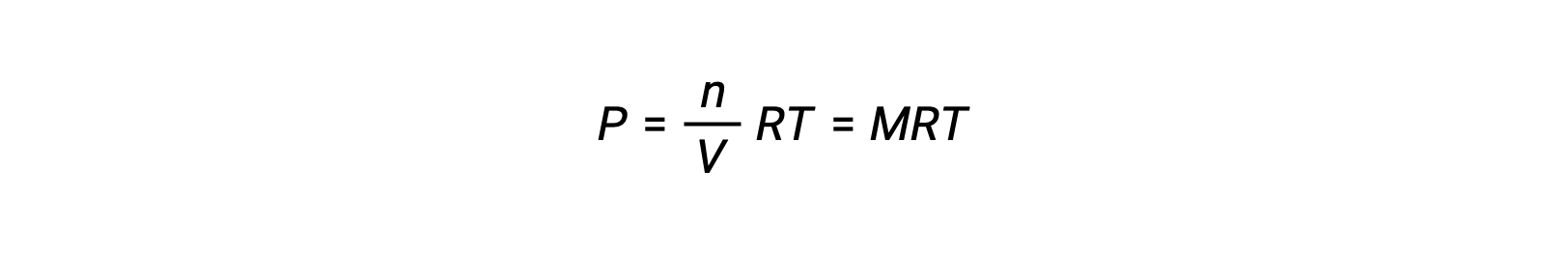
P가 부분압력인 경우, V는 부피이고, n은 두더지의 수이고, R은 가스 상수, T는 온도이고, M은 어금니 농도이다.
가스 상 반응: m A + n B ⇌ x C + y D
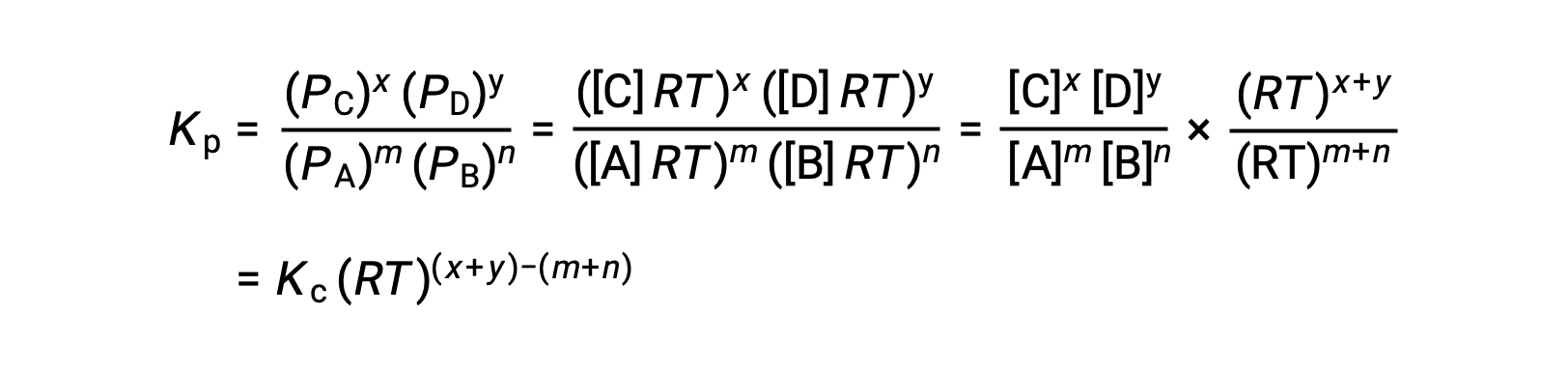
그래서KC와 KP의 관계는
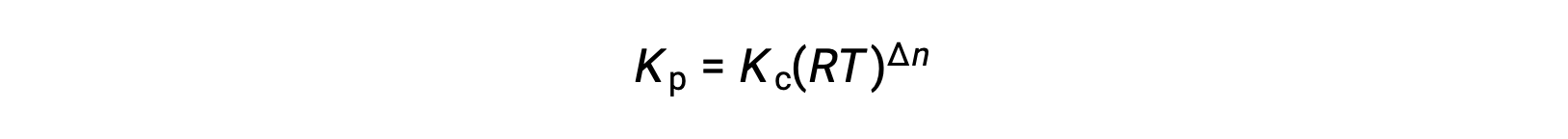
여기서 Δn은 제품 및 반응제 가스의 어금다량의 차이입니다.
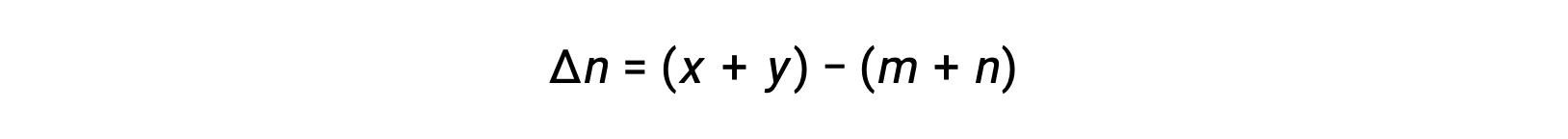
장에서 14:

Now Playing
14.3 : 기체 반응과 불균일계 반응의 평형
화학 평형
23.2K Views

14.1 : 동적평형
화학 평형
48.5K Views

14.2 : 평형상수
화학 평형
45.0K Views

14.4 : 평형상수 계산
화학 평형
29.7K Views

14.5 : 반응지수
화학 평형
47.1K Views

14.6 : 평형 농도 계산
화학 평형
46.0K Views

14.7 : 르샤틀리에의 원리: 농도 변화
화학 평형
56.3K Views

14.8 : 르샤틀리에의 원리: 부피 변화 (압력 변화)
화학 평형
33.2K Views

14.9 : 르샤틀리에의 원리: 온도 변화
화학 평형
28.2K Views

14.10 : 작은 x 가정
화학 평형
45.3K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유