수산화 및 수산화 이온은 순수한 물과 모든 수성 솔루션에 모두 존재하며, 그 농도는 물의 이온 생성물에 의해 결정된 바와 같이 반비례한다(Kw). 용액에서 이러한 이온의 농도는 종종 용액의 특성과 다른 솔틸테의 화학 적 행동의 중요한 결정요인입니다. 두 가지 솔루션은 100만 배, 10억 또는 심지어 조 배에 달하는 하이드로늄 또는 수산화 이온 농도에서 다를 수 있습니다. 많은 수주에 걸쳐 수량을 표현하는 일반적인 방법은 로그와스믹 스케일을 사용하는 것입니다. 따라서 용액의 pH는 [H3O+]용액에서 하이드로늄 이온의 어금니 농도인 다음과 같이 정의됩니다.
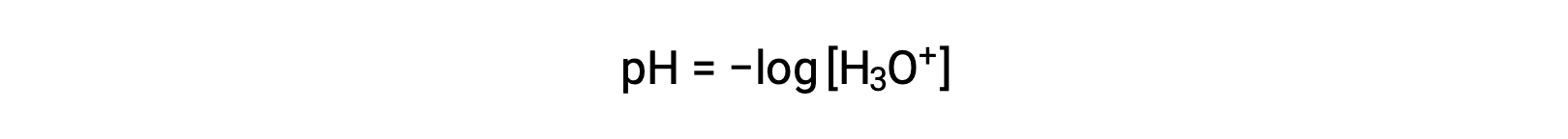
하이드로늄 이온 어금니를 분리하기 위해 이 방정식을 재배치하면 동등한 표현식이 생성됩니다.
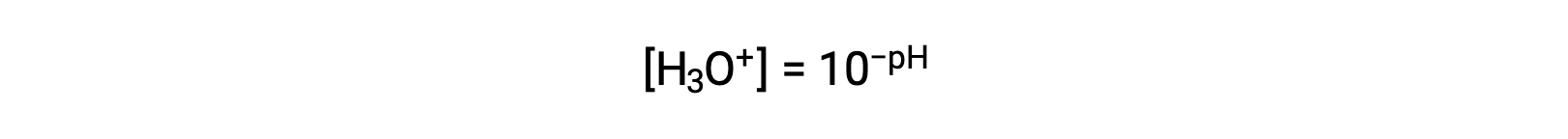
마찬가지로, 수산화이온 어모함은 p-function 또는 pOH로 표현될 수있다:
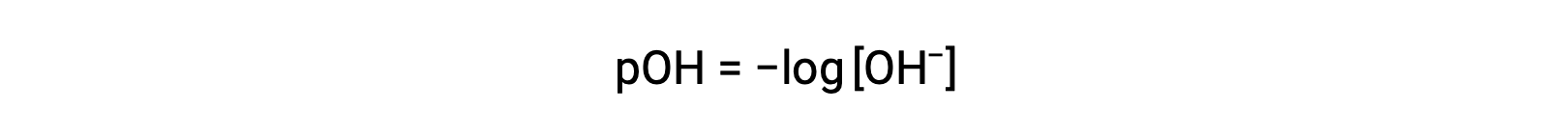
또는
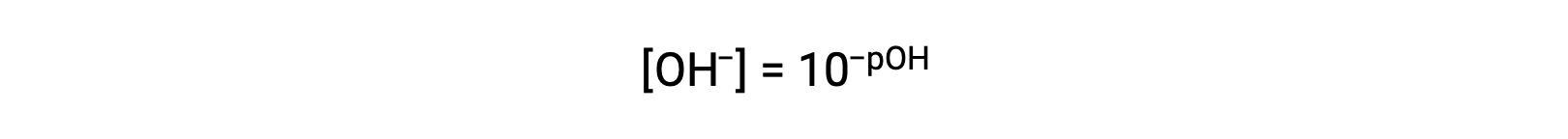
마지막으로, p-functions로 표현된 이 두 이온 농도 사이의 관계는 KW 식에서 쉽게 파생됩니다.
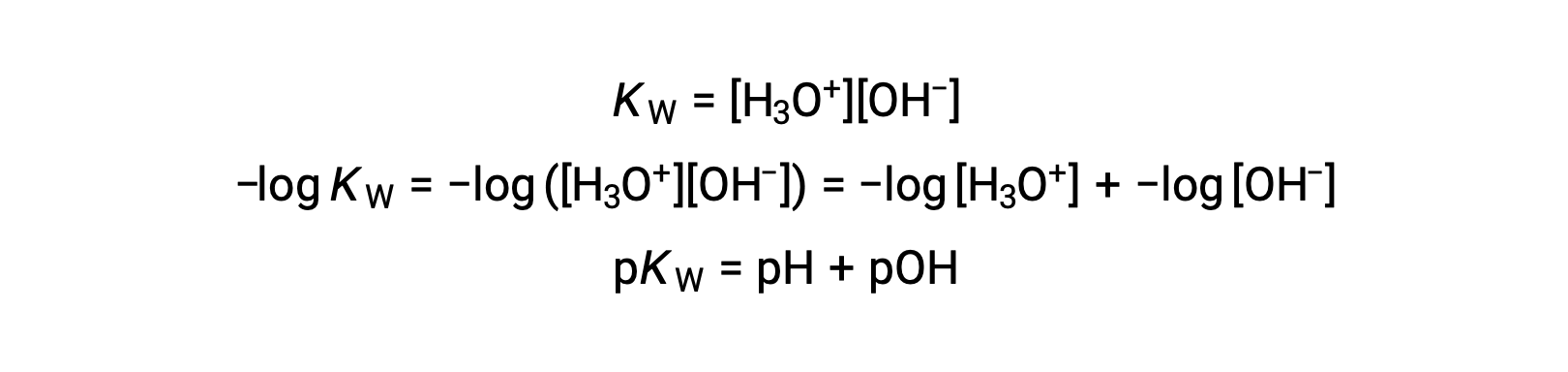
25 °C에서 K W의 값은 1.0 × 10-14이므로다음과 같은 것입니다.
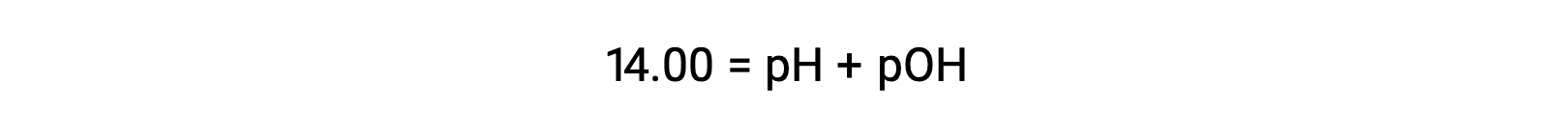
순수한 물(또는 임의의 중성 용액)의 하이드로늄 이온 어모함은 25°C에서 1.0 ×10-7M이다. 따라서 이 온도에서 중립 용액의 pH 및 pOH는 다음과 같습니다.
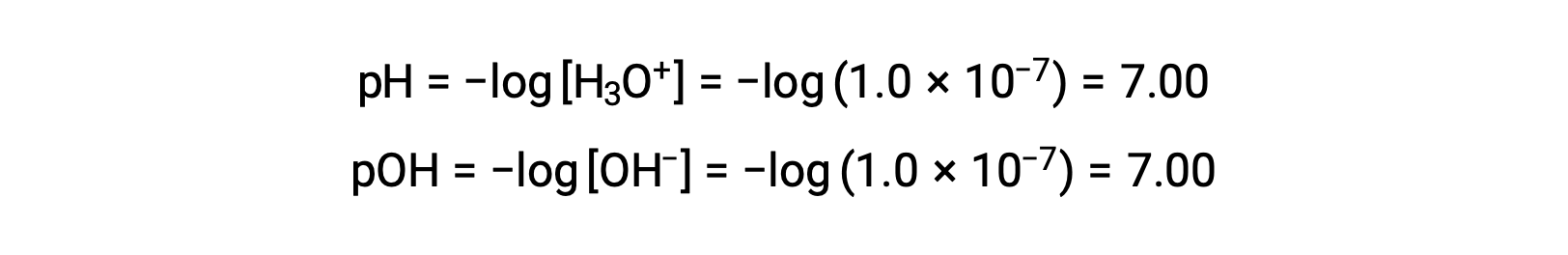
따라서, 이 온도에서 산성 솔루션은 1.0×10~7M 미만의 하이드로늄 이온 어금니를 가진 분이며 1.0× 미만의10-7M(pH 값 7.00 미만 및 7.00보다 큰 pOH 값)이다. 기본 솔루션은 1.0 × 보다 적은 하이드로늄 이온 어모를 가진 사람들 10-7 M 및 수산화 이온 어금니 1.0 보다 큰 1.0 × 10-7 M (7.00 보다 큰 pH 값 및 7.00 미만 pOH 값에 해당).
자가화 상수 KW는 온도에 따라 달라지므로 pH 값과 산성/중립/기본 형용사 간의 이러한 상관관계는 25°C 이외의 온도에서 상이할 것이다. 예를 들어, 80°C에서 순수한 물의 하이드로늄 어모함은 4.9 × 10-7 M이며, 이는 pH 및 pOH 값에 해당합니다.
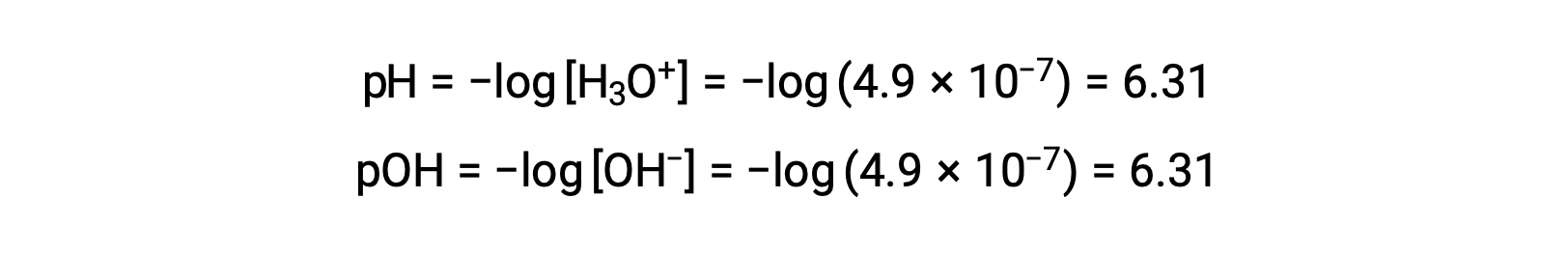
이 온도에서, 중성 솔루션은 pH = pOH = 6.31을 나타내며, 산성 솔루션은 6.31 미만의 pH를 나타내고 6.31보다 큰 pOH를 나타내며, 기본 솔루션은 6.31 보다 큰 pH를 나타내며 6.31 미만의 pOH를 나타낸다. 이러한 구별은 36 ~ 40°C 의 온도에서 온혈 유기체의 효소 반응과 같은 다른 온도에서 발생하는 특정 공정을 연구할 때 중요할 수 있습니다. 달리 언급되지 않는 한 pH 값에 대한 참조는 25 °C로 추정됩니다.
장에서 15:

Now Playing
15.4 : pH 척도
산과 염기
66.8K Views

15.1 : 브뢴스테드-로리 산 염기
산과 염기
88.1K Views

15.2 : 산/염기 세기와 해리상수
산과 염기
59.1K Views

15.3 : 물: 브뢴스테드-로리 산 염기
산과 염기
48.6K Views

15.5 : 짝산-염기쌍의 상대적 세기
산과 염기
44.4K Views

15.6 : 강산 용액과 강염기 용액
산과 염기
30.6K Views

15.7 : 약산 용액
산과 염기
36.9K Views

15.8 : 약염기 용액
산과 염기
21.9K Views

15.9 : 산 혼합
산과 염기
19.3K Views

15.10 : 산과 염기로서의 이온
산과 염기
22.7K Views

15.11 : 염용액의 pH 계산
산과 염기
42.7K Views

15.12 : 다양성자 산
산과 염기
28.3K Views

15.13 : 산 세기와 분자 구조
산과 염기
30.2K Views

15.14 : 루이스 산 염기
산과 염기
42.4K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유