JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
자궁의 자동 이식하여 수술 유발 Endometriosis의 마우스 모델
요약
장 장간막의 동맥 계단식으로 자궁 조직의 자동 이식에 의한 마우스 및 쥐에 endometriosis의 수술 유도의 설명입니다.
초록
Endometriosis 누구의 병인 알려지지 않은 남아 만성, 고통스러운 질병입니다. 또한, endometriosis의 치료 복강경 병변의 제거, 및 / 또는 통증과 불임 현상 만성 제약 관리를 요구할 수 있습니다. endometriosis와 관련된 비용은 미국 1 연간 22,000,000,000 달러로 추산되었습니다. 이 수수께끼의 질병을 기본 메커니즘에 대한 우리의 이해를 더하기 위해 동물 모델은 고용되었습니다. 영장류는 자발적으로 endometriosis를 개발하기 때문에 영장류 모델은 가장 밀접하게 여성 질환과 유사. 설치류 모델은, 그러나, 효과적인 비용과 2 쉽게 사용할 수 있습니다. 우리가 여기서 설명하는 모델은 장의 장간막 (그림 1) 자궁 조직의 autologous 전송을 포함하고 먼저 쥐 3 개발하고 나중에 마우스 4 전송되었습니다. 수술 유도 endometriosis의 autologous 설치류 모델의 목적은 모방하는 것입니다여성의 질병. 우리와 다른 이전에 변경 유전자 발현 패턴이 마우스 또는 질병 5,6있는 여성에서 관찰 쥐의 미러에서 endometriotic 병변에서 관찰하는 것으로 나타났습니다. 마우스에서 수술을 집도할 중 하나 장점은 가능한 유전자 변형 마우스 종자의 풍부한은 설치 및 endometriosis의 성장에 중요한 특정 구성 요소의 역할을 결정하는 연구자 도움 수있다는 것입니다. excised 인간 자궁 내막 조각이 immunocompromised 생쥐의 복막을 소개하는 대안 모델도 널리 사용되고 있지만 endometriosis 2,7에서 중요한 것으로 생각되는 정상적인 면역 체계의 부족에 의해 제한됩니다. 중요한 것은 수술 유도 endometriosis의 마우스 모델은 면역 체계 8, 9,10 호르몬과 환경 요인 11,12가 fert에 endometriosis뿐만 아니라 endometriosis의 효과에 미치는 영향 연구하는 데 사용되었습니다 다재 다능한 모델입니다ility 13 고통 14.
프로토콜
1. 라이브 - 동물 수술 계획
- 적절한 승인이 실험실 동물에서 작동하도록 수신되었는지 확인하십시오.
- 주문 마우스 및 새로운 환경에 acclimation 중 하나 이상 주 수 있습니다.
- 남성 페로몬에 노출의 부재에 보관되어 여성 쥐가 자전거를 막을 수 현상이 Whitten 효과 15,16이라고도합니다. 쥐 자전거 전송 소변 - 절어 남성 침구 여성 케이지마다 오일 유지합니다. 또한, 오픈 최고 케이지를 사용하는 경우, 여성이 정기적으로 순환 유지하는 남성의 두 케이지 사이의 여성의 새장을 넣으십시오.
- 그 생쥐는 (표 1) 수술을하기 전에 적어도 한 주일 동안 매일 질 세포학을 분석하여 17 사이클링 수 있도록.
- 여러 마우스의 질 뭉개진 수집 수 있도록 유리 슬라이드에 8 파티션을 생성하기 위해 왁스 연필을 사용합니다.
- 스포이트를 사용하여 0.2-0.25 ML 정상 식염수 또는 증류수로 음부를 플러시. 수의스포이트로 자궁 자극으로 그냥 질 구멍에 스포이트를 배치 ure 것은 pseudopregnancy가 발생할 수 있습니다. 세포 유형의 분석을 위해 유리 슬라이드에 질 세척을 넣으십시오. 슬라이드 신선한 읽기 (서부 유럽 표준시) 또는 다른 방법으로 고정 방법의 숫자와 표준 가벼운 현미경 17를 사용하여 검사하실 수 있습니다.
- 성공적인 무균 수술에 대한 모든 필요한 수술 장비 (자료 섹션을 참조하십시오) 18 청소 및 소독, 모아라.
- PBS의 진통제가 0.2 밀리그램 / kg 최종 투여량을 제공하는 살균 기술을 사용 buprenorphine 솔루션을 준비합니다. buprenorphine 솔루션의 농도는 0.0333 MG / 평균 성인 C57BL가 / 6 마우스가 약 0.025 kg와 마우스 당 0.15 ML의 피하 주사 부피 무게 가정 ML해야합니다. Buprenorphine은 미리 준비하고 aliquots로 저장할 수 있습니다. buprenorphine는 DEA 라이센스 및 세부 재고 로그를 필요로하는 일정 III 규제 약물됩니다.
- 페니실린 (100 U / ML) 및 스트렙토 마이신 (100 μg / ML)를 멸균 PBS를 준비합니다.
- 이전 유도 15 여성의 연습장 72시간에 소변 - 절어 남성 침구를 전송하여 발정주기를 동기화합니다.
2. 라이브 동물 수술에 대한 수술 영역을 준비
- 이전 18 설명된대로 수술 영역을 준비합니다.
- 전기 면도기, 안과 연고, 그리고 수술 스크럽을 설정하여 준비 영역을 준비합니다.
- 수술 전반에 걸쳐 체온을 유지하기 위해 외과 영역에 순환 온수 난방 패드를 배치하여 수술 영역을 준비합니다. 순환 온수 가열 패드를 통해 살균 방수 패드를 놓으십시오. 수술기구, 봉합, 멸균 유리 페트리 접시, 생검 펀치, 멸균 거즈, 상처 클립 및 멸균 수술 부위의 상처 클립 작은 주걱을 마련.
- 순환 온수 가열 패드 반 숙녀를 배치하여 복구 영역을 준비어 원할 경우 마우스가 열 멀리 이동할 수 있도록 빈 케이지.
3. 마취 및 수술 마우스를 준비
- 마우스의 무게를 기록하고 질 세포학을 평가하여 발정 단계를 결정합니다.
- 마취의 유도 들어, 빈 마취 챔버 (isoflurane에 대한 포털을 포함하는 고체 뚜껑이있는 빈 케이지)에 마우스를 놓으십시오. isoflurane 아닌 rebreathing 마취 시스템의 전원을 켜고 isoflurane 4% (0.5-1 L / 분 산소 흐름 속도)로 기화기를 설정합니다.
- 마우스가 준비 테이블에있는 원추의 isoflurane 원추형으로 흐름 (30-60 ML의 주사기 피복) 및 장소 마우스의 코와 입을 스위치 마취시. 적절한 마취는 수술 (~ 2.5-3.5 % isoflurane)의 나머지 부분에 걸쳐 isoflurane의 낮은 농도로 유지하실 수 있습니다. 마취의 적절한 깊이 발가락 핀치 자극에 대한 부정적인 반응에 의해 결정되어야합니다.
- 안과 연고의 t을 적용O는 수술 중에 눈을 건조하지 마십시오.
- 소형 전기 면도기를 사용하여 수술 사이트를 면도.
- 소독 세 chlorhexidine 스크럽의 교류 swipes 70 %의 에탄올과 수술 사이트를 준비합니다.
- 멸균 분야와 동물을 드레이프.
4. 자궁 내고
- 질구에 주동이의 1.0 cm - 작은 가위 또는 0.5을 종료 메스 블레이드 중 하나를 사용하여 소형 (~ 1cm) 중간선 절개를합니다.
- 날개가 시체 벽과 복벽 사이에하는 등 개방에 폐쇄 가위를 넣습니다. 부드럽게 천천히 복부 벽이 충분히 피부의 분리는 그러한 가위를 열고 닫는 절개 주변 지역을 해부하다 무딘. 절개 사이트 주변의 복벽과 피부 사이에 남은 볼 adhesions 신중 냈다 수 있습니다. 적절하게 절개 사이트를 해부하다 무딘 않으면 복부 벽을 더 어렵게 닫을 것입니다.
- 작은 F를 사용하여orceps, 부드럽게 왼쪽 자궁 경적을 찾습니다. 자궁 먼저 절개 사이트를 입력시 볼 무엇입니까 소장에 지느러미입니다. 어떤 경우에는 그것은 먼저 난소와 관련된 난소 지방 패드의 위치를 가장 쉽습니다. 부드럽게 자궁 뿔에 당겨와 견인기 역할로 아래 열린 포셉 밀어. 원하는 경우, 유도의 발정 단계 (표 1)에 관한 자세한 내용은이 때 난소와 자궁의 모양을 확인합니다.
- 부드럽게 뻗어 자궁 뿔 밑에 검은 꼰 5-0 실크 봉합사의 두 6-8cm 조각 (바늘없이)를 슬라이드.
- 안전 utero - tubual 교차점 (나팔관에 바로 꼬리)에서 각 위치에서 사각형 매듭을 사용하여 utero - 자궁 접합 (자궁 경부에 단지 주동이의)에서 경적을 ligate. 순간에 대한 봉합의 끝을 두십시오.
- 두 ligations 사이에 자궁 뿔의 부분을 잘라 살균 유리 페트리 접시 conta에 조직을 배치PBS가 포함된 페니실린 (100 U / ML) 및 스트렙토 마이신 (100 μg / ML)의 ~ 100 μL를 ining. 실크 봉합사 마지막의 끝을 잘라. 봉합사가 느슨하게하거나 거기에 출혈이있다 온다면, 선거 유세를 찾아 다른 매듭을 묶게.
5. excised 자궁에서 endometriotic 이식 준비
- excised 자궁가 조작되는 동안, 멸균 거즈로 복부를 커버하고 무균 PBS가 포함된 페니실린과 스트렙토 마이신과 필요에 따라 수화를 유지합니다.
- 지방의 excised 자궁 경적을 벗겨.
- 원하는 경우, excised 자궁 경적을 달다.
- 집게와 함께 경적을 누른 상태 루멘에 작은 가위 중 하나 블레이드 (14mm 블레이드의 길이)을 삽입하고 부드럽게 자궁 뿔 아래 가위를 슬라이딩하여 자궁 경적을 엽니다.
- 유리 페트리 접시에 세 동등한 크기의 보형물을 잘라 2mm 생검 펀치를 사용합니다.
6. 복막에 고인 endometriotic 이식을 Suturing
- 장소 steril즉시 절개 사이트와 멸균 PBS가 포함된 페니실린과 스트렙토 마이신과 함께 철저하게 서부 유럽 표준시 이상의 전자 거즈.
- 소규모로, 부드러운 포셉 부드럽게이게 맹장을 찾아 소장 rostrally 따라 이동합니다. 장 장간막의 동맥 폭포가 명확하게 볼 수 있도록이게 맹장에서 최소한 두 동맥 거리에 있으며 사전 침수 거즈에 부채처럼 배열 소장의 작은 (4~5센티미터) 섹션을 가져옵니다. 무균 식염수에 항상 대장 촉촉한을 유지해야합니다. 참고 : 변의를 처리하는 동안 둥둥 이빨 집게를 사용하지 마십시오.
- 부드럽게 장에서 약 0.5 cm 동맥 하나의 임플란트 치료하기 위해 절단 바늘을 반대로, P - 1, 11mm, 팔분의 삼 원을와 6-0 검정 ethilon의 치료를 사용합니다.
- 참고 : 장 장간막은 복막의 얇은 층으로 덮여 있습니다. 동맥 주위 suturing 동안이 계층을 통해 깨끗한 패스를 만들기 위해주의하십시오. 복막이나 파열을 찢어하지로 천천히 조심스럽게을 통해 봉합 당겨동맥.
- 이렇게하면 혈액 흐름과 대장과 죽음 이후에 괴사의 손실을 초래할 수 있으므로 하나의 완전한이 노트는 열심히 봉합을 강화하지 않도록주의하고, 각 던져. 보형물의 2mm 이내에 치료를 낸다. 젖은 창자 다시 다음 보형물로 이동하기 전에 보습을 유지하기 위해 계속합니다.
- 주동이의 방향으로 이동, 소장의 다음 3~4cm 꺼내 부드럽게 이미 보형물이 들어있는 섹션을 대체합니다. 이전 보형물 사이트에서 하나 또는 두 개의 동맥을 생략하고 다음 이식 치료. 세번째 이식에 대해 반복합니다.
- 복강의 창자를 모두 교체하십시오.
7. 위장 수술
- 위장 수술은 더 조직이 장의 장간막에 봉합되지 것을 제외 endometriosis 수술과 같은 단계를 사용하여 수행됩니다.
- 4 단계에서와 같은 소비세 왼쪽 자궁 경적.
- Endometriotic 이식 (5 단계)은 위장 수술이 준비되지 않습니다.원하는 경우 excised 자궁 나팔은 폐기 또는 다른 목적으로 사용할 수 있습니다.
- 봉합하지만, 아니 조직은 6 단계에서와 같이 장의 장간막의 동맥 폭포 세 동맥 주위에 배치됩니다.
8. 수술 상처를 폐회
- 장기의 자신의 해부 학적 위치로 약 돌아 있는지 확인합니다.
- 복부 벽 가까이에 비 연동 연속 스티치에 5-0 코팅 vicryl 봉합사를 사용합니다.
- 피부를 닫습니다 9mm의 상처 클립을 사용합니다.
9. 동물을 복구
- 0.2 MG / kg의 투여에 대한 피하 주사를 통해 0.15 ml/25 g 마우스에서 0.33 밀리그램 / ML buprenorphine을 관리할 수 있습니다. Buprenorphine은 복구 프로세스를 길게 할 수 더 심혈관 / 호흡 우울증을 방지하기 위해 사후 operatively 관리합니다.
- 부드럽게 그것은 수술 도중에 흠뻑 젖을있다면 kimwipes이나 종이 타월로 마우스를 건조.
- 케이지 P에서 아래 장소 동물 복부 쪽artially 동물 복구하고 흉골 드러누움을 (마취 신속하게 풀려 흡입으로 5 분 이내) 회복 때까지 순환 온수 물 패드 위에.
10. 포스트 수술 치료
- 그들이 수술 다음과 같은 그들의 정상적인 동작을 회복 때까지 매시간 흉골 드러누움를 유지할 수있을 때까지 마우스는 15 분 간격으로 관찰해야합니다.
- 마우스는 수술 후 24 시간 이내에 정상 나타납니다. 마우스는 복구 및 건강의 흔적을 7~10일 매일 모니터링해야합니다.
- 동물이 가난 건강, 고통, 또는 고통에 있는지 표시가 감소 활동, 자기 절단, ungroomed 모양, 또는 hunched 자세를 포함합니다.
- 동물은 수술 후 24 시간 이내에 건강 것으로 나타나지 않으면 buprenorphine를 (0.2 밀리그램 / kg) 관리하거나 동물을 안락사 중. 동물은 추가 buprenorphine 행정 동물 shoul 8 시간 이내에 개선되지 않으면대장 괴사 가능성이 그대로 D euthanized 수 있습니다.
- 70-10일 포스트 유도 상처 클립을 제거합니다.
- 실험 기간 동안 질 세포학의 시험으로 발정 cyclicity을 지속적으로 모니터. 1.3 단계에서 설명한대로 여성 연습장 소변 - 절어 남성 침구를 전송하여 72시간 이전 컬렉션에 발정주기를 동기화합니다.
11. 검시 및 조직 절단
- 검시의 타이밍은 특정 연구 질문에 의존하고 있으며 더욱 담당자 결과와 토론에 설명되어 있습니다.
- 이산화탄소 질식하여 마우스를 안락사.
- (원하는 경우) 1cc 주사기에 23 게이지 바늘을 사용하여 심장 소중히하여 혈액을 수집합니다.
- 컬렉션 17 시간에 발정 단계를 결정하기 위해 위에서 설명한대로 질 세포학의 얼룩를 수집합니다.
- utero - 튜발 교차로에 남아있는 자궁 경적을 잘라 자궁 경부에로, 지방 제거 무게, 및 프로세스(11.14와 11.15 참조) 원하는.
- endometriotic 병변 주위의 검은 봉합을 찾습니다. 사진 그대로 endometriotic 병변하면 원하는.
- 조심스럽게하지 랜스 병변에주의하고, 작은 가위와 집게로 endometriotic 병변을 둘러싼 adhesions을 해부하다. RNA 저하를 방지하기 위해 신속하고 신중하게 작동합니다.
- 측정 및 캘리퍼스를 사용하여 endometriotic 병변의 길이와 너비를 기록합니다.
- 소비세 종이 타월에 endometriotic 병변과 장소는 PBS로 moistened. 병변에서 이외의 endometriotic 조직을 제거합니다. 해부 현미경이나 돋보기 스탠드는 절개의 원조하는 데 사용할 수 있습니다.
- 이전에 봉합사를 제거하기위한 세 유체 가득한 endometriotic 병변 나가는거야.
- 부드럽게 endometriotic 병변에서 치료를 제거합니다.
- 조직학 들어, 포르말린 수정 한 유체 세 삼십분 PBS의 세척 및 최종 저장하여 다음에 두 시간 endometriotic 병변을 가득 차서 내가N 70 % 에탄올. 탈수 및 파라핀이 포함.
- endometriotic 병변의 랜스 둘. 다시 이것을 무게. 주기적 호르몬 변화가 낭종 유체의 양을 변경할 수 있기 때문에, 이것은 낭종의 무게 플러스 11.10로 측정 등 유체 이외에 조직 젖어 무게 측정을 제공합니다.
- RNA 분리 및 유전자 표현 연구, 즉시 -80에서 용해 구속력 솔루션과 저장소에있는 lanced endometriotic 병변 (또는 ~ 20 μg 자궁) 중 하나 ° C RNAqueous 키트 (Ambion) 또는 기타 방법으로 미래의 RNA 분리에 대한로 homogenize 원하는.
- RNA, DNA, 또는 단백질의 향후 절연 경우, 즉시 두 번째 lanced endometriotic 병변 스냅인을 동결 (또는 ~ 20 μg 자궁) -80에서 액체 질소와 가게에 ° C.
대표 결과
수술 유도 endometriosis의 마우스 모델에서 Endometriotic 병변은 morphologically과 histologically에서 관찰 사람과 유사여성. 여성과 마우스 모델 모두에서 endometriosis의 Histological 분석 endometriotic 병변이 자궁 내막 분비와 기질 (그림 2A)를 포함하는 것을 나타냅니다. 생쥐의 Endometriotic 병변은 또한 여성 endometriosis의 일반적인 특징 (그림 2B) 19아르 hemosiderin - 라덴 macrophages를 포함합니다.
생쥐에서 제거 Endometriotic 병변 사흘 포스트 유도 (그림 3A) 염증과 출혈이 나타납니다. 마우스 모델에서 성장 endometriotic 병변의 2-4주 후 낭종 같은, 액체 복막 adhesions으로 자필 둘러싸여 (그림 3B와 3C)입니다. 유도에서 병변 무게에 비해 액체 가득 병변은 862퍼센트 하나 큰 두달 후 유도하고 lanced 병변이 각각 51% 및 172% 크고 (그림 4A 및 4B)되었습니다 3백6%되었고. 우리는 다섯 가지 실험 (그림 5)를 통해 포스트 유도 한 달시 자필 endometriotic 병변 가중치를 lanced 일관성있는 액체를 획득했습니다. 일개월 후시duction 유체가 채워진 (7.44 ± 3.75 MG)와 lanced (2.92 ± 1.23 MG) endometriotic 병변 무게는 크게 (피어슨 상관 계수가 0.669 =, P는 <0.001) 상관되었습니다.
마우스의 연령 연령 세와 십개월 사이의 생쥐에 대한 병변 크기에는 영향을주지 않았다. 둘 일개월에 가득이나 endometriotic 병변 무게를 lanced 유동 포스트 유도는 크게 동물의 나이와 상관 없다 (R = -0.136, P = 0.380과 R = -0.063, P = 0.698, 각각).되었습니다
마우스 자궁의 발정주기 동안 스테로이드 호르몬의 영향에 의한 크기 변화, 액체 유지, 세포 증식 및 외관을 겪습. 우리는 다른 발정 단계로 동물의 나머지 손상 자궁 뿔의 무게에 endometriotic 병변 무게를 비교했다. 우리는 자궁 무게와 액체 충만 또는 lanced endometriotic 나 사이의 중요한 상관 관계를 찾지 못했습니다한 달 게시물 유도 (각각 R = -0.046, P = 0.765과 R = 0.232, P = 0.155)에서 esion 무게.
생쥐의 endometriotic 병변에서 관찰 유전자 발현 패턴은 밀접하게 질병 5 여성의 보도 거울. 삼일로 세포외 기질 리모델링, 세포 부착 및 angiogenesis를 조절 후 유도 유전자는 매우 upregulated 있으며, 이들 유전자의 대부분은 성장을 1 개월로 upregulated 남아 있습니다.
그림 및 표

그림 1. 마우스 autologus 자궁 송금으로 endometriosis의 외과 유도. 왼쪽 자궁 경적은 출혈도 잡았 excised, 그리고 endometrium을 폭로하기 위해 길이 방향 열립니다. 창자 mesente의 동맥 폭포의 세 2mm 두 biopsies는 준비가되어 있으며 각각은 동맥 봉합합니다스피. 일개월 후 유도으로 endometriotic 병변은 액체 아르 자필 adhesions에 둘러싸여.
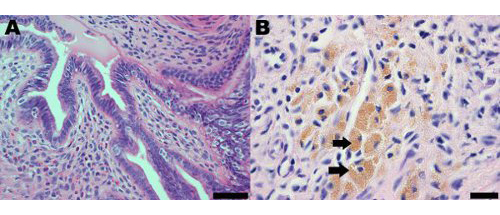
그림 2 일개월 후 유도에 endometriosis의 마우스 모델에서 자궁 내막 병변의 Hematoxylin 및 eosin 스테인드 섹션 시연 (A) 자궁 내막 분비과 존재 기질;. 스케일 바 = 50 μm의 및 (B) hemosiderin - 라덴 macrophages, 이 중 일부는 화살표로 표시되며 눈금 막대 = 20 μm의.

그림 3. 안락사 다음 마우스 모델에서 Endometriotic 병변, 중 삼일 후 유도 (A) 또는 일개월 후 유도 (B와 C).
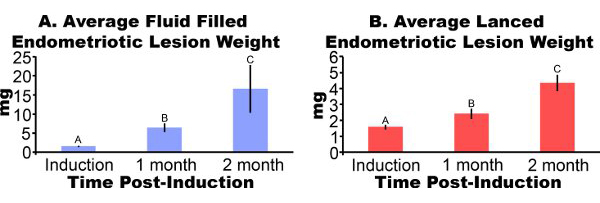
그림 4. 수술 EN을 유도 마우스에서 Endometriotic 병변dometriosis은 1 ~ 2 개월 후 유도에 excised와 무게가 있었다. 데이터는 평균 ± SEM 아르. 데이터 변환 로그인하여 다른 문자는 일방적인 피셔의 최소 유효 차이 Mulitple 비교하여 다음 편도 ANOVA하여 각 패널 내에서 의미를 나타냅니다했다. 유체 가득 endometriotic 병변처럼 (A) 낭종 (N 유도, 한 달, 또는 이개월 후 유도, 각각에 대해 = 10, 7 또는 5). (B) Lanced endometriotic 병변 (N = 유도 1 개월 또는 이개월 후 유도 각각 10, 8 또는 7).
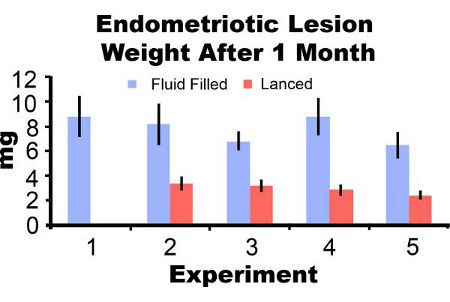
그림 5. Endometriotic 병변 서부 유럽 표준시 유체와 무게와 일개월 다섯 별도의 실험에서 포스트 유도에서 lanced. 데이터는 평균 ± SEM 아르. 마우스 N = 10, 6, 8, 7, 유체 가득한 병변과 0, 7 7, 10, 8, 각각 실험 1, 2, 3, 4, 5에 lanced 병변 8.

표 1. 질 세포학 및 난소와 자궁과 유도의 비주얼 외관에 의해 발정 단계의 전망대.
난소와 자궁의 외관은 시간 의존합니다. 다음은 각 사이클 하루 아침 8:00 주변 희생을 기반으로합니다. 또한, 관찰 주관하고 난소와 자궁 뿔을을 비교 것은 자궁 뿔을보다 더 나은 평가됩니다. 이러한 관찰은 매일 질 세포학의 결과에서 얻은 정보를 보완하기위한 있습니다.

표 2. 마우스 및 쥐에 수술의 비교.
Access restricted. Please log in or start a trial to view this content.
토론
생쥐에서 endometriosis의 수술 유도를 수행하는 동안 주목한다 몇 가지 중요한 매개 변수가 있습니다. 첫째, endometriosis는 에스 트로겐에 의존 질병 등이 수술로 손상 동물이나 또는 estrogens에 20 보충 ovariectomized 동물 수행해야합니다. 둘째, 동맥 폭포로 자궁 biopsies를 suturing 것은 극도의주의 수행해야합니다. 우리는 하나 두 비교적 느슨한 매듭을 사용하면 변의와 후속 조직 괴사 및 동물 죽음...
Access restricted. Please log in or start a trial to view this content.
공개
관심 없음 충돌 선언하지 않습니다.
감사의 말
최적화에서 지원 크리스 Kassotis이 원고의 중요한 검토 오드리 베일리와 박사 스콧 Korte, 요셉 Beeman, 앨리슨 Curfman, 폴 Kimball, 브리짓 Neibreggue, 야곱 Redel, 에이미 Schroder, Maija 스테인 버그, 그리고 스테이시 Winkeler 특별 감사 우리 연구실이 모델. 자금은 임상 Biodetectives 교육 그랜트 (NIH T90) (KEP), 미주리 생명 과학 대학 학부 연구 기회 프로그램, MU 연구위원회, 연구위원회 MU 부여와 NIH R21HD056441 (SCN)에 의해 제공되었다.
Access restricted. Please log in or start a trial to view this content.
자료
| Name | Company | Catalog Number | Comments |
| 시약 / 장비의 명칭 | 회사 | 카탈로그 번호 | |
| 왁스 연필 | 어부 | NC9954135 | |
| 유리 슬라이드 | 어부 | 12-550-433 | |
| 스포이트 | 어부 | S79383 | |
| 질 세포학 얼룩을 평가하기위한 표준 가벼운 현미경 | |||
| Buprenorphine HCL C3 (CARJET) 10X1ml | 버틀러 동물 건강 공급 | 022,891 | |
| 멸균 인산은 버퍼링 식염수 (PBS) | Gibco | 14040-117 | |
| 10,000 U / ML 페니실린, 0.85 % NaCl 10,000 μg / ML 스트렙토 마이신 | Hyclone | SV30010 | |
| Isoflurane | 애보트동물 건강 | 05260-05 | |
| Isoflurane 아닌 rebreathing 마취 시스템 | |||
| 순환 온수 난방 패드 | |||
| 30 ML 주사기의 드레스 | 어부 | 14-823 - 16G | |
| 파우더 무료 무균 장갑 | Fisherbrand | 19020558 | |
| 안과 연고 | 주요 제약 | 10033691 | |
| 소형 전기 면도기 | Wahl | 9861-600 | |
| Chlorhexidine 스크럽 | 어부 | NC9863042 | |
| 70 % 에탄올 | |||
| Polylined 무균 분야 | Busse 병원 Disposables | 696 | |
| 크기 3 메스 | 어부 | 22-079-657 | |
| 10 번 메스 블레이드 | 어부 | 22-079-681 | |
| 중소 외과 가위 | Roboz | RS - 5850 | |
| 작은 톱니 모양의 세미 곡선 포셉 | Roboz | RS - 5135 | |
| 5-0 검은 꼰 실크 봉합사 | Ethicon | K870H | |
| 멸균 pyrex 유리 배양 접시 | 코닝 | 70160-101 | |
| 2mm 생검 펀치 | Miltex | 33-31 | |
| 멸균 거즈 | 켄달 | 1806 | |
| 6-0 검은 monofilament의 ethilon 나일론 봉합 | Ethicon | 697G | |
| 니들 드라이버 (옵션) | 세계 정밀 계측기 | 500,023 | |
| 5-0 undyed 꼰 코팅 Vicryl 봉합사 | Ethicon | J490G | |
| 9mm Autoclip이 클립을 상처 | Becton 디킨슨 | 427,631 | |
| Autoclip applier 및 제거 | Becton 디킨슨 | 427,630 | |
| 23G 바늘 | Becton 디킨슨 | 305,193 | |
| 1cc 주사기 | Becton 딕슨 | 301,025 | |
| 배 돋보기 스탠드 (옵션) | 어부 | 14-648-23 | |
| 10 % 포르말린 버퍼 | 어부 | SF100 - 4 | |
| 캘리퍼스 | Roboz | RS - 6466 | |
| 카세트 처리 / 삽입 | 어부 | 15-197 - 700A | |
| 생검 거품 패드 | 어부 | 22-038-222 | |
| RNAqueous RNA 분리 키트 | Ambion | AM1912 | |
| 액체 질소 | |||
| 스냅 캡 microcentrifuge 평면 상단 튜브 | 어부 | 02-681-240 | |
| 케타민을 (옵션) | Simga | K4138 | |
| Domitor (medetomidine 하이드로 클로라이드) (옵션) | Tocris | 2023 | |
| Antisedan (atipamezole) (옵션) | 시그마 | A9611 |
참고문헌
- Simoens, S., Hummelshoj, L., D'Hooghe, T. Endometriosis: cost estimates and methodological perspective. Hum. Reprod. Update. 13, 395-404 (2007).
- Grummer, R. Animal models in endometriosis research. Hum. Reprod. Update. 12, 641-649 (2006).
- Vernon, M. W., Wilson, E. A. Studies on the surgical induction of endometriosis in the rat. Fertil. Steril. 44, 684-694 (1985).
- Cummings, A. M., Metcalf, J. L. Induction of endometriosis in mice: a new model sensitive to estrogen. Reprod. Toxicol. 9, 233-238 (1995).
- Pelch, K. E. Aberrant gene expression profile in a mouse model of endometriosis mirrors that observed in women. Fertil. Steril. 93, 1615-1627 (2010).
- Flores, I. Molecular profiling of experimental endometriosis identified gene expression patterns in common with human disease. Fertil. Steril. 87, 1180-1199 (2007).
- Giudice, L. C., Kao, L. C. Endometriosis. Lancet. 364, 1789-1799 (2004).
- Lin, Y. J., Lai, L. ei, Y, H., Wing, L. Y. Neutrophils and macrophages promote angiogenesis in the early stage of endometriosis in a mouse model. Endocrinology. 147, 1278-1286 (2006).
- Fang, Z. Intact progesterone receptors are essential to counteract the proliferative effect of estradiol in a genetically engineered mouse model of endometriosis. Fertil. Steril. 82, 673-678 (2004).
- Fang, Z. Genetic or enzymatic disruption of aromatase inhibits the growth of ectopic uterine tissue. J. Clin. Endocrinol. Metab. 87, 3460-3466 (2002).
- Cummings, A. M., Metcalf, J. L., Birnbaum, L. Promotion of endometriosis by 2,3,7,8-tetrachlorodibenzo-p-dioxin in rats and mice: time-dose dependence and species comparison. Toxicol. Appl. Pharmacol. 138, 131-139 (1996).
- Foster, W. G. Morphologic characteristics of endometriosis in the mouse model: application to toxicology. Can. J. Physiol. Pharmacol. 75, 1188-1196 (1997).
- Cummings, A. M., Metcalf, J. L. Effect of surgically induced endometriosis on pregnancy and effect of pregnancy and lactation on endometriosis in mice. Proc. Soc. Exp. Biol. Med. 212, 332-337 (1996).
- Lu, Y., Nie, J., Liu, X., Zheng, Y., Guo, S. W. Trichostatin A, a histone deacetylase inhibitor, reduces lesion growth and hyperalgesia in experimentally induced endometriosis in mice. Hum. Reprod. 25, 1014-1025 (2010).
- Whitten, W. K. Modification of the oestrous cycle of the mouse by external stimuli associated with the male. J. Endocrinol. 13, 399-404 (1956).
- Whitten, W. K., Bronson, F. H., Greenstein, J. A. Estrus-inducing pheromone of male mice: transport by movement of air. Science. 161, 584-585 (1968).
- Goldman, J. M., Murr, A. S., Cooper, R. L. The rodent estrous cycle: characterization of vaginal cytology and its utility in toxicological studies. Birth. Defects. Res. B. Dev. Reprod. Toxicol. 80, 84-97 (2007).
- Pritchett-Corning, K. R., Mulder, G. B., Luo, Y., White, W. J. Principles of Rodent Surgery for the New Surgeon. J. Vis. Exp. (47), e2586-e2586 (2011).
- Moen, M. H., Halvorsen, T. B. Histologic confirmation of endometriosis in different peritoneal lesions. Acta. Obstet. Gynecol. Scand. 71, 337-342 (1992).
- Cummings, A. M. Methoxychlor as a model for environmental estrogens. Crit. Rev. Toxicol. 27, 367-379 (1997).
- Fowler, R. E., Edwards, R. G. Induction of superovulation and pregnancy in mature mice by gonadotrophins. J. Endocrinol. 15, 374-384 (1957).
- Wilson, E. D., Zarrow, M. X. Comparison of superovulation in the immature mouse and rat. J. Reprod. Fertil. 3, 148-158 (1962).
- Lee, B., Du, H., Taylor, H. S. Experimental murine endometriosis induces DNA methylation and altered gene expression in eutopic endometrium. Biol. Reprod. 80, 79-85 (2009).
- Somigliana, E. Endometrial ability to implant in ectopic sites can be prevented by interleukin-12 in a murine model of endometriosis. Hum. Reprod. 14, 2944-2950 (1999).
- Hirata, T. Development of an experimental model of endometriosis using mice that ubiquitously express green fluorescent protein. Hum. Reprod. 20, 2092-2096 (2005).
- Story, L., Kennedy, S. Animal studies in endometriosis: a review. Ilar. J. 45, 132-138 (2004).
- Cummings, A. M., Hedge, J. M., Birnbaum, L. S. Effect of prenatal exposure to TCDD on the promotion of endometriotic lesion growth by TCDD in adult female rats and mice. Toxicol. Sci. 52, 45-49 (1999).
- Cummings, A. M., Metcalf, J. L. Effects of estrogen, progesterone, and methoxychlor on surgically induced endometriosis in rats. Fundam. Appl. Toxicol. 27, 287-290 (1995).
- Sharpe-Timms, K. L. Endometriotic lesions synthesize and secrete a haptoglobin-like protein. Biol. Reprod. 58, 988-994 (1998).
- Yavuz, E., Oktem, M., Esinler, I., Toru, S. A., Zeyneloglu, H. B. Genistein causes regression of endometriotic implants in the rat model. Fertil. Steril. 88, 1129-1134 (2007).
- Dmitrieva, N. Endocannabinoid involvement in endometriosis. Pain. 151, 703-710 (2010).
- Efstathiou, J. A. Nonsteroidal antiinflammatory drugs differentially suppress endometriosis in a murine model. Fertil. Steril. 83, 171-181 (2005).
- Becker, C. M. Endostatin inhibits the growth of endometriotic lesions but does not affect fertility. Fertil. Steril. 84, Suppl 2. 1144-1155 (2005).
- Becker, C. M. Short synthetic endostatin peptides inhibit endothelial migration in vitro and endometriosis in a mouse model. Fertil. Steril. 85, 71-77 (2006).
- Sharpe-Timms, K. L. Using rats as a research model for the study of endometriosis. Ann. N.Y. Acad. Sci. 955, 318-327 (2002).
- Stilley, J. A., Woods-Marshall, R., Sutovsky, M., Sutovsky, P., Sharpe-Timms, K. L. Reduced Fecundity in Female Rats with Surgically Induced Endometriosis and in Their Daughters: A Potential Role for Tissue Inhibitors of Metalloproteinase 1. Biol. Reprod. 80, (2009).
Access restricted. Please log in or start a trial to view this content.
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유