JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
의 정위 주입 MicroRNA의 발현 마우스 해마 CA1 영역으로 렌티 바이러스 및 행동 결과의 평가
요약
마이크로 RNA는 뇌의 구조와 기능에 중요한 역할을한다. 여기에 우리가 과다 발현은 설계 miRNA의 발현 렌티 바이러스의 정위 주사를 사용하여 해마 miRNA의를 적용하는 방법을 설명합니다. 이 방법은을 평가하는 상대적으로 빠른 방법으로 사용할 수 있습니다 생체 내 특정 뇌 영역의 이상 발현의 miRNAs의 효과.
초록
마이크로 RNA는 (miRNAs는) 오래 22 세포핵 주변에 작은 규제 단일 가닥 RNA 분자하는 수있는 각 대상 다수의 mRNA의 성적 증명서 및 유도 파괴 및 / 또는 이러한 대상의 억제에 의해 번역 희미 전체 유전자 발현 통로. 몇 가지의 miRNAs는 신경 세포의 구조와 기능을 유지하고 높은 수준의 뇌 기능에 중요한 역할을하고, 방법은 이러한 기능을 탐험에 대한 자신의 수준을 조작하기위한 돕고 있습니다. 여기, 우리는 miRNA의 인코딩 바이러스 입자의 정위 주사 생쥐의 과잉 적용의 miRNAs의인지 결과를 조사하기위한 생체 방법으로 직접 제시한다. 특히, 현재의 프로토콜은 포유류의 메모리 통합, 학습, 스트레스 반응에 기여하고, 편리 주사 부위를 제공하는 해마 CA1 영역,에 주입을 포함한다. 좌표는 마우스 브레 그마 및 바이러스 관류 디지털 제어와 매우 느린 유지에 따라 측정됩니다.주사 후, 수술 상처 밀봉 동물 복구합니다. 해당 mRNA의 목표 소음기를 인코딩 렌티 바이러스는 순진 마우스와 관찰 결과에 대한 책임 특정 miRNA에 / 타겟 상호 작용을 내포하는 역할을, 식염수 컨트롤과 같은 "빈"lentivirus를 벡터로 주입 생쥐에 주입 쥐. 한 달 후 주입, 동물들은 탐색 학습과 기억 능력을 평가하기위한 모리스 물 미로 (MWM)에서 검토된다. MWM 1 센티미터 물 표면 아래 물속에 작은 플랫폼과 색 물이 가득 라운드 탱크. 탱크 주위에 꾸준한 시각적 공간적 탐색 (소리와 지구의 자기장도 탐색에 동물을 도움이 될)을 허용합니다. 비디오 카메라 모니터링 찾아 플랫폼을 양에 수영 시간의 경로를 측정 할 수 있습니다. 마우스가 먼저 숨겨진 플랫폼을 장착하면 강제 수영에서 탈출을 제공하는 배운, 그것은 다음이 탈출와 f를 사용하기위한 테스트inally, 플랫폼을 제거하고 마우스의 이전 위치를 기억하는 경우 프로브 테스트 검사합니다. 여러 개의 연속적인 일 동안 반복 테스트 플랫폼을 찾아 마운트 짧은 대기 시간의 테스트 생쥐의 향상된 성능을 강조하고 더 직접적인 경로는 플랫폼 또는 그 위치에 도달 할 수 있습니다. 이러한 개선 후 (고가 플러스 미로 등) 구체적으로 테스트 할 수 있습니다 장애 학습과 기억 및 / 또는 불안을 나타냅니다 표시하는 오류가 발생했습니다. 이 방법은 연구인지 및 / 또는 스트레스 관련 프로세스의 특정 miRNA에 및 대상 증명서의 유효성을 검사 할 수 있습니다.
서문
신경계의 기능의 특정 miRNA에의 역할은 최근 여러 연구에서 렌티 바이러스 주입에 의해 도전되었다. 의 miRNAs는 시냅스 구조 1, 시냅스 2 시냅스 리모델링 및 유지 보수 3을 유지하고 재 형성에 중요한 것으로 발견되었습니다. 이러한 연구는 강하게 최대 형성 모두와 신경계,인지 기능의 메인 출력을 유지하고있는 다중 수준 조절 효과를 통해, miRNAs는이 종사하는 것이 좋습니다. 쥐 뇌의 특정 영역으로 렌티 바이러스 입자의 정위 주사 시냅스 형태와 신경 활동의 변화를 검색 가능하게하고, 4,5 이상 발현의 성적 기능 중요성을 설정하는 데 사용되었다. miRNA의 발현 렌티 바이러스와 잘 정의 된 뇌 영역의 뉴런의 직접적인 감염은 노화, 뇌 질환 및 신경 변성 연구에 연루 될 수 있으며 miRNA에 대한 연구들 행동 규칙 6-8의 영역에서 훨씬 적은 고급 상태에있다, 그리고 정위 주입 miRNA의 발현 행동 검사 다음 렌티 바이러스 입자는 이러한 목적을 위해 유용 할 수 있습니다. 위로 또는 아래의 발현을 유도하기위한 훨씬 더 힘드는 방법은 유전자 녹아웃 또는 녹아웃 마우스 조작이 포함됩니다. 유전 시스템은 더 발현 조건과 시간적 제어 (예를 들어, 크레 - 훈제 연어, 테트 시스템)을 허용 할 수 있지만, 이것들은 거의 주입 절차의 공간 특이성을 제공하지 않으며 leakiness의 일정 금액은 거의 항상있다. 또한, 설계 절차는 수술을 필요로하지 않는 비교적 좋은 재현성 실험실에서 사용할 수 있지만, 그들은 느린 그리고 더 많은 인력과 재정 자원을 필요로합니다. 또한,의 시간적 제어를 통해 또는 주입 생쥐에서 아래의 발현은 유전자 조작 생쥐에 비해 훨씬 더 정확합니다.
프로토콜
1. lentivirus를 준비
- 90 %의 합류로 HEK-293FT 세포를 성장.
- 혈청이없는 DMEM에 형질 변화 세포 매체의 날에 1 밀리미터 글루타민, 50 MG / ML 페니실린 - 스트렙토 마이신과 보충.
- pLKO.1 - 푸로 벡터로 및 캐리어 9로 1 MG / ML polyethylenimine의 10 μl를 사용하여 델타 R8.2 및 VSV-G 잔기와 관심의 miRNA에 대한 코딩 플라스미드와 세포를 공동 형질.
- 0.45 μm의 필터를 통해 필터, 24 시간 및 48 시간의 포스트 형질에서 패키지 렌티 바이러스를 수집합니다.
- 2 시간 15 ° -70에서 C, 나누어지는 및 저장 ° C.를 들어, 70,000 XG에서 원심을 사용하여 렌티 바이러스를 집중
- 순차적으로 희석 바이러스 제제 (물론 당 벡터의 1 ~ 10 -6 ML)와 HEK - 293T 세포를 감염시켜 측정 바이러스 역가. 결과 역가가 (~ 1 최소 ML 당 × 10 9 전염성 입자 권장) GE의 발현에 대해 평가됩니다관심 NE, puromycin 선택을 사용하여 형광 세포를 계산을 통해 바이러스를 표현 GFP를 정량화 있습니다.
렌티 바이러스 준비의 자세한 프로토콜 10을 참조하십시오.
2. 수술 동물 준비
- 외과 복장은 수술 가운, 멸균 장갑, 모자, 마스크를 포함해야합니다.
- 동물의 무게를 측정 한 후 각 약물에 대해 지정된 동물의 무게에 비례 볼륨, 케타민 혼합물의 IP 주입으로 마취. 케타민을 / Xylazine 혼합물, 80-200 MG / kg 케타민을 및 7-20 ㎎ / kg Xylazine의 복용량 범위는 일반적으로 마우스에 사용됩니다.
- 동물이 완전히 마취 될 때까지 기다린 후 다리를 확장 한 다음 손가락으로 누르면 동물의 뒷다리의 탈퇴 반사의 부족을 확인합니다.
- 상자에 지정된 통증 완화를 위해, Rimadyl 피하 동물을 주입한다. Rymadil에 대한 일반적인 복용량 범위는 5 ~ 10 밀리그램이다.
- 정상 체온을 유지하고 연고와 눈을 축축하게하는 가열 패드에 동물을 배치합니다.
- 트리밍 기계로 두 귀 사이의 영역을 면도.
- 베타 딘과 피부를 소독합니다.
3. 두개골과 드릴링 노출
- 동물의 귀 바로 앞쪽에 갈라진 틈에 막대를 조정하여 stereotact 내부에 동물을 배치합니다.
- 귀 사이에 약 1.5 cm의 전방 후방 절개를하고 수술 클램프 (serfines)과 열 유지하기 위해 메스를 사용합니다.
- 브레 그마와 관상 lambdoid 봉합 사이의 교차점 즉; 관상 봉합과 시상 봉합 사이의 교차점까지 면봉으로 두개골의 표면을 청소 즉 람다가 표시됩니다.
- 세 축 모두에서 브레 그마 점에 stereotact에 의해 개최 주사기의 끝을,,, 가리 킵니다. 좌표를 기록합니다. 이 점은 제로 PO로 간주됩니다세 축 모두에서 int로.
- 평면 운동 두개골을 긁 올바른 위치에 주사기 헤드를 이동하지 않을 수 있도록 수직 축에 주사기를 들어 올립니다. -2 전방 / 후방 축에서 ± 내측 / 외측 축에서 1.8 지느러미 / 복부 축에서 -1.5 : 해마 CA1 주사는 다음과 mm의 브레 그마에 대한 상대 좌표가 필요합니다.
- 이 두개골에 닿을 때까지 주사기의 끝을 내리고 마커 지점을 표시합니다. 찔러 방지하기 위해 다시 주사기를 제거합니다.
- 단지 좋은 파기을 사용하여 두개골 뼈에 얕은 구멍을 뚫습니다. 그래서 부드러운 조직 아래에 드릴을 계속하지 않을 파기를 고정. 당신은 서로 견고하게 한 손으로 짧은 펄스 천공하여이 작업을 방지 할 수 있습니다.
4. 의 Lentivirus 주입
- 집중 렌티 바이러스 솔루션의 0.5 ML를 철회.
- 구멍 바로 위에 주사기를 배치하고 REA 때까지 천천히 수직으로 내려두개골의 CHES 표면. 아주 천천히 뇌에 주사기를 낮추기 위해 계속합니다. 이 단계에서 약간의 출혈은 반드시 실패 침투를 표시하지 않는 발생할 수 있습니다. 출혈이 발생하는 경우 면봉으로 닦아내시오.
- 디지털 펌프 0.02 ML / 분 (0.5 μL가 25 분에 주입 될 것입니다) 설정하고 주입을 시작합니다. 천천히 주입 조직에 바이러스의 확산 효과를 허용하고 역류를 방지합니다. 일부 주사기 종류의 원래의 좌표와 불어로 후퇴하기 전에 0.5 mm의 여분의 깊이 주사기를 삽입하는 것이 좋습니다.
- 주입이 완료되면 재료가 대신 주사기에 의해 형성된 운하로 다시 후퇴의 두뇌에 확산 할 수 있도록 추가로 5 분 기다립니다.
- 아주 천천히 주사기를 제거하고 다시 흐름을 감시. 다시 흐름이 단계에서 관찰되는 경우, 주입 물질의 일부는 아마 분실되었다.
5. 상처 씰링 및 복구
- 씰 일E는 histoacryl에 상처. 눈에 histoacryl 누출되지 않도록해야합니다.
- 탈수를 방지하기 위해, 1 ML 예열 식염수 동물 복강 (IP)을 주입한다.
- 가열 패드에 배치되어 복구 케이지에 동물을 배치합니다. 그것은 추가 시간 복구하는 동안 동물을보십시오.
체중 감소, inappetance의 경우, 약점 / 사료 또는 물, 죽어가는 상태 또는 감염 동물의 안락사를 얻기 위해 무능력을 수행해야합니다. 설치류의 안락사 허용 방법은 바르비 투르 산염, 흡입 마취제, CO 2, CO, 또는 전신 마취와 함께 염화칼륨 수 있습니다.
4~6주 후, 동물의 내비게이션 메모리 모리스 물 미로에서 평가되어 평가합니다. 렌티 바이러스는 일반적으로 주입 영역에서 대부분의 세포를 감염됩니다.
6. 모리스 물 미로의 행동 평가
- M의 동물을 훈련오리스 물 미로. 정확한 훈련과 테스트 프로토콜 11을 참조하십시오. 각 시험 후, 마른 수건으로 동물을 건조의 케이지를 교체하고 탱크에 물을 새로 고칩니다.
- 매일 연속 3 일, 시험에 대한 모리스 물 미로의 동물을 테스트합니다. 동서 - 남북 둘째 날 : 서쪽 - 남쪽 매일 예를 들어 하루에 하나, 변화하는 순서로 미로 (북쪽, 남쪽, 동쪽과 서쪽)의 4 방향의 각 미로 동물을 삽입 - 북동. 각 실험 후 동물을 닦으십시오.
- 시험 중에 시험은 Noldus 추적 시스템으로 추적 시스템과 동물을 추적 할 수 있습니다.
- 12 일 시험 시행 후 1 분을위한 플랫폼없이 물 탱크에 동물을 삽입합니다. 이 동물이 복용 검색 전략을 분석하는 데 사용됩니다.
- 12 제안으로 데이터를 분석 할 수 있습니다.
결과
프로토콜 섹션에 표시된 유량 마우스 해마의 CA1 지역에 0.5 μL 렌티 바이러스의 주입 주동이의 - 꼬리 축에서 약 1 mm의 감염 영역을 산출하고, 0.5 내측 - 외측에서 mm와 전방에 관하여 - 후방 축 (그림 3).
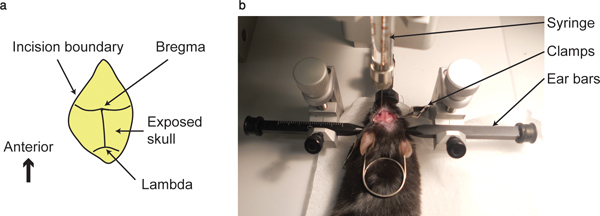
그림 1. 브레 그마 점과 주입 장치. (가) 보이는이 브레 그마 (관상 ?...
토론
렌티 바이러스의 정위 주입을위한 두 위쪽 또는 다른 유전자와 miRNA에의 다운 규제 생체 내 평가에 대한 상대적으로 빠른 방법입니다. 주요 대안은 다음 훨씬 더 힘들고 시간이 많이 소요되는 기술을 직접 lentivirus를 주입이다 유전자 조작 마우스입니다. 또한, 최대 규제, lentivirus의 주입에 성인 마우스의 특정 시간에 발생하고 대부분 시간적 컨트롤을 포함 유전자 조작 생쥐의 경우와 같이, ...
공개
저자는 그들이 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
이 연구는 뇌 과학 에드몬드 릴리 프라 센터 (SB 교제), 이스라엘 과학 재단 (HS 권한 부여 번호 11분의 378)의 유산 유산의 생명 과학 파트너십 프로그램 및 과학에 대한 독일 이스라엘 재단에 의해 지원되었다 연구와 개발 (GIF) (HS 권한 부여 번호 1093-32.2/2010).
자료
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Rodent weigh scale | Burtons (UK) | 115-455 | |
| heating pad | FIRstTechnology | DCT-25 | |
| trimming machine | Stoelting | 51465 | |
| stereotact | Stoelting | 51730 | |
| Scalpel and blades | Kent scientific | INS500348 | |
| Harland syringe | Hamilton | 7632-01 | |
| driller | Stoelting | 51449 | |
| digital pump | Harvard apparatus | 704507 | |
| Water tank and platform | Stoelting | 60135 | |
| Reagents | |||
| ketamine | Vetoquinol(Lure France) | 3055503 | |
| domitor | Orion pharma | 107140-10 | |
| Rimadyl | Pfizer animal health | 24751 | |
| moisture ointment - Synthomycine 5% | Rekah Pharmaceutical | 195 | |
| histoacryl | Braun | 112101 | |
| saline | Sigma Aldrich | D8662 | |
참고문헌
- Siegel, G., et al. A functional screen implicates microRNA-138-dependent regulation of the depalmitoylation enzyme APT1 in dendritic spine morphogenesis. Nature Cell Biology. 11, 705-716 (2009).
- Jin, P., et al. Biochemical and genetic interaction between the fragile X mental retardation protein and the microRNA pathway. Nature Neuroscience. 7, 113-117 (2004).
- Simon, D. J. The microRNA miR-1 regulates a MEF-2-dependent retrograde signal at neuromuscular junctions. Cell. 133, 903-915 (2008).
- Consiglio, A. In vivo gene therapy of metachromatic leukodystrophy by lentiviral vectors: correction of neuropathology and protection against learning impairments in affected mice. Nature Medicine. 7, 310-316 (2001).
- Jakobsson, J., Lundberg, C. Lentiviral vectors for use in the central nervous system. Molecular Therapy: The Journal of the American Society of Gene Therapy. 13, 484-493 (2006).
- Berson, A. Cholinergic-associated loss of hnRNP-A/B in Alzheimer's disease impairs cortical splicing and cognitive function in mice. EMBO Molecular Medicine. , (2012).
- Haramati, S. MicroRNA as repressors of stress-induced anxiety: the case of amygdalar miR-34. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience. 31, 14191-14203 (2011).
- Shaltiel, G., et al. Hippocampal microRNA-132 mediates stress-inducible cognitive deficits through its acetylcholinesterase target. Brain Structure & Function. , 10-1007 (2012).
- Boussif, O., et al. A versatile vector for gene and oligonucleotide transfer into cells in culture and in vivo: polyethylenimine. Proceedings of the National Academy of Sciences of the United States of America. 92, 7297-7301 (1995).
- Mendenhall, A., Lesnik, J., Mukherjee, C., Antes, T., Sengupta, R. Packaging HIV- or FIV-based lentivector expression constructs & transduction of VSV-G pseudotyped viral particles. J. Vis. Exp. (62), e3171 (2012).
- Nunez, J. Morris Water Maze Experiment. J. Vis. Exp. (19), e897 (2008).
- Bromley-Brits, K., Deng, Y., Song, W. Morris water maze test for learning and memory deficits in Alzheimer's disease model mice. J. Vis. Exp. (53), e2920 (2011).
- Regev, L., Ezrielev, E., Gershon, E., Gil, S., Chen, A. Genetic approach for intracerebroventricular delivery. Proceedings of the National Academy of Sciences of the United States of America. 107, 4424-4429 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유