JoVE 비디오를 활용하시려면 도서관을 통한 기관 구독이 필요합니다. 전체 비디오를 보시려면 로그인하거나 무료 트라이얼을 시작하세요.
Method Article
요리사 tdTomato를 사용하여 Zebrafish Somatosensory의 뉴런의 Optogenetic 활성화
요약
Optogenetic 기법은 가능한 행동에 특정 뉴런의 공헌을 공부 만들었습니다. 우리는 다이오드 펌핑 고체 상태 (DPSS) 레이저 channelrhodopsin 변형 (요리사)를 표현하고 고속 비디오 카메라로 elicited 행동을 녹화 한 somatosensory 뉴런을 활성화하기위한 애벌레의 zebrafish의 방법을 설명합니다.
초록
애벌레의의 zebrafish는 간단 신경 회로의 개발과 기능을 설명하기위한 모델로 등장하고 있습니다. 외부 기름지게, 신속한 개발 및 투명도로 인해 zebrafish는 특히 신경 회로 기능을 조사 optogenetic 접근 방식에 적합합니다. 이 방법에서는 빛에 민감한 이온 채널이 활성화하거나 억제를 마음대로하기 때문에 특정 행동에 대한 그들의 공헌을 평가하는 실험을 사용, 특정 뉴런에서 표현됩니다. 애벌레의 zebrafish에서 이러한 방법을 적용하는 것은 개념적으로 간단하지만 기술적 인 세부의 최적화가 필요합니다. 여기 애벌레의 zebrafish somatosensory의 뉴런, 사진 활성화 한 셀에 channelrhodopsin의 변형을 표현하고 그 결과 행동을 기록하기위한 절차를 보여줍니다. 이전에 설정 한 방법에 몇 가지 수정을 도입함으로써,이 방식은 최대 활성화 한 뉴런에서 행동 반응을 유도하는 데 사용할 수 있습니다최소 4 일 후 수정을 (dpf). 특히, 우리는 태그 channelrhodopsin 변형, 요리사 tdTomato의 표현을 유도 할 somatosensory 신경 세포 증강, CREST3를 사용하여 transgene을 만들었습니다. 공 촛점 현미경으로 이미징 할 수 있습니다 somatosensory 뉴런의 모자이크 표현, 1 세포 단계의 배아 결과에이 transgene를 주입. 조명은 473 nm의 DPSS 레이저의 빛이 동물에서 세포를 식별 광섬유 케이블을 통해 안내, 고속 비디오 카메라로 기록하고 양적 분석 할 수 동작을 elicits. 이 기술은 모든 zebrafish의 신경 세포를 활성화하여 elicited 학습 행동에 적용 할 수 있습니다. 유전자 또는 약리 섭동으로이 방법을 결합하면 회로 형성 및 기능을 조사 할 수있는 강력한 방법이 될 것입니다.
서문
빛의 정의 파장과 neuronal 흥분을 광고하거나 억제를위한 optogenetic 방법의 개발은 가능한 행동을 1, 19, 21 제어 신경 회로의 뉴런의 뚜렷한 인구의 기능을 공부 만들었습니다. 이 기술은 종종 뉴런의 그룹을 활성화하는 데 사용됩니다,하지만 또한 개별 뉴런을 활성화하는 데 사용할 수 있습니다. 그들은 반투명 때문에 Zebrafish 애벌레 이러한 방법으로 특히 의무가 있으며, 자신의 신경 시스템은 신속하게 개발하고, 유전자 변형 동물을 만드는 것은 빠르고 일상입니다. 그러나, 중요한 기술적 장애물이 안정적으로 하나의 신경 세포 활성화를 달성하기 극복해야합니다.
한 zebrafish의 뉴런의 optogenetic 활성화를위한 절차를 최적화하기 위해, 우리는 somatosensory 뉴런에 집중했다. 머리를 신경을 분포시키다 삼차 뉴런, 그리고 Rohon-비어드 (: Zebrafish의 애벌레는 두 뉴런의 인구를 사용하여 somatosensory 자극의 다양한 감지몸의 나머지 부분을 신경을 분포시키다 RB) 뉴런. 각 삼차와 RB 신경 세포는 피부에 광범위하게 가지 자극 및 다운 스트림 신경 회로에 연결 중심 축삭을 감지 할 수있는 주변 축삭을 계획했다. 동물은 코 히어 런트 somatosensory 회로, 18 5 형성 나타내는 이른 시간 후 수정을 (hpf) 21으로 만져 응답합니다. 애벌레의 개발 과정 적어도 Mauthner 셀로 일부 삼차와 RB 뉴런의 시냅스는 고전 탈출 응답을 활성화하지만, 증거를 축적하는 것은 탈출의 행동 2, 4에 변형을 유도 할 수 있습니다 연결성 다른 패턴으로 somatosensory 뉴런의 여러 클래스가 있다는 것을 시사하는 10, 12, 14, 15, 16, 17. 이 방법을 개발하기위한 우리의 동기는 somatosensory 뉴런의 서로 다른 클래스의 행동 기능을 특징하는 것이 었습니다하지만이 접근 방식은 원칙적으로 고맙다에서 뉴런의 거의 모든 신경 세포 나 인구의 기능을 연구하는 데 사용할 수 있습니다발 zebrafish.
더글라스 외가. 이전 활성화를위한 방법을 설명 Channelrhodopsin을-2-표현, 푸른 빛으로 somatosensory 뉴런을 탈출 행동 3을 도출하도록 의도. 그들의 접근 방식은 somatosensory 뉴런에 ChR2-EYFP의 표현을 유도 할 isl1 유전자에서 증강 요소를 사용했습니다. 이 transgene는하지만, 두 번째 기자의 공동 주사를 필요로 상대적으로 약한 형광을 표시하는 것으로보고되었습니다 UAS :: GFP는 ChR2-EYFP을 표현 세포의 시각화를 허용합니다. 이 접근 방식은 24-48 hpf 사이에 행동 반응을 유도하기 위해 사용되었지만, 72 hpf 과거의 응답을 이끌어내는 수 없다. 이 방법은 매우 일찍 애벌레의 단계 (24-48 hpf)에서 신경 회로를 공부를 위해 일 동안 따라서, 그것은 더 다양한 행동 반응이 명백하고 신경 회로가 더 성숙한 나이가 애벌레에서 신경 회로 및 행동 반응을 특성화에 불충분합니다.
우리는 모색애벌레의 RB의 뉴런의 subpopulations의 기능을 특성화하기 위해이 기법의 감도를 향상시킬 수 있습니다. 표현을 개선하기 위해 우리는 휘황 태그 가벼운 활성화 된 채널의 표현을 확대하려면 LexA-VP16의 표현과 LexA 운영자 시퀀스 (4xLexAop) 11의 스트레칭을 유도하기 위해 somatosensory 특정 증강 (CREST3) 20를 사용했습니다. 이 구성은 두 번째 기자가 공동 표현하고 우리가 직접 각각의 신경 세포에 채널의 상대적으로 풍부한을 결정 할 수 있도록에 대한 필요성을 제거, 채널의 표현을 증폭. LexA / LexAop 순서를 사용하면 우리가 Gal4/UAS 시스템을 사용 zebrafish 기자 라인으로 transgene을 소개 할 수있는 추가 혜택을했다. 이 transgene의 과도 표현은 표현의 수준을 변화의 결과 있지만, 일반적으로 몇 일 동안 전지 본체 및 개별 뉴런의 axonal 예측 모두를 시각화 할 수있을만큼 강력한했습니다. 민감한를 최적화 할 수빛으로 ity 우리는 채널 요리사, 나선형 루프 EF 13에서 교차 사이트와 channelopsin-1 (Chop1)과 channelopsin-2 (Chop2)의 키메라로 구성된 channelrhodopsin의 변형을 활성화 빛을 사용했습니다. 이 채널은 ChR2 같은 파장에서 작동하지만, ChR2 등 다른 일반적으로 사용되는 채널보다 더 민감하고, 활성화를위한 낮은 빛의 세기가 필요합니다. 요리사 단백질은 우리가 채널을 활성화하지 않고 단백질 표현 상영 할 수 있도록, 빨간 형광 단백질, tdTomato에 융합되었다. 광원으로, 우리는 다이오드는 애벌레의 특정 지역에 푸른 빛의 정확한, 고출력 펄스를 제공 할 수있는 광섬유 케이블에 연결된 고체 (DPSS) 레이저를 펌핑 사용됩니다. 이것은 우리가 하나의 뉴런에서 채널을 표현하는 희귀 한 유전자 변형 동물을 찾는에 대한 필요성을 제거, 개별 뉴런에 레이저 광을 포커싱 할 수있었습니다. 이 방법을 사용하여, 우리는 하나의 RB의 뉴런을 활성화 행동 반응을 기록 할 수 있었다고속 비디오 카메라 및 이미지 공 촛점 현미경과 고해상도의 활성화 뉴런과 s입니다.
프로토콜
미리 다음 사항을 준비합니다.
1. 광 케이블을 준비
- ~ 150 ° 각도를 만드는 분젠 버너 위에 유리 파스퇴르 피펫의 테이퍼 목을 용해하여 광 케이블을위한 저장 장치를 만들 수 있습니다.
- 와이어 커터 또는 면도날을 사용하여 조심스럽게 두 가지로 광 케이블을 잘라. 각 태그는 FC / PC 어댑터 한 노출 끝으로 한쪽 끝이 있어야합니다. 예비 케이블로 한 조각을 저장합니다.
- 케이블의 절단 끝의 5.0 cm에서 섬유 재킷과 강화 섬유 (그림 1A)를 제거하여 cladding에 광 케이블을 제거합니다.
- 준비된 파스퇴르 피펫으로 광 케이블을 삽입합니다. 케이블이 쉽게 피펫 팁에 들고 이동할 수 있는지 확인하십시오.
- 광 케이블 신중하게 유리 섬유 각국에서 섬유 cladding을 잘라 제거, 파스퇴르 피펫의 끝에서 튀어으로, 잘라 내기 끝에서 ~ 2mm.
- 닉 ㅇ 해제하고, 다이아몬드 펜 / 유리 커터 유리 섬유 사용FF는 끝 섬유 (그림 1B)의 끝 부분에 깨끗한 절단 / 표면을 만들 수 있습니다.
- 저장을 위해 파스퇴르 피펫에 광 케이블을 철회. 광섬유의 끝이 unevenly 빠졌거나 바꿈됩니다 경우 단계 (1.6)를 반복합니다.
- 파스퇴르 피펫의 위치 광 케이블은 micromanipulator (그림 1C)를 사용하여.
절차 2-8는 많은 zebrafish 실험에 일반적으로 적용 할 수있는 배아로 transgenes을 주입하는 방법을 설명합니다. 다른 주피터 비디오 6, 7, 8, 9에 설명 된 것과 같은이 방법에 대한 변형은, 22 동등하게 효과적입니다.
2. 사출 바늘을 당겨
- 바늘 풀러 사용하여 점차적으로 테이퍼 팁으로 두 주사 바늘에 붕규산 유리 튜브를 당긴다. 풀러 설정이 달라집니다. (셔터 인스트루먼트의 바늘 풀러에서 우리는 설정을 사용합니다 : P = 500, 예선 = 720 = 50, 속도를 당겨 = 70 시간 = 150). 모든 바늘 풀러 서로 다른이기 때문에, 풀러 설정 할 놈들을 최적화pirically. 자세한 테이퍼 바늘은 열 및 /을 늘리거나 당겨. 적은 테이퍼 바늘의 경우, 시간 및 / 또는 감소를 끌어을 향상시킬 수 있습니다.
- 안전한 용기에 저장 바늘 (즉, 압연 테이프 페트리 접시, 접착제 측면에서).
3. 사출 금형을 넣어
- 아가로 오스가 완전히 용해 될 때까지, 30 ML의 배아 / 푸른 물에 0.5 g 아가로 오스를 녹여.
- 페트리 접시의 절반 아랫 부분에 넣어.
- , 아가로 오스에 우물 (그림 2)를 장착 우물 주위에 거품 형성을 제한하는주의가되는 직사각형 몰드를 놓습니다.
- 아가로 오스는 더욱 강화 할 수 있습니다.
- 몰드를 제거하고 블루 / 배아 물 페트리 접시를 입력합니다.
- 수직 저장, 당일 사용 온도는 실온에서 또는 4에서 ° C 향후 사용에 대비, 깨끗한 물로 가득 찼다.
4. 주사에 대한 플라스미드 DNA 믹스 만들기
- ddH 2 O.에서 1시 10분 페놀 붉은 색이있는 50 NG / μl의 농도에 플라스미드 DNA를 희석 에예 :
1.0 ML 플라스미드 DNA (250 NG / ML) 0.5 ML 페놀 레드 3.5 ML ddH 2 O - 며칠 동안 즉시 사용 또는 4 ° C에 보관하면 DNA 믹스는 실온에서 보관 할 수 있습니다.
5. 번식 쌍을 설정
당신이 주사를 계획하기 전에이 작업은 저녁 시간을 완료해야합니다.
- 함께 시스템 물 및 장소 남성과 여성의 물고기 사육 탱크를 채우십시오. 불이 구분선과 함께 시설에서 별도의 남성과 여성의 생선을 켜로 주사는 즉시 수행 할 수없는 경우.
6. 주사 준비는 (배아을 기다리는 동안 수행 할 수 있습니다)
- 압력 주입기 장비를 켜십시오. 시스템이 펄스로 설정되어 있는지 확인하십시오. 1 PULSE 기간 설정을 시작합니다.
- AIR 밸브의 전원을 켜고~ 20 PSI로 주입기 압력을 조정합니다.
- 가장 높은 배율에서 박리 범위를 사용하여 집게 또는 ~ 2 μm 영업 (그림 3, 영화 1) 생성 할 수있는 포커와 바늘의 끝을 부러.
- 에 의해 DNA 믹스로 바늘을 채우 : 1. DNA 믹스로, 바늘, 팁 측을 걸기와 바늘은 모세관 작용 또는 2에 의해 작성 해준다. DNA 1-2 μl를 피펫하는 긴 도달 팁을 사용하면 바늘에 직접 섞는다.
- 장소 주입 할 준비가 될 때까지 안전한 장소에 바늘을 가득 채웠다.
7. 태아를 수집
- 시설 등이 설정 한 후 디바이더를 (해당되는 경우)를 제거하십시오. 스트레이너 / 작은 체와 배아를 수집하고 신선한 블루 / 배아 물 페트리 접시로 전송할 수 있습니다.
8. 1-2 셀 단계에서 배아를 주입
- 플라스틱 피펫을 사용하여 사출 금형에 수확 배아를 전송합니다.
- 해부 현미경을 사용하여 부드럽게으로 배아를 밀어포셉 또는 무딘 포커와 우물 (그림 4, 영화 2).
- 태아 이상 micromanipulator와 위치에로드 바늘을 삽입합니다.
- 원하는 볼륨 (~ 1 NL)을 달성 할 때까지 1 단계 씩 PULSE 기간을 조정하여 주입 볼륨을 보정합니다. 이것은 이전 주피터 비디오 8, 22에 설명 된대로, 마이크로 미터 슬라이드로 교정하지만, 사출 볼륨의 다양한 범위가 적절한 표현 될 수 있기 때문에이 실험의 정밀도를 들어, 필요하지 않습니다 될 수 있습니다.
- ~를 삽입 한 NL DNA는 배아의 세포와 반복에 직접 섞는다. DNA는 난황에 주입하지만,이 (그림 5, 영화 3) 이하 효율적 경향이 될 수 있습니다.
- 블루 / 배아 물을 부드러운 스트림을 사용하여 몰드에서 주입 배아를 제거합니다.
- 스토어는 어둠 속에서 28.5 ° C에서 배아를 주입했다.
- 정기적으로 unfertilized, 손상되거나 죽은 태아를 제거합니다.
- 배아 무선 인터넷 접속을 치료착색을 방지하기 위해 18-24 hpf 사이 일 PTU.
9. Transgene 표현을위한 화면
- 수동으로 dechorionate 24-48 hpf의 배아는 포셉을 사용합니다.
- tricaine 0.02 %를 사용하여 애벌레를 마취.
- 형광 해부 현미경을 사용하여, RB 또는 삼차 신경 표현과 애벌레를 식별하고 신선한 PTU 파란색 / 배아 물과 새로운 요리들에게 전송할 수 있습니다. 쉽게 식별 할 셀의 희박한 표정으로 태아는 최적이지만 표현 밀도의 다양한 범위가 허용하도록 각각의 뉴런은 광섬유 케이블과 활성화를 위해 타겟팅됩니다.
- 저장 배아 28.5에서 어둠 속에서 ° C 원하는 실험 단계까지.
10. 행동 실험에 애벌레를 탑재
- ddH 2 O와 응고되지 않도록하기 위해 42 ° C 열 블록의 저장소에 1.5 %의 낮은 용해 아가로 오스하십시오.
- 욕조에 유리 파스퇴르 피펫, 전송 사전 검사 애벌레 중 하나를 사용가능한 한 작은 파란색 / 배아 물과 1.5 %의 낮은 용해 아가로 오스의 전자.
- 작은 페트리 접시로 아가로 오스의 드롭 애벌레를 전송합니다.
- 해부 현미경 아래 위치 유충 등쪽 업.
- 아가로 오스가 확정되면, 전체 유충 주위에 한천의 쐐기를두고, 얇은 면도날 (# 11 메스)와 아가로 오스을 떼어.
- 난황의 양쪽에서 두 대각선 상처를, 닉에 유충을 신경 안 걸릴.
- 태아 / 푸른 물과 아가로 오스 주변 지역을 입력합니다.
- 애벌레의 몸통과 꼬리 (그림 6)에서 멀리 아가로 오스를 당겨.
11. 고속 카메라 및 이미징 소프트웨어를 준비
- 범위를 해부에 고속 카메라를 탑재합니다.
- 컴퓨터에 카메라를 연결합니다.
- 컴퓨터를 켭니다.
- 고속 카메라를 켜십시오.
- 오픈 비디오 / 이미징 소프트웨어 (우리는 AOS 이미징 소프트웨어를 사용하고 여기에 사용에 대한 절차를 설명되지만 다른 영상소프트웨어)는 동일하게 사용할 수 있습니다.
- 이에 따라 카메라 설정 (초 당 즉, 1,000 프레임 (프레임), 50 % 트리거 버퍼 또는 기타 기본 설정)를 조정합니다.
- 녹화를 시작합니다.
12. 473 nm의 레이저를 사용하여 단일 뉴런을 활성화
- stimulator, 레이저 및 광 케이블을 연결합니다.
- stimulator를 켭니다.
- 5 볼트의 최대 5 밀리 초의 펄스 기간에 stimulator를 설정합니다.
- 제조업체의 지침에 따라 레이저를 켜십시오.
- 요리사 tdTomato 표현 (그림 6)과 신경 세포의 세포 시체 근처의 광 케이블의 끝을 위치 시키도록 해부 현미경을 사용합니다.
- 감각 뉴런을 활성화하려면 파란색 빛의 펄스를 제공합니다.
- 고속 카메라를 사용하여 기록 동작은 초 당 500 또는 1,000 프레임 설정합니다.
- habituation을 방지하기 위해 각 활성화 사이에 1 분을 기다리고, 원하는대로 실험을 반복합니다. (우리는 각각의 뉴런위한 세 가지 반응의 최소를 기록).
- 에릴리스 애벌레, 동물을 다치게하지 돌보는, 포셉으로 아가로 오스를 분해 내다. 이 동물은 더 발전 할 수 할 수 있으며 절차는 행동의 개발을 특성화 이전 단계에서 반복 할 수 있습니다. 태아는 아래에 설명 된 것과 같이, 휴대 구조와 동작을 연관시키는 활성 셀의 고해상도 공 촛점 이미징에 대한 remounted 할 수 있습니다.
- 신선한 블루 / 배아 물과 문화 판에 유충을 전송합니다. 우리는 각각의 애벌레를 추적하기 위해 24 잘 플레이트를 사용합니다.
13. 공 촛점 현미경으로 이미지 뉴런 (들)
- 0.02 % tricaine과 애벌레를 마취.
- 1.2 % 낮은 용해 아가로 오스 나 등쪽 금형에 마운트 애벌레, 최대 등쪽면.
- 543 nm의 레이저 및 적절한 필터와 목적이있는 이미지 요리사 tdTomato의 뉴런. 우리는 20x 목표를 사용합니다.
- 아가로 오스의 애벌레를 제거하고 블루 / 배아 물과 잘 개인으로 돌아갑니다.
- 28.5에서 저장 부에 어둠 속에서 ° Crther 분석.
결과

1 그림. 광 케이블은 설정합니다. 광섬유 케이블의 (A) 레이어. 파스퇴르 피펫의 (B) 사라지고 광섬유 케이블. (C) 파스퇴르 (Pasteur) 피펫의 광섬유 케이블은 micromanipulator를 사용하여 위치.
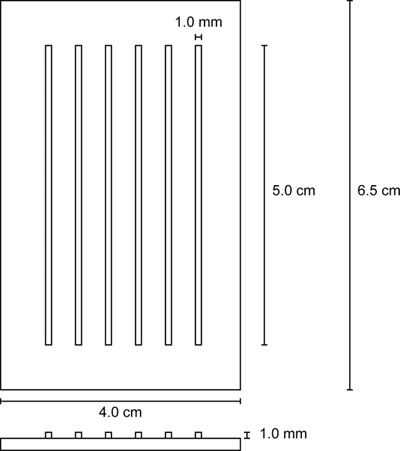
그림 2....
토론
우리는 라이브 zebrafish의 단일 RB의 뉴런의 optogenetic 활성화를위한 접근 방식을 설명하고 있습니다. 우리의 방법은 특정 somatosensory 뉴런에서 휘황 태그 channelrhodopsin의 변형, 요리사 tdTomato 13, 표현할 수있는 과도 transgenesis을 사용합니다. 이 접근 방식은 쉽게 다른 애벌레의 zebrafish 세포 집단에 사용하기 위해 적용 할 수 있습니다.
이 방법을 사용하여 우리는 지속적으?...
공개
제작자들은 더 경쟁 금융 관심이 없다는 것을 선언합니다.
감사의 말
우리는 레이저가 설정 행동 실험과 DPSS에 대한 조언을 Fumi Kubo, 토드 Thiele과 HerwigBaier (UCSF / 최대 플랑크 연구소) 감사, 요리사 tdTomato 실험에 도움을위한 MBL 신경 생물학 과정에서 희수 킴과 키아라 Cerri, PetronellaKettunen (예테보리 (Gothenburg) 대학 ) 초기 optogenetic 실험에 협력, BaljitKhakh, 에릭 허드슨, 마이크, Baca 및 기술 조언 존 Milligan (UCLA) 및 요리사 tdTomato에 대한 로저 Tsien (UCSD) 구성합니다. AS :이 작품은 NSF에서 AMSP와 부여 NRSA (5F31NS064817) 수상 (0,819,010 장비)에 의해 지원되었다.
자료
~ 7.0으로 pH를 조정
장기 저장을위한 4 ° C 또는 -20 ° C에 저장
| Name | Company | Catalog Number | Comments |
| 시약 / 재료의 이름 | 회사 | 카탈로그 번호 | 코멘트 |
| 자료 | |||
| 유리 파스퇴르 피펫 | 어부 | 1367820B | 또는 이에 상응하는 페이지 (10-15mm 직경) |
| 200 μm 광섬유 | ThorLabs | AFS200/220Y-CUSTOM | 패치 코드, 길이 : 3m는 최종 A : FC / PC, 종료 B : FC / PC, 재킷 : FT030 |
| 50 μm 광섬유 | ThorLabs | AFS50/125Y-CUSTOM | 패치 코드, 길이 : 3m는 최종 A : FC / PC, 종료 B : FC / PC, 재킷 : FT030 |
| 조정 깎아 도구 | ThorLabs | AFS900 | 또는 3 홀 스트리핑 도구 (FTS4) |
| 다이아몬드 웨지 서기 | ThorLabs | S90W | |
| / 브라운 Micropipette 풀러을 불타는 | 셔터 악기 | P-97 | 또는 동급 |
| 필라멘트가있는 붕규산 유리 관 | 셔터 악기 | BF-100-78-10 | |
| 사출 금형 | N / A | N / A | 그림 5 |
| 1.5 ML의 원심 분리기 튜브 | 어떤 | 어떤 | |
| 페트리 접시 (100x15 mm) | 어떤 | 어떤 | |
| 페트리 접시 (60x15 mm) | 어떤 | 어떤 | |
| 압력 주입기 | ASI | MPPI-3 | 또는 동급 |
| Micromanipulator 및 금속 스탠드 | Narashige | M152 | 또는 동급 |
| 일회용 플라스틱 피펫 | Fisherbrand | 13-711-7 | 또는 동급 |
| 포커 (핀 홀더와 곤충 핀) | 고급 과학 도구 주식회사 | 26018-17 및 26000-70 | 또는 동급 |
| 집게 | 고급 과학 도구 주식회사 | 11255-20 | 또는 동급 |
| Microloader 피펫 팁 | Eppendorf | 9300001007 | |
| 28.5 ° C 배양기 | 어떤 | 어떤 | |
| 42 ° C 열 블록 | 어떤 | 어떤 | |
| 비 무균 메스 블레이드 # 11 | 고급 과학 도구 주식회사 | 10011-00 | 또는 동급 |
| 을 해부대처하다 | Zeiss | Stemi | 또는 동급 |
| 표준 필터 형광 해부 범위 | 어떤 | 어떤 | 또는 동급 |
| 공 촛점 현미경 | Zeiss | LSM 510 또는 710 | 또는 GFP 및 RFP에 대한 레이저와 동등한, 그리고 10 배, 20x 및 40x 목표 |
| 고속 카메라 | AOS 테크놀로지스 주식회사 | X-PRI (130025-10) | 또는 동급 |
| 473 nm의 휴대용 레이저 | 크리스탈 레이저 | CL-473-050 | TTL 옵션을 사용하여 이상 전원, |
| S48 Stimulator | 아스트로 - 메드 주식회사의 잔디 악기 부문 | S48K | 또는 동급 |
| FC / PC 결합 슬리브에 FC는 / PC | ThorLabs | ADAFC1 | 월 NE광 케이블 연결을위한 에드 |
| 레이저 안전 안경 | ThorLabs | LG10 | 또는 동급 |
| 24 문화 판 | Genesee | 25-102 | 또는 동급 |
| 단일 우울증 슬라이드 | 어부 | S175201 | 또는 동급 |
| 시약 | |||
| 인스턴트 바다 | 수중 생태계 | IS50 | |
| 메틸렌 블루 | 어부 | S71325 | |
| 페놀 레드 | 시그마 | P4758 | |
| 아가로 오스 | EMD | 2125 | 또는 동급 |
| 낮은 용융 아가로 오스 | 시그마 | A9045 | 또는 동급 |
| PTU | 시그마 | P7629 | |
| Tricaine | 시그마 | A5040 | |
| 블루 / 배아 물 | 10 L ddH 2 O 0.6 g 인스턴트 오션 6 물방울 메틸렌 블루 | ||
| 페놀 레드 | (0.2 M KCl 5 MG / ML) | ||
| 100x PTU | 0.150 g PTU 50 ML ddH 2 O 70에 용해 ° C, 자주 흔들 -20 ° C에서 나누어지는 및 매장 | ||
| 1X PTU | 한 ML 100x PTU 99 ML 블루 / 생선 물 | ||
| Tricaine 재고 솔루션 | 400 밀리그램 tricaine 97.9 ddH 2 O | ||
| ~ 2.1 ML 1M 트리스, pH9.0 |
참고문헌
- Arrenberg, A. B., Del Bene, F., Baier, H. Optical control of zebrafish behavior with halorhodopsin. Proc. Natl. Acad. Sci. U.S.A. 106 (42), 17968-17973 (2009).
- Burgess, H. A., Johnson, S. L., Granato, M. Unidirectional startle responses and disrupted left-right co-ordination of motor behaviors in robo3 mutant zebrafish. Genes Brain Behav. 8 (5), 500-511 (2009).
- Douglass, A. D., Kraves, S., Deisseroth, K., Schier, A. F., Engert, F. Escape behavior elicited by single, channelrhodopsin-2-evoked spikes in zebrafish somatosensory neurons. Curr. Biol. 18 (15), 1133-1137 (2008).
- Downes, G. B., Granato, M. Supraspinal input is dispensable to generate glycine-mediated locomotive behaviors in the zebrafish embryo. J. Neurobiol. 66 (5), 437-451 (2006).
- Drapeau, P., Saint-Amant, L., Buss, R. R., Chong, M., McDearmid, J. R., Brustein, E. Development of the locomotor network in zebrafish. Prog. Neurobiol. 68 (2), 85-111 (2002).
- Eisenhoffer, G. T., Rosenblatt, J. Live Imaging of Cell Extrusion from the Epidermis of Developing Zebrafish. J. Vis. Exp. (52), e2689 (2011).
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J. Vis. Exp. (26), e1217 (2009).
- Kague, E., Weber, C., Fisher, S. Mosaic Zebrafish Transgenesis for Evaluating Enhancer Sequences. J. Vis. Exp. (41), e1722 (2010).
- Kemp, H. A., Carmany-Rampey, A., Moens, C. Generating Chimeric Zebrafish Embryos by Transplantation. J. Vis. Exp. (29), e1394 (2009).
- Kohashi, T., Oda, Y. Initiation of Mauthner- or non-Mauthner-mediated fast escape evoked by different modes of sensory input. J. Neurosci. 28 (42), 10641-10653 (2008).
- Lai, S. L., Lee, T. Genetic mosaic with dual binary transcriptional systems in Drosophila. Nat. Neurosci. 9 (5), 703-709 (2006).
- Liao, J. C., Haehnel, M. Physiology of afferent neurons in larval zebrafish provides a functional framework for lateral line somatotopy. J. Neurophysiol. 107 (10), 2615-2623 (2012).
- Lin, J. Y., Lin, M. Z., Steinbach, P., Tsien, R. Y. Characterization of engineered channelrhodopsin variants with improved properties and kinetics. Biophys J. 96 (5), 1803-1814 (2009).
- Liu, K. S., Fetcho, J. R. Laser ablations reveal functional relationships of segmental hindbrain neurons in zebrafish. Neuron. 23 (2), 325-335 (1999).
- Liu, Y. C., Bailey, I., Hale, M. E. Alternative startle motor patterns and behaviors in the larval zebrafish (Danio rerio). J. Comp. Physiol. A. Neuroethol. Sens Neural. Behav. Physiol. 198 (1), 11-24 (2012).
- Palanca, A. M., Lee, S. L., Yee, L. E., Joe-Wong, C., Trinh, L. A., Hiroyasu, E., Husain, M., Fraser, S. E., Pellegrini, M., Sagasti, A. New transgenic reporters identify somatosensory neuron subtypes in larval zebrafish. Dev. Neurobiol. , (2012).
- Pujol-Martí, J., Zecca, A., Baudoin, J. P., Faucherre, A., Asakawa, K., Kawakami, K., López-Schier, H. Neuronal birth order identifies a dimorphic sensorineural map. J. Neurosci. 32 (9), 2976-2987 (2012).
- Saint-Amant, L., Drapeau, P. Time course of the development of motor behaviors in the zebrafish embryo. J. Neurobiol. 37 (4), 622-632 (1998).
- Szobota, S., et al. Remote control of neuronal activity with a light-gated glutamate receptor. Neuron. 54 (4), 535-545 (2007).
- Uemura, O., et al. Comparative functional genomics revealed conservation and diversification of three enhancers of the isl1 gene for motor and sensory neuron-specific expression. Dev. Biol. 278 (2), 587-606 (2005).
- Wyart, C., Del Bene, F., Warp, E., Scott, E. K., Trauner, D., Baier, H., Isacoff, E. Y. Optogenetic dissection of a behavioural module in the vertebrate spinal cord. Nature. 461 (7262), 407-410 (2009).
- Yuan, S., Sun, Z. Microinjection of mRNA and Morpholino Antisense Oligonucleotides in Zebrafish Embryos. J. Vis. Exp. (27), e1113 (2009).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유