Method Article
소설
요약
The accessibility of reliable models to investigate vascular blood interactions in humans is lacking. We present an in vitro model of cultured primary human endothelial cells combined with human whole blood to investigate cellular interactions both in the blood (ELISA) and the vascular compartment (microscopy).
초록
알려진 모든 질병의 대부분은 심혈 관계 질환을 수반한다. 심장 혈관 병리 동안 활성화 된 상호 작용 경로의 복잡성에 대한 연구는, 그러나, 강력한 생리 학적으로 관련 방법의 부족에 의해 제한됩니다. 병적 혈관 사건을 모델링하기 위해, 우리는 내피 전혈 사이의 상호 작용을 연구하기위한 시험 관내 분석을 개발 하였다. 분석은 인간의 전체 혈액과 접촉에 배치됩니다 차 인간의 내피 세포로 구성되어 있습니다. 상기 방법은 혈관에 존재하는 분자 및 세포 성분 간의 미묘한 상호 작용 연구를 가능 거의 혹은 전혀 항응고제 네이티브 혈액을 이용한다.
우리 또는 인간 제대 정맥 내피 세포 (HUVEC) 배양없이 다른 혈액 부피로 응고의 활성화를 비교함으로써 분석의 기능을 조사 하였다. 큰 혈액 부피에 기여하는 반면트롬빈 안티 트롬빈의 형성 증가 (TAT) 복합체, HUVEC의 존재는 응고 활성의 감소 결과. HUVEC는 종양 괴사 인자 (TNFα)로 자극과 혈액의 접촉 후 자극되지 않은 세포에 비하여 TNFα 세포 자극에 상당히 높은 것으로 CD16 + 세포의 존재를 발견에 더욱이, 우리는 백혈구의 부착 이미지 분석을 적용 하였다. 결론적으로, 분석은 내피 세포 및 혈액 구획 사이의 상호 작용을 교란되어 혈관 병리 현상을 연구하기 위해 적용될 수있다.
서문
심혈관 질환에서 혈액 혈관의 상호 작용을 분석하는 방법은 일반적으로 동물 연구 실험을 포함한다. 실험 연구 동물 모델에서 생성 된 결과 그러나. 인간의 질병에 대한 거의 또는 전혀 의미가 이와 같이 1,2- 수 혈액 구획과 혈관 내피 세포 간의 세포 상호 작용을 조사하는 시험 관내 모델에서 좋은 신뢰성에 대한 요구가있다 인간과 같은 시스템. 따라서 우리는 혈액 내피 세포 챔버 모델을 설립했다. 이 생체 물질과 인간의 전체 혈액 사이의 상호 작용을 조사하기 위해 사용 이전에 설명한 모델을 기반으로합니다. 일반적으로 정제 된 구성 요소의 수를 제한 다른 시험관 설정 3는 달리 즉, 혈소판은 백혈구 나 내피 세포가 사용할 수 있으며, 본 모델은 모든 통합 성분은 혈관에 제시한다.
혈액 내피 (c)의 설치엘 실 모델은 거의 또는 전혀 추가 항응고제 갓 그려진 인간의 혈액의 사용을 가능하도록 설계되었습니다. 긴 시간 기간 동안 저장된 혈액은 그래서 적혈구의 파괴가 혈액과 혈관 내피 세포 사이의 미묘한 상호 작용을 방해 할 수있는 저장 병변라고 획득을 누릅니다. 4
생체 전체 혈액의 취급시 혈전 형성을 방지하려면 항응고제의 혈액과 접촉하는 모든 물질이 비 활성화 할 필요가 다량으로 복용 중 하나가 필요합니다. 비 - 활성화 된 표면은 실험실 환경에서 드문 같이, 물질은 별도로 고정 된 헤파린의 보호 층을 구비 할 수있다. 고정화 헤파린의 보호 층을 피 접촉은 응고 캐스케이드의 활성화를 야기하지 않고 발생할 수있는 표면을 생성 대부분의 물질에 적용될 수있다 (이하 Corline 헤파린 표면 (CHS)이라 함). (5)을 따라서 함께 챔버 가구하여 CHS, 혈액 내피 CELL 챔버 모델은 혈액에 항응고제의 매우 낮은 농도의 사용을 가능하게한다. 혈액 내피 챔버 모델에서 항 응고 고농도의 첨가를 피하는 것은 달리 마스킹 될 수있는 혈관 내의 중요한 상호 작용을 검토하는 것이 가능하다. (6)
플라스틱 현미경 슬라이드에 :; (9mm 반경 8mm 높이) 혈액 내피 세포 챔버 모델은 플라스틱 실린더를 부착하여 형성된 2 개의 챔버로 구성되어 있습니다. 실린더에 위로 향 가장자리가 세포 배양 슬라이드에 챔버를 밀봉에 사용되는 고무 O 링이 장착되어 홈이 장착되어 있습니다. 챔버는 부분적으로 챔버는 이후 수직 위치 (그림 1)으로 회전 할 때 실에 남아있는 공기가 운동에 혈액을 유지 혈액으로 가득 차 있습니다.
모델의 기능을 평가하기 위해, 우리는 하나 완전히 CHS 코팅 실험을 수행챔버 또는 인간 제대 정맥 내피 세포 (HUVEC). 두 개의 분리 된 혈액 볼륨 측정 하였다 트롬빈과 안티 트롬빈 (TAT) 복합체 (응고의 간접 마커)의 형성은 효소 면역 분석법 (ELISA)으로 측정 하였다. 그런 다음 혈액 볼륨 및 종양 괴사 인자 (TNFα) 화상 해석에 의해 백혈구 보충에 내피 세포를 자극하는 효과를 평가 하였다.
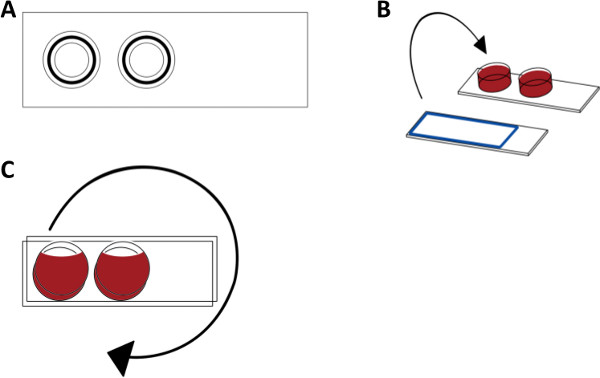
혈액 내피 세포 챔버 모델 1. 설정을 그림. (A) 위쪽 PMMA에서 만든 혈액 챔버의 개략도를 볼 수 있습니다. (B) 1 차 인간의 내피 세포가 1 웰 챔버 슬라이드에서 배양한다. 신선한 인간 전혈은 현미경 슬라이드에 두 챔버에 첨가된다. 혈액을 처리하는 데 사용 챔버 및 모든 자료는 보호 HS 코팅으로 처리됩니다. CE의 벽을 제거한 후에LL 배양 슬라이드, 세포는 혈액 대향 배치되고 시스템은 셧을 클램프한다. (C) 혈액 내피 세포 챔버는 37 ° C에서 회전하에 배양 하였다. 그 후, 혈액 구획 반응은 ELISA에 의해 분석 될 수 있으며, 내피 세포를 현미경으로 분석 될 수있다.
프로토콜
참고 : 혈액 웁살라 윤리 심의위원회 (허가 번호 264분의 2,008)와 승인의 개방형 시스템 정맥 천자에 의한 건강한 사람에서 도출되었다.
1. 시드 세포
- T75 플라스크 중 5 %에서 37 ° C에서 CO 2 차 배양 인간 제대 정맥 내피 세포 (HUVEC)는 PBS (pH 7.4) 중 1 % 젤라틴으로 코팅.
- T75의 HUVEC을 포함하는 플라스크 (또는 기본 인간의 내피 세포의 다른 유형)에서 배지를 제거하고 PBS의 pH를 7.4에서 2.1 mM의 EDTA로 세포를 씻으십시오. 37 ° C에서 3 분 - 1 ml의 0.25 % 트립신 EDTA를 추가하고 2 배양하여 세포를 분리합니다.
- PBS pH를 7.4에서 9 ml의 10 % FBS로 플라스크를 세척하여 세포를 수집하고 15 ㎖의 튜브에 세포 현탁액을 전송. 5 분 동안 735 XG에서 세포를 스핀 다운.
- 상등액을 제거하고 내피 세포 성장 배지 미세 혈관 (EC GMMV) 신중 세포 펠렛을 재현 탁하고 Bürker 챔버에서 세포를 카운트. 21,000 C 종자ELL 학생 / 1 웰 세포 배양 슬라이드에 cm 2, 37 ° C에서 품어. 문화 2 일 - HUVEC은 1 일 이후에 컨 플루 언트됩니다. 가벼운 현미경으로 세포 형태와 컨 플루 매일을 모니터링합니다.
전혈 2. 준비
- 제조업체의 지침에 따라 고정 된 헤파린 (CHS)의 더블 레이어 혈액과 접촉하는 모든 인공 표면을 준비합니다. 먼지로부터 보호 CHS 코팅 재료는 기능의 손실없이 최대 6 개월 실온에서 저장 될 수있다.
- 혈액 내피 챔버 실험을 시작하기 전에 곧 건강한 기증자 (<30 분)에서 혈액을 채취하는 개방형 시스템 정맥 천자를 사용합니다. 조심스럽게 CHS 코팅 된 50 ㎖ 튜브에 혈액을 수집하기 전에 : (2mm 내경) 커플은 피하 주사 바늘 CHS 코팅 실리콘 튜브로 (18 G는 50mm를 X). 미분 획 헤파린 보충 혈액 0.75 IU / ml의 최종 농도에 도달한다. INVE에 의해 부드럽게 혈액을 혼합3 회 - 튜브 2를 rting.
3. 혈액 내피 상공 회의소 모델
- PMMA 슬라이드 (25 X 75mm)에 붙어 두 개의 실린더 (높이 8mm 및 반경 9mm)로 구성된 아크릴 폴리 메틸 메타 크릴 레이트 (PMMA)에서, 혈액 챔버 (상위 뷰 그림 1A)를 제작합니다. 배양 된 내피 세포 (도 1b)를 가진 유리 슬라이드에 대해 혈액 챔버를 밀봉하기 위해 고무 O 링이 위쪽으로 향하도록 실린더의 가장자리를 장착한다. 그 후 수직 위치 (그림 1C)에서 내피 세포와 배양 슬라이드에 연결된 혈액 챔버를 회전합니다.
- 혈액을 활성화하지 챔버 돌보는 코팅 각 CHS에 1.5 ml의 혈액을 전송하는 CHS 코팅 피펫 팁을 사용합니다.
- MK에게 μL 0.34 3 30 EDTA를 함유하는 마이크로 원심 분리 튜브로 이동 1 ml의 혈액을 사용하여 초기 혈장 단백질 농도 측정을 위해 10 mM의 K 3 EDTA의 최종 농도에 도달효소 면역 분석법 (ELISA)를 연결. 조심스럽게 피를 혼합하고 얼음에 튜브를 유지.
- PBS pH를 7.4에서 세포를 씻어 신중 제조업체의 지시에 따라 세포 배양 유리 슬라이드의 플라스틱 벽을 제거하고. 이후 슬라이드에서 가능한 한 많은 액체를 제거해야합니다. 세포가 건조하게하지 마십시오.
- 혈액에 직면 세포, 혈액 챔버의 상단에 슬라이드를 놓습니다. 혈액 내피 세포 챔버 주위에 클램프를 배치하여 슬라이드를 고정. 클램프를 배치 할 때 세포 배양 유리 슬라이드의 파손을 방지하기위한 추가 지원 플라스틱 슬라이드를 사용한다.
- 37 ° C의 물을 욕조에 회전 바퀴에 혈액 내피 세포 챔버를 수정 (40 직경 CM) 장소. 30 분 동안 0.5 XG에서 바퀴의 각 실을 돌립니다.
- 배양 후, 혈액 내피 세포 챔버 해체. F PBS의 pH를 7.4에서 세포 배양 슬라이드를 세척하고 (PFA)를 얼음 차가운 1 % 파라 포름 알데히드로 세포를 고정또는 10 분. μL 0.34 MK 3 EDTA를 (30)를 포함하는 마이크로 원심 튜브에 각각의 챔버에서 전송 1 ml의 혈액을 10 mM의 K 3 EDTA의 최종 농도에 도달하고 부드럽게 튜브를 혼합합니다. 얼음에 튜브를 유지합니다.
- 4 ℃에서 10 분 동안 4,560 XG에서 튜브를 원심 분리기. 추가 분석 할 때까지 -70 ℃에서 새로운 마이크로 원심 튜브 및 저장소에 혈장을 전송합니다.
혈액 내피 세포의 상호 작용 4. 분석
- 보조 염소 항 - 마우스 알렉사 488과 팔로이 딘 - TexasRed 다음 마우스 항 - 인간 CD16과 면역 형광 염색을 수행합니다. 실온에서 1 시간 동안 각 염색 공정을 수행하고, 각 단계 사이에 PBS pH를 7.4에서 슬라이드를 세척 하였다. 실온에서 10 분 동안 DAPI로 핵 Counterstain과. 이미지 분석은 CellProfiler 같은 적당한 이미지 분석 소프트웨어를 이용하여 조합하여 형광 현미경으로 혈관 내피 세포에 결합 된 혈액 성분을 분석한다.
- 정량화회계 연도 혈장의 제조 업체의 지침에 따라 트롬빈 - 안티 트롬빈 (TAT) ELISA와 혈액 구획의 반응.
- 적절한 통계 도구, 예를 사용한다., 짝 t 테스트를, 데이터를 분석.
결과
CHS 코팅의 필요성
내피 세포에 의해 유발 된 것과 특정 전혈에서 반응을 측정하기 위해, 혈액 내피 세포 챔버에 사용되는 모든 재료는 사용 전에 CHS 코팅으로 제공되어야한다.도 2a는 (왼쪽)의 30 분 후, 코팅 챔버를 도시 명확하게 볼 혈전 현재와 혈액의 접촉. 반면에, CHS와 챔버 (도 2A, 오른쪽)을 처리하여 결과 내피 세포 - 혈액의 상호 작용에 기인하도록 보장 제어되지 않은 활성화로부터 혈액을 보호한다.
챔버 내의 혈액 볼륨의 효과
활성화 응고 인자 사이의 상호 작용의 확률이 증가함에 따라 응고의 활성화는 정체 혈중 쉽다. 혈액 내피 세포 챔버 모델에서 혈액 인하여 챔버 내부의 기포의 순환 운동에 유지된다. O를RDER 따라서 또한 기포 크기 혈액량의 변화의 효과를 결정하고, CHS 코팅 챔버는 1.5 ml를 30 분 동안 1.75 ml의 전혈 테스트 하였다 CHS 코팅 된 유리 슬라이드에 연결되었다. 혈액 1.75 ㎖의 혈액을 1.5 ㎖의 (도 2B)를 사용하는 경우에 비해, 챔버에 추가 될 때 기포에 의한 운동이없는 혈액의 부피가 2.5 배 더 크다. 측정 된 TAT-값은 증가 혈액 볼륨 (그림 2D)와 TAT-형성을 증가 제안했다. HUVEC (도 2C)가 전혈 1.5 중 1.75 ㎖를 함께 배양 하였을 때, 차이는 내피 세포가 응고의 활성화 (도 2D)를 조절할 수 있음을 시사한다, 두 그룹간에 유의하지 않았다.
혈액 세포 모집에 TNFα의 효과와 응고의 활성화
백혈구 모집에 TNFα의 효과를 연구하기 위해, HUVEC은 치료했다20 NG와 ED / ㎖ TNFα 4 시간 혈액에 접촉하기 전에. 혈액 접촉 - 중 1.5 ml의 또는 1.75 ml의 혈액와 함께 -, 문화 슬라이드 CD16 (그림 2 층)에 대한 염색 된 후 30 분 동안 계속 이미징 및 CD16 + 세포의 수를 정량화 하였다. CD16 + 세포의 모집은 1.5 ml의 혈액 100 ~ 256 CD16 + 세포 / mm 2 (P <0.0001)에서 TNFα 치료 (그림 2E)으로 크게 증가, 172에서 1.75 ml의 혈액 378 (P <0.0001)에. TAT 복합체의 형성은 어느 TNFα가 처리되거나 비 처리 된 세포 (도 2G)와 함께 배양 혈액 대응 혈장 샘플에서 측정 하였다. 비 처리 된 세포에 비하여 TNFα 자극 된 세포는 TAT 복합체의 대략 배가를 유도.
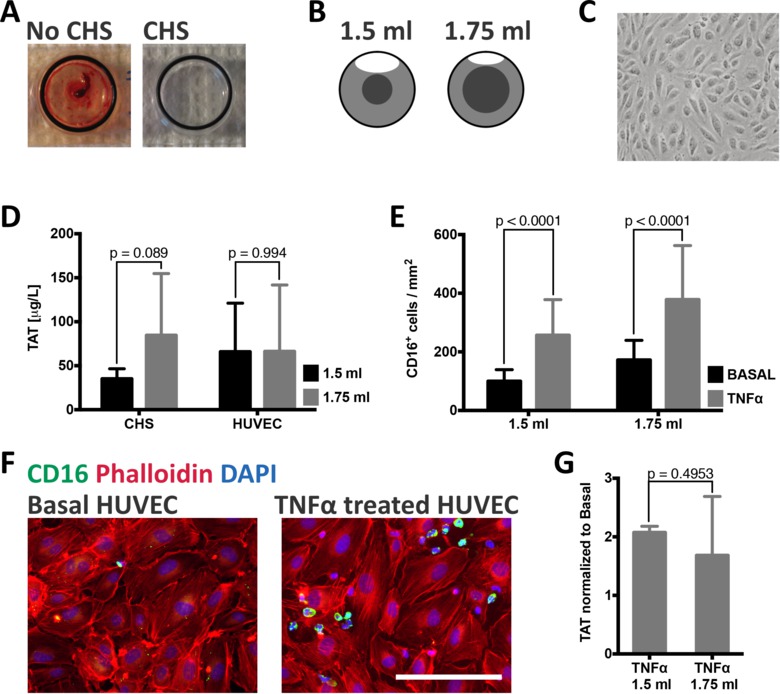
무화과URE 2 : 혈액 내피 세포 챔버 모델의 기능을 제공합니다. CHS 유무에 관계없이 (A) 챔버는 전체 혈액 배양 하였다. CHS없이 혈전을 30 분 후에 형성되었다. CHS없이 배양 혈액에서 트롬빈 - 안티 트롬빈 (TAT) 단지, 응고의 간접 마커의 측정> 6,000 ㎍ / ㎖를했다. (B) 혈액의 볼륨은 다른 혈액 볼륨에 따라 달라집니다 회전 기포에 의해 움직이는 유지되지. 그것은 1.75 ㎖를 첨가하여 0.74 ml의 증가 반면 혈액 1.5 ㎖를 첨가하여이 부피는 0.3 ml의 것이다. 합류 단층의 위상차 현미경 쇼 전형적인 내피 세포 형태 앞서서와 (C) HUVEC 이미지화 다른 혈액 볼륨이 추가 될 때 혈액 접촉. (D) 완전히 CHS 코팅 챔버에 대한 TAT 값은 약간의 차이를 보여줍니다. 1.5 ml의 혈액의 첨가는 85 ml의 결과 1.75로 ± 11 ㎍ / ㎖ (N = 7)에 비하여 35 귀착77; 70 ㎍ / ml의 TAT (N = 8). HUVEC 동일한 혈액량 함께 배양 될 때 이러한 차이는 더 이상 존재하지 않는다; 1.5 ml의 66 ± 55 μg의은 / ㎖ (n = 5)으로 나누고, 66 ± 29 1.75 ㎖ (없음 7 =) 비자극 또는 TNFα 하나에서 CD16 + 세포의 수. (E) 부량 본이 후 HUVEC를 자극 용 ㎍ / ml의 혈액 접촉. 또는 1.75 ㎖ (기초 :; TNFα 중 하나를 1.5 ㎖ (256 ± 121 세포 / mm TNFα 100 ± 40 세포 / mm 기저) : 배양 세포를 자극하여 CD16 + 세포의 수는 크게 증가 172 ± 67 세포 / mm를; TNFα : 전체 혈액의 378 ± 185 세포 / mm) (F) HUVEC은 팔로이 딘 (적색 염색을 자극 비자극 및 TNFα의 대표 이미지), CD16 (녹색) 및 DAPI (파란색).. 스케일 바 = 250 μm의 혈액 (1.5 ㎖로 배양 처리하지 않은 세포에 비해 TAT 복합체의 형성은 약 TNFα에 의해 배가된다 (G) 세포를 자극 :. 2.1 ± 0.1 배 이상 TAT, N = 3; 1.75 ml의 1.7 ± 1.0 배의 TAT, N = 4). 모든 값은 평균 ± 표준 편차로 표시된다 P 값이 짝 t 테스트에 의해 계산 하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
혈액 및 혈관 벽 사이의 다중의 상호 작용은 일반적 의한 내피 세포의 비 - 접착 성 및 항 혈전 특성으로 정지 상태로 유지된다. (7) 염증과 관련된 병리 적 상태 동안, 내피 세포 부착 수용체 발현 8에서 얻어진 증가 활성화되고 감소 된 능력을 억제하는 지혈. 차례의 혈액에서 캐스케이드 시스템 (9) 활성화가 더 혈전증 및 백혈구 모집의 원인이되는 혈관 내피 세포의 혈전을 증폭시킨다. (10) 내피 세포 및 전체 혈액 사이의 미묘한 상호 작용에 대한 이해를 얻으려면, 우리가 배양 된 내피 세포는 전체 혈액과 접촉에 배치됩니다 체외 방법에 소설을 개발했다. 우리가 알기로는, 우리의 설치는 더 이상 기간에 대한 아니오 전체 인간의 혈액 또는 약간의 항응고제로 배양 내피 세포를 보여 처음이다.
NT ">이 시스템의 감도는 혈액과 접촉에 배치 모든 표면에 고정화 된 헤파린의 보호 층과 함께 개방형 시스템 정맥 천자로 사용할 수 있습니다. 혈액 조달 동안 개방형 시스템의 사용은 정맥 천자시 캐스케이드 시스템의 활성화를 감소 항응고제의 자기 결정된 양의 사용을 허용하는 동안. 시판 진공 혈액 튜브 그러나, 연구의 의도 끝점에 따라 사용될 수있다. 대부분의 시판 폐쇄계 튜브에 첨가 항응고제의 최종 농도가 민감 억제 할 수 , 그렇지 않으면 하드 설정에서, 상호 작용을 연구합니다. (6) 보호 헤파린 표면이 더 내피 세포 이외의 다른 표면으로 표면 접촉을 통해 혈액의 활성화를 제거한다. (5) 실제로, 미분 획 헤파린의 소량 첨가 된 전체 혈액의 배양을 CHS의 보호없이 챔버는 혈전 형성의 결과. 챔버 내부의 공기 거품 내피 세포 배양시 혈액의 혼합을 가능하게한다. 기포 크기의 영향을 평가하기 위해, 우리는 두 가지 혈액량을 사용했다. 이 모델에서는 HUVEC 배양 챔버에 관계없이 기포의 크기 TAT 비슷한 수준을 측정 하였다. TAT는하지만, 완전히 CHS에 작은 기포 크기가 증가 챔버 처리했다. 이것은, 전술 내피 세포의 특성 (11)에 따라, 불활성 CHS 챔버에서 결여되어 내피 세포에 의해 제공 응고의 증가 된 활성화시 조절 효과를 나타낸다. 시스템의 공기 방울은 챔버의 회전에 따라 흐름을 만듭니다. 거품의 크기는이 회전 시스템 내에서 힘에 영향을 미칠 것입니다. 이것은 작은 기포가 혈액 예에 따라 감소 된 힘을 나타내는 높은 TAT 값을 생성 그림 2D에서 우리의 결과에 의해했다 표시됩니다, 혈액 이동챔버는 낮고 캐스케이드 시스템의 활성화함으로써 높은 정도로 발생 내에. 그것은이 시스템에서 우리는 벽과 중앙에서 가장 낮은 함께 최고 속도로 챔버에서 속도 다를 수 있습니다 회전 흐름을 만드는 것을 언급해야한다. 이것은 분명히 내피 세포에 대한 흐름과 관련하여 전단 응력을 가진 최적의 환경 아니지만, 여전히 우리는 안정적이고 반복 가능한 결과를 생성하는 시스템을 갖는다. 더 최적의 조건은 난류의 부재 층류 순환 포함한다. 이 여기에 표현 된 모델에서, 그러나 불가능하며 우리의 지식에 이러한 시스템은 날짜에 사용할 수 없습니다. 시스템에 추가 항응고제없이 또는 낮은 수준으로 전체 혈액과 결합 할 수없는 몇 가지 미세 유체 시스템을 시판이 있지만함으로써 혈액과 혈관 내피 세포에 존재하는 모든 구성 요소 사이의 상호 작용의 적절한 민감한 평가를 가능하게 실패.또한 TNFα는 독립적 혈액량의 TAT의 배 형성과 조합 HUVEC 활성화쪽으로 혈액 세포의 모집 2 배 증가 하였다. 이 모델 시스템의 안정성을 확인하고 또한 전혈과 함께 활성화 된 내피 세포를 사용할 수있는 가능성을 보여준다. 혈액 내피 세포 챔버는 다양한 조건 하에서 활성화의 단계에서 발현 세포 마커의 종류에 의해 활성화 된 내피 세포쪽으로 혈액 세포 모집을 조사하는데 사용될 수에 미래. 더욱이, 모델은 염증 상태에 대한 영향을 평가하기 위하여 약리학 적 제제와 조합하여 사용할 수있다.
요약하면, 우리는 혈관 질환 관련 조사를 수행하는 시험 관내 시스템에서의 완전한 인간을 만드는 사람의 혈액 및 혈관 세포 챔버 모델을 조합하는 큰 이점을 나타낸다.
공개
The authors have nothing to disclose.
감사의 말
본 연구는 N 602699 (DIREKT) ° 부여 계약에 따라 스웨덴 연구 협의회 (90293501, A0290401, A0290402), 유럽 공동체의 일곱 번째 프레임 워크 프로그램에서 보조금에 의해 지원되었다, NovoNordisk 재단, Gurli 에드워드 Brunnberg 재단, 치료, Vleugel 줄기 재단과 아케 WIBERG 재단.
자료
| Name | Company | Catalog Number | Comments |
| Human Umbilican Vein Endothelial Cells (HUVEC) | PromoCell | C-12200 | Any other type of primary human endothelial cell may be used. |
| Endothelial Cell Growth Medium MV (ECGM MV) | PromoCell | C-22120 | |
| Gelatin | Sigma-Aldrich | G-2500 | Prepare 1% gelatin in PBS, incubate 5 ml in a T75 for 15 min and remove before culturing cells. |
| TAT ELISA | Enzyme Research Lab. | TAT-EIA-C | |
| Mouse anti-human CD16 | DAKO | F7011 | Dilution 1:100 |
| Goat anti-mouse Alexa 488 | Molecular Probes | A11001 | Dilution 1:500 |
| Phalloidin-Texas Red | Molecular Probes | A22287 | Dilution 1:200 |
| DAPI | Molecular Probes | D1306 | Dilution 10 μg/ml |
| EDTA | Sigma | E-6758 | |
| 0.25% Trypsin-EDTA | Gibco Life Tecnologies | 25200-056 | |
| Fetal Bovine Serum (FBS) | Gibco Life Technologies | 10437 | |
| 1 well cell culture slides | BD Falcon | 354101 | |
| Blood Chambers | NA | NA | Blood Chamber may be manufactured in PMMA or any other plastic able to bind CHS |
| Clamps | Office Depot | 2052204 | |
| Corline Heparin Surface (CHS) | Corline Systems AB | 945-00 | |
| Hypodermic needle | Terumo | NN-1850R | Size: 18 G x 5 mm |
| Unfractionated Heparin (UFH) | Leo Pharma | 585679 | |
| K3EDTA | Alfa Aesar | 1709958 | Prepare a 0.34 M stock solution in milliQ H2O |
| PFA | Sigma-Aldrich | P-6148 | |
| Fluorescence microscope | Nikon | 80i | |
| Light microscope | Nikon | TS100 | |
| Image analysis software | Broad Institute | CellProfiler | Available for free at www.cellprofiler.org |
참고문헌
- Mestas, J., Hughes, C. C. W. Of Mice and Not Men: Differences between Mouse and Human Immunology. J Immunol. 172 (2), 2731-2738 (2004).
- Seok, J., et al. Genomic responses in mouse models poorly mimic human inflammatory diseases. Proc Natl Acad Sci U S A. 110 (9), 3507-3512 (2013).
- Hong, J., Ekdahl, K. N., Reynolds, H., Larsson, R., Nilsson, B. A new in vitro model to study interaction between whole blood and biomaterials. Studies of platelet and coagulation activation acid the effect of aspirin. Biomaterials. 20 (7), 603-611 (1999).
- Doctor, A., Spinella, P. Effect of Processing and Storage on Red Blood Cell Function In. Vivo. Semin Perinatol. 36 (4), 248-259 (2012).
- Andersson, J., et al. Optimal heparin surface concentration and antithrombin binding capacity as evaluated with human non-anticoagulated blood in vitro. J Biomed Mater Res A. 67 (2), 458-466 (2003).
- Ekdahl, K. N., Hong, J., Hamad, O. A., Larsson, R., Nilsson, B. Evaluation of the blood compatibility of materials, cells, and tissues: basic concepts, test models, and practical guidelines. Adv Exp Med Biol. 735, 257-270 (2013).
- Aird, W. C. Spatial and temporal dynamics of the endothelium. J Thromb Haemost. 3 (7), 1392-1406 (2005).
- Cines, D. B., et al. Endothelial cells in physiology and in the pathophysiology of vascular disorders. Blood. 91 (10), 3527-3561 (1998).
- Kirchhofer, D., Tschopp, T. B., Hadvary, P., Baumgartner, H. R. Endothelial cells stimulated with tumor necrosis factor-alpha express varying amounts of tissue factor resulting in inhomogenous fibrin deposition in a native blood flow system. Effects of thrombin inhibitors. J Clin Invest. (5), 2073-2083 (1994).
- Esmon, C. T. Molecular circuits in thrombosis and inflammation. Thromb Haemost. 109 (3), 416-420 (2013).
- Rosenberg, R. D., Aird, W. C. Vascular-Bed–Specific Hemostasis and Hypercoagulable States. N Engl J Med. 340 (20), 1555-1564 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유