Method Article
해제 배아 마음에 관상 동맥 혈관의 분석
요약
우리는 광 클리어런스 및 초점 현미경이어서 표준 면역 염색 방법을 이용하여, E15.5까지 온 뮤린 배아 하트 관상 혈관의 분석 프로토콜을 제시한다. 이 기술은 직렬 섹션 시간 소모 분석 할 필요없이 전체에 걸쳐 심장 혈관의 시각화를 가능하게한다.
초록
Whole mount visualization of the embryonic coronary plexus from which the capillary and arterial networks will form is rendered problematic using standard microscopy techniques, due to the scattering of imaging light by the thick heart tissue, as these vessels are localized deep within the walls of the developing heart. As optical clearing of tissues using organic solvents such as BABB (1 part benzyl alcohol to 2 parts benzyl benzoate) has been shown to greatly improve the optical penetration depth that can be achieved, we combined clearance of whole, PECAM1-immunostained hearts, with laser-scanning confocal microscopy, in order to obtain high-resolution images of vessels throughout the entire heart. BABB clearance of embryonic hearts takes place rapidly and also acts to preserve the fluorescent signal for several weeks; in addition, samples can be imaged multiple times without loss of signal. This straightforward method is also applicable to imaging other types of blood vessels in whole embryos.
서문
작동하는 관상 동맥 네트워크를 설정하면이 발달 과정을 기본 분자 신호로 귀중한 통찰력을 제공 할 수있는 심장 기능 및 배아 발달, 유전 마우스 돌연변이의 분석을 위해 매우 중요하다. 전체 배아 관상 신경총을 시각화하는 능력은 오히려 학적 부분의 연속 표시보다는 유전자 돌연변이의 혈관 패턴의 분석을 용이하게하기 위하여 필수적이며, 기계적으로 인해 발생할 수있는 정보의 손실 가능성을 회피 조직의 슬라이스. 동맥을 형성하는 운명 혈관과 모세 혈관이 깊은 심실과 대동맥 1-3 모두의 벽 내에서 지역화됩니다. 그러나 wholemount 표지 표재성 정맥 / 림프관 4,5- 고해상도 화상을 제공 할 수 레이저 스캐닝 공 초점 현미경과 결합 된 세포의 형광 표지 반면 영상의 깊이는 광 투과에 의해 제한된다. 캡의 고해상도 영상화심장의 전체 깊이에 걸쳐 illaries 및 동맥 조직 청산의 형태 않고 따라서 수 없습니다.
불량 광 투과는 여러 세포 및 세포 외 (예컨대, 콜라겐과 탄성 섬유) 두께의 조직 성분의 고 굴절률에 의해 야기된다. 이것은 영상 광을 산란 블러 일으키고 콘트라스트를 감소시켰다. 삭제 에이전트는 일반적으로 빛이 방해받지 샘플을 통과하고 조직으로 깊이 침투 할 수 있다는 것을 의미, 이러한 조직의 높은 굴절률을 일치합니다. 물이 비교적 낮은 굴절률로 클리어 전에 조직은 일반적으로 탈수된다. 새로운 청소 방법의 과다 그러나, 청산 과정이 며칠 또는 몇 주 걸릴 수 있으며 비용이 많이 드는 시약 6-9 필요할 수 있습니다 사용 된 기술에 따라, 최근에 개발되었다. BABB (1 : 벤질 알코올, 벤질 벤조 에이트의 혼합물을 2)는이있는 저렴하고 일반적으로 사용되는 소거 에이전트이며매우 신속하게 샘플을 삭제의 장점. BABB 계 클리어 이미징 기술은 신경 샘플 및 다양한 기관 10-13 위해 전술되었다. 15.5 - 여기에서 우리는 E (배아 일) 11.5에서 쥐의 마음 혈관의 시험에 특정 참조하여, 공 초점 현미경으로 다음 면역 염색 샘플의 BABB 통관을위한 강력하고 간단한 방법을 설명합니다. 또한 입증되었다 그러나, 상기 기술은 동일하게 한 관심 마커 고품질 항체를 사용할 수 있으며, 전체 배아 분석뿐만 아니라 다른 세포 유형에 적용될 수있다.
프로토콜
모든 동물 연구는 영국 홈 오피스에서 라이선스 기관의 지침에 따라 실시 하였다.
1. 해부 및 배아 마음의 고정
- 윤리적으로 승인 컬링 기술, 자궁 경부 전위 다음에 예를 들면, CO 2 마취를 사용하여 필요한 날에 시간 초과 - 임신 마우스를 안락사, 인산염 완충 식염수로 가득 10cm 페트리 접시에 배치, 배아 낭 (14)을 제거 (PBS) .
- 탯줄을 절단하고 난황을 제거, 신중하게 각각의 배아를 자궁 주머니를 열고 제거, 해부 현미경과 집게를 사용.
- 유전자형을 위해, 나중에 용해 / DNA 추출을위한 1.5 ml의 microcentrifuge 관에서 배아의 꼬리와 장소를 제거합니다.
- 스테인레스 스틸 minutien 핀을 사용하여 PBS 채워진 실리콘 탄성 중합체 코팅 35mm 페트리 접시의 뒷면에 각각의 배아를, 마음을 제거 고정하기 위해. 미세 집게를 ca를 사용하여refully 가슴을 열고 큰 혈관을 절단, 심장에 전방. 그런 마음의 뒤에 배를 잡고 마음을 제거하고 부드럽게 당겨 집게로 마음 뒤에 도달; 폐도 동시에 얻어 올 수있다.
- PBS를 함유하는 신선한 35mm 페트리 접시에 중심을 전송하고, 필요한 경우, 폐 조직을 얻어 트림 미세 핀셋을 사용한다. 그런 다음 차가운 PBS로 가득 찬 48 웰 플레이트의 웰에 마음을 전송합니다.
- 48 웰 플레이트에있는 모든 마음을 수집 한 후, 뾰족한 플라스틱 파스퇴르 피펫으로 PBS를 대기음 0.5 ml의 4 % 파라 포름 알데히드 (PFA)로 교체합니다.
주의 : PFA는, 알레르기 발암 성, 독성 것으로 알려져있다.- 수정 E11.5 - 실온에서 4 % PFA에 30 분 동안 15.5 마음 - 20 분, E14.5 12.5에서 15 분 동안 마음, E13.5 마음입니다.
- 뾰족한 플라스틱 파스퇴르 피펫으로 PFA를 대기음과 마음 2 배 차가운 PBS로 씻어.
CAUTION : PFA는 위험합니다 및 기관 규정에 따라 폐기해야합니다. - 25 % 메탄올 / 75 % PBS, 50 % 메탄올 / 50 % PBS, 75 % 메탄올 / 25 : 전체 마운트 면역 염색 즉시 사용하지 않을 경우 다음 해결책에 연속 5 분 세척을 수행하여 마음을 탈수, (섹션 2 참조) % PBS.
주의 : 메탄올은 독성, 장갑을 착용하십시오. 100 % 메탄올에서 -20 ° C에서 마음을 저장합니다.
안티 PECAM1 항체와 배아 마음의 2. 전체 마운트 면역 염색
참고 : 안티 PECAM1 항체가 관상 동맥 혈관을 염색 잘 작동하지만 적합 할 것 강력한 신호를 제공하는 범 내피 세포 마커 (단계 2.4 참조).
- 100 % 메탄올에 저장되었다 마음을 사용하는 경우, 1.5 ml의 마이크로 원심 튜브에 옮기고 다음 방법에 연속 5 분간 세척을 실시하여 재수 : 75 % 메탄올 / 25 % PBS, 50 % 메탄올 / 50 % PBS 및 25 % 메탄올 / 75 % PBS.
- 실온에서 회전, 1.0 ml의 PBST (PBS / 0.1 % 트윈 -20) - 0.5에서 3 회 10 분 세척을 수행함으로써 마음 Permeabilize 하시려면.
- PBST 1.0 ml의 10 % 염소 혈청을 실온에서 1 시간 동안 회전시켜 하트 차단.
- 뾰족한 플라스틱 파스퇴르 피펫 또는 1,000 μL 피펫 팁으로 차단 버퍼를 제거하고 400로 교체 - 1시 50분 희석 방지 PECAM1 차 항체를 포함하는 500 ㎕의 신선한 블록. 4 ℃에서 하룻밤 튜브를 돌립니다.
- 다음 날, 실온에서 튜브를 회전, 뾰족한 플라스틱 파스퇴르 피펫 또는 1,000 μL 피펫 팁과 블록 / 차 항체를 대기음 및 1.0 ml의 PBST 적어도 6 배 1 시간 세척을 실시하고 있습니다.
- 1 희석 형광 접합 된 이차 항체를 포함하는 신선한 차단 버퍼의 마지막 세척 교체 : (500), 및 회전, 4 ° C에서 밤새 품어. 호일에 튜브를 포장하여 빛으로부터 보호합니다.
- 다음 날, 블록 / 초를 대기음뾰족한 플라스틱 파스퇴르 피펫으로 ondary 항체는 실온에서 튜브를 회전, 1.0 ml의 PBST 적어도 6 배 1 시간 세척을 실시하고 있습니다.
- 4 °의 (빛으로부터 보호) C 필요할 때까지의 마음을 저장합니다.
용지 솔루션 및 현미경 요리 3. 준비
참고 : BABB에 마음을 이미징 할 때 BABB 솔루션 중 어느 것도 현미경의 구성 요소와 접촉 없다는 것이 매우 중요합니다. 이를 위해 다음과 같은 프로토콜은 사전에 준비 할 수 형광 현미경에 적합한 실리콘 엘라스토머 밀봉 요리를 준비하기위한 지침이 포함되어 있습니다. 실리콘 엘라스토머는 BABB을 포함하며 잠재적으로 유리 바닥 접시의 폴리 카보네이트 측간 스며드는 것을 방지하기위한 장벽을 제공한다.
- 직경 실리콘 엘라스토머 코팅 요리를 준비하기 위해, 나사 상단 병을 4 ml의에서 모자를 광학 유리 바닥 문화 요리를 가지고 배치 (약 1.5 cm) 각 요리의 중심입니다.
주 : 엘라스토머 접시에 적용되는 경우는 샘플이 잘 형성된다. - 제조업체의 지시에 따라, 이들이 적용되는 바와 같이 두 성분을 혼합하여 도포 카트리지를 이용하여 약 0.5 cm의 깊이로 실리콘 엘라스토머를 요리 채운다. 유리 병 캡은 각 요리의 중심에 남아 있는지 확인하고, 최소 24 시간 동안 치료 둡니다.
주 : 눈을 가진 실리콘 엘라스토머의 우발적 인 접촉을 방지하기 위해 보안경을 사용하십시오. - 엘라스토머의 경화 후, 각 접시의 바이알 뚜껑을 제거 이것은 샘플 접시의 바닥 유리와 직접 접촉하여 배치 될 수있는, 촬영 중앙 웰을 떠날 것이다.
참고 : 경화 때 엘라스토머 터치에 확고하고 건조해야합니다. - (2 부품 벤질 벤조 에이트 1 부 벤질 알코올)을 BABB 솔루션을 준비합니다. 이 유리 병에 저장하고 빛으로부터 보호되어야한다.
주의 : BABB는 독성, 부식성 솔루션입니다. 적절한 보호 복을 착용하는 동안 흄 찬장에서 처리합니다. - 유리 병에 - (5 ㎖ 1) 혼합 BABB 및 메탄올을 50:50 솔루션을 확인합니다. 호일 유리 병 포장으로, 예를 들면 빛으로부터 보호합니다.
4. 탈수, 지우기 및 공 초점 현미경에 대한 마음의 장착
참고 : 큰 샘플은 다소 작은 샘플 4 mL 유리 바이알에 클리어 할 수 (예 E13.5까지 하트)는 현미경 접시에 직접 정화 공정을 수행하는 것이 낫다. 이 방지하는 데 도움이 마음 한 번 클리어 매우 투명 해짐에 따라 샘플을 '손실'. 이 작은 샘플에 대한 청소는 몇 분 이내에 발생, 매우 빠른입니다.
참고 : / 포장 호일로 튜브와 요리를 포함하는 모든 다음 단계에서 빛으로부터 샘플을 보호합니다.
- 삭제하기 전에, 룸 템피에 마음을 돌려 메탄올 시리즈를 통해 면역 염색 - 마음을 탈수다음 솔루션의 연속적인 변화에 1.5 ml의 microcentrifuge 관에서 rature : 메탄올 / 75 % PBS, 50 % 메탄올 / 50 % PBS 75 % 메탄올 / 25 % PBS (각 5 분) 25 %. 마지막으로, 100 % 메탄올 3 × 5 분 동안 회전합니다.
- 최대 현미경 접시의 중앙에 E13.5, 장소의 마음에 대한; 현미경으로 심장의 지느러미 쪽 맨으로 지향되어 있는지 확인합니다. 뾰족한 플라스틱 파스퇴르 피펫으로 심장 주위에서 모든 메탄올을 제거합니다.
- 깨끗한 뾰족한 플라스틱 파스퇴르 피펫을 사용하여, BABB를 추가 : 메탄올 50:50 솔루션을 중심 몰입하기에 충분한 볼륨 (약 300-400 μl를). 마음이 때때로 용액에 뒤집어 수 이상으로 마음은 여전히 불투명 동안, 다시 방향을 확인합니다. 5 분 동안 용액에 둡니다.
- 흄 후드에 유리 폐기물 병에 50:50 솔루션을 제거하고 다시 뾰족한 플라스틱 파스퇴르 피펫을 사용하여, BABB로 교체합니다.
주 : 많은 양이 요구되지 않는다; suff 추가icient은되도록 마음은 용액 한 방울 내에서 앉아있다. 핵심은 5 분 이내에 취소해야합니다. - 큰 하트를 들어, 유리 바이알에 샘플을 취소합니다.
주 : E15.5 마음은 30 분 - 1 시간 이내에 취소해야하지만, 필요한 경우 하룻밤 남아있을 수 있습니다. - 샘플 클리어 한 후, 용액을 제거하고 BABB 최소한의 양으로 대체. 선택적으로, 그러나이 절대적으로 필요하지 않습니다, 장소에 보관하는 데 도움이, 커버 슬립과 샘플을 커버한다. 영상의 마음을 사용합니다.
공 초점 현미경 5. 이미징 해제 하트
참고 : 이미지는 10 배 또는 20 배 건조 목표를 사용하여 반전 공 초점 현미경에 포착되었다. 이 직립 촛점에 식기를 사용할 수있다하더라도, 특별한주의가 BABB 용액 목적의 접촉을 피하도록주의해야한다.
- 심장 (15)의 Z-검사를 수집합니다. 심장의 크기에 따라 타일 스캔 이미지 전체 심장 (16)에 요구 될 수있다. />주의 : BABB는 부식성 해결책이 깨끗한 장갑을 착용하고 현미경 접시의 외부는 BABB에서 무료로 확인합니다. 주의 접시 처리하고 현미경 상 우연한 누출의 위험을 최소화하기 위해 접시에 뚜껑을 유지한다.
- 목적 작동 거리가 허용하는 경우, 관심 지역의 고해상도 사진을 달성하기 위해 더 높은 배율을 사용합니다.
피지 소프트웨어를 사용 6. 데이터 분석
- 피지 (17)의 이미지의 z 스택을 엽니 다.
- 전체 스택 또는 그것의 일부의 아리조나 투사하려면 이미지를 클릭 Z 프로젝트 다음 스택을 선택합니다. 시작을 입력하고 슬라이스 번호를 중지 및 z 투사, 예를 들어, 평균 강도, 최대 강도의 유형을 선택합니다.
- 타격 도구를 사용하여 이미지 조각의 스택 내의 개별 선박을 강조합니다 (플러그인 메뉴 선택 분할에서 다음 올가미 도구 / 불어) 및 이미지의 영역을 클릭하여 개에 가득합니다채널 조각. 선택의 전경 색상으로 선택 영역을 채우기 위해 (다음 채우기를 선택하고 편집을 클릭) 채우기 명령을 사용하여 (색상 및 전경 다음 옵션을 선택한 다음 편집을 클릭합니다).
- 이미지가 이전 스택 Z 프로젝트.
관상 동맥의 7 3D 표면 볼륨 렌더링 Imaris를 사용하여 생성
- 화면 상단에있는 능가보기 아이콘을 클릭하고 드래그하여 데이터 창에 이미지 파일을 놓습니다. 화면 상단의 3D 뷰 아이콘을 클릭합니다.
- 표면 아이콘 (파란색 아이콘)을 선택하고 만들기 탭을 클릭합니다. '수동으로 편집, 자동 생성 건너 뛰기'대화 상자를 클릭하고 그리기 아이콘 (얇은 연필 아이콘)을 클릭합니다.
- 컨투어 탭을 클릭 한 다음 모드 탭을 선택합니다. 모드에서는 마법 지팡이 또는 isoline 아이콘을 클릭합니다. '선택'을 클릭하여 다음에 화면의 오른쪽에있는 포인터 선택 포인터의 모드를 선택하고 '그리기 클릭9; (화면의 왼쪽 아래에) 상자.
- 연속적인 조각에 동맥의 윤곽을 선택 isoline 또는 마술 지팡이 도구를 사용합니다. 슬라이스 위치 슬라이더를 사용하여 슬라이스 조각에서 이동합니다.
- 모든 윤곽이 선택되었을 때, 표면을 만들기 상자를 클릭합니다. 주변 음량이 보이지 또는 블렌드 모드를 사용하여 다소 불투명 할 수있다; 강조 표시 한 다음 모드 탭 다음 설정 탭을 선택하기 위해 볼륨을 클릭합니다. 블렌드를 선택하고 불투명도를 변경하려면 슬라이더를 사용합니다.
- 스냅 샷 기능을 사용하여 이미지를 캡처합니다.
결과
심장이 개발됨에 따라, 심실 심근는 다양한 소스로부터의 내피 세포 (EC에)에 의해 침입하고, 혈관 총이 형성된다. 심실 심근 내에서 개발 선박은 심장 조직 (18)에 산소 혈액을 전달하는 모세 혈관과 동맥 네트워크를 형성하기에 이동합니다. 대동맥 14,19,20의 루멘을 둘러싸 관상합니다 (peritruncal 신경총라고도 함) 별도의 모세관 네트워크로부터 독립적으로 개발되기 시작 줄기 (E11.5 정도) 동시에. Peritruncal 신경총 EC를 처음하지만 궁극적으로 오직 하나의 용기 좌우 관상 동맥 (21)의 뿌리를 형성하는 일, 대동맥의 각각의 측면에 유지되며, 상기 밸브 부비동의 수준에서 대동맥의 내강으로 여러 개의 연결을 형성한다. 주위 peritruncal을 E13.5 심실의 심근 혈관은 A로부터 혈류있게 상호 연결된 네트워크를 형성하도록 합류오르타 관상 혈관 14, 22로. 본래 마음의 BABB 허가와 함께 안티 PECAM-1 항체와 내장 컴퓨터의 염색은 가장 빠른 단계에서 개발 관상 동맥 네트워크의 분석을 허용한다. 나중에 발달 단계에서 성숙 관상 동맥의 패턴도 검사 할 수 있습니다. 이 방법도 전 배아의 혈관을 염색하는데 이용 될 수있다 (최대 E11.5 적어도), 및 예를 들어 다른 항체와 안티 - 알파 평활근 액틴 (Sm22α) 및 Endomucin.
그림 1은 피지 소프트웨어를 사용하여 생성 된 E11.5 심장의 최대 강도 Z-전망을 보여줍니다. 타일 기능은 심장의 복수의 부분 화상을 수집하여 완전한 이미지로 붙여서하는데 사용되었다; 이 전체 표본의 염색의 개요를 제공하는 데 유용합니다. 이 단계의 PECAM1 항체에서 주로 심장과 유출 V의 내막 안감 얼룩essels 그러나 몇되는 EC는 ( '1A에 확대 표시, 그림 1A에서 박스 영역) 좌심실 벽에서 관찰 할 수있다. 또한 peritruncal 신경총 명확 유출 관 (OT) (도 1b에 박스 영역)의 벽에서 관찰 될 수있다. 후자의 경우, 투영을 생성하는 데 사용되는 Z 스택 슬라이스의 수를 감소시키는 것은 (도 1b ')보다 명확하게 가시화 될 대동맥의 내강으로의 연결을 허용하는, 이미지의 선명도를 향상시켰다. 그림 2에서 대동맥으로 증가 된 혈관의 근위부는 E12.5 마음에서 관찰 할 수있다. 그림 3은 E12.5 마음에 peritruncal 신경 얼기를 보여줍니다. 도 3a의 12 슬라이스 z를 투영은 일부 선박은 Z-스택 내가 분할, (도 많이 방지 PECAM1 항체로 염색한다) 대동맥의 루멘에 복부 지역화 그러나으로, 전체 신경 얼기를 보여줍니다하위 스택의 수 NTO (그림 3B-D)는 시각적 정보를 제공합니다. 예를 들어,도 3b에 투영 된 하위 스택은 전체 투사에 표시되지 대동맥 루멘의 복부 표면에 연결하는 peritruncal 용기를 보여줍니다. 그림 4는 E15.5 심장의 일부를 보여줍니다; 관상 동맥이 단계 (그림 4A, 30 슬라이스 돌기)에서 명확하게 볼 수 있습니다. 5 조각 z는도 4b에 도시 계획과 C에서 대동맥과 폐동맥 밸브는 PECAM1 염색으로 가시화 될 수있다 가지와 관상 동맥 모세 혈관 네트워크의 상호 연결이 더 작은 하위 스택 예측에도 명확하다. 수동 세그멘테이션 기술은 피지 (도 4d) 또는 Imaris (도 4d 및 E)을 사용하여 관상 동맥을 강조하기 위해 사용되어왔다. 관상 동맥의 3D 표면 볼륨 렌더링 / 대동맥 루멘 U 생성노래 Imaris 함께 또는 주변 혈관 (도 4E 및 F)없이 볼 수있다.
전체 배아의 혈관은 PECAM1 염색 / BABB 정리를 사용하여 검사 할 수 있습니다. 각각의 배아 및 좌측 (Z 슬라이스 66-110) -도 4A 및 '는 오른쪽부터 하위 스택에서 발생 Z 돌기 (65 Z 슬라이스 11)을 나타낸다. 두 이미지의 비교는 형광 신호의 세기가 상당히 조직으로 침투 깊이에 따라 감소하지 않았다는 것을 보여준다. 도 4b, PECAM1 (적색 신호) 및 Endomucin (녹색 신호)에서 항체는 E11.5 배아의 각각 intersomitic 동맥 (ISA들)과 정맥 레이블을 결합했다. 도 4c는 SM22α (적색 신호)와 E11.5 배아에서 ISA들의 PECAM1 염색 (녹색 신호)를 보여줍니다. 그림 6에서, E11.5 배아PECAM 1로 염색은 BABB 통관 (그림 4A) 후 즉시 군데, 또는 약 2 개월 (그림 4B)의 간격 후했다. 형광 신호가 성공적으로 BABB에서 샘플의 장기간 보관 후 정지 화상에 충분히 강했다.
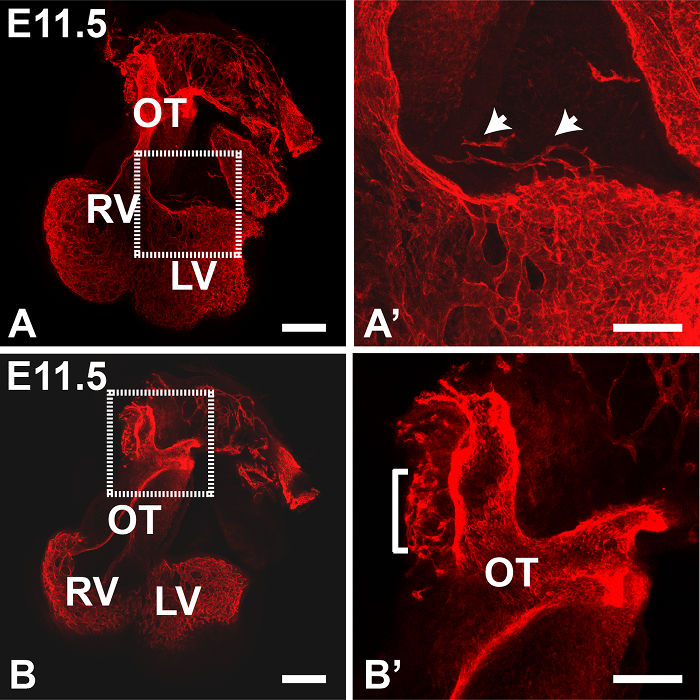
(알렉사 594에 안티 쥐 IgG의 공역으로 감지) 안티 PECAM1 항체를 가진 E11.5 마음의 그림 1. 면역 염색. (A, B)는 2 × 2 타일 이미지 반전 공 촛점 현미경으로 10 배의 대물 렌즈를 사용하여 수집 하였다. PECAM1 항체 얼룩 내막 및 혈관의 EC 양. 돌기 (최대 강도) 피지 소프트웨어를 사용하여 22 (A), 5 (B) Z 슬라이스 4 μm의 두께에서 각각 생성 하였다. A '와 B'enlargemen은각각 A와 B의 박스 영역의 TS. 'A에서 화살표 심실 벽 혈관을 나타낸다; B '에서, 브래킷은 peritruncal 총을 나타냅니다. OT, 유출 관; LV, 좌심실, RV 우심실. 모든 이미지는 정면 도면이다. 스케일 A의 바, B = 200 μm의; A '와 B'= 100 μm의 규모 바. 패널 (1B)는 '아이 빈스 등. 2015 년 19에서 적응했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
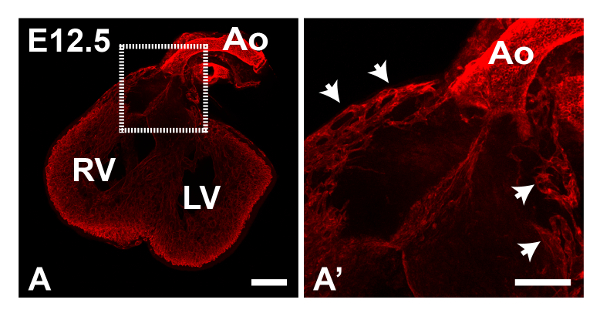
안티 PECAM1 항체를 가진 E12.5 심장 그림 2. 면역 염색. 패널 A는 2 × 2 타일 스캔 아리조나 투사 (최대 강도)를 보여줍니다. A의 박스 영역은 enlarg 표시됩니다A의 에디션 '; 화살표는 근위 대동맥 (아오)에 여러 혈관을 나타냅니다. LV, 좌심실, RV 우심실. 모든 이미지는 정면 도면이다. A의 스케일 바 = 200 μm의; A '= 100 μm의 규모 바. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
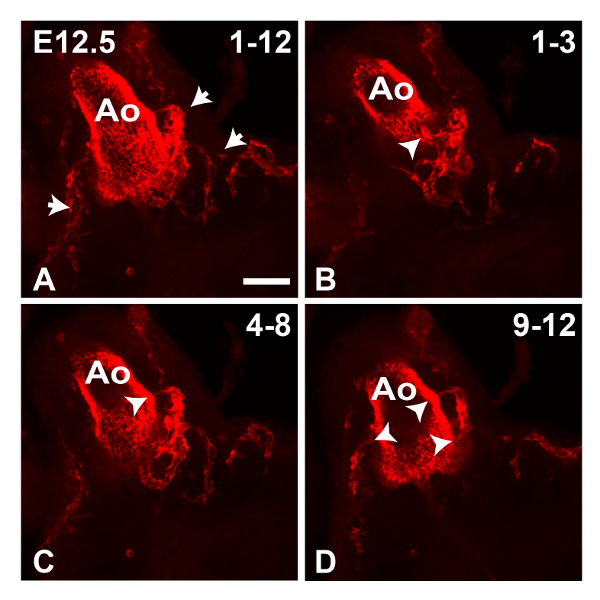
E12.5 마음에 Peritruncal 신경총 3. 이미지를 그림. 안티 PECAM1 항체로 염색 E12.5 대동맥 (ㅡ)의 공 촛점 이미지는 10X 대물 렌즈를 사용하여 수집 하였다. A의 Z 돌기 (최대 강도) 12 Z 조각 (4 μm의 두께)에서 생성 된; 화살표는 peritruncal 총 선박을 나타냅니다. 표시된 분리 projecti를 생성하도록 사용되는 BD 12 Z 슬라이스 세 서브 - 스택으로 나누어기능; 화살촉은 대동맥의 루멘에 peritruncal 총에 의해 형성된 연결을 나타냅니다. 대동맥의 루멘에 복부 지역화 Peritruncal 선박은 B와 C에서 볼 수 있습니다. 모든 이미지는 정면 도면이다. 스케일 바는 50 μm의 =. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
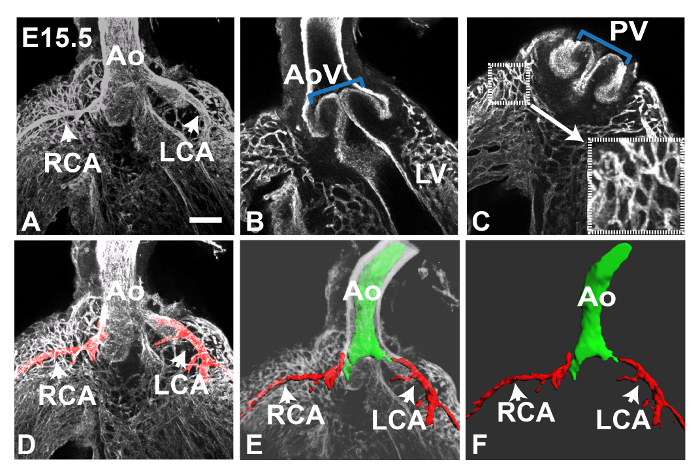
E15.5 마음에 4. 관상 동맥 및 모세관 신경총 그림. 안티 PECAM1 항체로 염색 E15.5 심장 공 촛점 이미지는 10X 대물 렌즈를 사용하여 수집 하였다. 패널 A는 Z 30 조각 (4 μm의 두께)에서 생성 된 최대 강도 Z 투영을 나타낸다 화살표는 대동맥 (아오)에 연결 볼 수있는 왼쪽과 오른쪽 관상 동맥 (LCA 및 RCA)를 나타냅니다. differen 사용t 5 Z 슬라이스 대동맥과 폐동맥 밸브 (AOV 및 PV)는 각각 (파란색 브래킷) B와 C에서 볼 수있는 서브 - 스택. 심실 모세 혈관 총이 더 작은 하위 스택 예측에도 명확; 폐 밸브 (작은 상자)에 인접 혈관이 패널 C (큰 상자)의 오른쪽 하단에 확대 표시됩니다. 피지는 불어 / 올가미 도구는 이전에 투영 각 Z 슬라이스에서 수동 빨간색으로 관상 동맥을 채우기 위해 사용 된 패널 D에 대해, 예를 들면 개별 혈관을 강조하기 위해 사용되었다. Imaris 소프트웨어 동맥 (적색) 및 E 및 F의 동맥 루멘 (녹색)의 3 차원 이미지를 생성하기 위해 사용되었다; 다시 각 Z 슬라이스의 객체 윤곽을 만들기 위해 마법의 지팡이 도구를 사용하여 수동으로 이루어졌다. 주변 음량의 불투명도는 E에서와 같이, 혼합 모드로 변경 될 수있다. F에 도시 된 바와 같이, 대안 적으로, 3D 이미지는 추출 될 수있다 . LV, 심실을 떠났습니다. 모든 이미지는 정면 도면이다. A = 100 μm의 규모 바. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
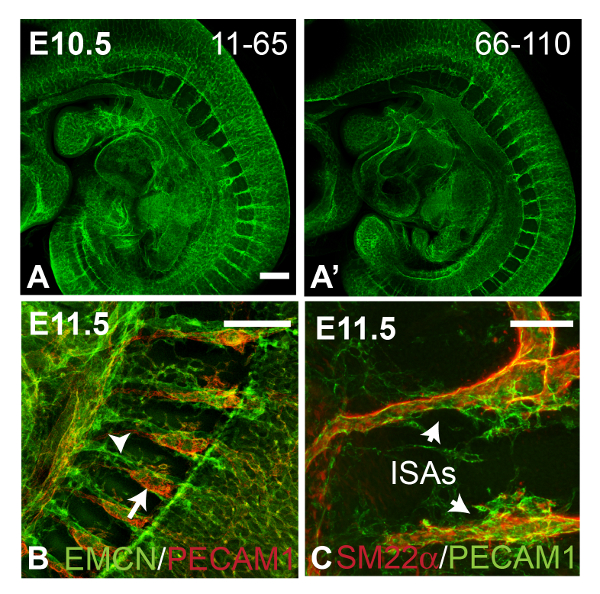
배아 혈관 5. 이미지를 그림. 패널 A 및 10X 대물 렌즈 (바둑판 스캔)을 사용하여 수집 한 항 PECAM1 항체로 염색 E10.5 야생형 배아의 A '표시 촛점 이미지. 평균 강도 Z 돌기 배아의 두께에 걸쳐 형광 강도의 단지 약간의 손실을 나타내는 120 Z 슬라이스 스캔 (4 μm의 두께 조각)의 Z 슬라이스 11-65 (A) 및 66-110 (A ')에서 생성 된 . 패널 B는 antibod로 염색 E11.5 배아의 intersomitic 혈관을 보여줍니다 타일에서 (평균 강도 Z 프로젝션 각각 intersomitic 동맥 (화살표)과 정맥 (화살촉)를 얼룩 PECAM1 (594 - 복합 이차 항체에서 빨간 신호) 및 Endomucin (EMCN, 488 - 복합 이차 항체에서 녹색 신호)에 대한 IES 주사). 패널 C는 PECAM1에 대한 항체로 염색 E11.5 야생형 배아에서 intersomitic 동맥 (ISA들) (녹색 488 - 복합 이차 항체에서 신호) 및 SM22α (594 - 복합 이차 항체에서 빨간 신호)를 보여줍니다. 공 촛점 이미지는 20X 대물 건조를 사용하여 수집 된 최대 강도 Z 돌기 생성에 사용 하였다. 모든 이미지는 시상도이다. A와 B의 스케일 바 = 250 μm의, C = 100 μm의 규모 바. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
D / 54800 / 54800fig6.jpg "/>
BABB에서 해제 그림 6. 면역 염색 샘플은 최소 두 달 동안 형광 신호를 보관하십시오. E11.5 배아는 PECAM1 항체로 염색하고 BABB으로 삭제되었다; 같은 배치에서 배아는 즉시 또는 2 개월 간격 후 몇 군데 있었다. 패널 A는 즉시 이미징 배아의 intersomitic 동맥을 보여줍니다 패널 B는 배아가 두 달 후 몇 군데 보여줍니다. 공 촛점 이미지는 10X 대물 건조를 사용하여 수집 된 최대 강도 Z 돌기 생성에 사용 하였다. DAO, 지느러미 대동맥. 이미지는 시상 뷰를 보여줍니다. 스케일 A의 바, B = 100 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
전체 배아 마음에 관상 동맥 혈관 광학 통관 및 공 초점 현미경으로 다음 항 PECAM1 항체 wholemount 면역 염색에 의해 촬영되었다. 간단한 방법은 BABB와 배아 마우스 마음의 정리를 위해, 여기에 기술, 광학 침투를 증가시키고 대동맥과 심실 벽에 지역화 된 혈관의 고해상도 이미지를 캡처 할 수 있습니다. 이러한 Vectashield (굴절률 1.45) 등의 글리세롤 계 장착 시약은 BABB의 고 굴절율 (1.56)는 깊은 조직 침투를 가능 또 광 산란을 감소하지만 관상 혈관 (22)의 촬상을 위해 사용되어왔다. 조직의 간극은 덜 쉽게 사용할 연구자 수있다 광자 빛 시트 현미경 등 현미경의 더 복잡한 고가의 형태에 대한 필요성을 제거한다. 청산 과정은 다른 방법 6-9에 작은 샘플 캘리포니아 될 수를 비교하는 매우 빠르다직접 현미경 접시에 시약의 작은 볼륨을 사용하여 rried. 맥관 구조의 견고한 염색 고품질 화상을 달성하기 위해 요구된다; 안티 PECAM1 항체는 염색 적절히 높은 수준을 수득 발견 된 관상의 EC 및 상업적인 항체의 다수의 모든 유형을 표시로서 선택 하였다. 또한, 형광 염색 BABB에서 매우 안정적인 것으로 보인다; (빛으로부터 보호) BABB 실온에서 저장된 샘플 몇 개월 동안 형광 신호를 유지했다. peritruncal 신경총의 이미지를 캡처 특히 PECAM1 항체 효율적뿐만 아니라 혈관 때때로 문제가 있다는 관상 동맥 내막 레이블 사실. peritruncal되는 EC에 비해 대동맥 루멘의 강력한 염색 이미징 매개 변수의주의 깊은 조정이 필요했다 즉, 이미지의 일부 지역을 통해 포화의 위험이 발생했습니다. 이상적으로, 항체 염색 단지 혈관의 EC가 사용된다; 실제로,그러나 wholemount 염색법의 요구 수준을 산출 적합한 항체를 찾는 것은 어려울 수 있습니다. 최근, 지방산 결합 단백질 4 (FABP4)는 관상 혈관의 EC (23)의 마커로 도시되어 있으므로 PECAM1 대안을 나타낼 수있다.
하지만, 샘플이 평면 장착되지 않은 대동맥과 심장 챔버의 3D 형태를 유지하기 위해 대신 유리 바닥 요리 군데 있었다. 묘화 될 수있는 샘플의 깊이는 그들의 짧은 작동 거리로 높은 배율의 대물 렌즈의 사용을 배제. 그러나 높은 해상도 이미지는 픽셀 체류 시간을 증가시키고 촬상하기위한 적어도 1024 X 024의 픽셀 어레이 크기를 사용하여 10 배의 대물 렌즈를 사용하여 여전히 달성 하였다. 그러나 이것은 세포 구조의 미세한 분석 시료의 평면 설치가 필요할 수 있습니다, 구조 및 관상 동맥 혈관의 분포의 분석에 충분했다. 설치에 대한 마음의 개별 부품의 해부,예를 들어, 심실 벽, 또는 대동맥, 또한 필요할 수 있습니다. 대안 적으로, 오버 샘플링 디콘 볼 루션에 의해 다음 이미지의 해상도와 감도를 증가시키기 위해 수행 될 수있다; 그러나 이것은 상당히 긴 스캔 시간을 필요로하고 처리하는 컴퓨팅 파워를 많이 필요로 매우 큰 이미지 파일을 만듭니다.
E15.5까지 하트 성공적이 방법을 이용하여 묘화하고, 동일한 프로토콜을 사용하여 (적어도 E11.5까지) 전체 배아의 혈관계를 분석하는 것도 가능하다. 다른 세포 유형, 예컨대, 평활근 세포는 또한이 기술을 사용하여 실험실에서 촬상되고있다. 두꺼운 조직, 예를 들어, 마음 E15.5보다 나이가 들어, 항체 침투가 제한 요인이 될 수있다; 이상 배양 및 / 또는 증가 된 세제가 필요할 수 있습니다. 많은 이미지 Z 스택을 수집 할 때뿐만 아니라, 레이저는 조직의 가장 먼 부분을 투과으로 강도가 감소 될 수있다 신호; 그러나 conf의OCAL 설정 증가 Z 거리 레이저 전력을 증가하도록 조정될 수있다.
이 방법은 관상 혈관 형성의 초기 단계 이상 발생 단계에서의 관상 동맥의 패터닝 모두 공 촛점 현미경 분석을 용이하게한다. 분포 분지 혈관의 구조에 대한 상세한 정보는 본에게 혈관 형성 경로의 특정 결함 유전자 돌연변이 마우스의 연구를위한 가치있는 도구를 만드는 단시간에 취득 할 수있다.
공개
The authors have nothing to disclose.
감사의 말
작품은 어린이 NHS 재단 트러스트와 영국 런던 대학의 완벽한 오몬드 스트리트 병원에서 건강 연구 바이오 메디컬 연구 센터의 국립 연구소에 의해 지원되는 영국 심장 Foundation'and에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| PBS | Life Technologies | 14190-094 | |
| Forceps | FST | 11251-30 | |
| 10 cm Petri dishes | Falcon | 351029 | |
| 35 mm Petri dishes | Sigma | P5112 | |
| Stainless steel minutien pins 0.2 mm diameter | FST | 26002-20 | |
| Fine tip pastettes | Alpha Laboratories | LW4061 | |
| 1,000 ml pipette tips | Sorenson | 34000 | |
| 48-well plate | Falcon | 353078 | |
| Kwik-Gard | World Precision Instrument | KWIKGARD | Silicone elastomer Sylgard184 packaged in a cartridge for mixing and dispensing |
| Kwik-Gard refill | World Precision Instrument | KWIKGLUE | Refill cartridges and dispensing tips |
| Paraformaldehyde | Sigma | P6148 | Make up in PBS and store at -20 °C |
| 100% methanol | VWR | 20847307 | |
| Tween®20 | Sigma | P1379 | |
| Goat serum | Sigma | G9023 | |
| Anti-PECAM1 antibody, rat anti-mouse | BD Pharmingen | 553370 | Primary antibody, dilute 1 in 50 |
| Anti-CD31 polyclonal, rabbit polyclonal | Abcam | ab28364 | Primary antibody, dilute 1 in 50 |
| Anti-CD31/PECAM1 clone 2H8, armenian hamster monoclonal | Thermo Fisher Scientific | MA3105 | Primary antibody, dilute 1 in 400 |
| Endomucin antibody (V.7C7), rat monoclonal | Santa Cruz Biotechnology | sc-65495 | Primary antibody, dilute 1 in 50 |
| Anti-SM22 alpha antibody, rabbit polyclonal | Abcam | ab14106 | Primary antibody, dilute 1 in 250 |
| Goat anti-rat IgG (H+L)Alexa Fluor 594 | Thermo Fisher Scientific | A11007 | Secondary antibody, dilute 1 in 500 |
| Goat anti-rabbit IgG (H+L)Alexa Fluor 594 | Thermo Fisher Scientific | Secondary antibody, dilute 1 in 500 | |
| Goat anti-Armenian Hamster IgG (H+L)Alexa Fluor 488 | Abcam | ab173003 | |
| Goat anti-rat IgG (H+L)Alexa Fluor 488 | Thermo Fisher Scientific | A21208 | Secondary antibody, dilute 1 in 500 |
| Phenolic screw cap | Wheaton | 240408 | |
| Benzyl alcohol | Sigma | 402834 | |
| Benzyl benzoate | Sigma | B6630 | |
| Imaris | Bitplane Imaging | image analysis software | |
| ImageJ software | NIH | Freeware |
참고문헌
- Red-Horse, K., Ueno, H., Weissman, I. L., Krasnow, M. A. Coronary arteries form by developmental reprogramming of venous cells. Nature. 464 (7288), 549-553 (2010).
- Tian, X., et al. Subepicardial endothelial cells invade the embryonic ventricle wall to form coronary arteries. Cell Res. 23 (9), 1075-1090 (2013).
- Wu, B., et al. Endocardial cells form the coronary arteries by angiogenesis through myocardial-endocardial VEGF signaling. Cell. 151 (5), 1083-1096 (2012).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Nam, J., et al. Coronary veins determine the pattern of sympathetic innervation in the developing heart. Development. 140 (7), 1475-1485 (2013).
- Zhu, D., Larin, K. V., Luo, Q., Tuchin, V. V. Recent progress in tissue optical clearing. Laser Photon. Rev. 7 (5), 732-757 (2013).
- Chung, K., Deisseroth, K. CLARITY for mapping the nervous system. Nat. Methods. 10 (6), 508-513 (2013).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nat. Neurosci. 14 (11), 1481-1488 (2011).
- Ke, M. T., Fujimoto, S., Imai, T. SeeDB: a simple and morphology-preserving optical clearing agent for neuronal circuit reconstruction. Nat. Neurosci. 16 (8), 1154-1161 (2013).
- Dodt, H. U., et al. Ultramicroscopy: three-dimensional visualization of neuronal networks in the whole mouse brain. Nat. Methods. 4 (4), 331-336 (2007).
- Zucker, R. M., Hunter, E. S., Rogers, J. M. Confocal laser scanning microscopy of morphology and apoptosis in organogenesis-stage mouse embryos. Methods Mol. Biol. 135, 191-202 (2000).
- Erturk, A., et al. Three-dimensional imaging of solvent-cleared organs using 3DISCO. Nat. Protoc. 7 (11), 1983-1995 (2012).
- Erturk, A., Lafkas, D., Chalouni, C. Imaging cleared intact biological systems at a cellular level by 3DISCO. J. Vis.Exp : JoVE. (89), (2014).
- Dyer, L. A., Wu, Y., Patterson, C. Protein isolation from the developing embryonic mouse heart valve region. J. Vis.Exp s : JoVE. (91), e51911 (2014).
- Wilsbacher, L. D., Coughlin, S. R. Analysis of cardiomyocyte development using immunofluorescence in embryonic mouse heart. J. Vis.Exp : JoVE. (97), (2015).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature methods. 9 (7), 676-682 (2012).
- Tian, X., Pu, W. T., Zhou, B. Cellular origin and developmental program of coronary angiogenesis. Circ. Res. 116 (3), 515-530 (2015).
- Ivins, S., et al. The CXCL12/CXCR4 Axis Plays a Critical Role in Coronary Artery Development. Dev. Cell. 33 (4), 455-468 (2015).
- Theveniau-Ruissy, M., et al. Coronary stem development in wild-type and Tbx1 null mouse hearts. Dev. Dyn : an official publication of the American Association of Anatomists. 245 (4), 445-459 (2016).
- Tomanek, R. J. Formation of the coronary vasculature during development. Angiogenesis. 8 (3), 273-284 (2005).
- Chen, H. I., et al. VEGF-C and aortic cardiomyocytes guide coronary artery stem development. J. Clin.Iinvest. 124 (11), 4899-4914 (2014).
- Tian, X., et al. Vessel formation. De novo formation of a distinct coronary vascular population in neonatal heart. Science. 345 (6192), 90-94 (2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유