Method Article
Intravital 현미경 종양 관련 맥 관 구조를 사용 하 여 고급 등 유전자 변형 형광 생쥐 피부 집계 창 실
요약
이 프로토콜 셀 전용 형광 마커를 표현 하는 유전자 변형 생쥐의 intravital 영상을 설명 합니다. Intravital 이미징 생체 삽입형 윈도 통해 프로세스의 미세한 시각화는 가능한를 사용 하 여 고해상도 관측에 대 한 비-침략 적 방법을 제공 한다. 이 방법은 경도 과정 공부에 특히 유용 합니다.
초록
치료제, 종양 반응 뿐만 아니라 종양 및 종양 혈관 개발, 높은 동적 생물 학적 프로세스 있습니다. 조직학 정적 정보 제공 되며 올바른 해석에 대 한 충분 한 자주 없습니다. Intravital 평가, 프로세스 시간, 다음 추가 하 고 종종 예기치 않은 정보를 제공 합니다. 셀 전용 마커 및 라이브 셀 추적기, 영상 장비, 개선 및 여러 이미징 챔버의 개발을 표현 하는 유전자 변형 동물의 창조와 함께 intravital 현미경 검사 법 더 잘 이해 하는 중요 한 도구가 되고있다 생물 학적 프로세스입니다. 이 종이 공간 및 시간 방식으로 치료 효과 종양 혈관 개발의 수사를 위한 실험적인 디자인을 설명합니다. 이 설정을 사용 하 여, 선박 개발, 팁 셀 및 루멘 형성, 혈액 흐름, 넘쳐 흐름, 설립된 혈관 침대, 및 혈관 파괴의 무대 시각 고 따 랐 다. 또한, 치료 효과, intratumoral 운명, 그리고 화학요법 화합물의 지역화 또한 다음 수 있습니다.
서문
생체 외에서 연구 고해상도 키네틱 이미징 프로세스를 사용 하는 동안 생체 외에서 실험 적절 한 맥락에서 평가 사용 하지 않습니다. 예를 들어, stromal 구획 또는 약물 전달 종양 내부 배포와 종양 세포의 상호 작용은 문화 접시에 공부 될 수 없습니다. 동물 모델 따라서 인간의 생리와 병 리를 모방 하는 데 사용 됩니다. 그러나, 경도 이미징 프로세스, 특히 subcellular 해상도에 도전 이다. 분자 이미징 방법, 자기 공명 영상 (MRI) 등 단일 광자 방출 컴퓨터 단층 촬영 (SPECT)과 양전자 방출 단층 촬영 (PET), 부족 해결 하지만 좋은 침투 깊이 또는 해 부 구조를 설명 하기 위해 실패. 광학 이미징 높은 해상도 제공 하 고 구조, 이미징 가능 하지만 그것은 동반 가난한 최소 침투1. 응용 프로그램 창 함께에서 intravital 현미경의 skinfold 챔버는 지 느 러 미와 같은 기술 또는 복 창, 고해상도 이미징 vivo에서2,,34에 대 한 있습니다. 이 기술은 고유한 이점이 있다, 이미징 프로세스 (예를 들어, 세포 세포 상호 작용 군데 조직에), 적절 한 맥락에서의 고 해상도의 광학 한계에 대 한 시간 및 일도, 경도 이미징에 대 한 허용 고급 confocal 및 multiphoton 현미경입니다.
유전자 변형 동물 세포 또는 단백질 특정 형광 라벨의 비보와 ex vivo 실험에 대 한 가능성의 과다를 열립니다. 대 한 인스턴스, 세포 세포 상호 작용, 단백질의 생산 및 조작 이나 치료에 응답은 공부 될 수 있다 vivo에서 이들을 사용 하 여5,6,,78모델. 중요 한 것은,에 위치 장소 및 시간 적절 한 영상 장비와 방법론 결정 될 수 있다. Intravital 현미경 검사 법, 여기는 수정에 이식 종양에 에이전트와 함께 조합에 내 피 마커를 표현 하는 동물의 등 쪽 피부 집계 창 챔버 제공 됩니다.
프로토콜
네덜란드 법에 따라 모든 동물 실험 끝났다 고 프로토콜은 에라스무스, 로테르 담, 네덜란드의 동물 실험의 위원회에 의해 승인 했다.
1. 받는 사람 마우스
- 유전자 변형 생쥐는 태어난 때 화면 표준 절차9를 사용 하 여 적절 한 유전자 형에 대 한 동물.
참고:이 원고에서 자체 개발 된 eNOStag GFP 선9 및 구매로 사 mTmG (사진 007676)10 라인에서 얻은 데이터는 제시 됩니다. - 12 주 이상 그리고 그 20 g 이상 마우스를 사용 합니다.
2. 기증자 마우스
참고: 종양 조각 등 창에서 이식에 대 한 비-유전자 변형 기증자 동물에서 얻은 것입니다. 종양의 종류에 따라 보통 (와 함께 syngeneic 종양) 또는 immunodeficient (xenografts) 마우스 사용 됩니다.
- 37 ° C, 5% CO2배양 플라스 크에 적절 한 보조 제와 함께 매체에 종양 세포 성장.
- 셀 플라스 크에서 매체를 제거, 1 x PBS로 한번 세척 하 고 0.25 %trypsin 사용 하 여 셀을 분리.
- 세포 배양 매체를 추가 하 여는 트립 신을 비활성화. 셀을 수집 하 고 5 분 동안 1200 x g에서 스핀 다운 5 ml PBS의 펠 릿을 resuspend.
- 죽은 세포 얼룩 trypan 파랑의 20 µ L로 세포 정지의 20 µ L를 희석. Hemocytometer;를 사용 하 여 생활 하 고 죽은 세포의 수를 계산 죽은 세포의 수는 10%를 넘지 말아야 한다.
- 다시 5 분 동안 1200 x g에서 셀 회전 얼음 처럼 차가운 PBS에 셀 펠 릿 resuspend, 당 100 µ L. 저조한 1 백만 셀 전송 수술 실에 얼음에 셀.
- 동물 isoflurane/O2를 사용 하 여 anesthetize 산소를 켜고 0.5 mL/분 조정 3 %isoflurane 기화로 흐름을 조정. 몇 분 후 마 취 실에서 마우스를 놓습니다.
참고: 그것은 스트레스를 최소화 하기 위해 사용할 수 있도록 챔버 프리 필. -
마우스 진정 운영 난방 테이블, 37 ° C에서 보관에 동물을가지고 고 마 취 코 콘에 주 둥이 놓습니다.
- 참고: 노상 강도 핀치에 아무 반응 주목 때 동물 진정 제대로입니다.
- 마우스 잘 사출 사이트 시각화를 면도. 0.5 mL 인슐린 주사기;를 사용 하 여 접종 마우스의 측면에 셀의 100 µ L를 주입 하 고 개발 하는 종양을 허용 합니다.
- 동물 마 취 기관 동물 관리 및 사용 위원회에서 승인 된 자 궁 경부 전위에 의해 안락사. 마이크로 위와 집게를 사용 하 여 자르면 피부 종양의 위치에 하 고 종양을 해 부. PBS와 페 트리 접시에 종양을 넣어. 마이크로 위와 집게, 종양 약 1 m m3 (그림 1A는)의 조각으로 잘라 사용 합니다.
참고: 기증자 마우스의 종양 큰 만큼 충분 한 자료를 제공 해야 하지만 큰, 괴 사 성 종양을 피해 야 한다. 대부분 종양에 대 한 평균 직경 10 mm 충분합니다.
3입니다. 창 챔버의 주입
- 무 균 조건 하에서 모든 절차를 수행 합니다. 오토 클레이 브는 수술 도구 (그림 1A)와 챔버 자료 (그림 1B).
참고: 여기, 1.1 g의 총 무게로 사용 창 챔버가 만들어진다 폴 리 에테르 에테르 케 톤 (PEEK), 빛, 합성 재료 MRI 호환. 픽 3.4-fold이 창에 대 한 문학에서 일반적으로 사용 되는 티타늄 보다 가벼운입니다. 대부분의 화학 물질에 저항, 불활성, 면역 반응, 자극 하지 않습니다 이며 튼튼한. 이 창은 이전 게시 된 windows에 비해 디자인도 작습니다. 이 창 쇼의 전체 용량으로 마우스 동작, 상승, 고 창 챔버 없이 쥐를 대 등 하 게 체중 수 있습니다. 합성 윈도 조금 짧은 지속 될 수 있습니다 동물 창에 물린 수 있습니다, 때문에 티타늄 windows;에 비해 그러나, 그들은 쉽게 저렴 하 게입니다. 이러한 특정 windows는 사내 고 요청 시 취득 될 수 있다. - 마 취 실에서 흡입 마 취약 (즉, isoflurane/O2)를 사용 하 여 받는 사람 마우스 진정 37 ° C에서 보관 온수 운영 테이블에 마우스를 가져다 고 마 취 코 콘에 주 둥이 (단계 2.6 참조). 건조를 피하기 위해 눈 연 고를 적용 합니다.
- 면도 하 고 머리카락 제거 젤을 적용 하 여 다시 전체에서 머리를 제거 합니다. 주의 모든 젤 손 따뜻한 수돗물으로 신중 하 게 동물을 rinsing 하 여 제거 됩니다. 동물을 건조 하 고 70% 에탄올과 피부를 청소.
참고: 면도 절차 또한 할 수 있습니다 창 이식 전날. 크림이 피부 자극을 일으킬 수로 손을 따뜻한 물으로 철저 하 게 제거 될 필요가 있다. - 챔버의 대칭 위치 되도록 표시와 함께 마우스 척추에 중심선을 표시 합니다. 마우스 위치, 접히는 위치도 중심선을 사용 하 여 플랩으로 피부를 당겨 하 고의 중간을 잡고. 프레임의 위쪽은 적어도 2 m m 센터 라인과 동그라미 표시와 함께 피부에 창 보기 영역 아래는 윈도우를 놓습니다.
- 15 고 마이크로 위 메스 홀더/블레이드 크기를 사용 하 여 그려진된 원형 선 따라 피부를 제거 합니다. 기본 근 막 손상 되지 않도록 주의 수 있습니다.
참고:이 종양 이식는 챔버의 창의 보기 영역을 만듭니다. - 올려는 피부 집계로 귀 뚫는 펀치 구멍 직경은 피부를 통해, 보기 영역 (그림 1A-b)의 양쪽에 하나 1 m m를 사용 하 여.
참고: 이들은 창 프레임을 함께 해결 하기 위해 2 개의 볼트에 대 한 구멍입니다. - 볼트 (그림 1B는, 1B-c)를 사용 하 여 주문 품 전면 챔버 프레임 놓고 볼트에 다시 프레임 (그림 1B-b)를 배치 합니다. 볼트에 다시 프레임에 너트 (그림 1B-d)를 배치 합니다.
참고: 이러한 볼트에 대 한 함께 챔버를 해결 하기 위해 사용 하는 피부 집계 나중 현미경 평가 동안 챔버를 무력화 하는 데 사용 됩니다. - 2-3 m m 프레임의 상단 위에 피부를 당기고 transplantable 창 보기 지역 상공 회의소 지역 일치 하는지 확인. 구멍을 통해 두 개의 작은 봉합 (그림 1B, 검은색 화살표) 프레임의 상단에의 장소 23 G 바늘 마이크로 드라이버 (그림 1A-c)와 클램핑 바늘 홀더 고정 너트를 볼트에 너트를 조입니다.
참고: 피부는 볼트 주위 설정 하지 않습니다 보장 하기 위해 예방 조치 고 너무 많이 강화 하지 않습니다. - 바늘을 봉합, 피부에 대 한 프레임을 해결 하기 위해 상단에서 시작 바꿉니다. 프레임에 봉합 구멍 (그림 1B, 흰색 화살표)의 5 쌍이 마십시오.
- 마우스 창 챔버의 뒷면을 공개를 설정 합니다. 10 m m의 직경 및 두께 0.55 m m (그림 1B-e) 그리고 12 mm (그림 1B-f)의 표준 커버 유리 필러 유리의 두꺼운 조각을 넣으십시오. 다시 챔버 지역의 고정 링 (그림 1B-g)을 이러한 보안.
참고: 필러 유리 공간 근 막 및 이미징에 사용 되는 전면 창 사이의 열을 방지 합니다. - 살 균 0.9 %1 mL 주사기를 작성 하 여 종양은 삽입 창 보기 영역 화 NaCl. 가을이 보기 영역에 몇 방울을 허용 합니다. 메 마른 면 팁으로 과잉 염 분을 제거 합니다.
- 근 막에는 1 m m3 종양 조각 (그림 1A는) 그것의 팁 25g 바늘을 사용 하 여 (그림 1A-d) 90 ° 각도로 구 부 러를 충분히 큰 포켓을 만듭니다. Using 켈리 포 셉 또는 바늘 홀더,이 주머니에 transplantable 창 보기 영역 가운데 종양 조각을 삽입 합니다.
- 12 m m와 고정 링의 표준 커버 유리 창 보기 영역을 닫습니다.
참고: 공기 방울이 형성 수 있습니다, 하지만 그것은 시간 안에 사라질 것 이다.
4. 사전 및 동물의 사후 관리
- 피하 당신의 기관 동물 관리 및 사용 위원회에 의해 승인 통증 (즉, 0.05 mg/kg buprenorphine)에 대 한 약물을 관리 합니다. 마우스 마 취가 열 램프 아래에서 복구를 허용 합니다.
- 장에 32 ° c와 습도 50% 이상 설정 기후 제어 방에 창 베어링 마우스를 개별적으로 배치 합니다. 물 병 누설을 방지 하기 위해 감 금 소에 그들을 배치 하기 전에 환경 온도에 있다 다는 것을 확인 하십시오. 감 금 소 및 농축 가리지 운동과 음식과 물에 대 한 액세스를 허용 하는 사용 합니다.
참고:이 창 챔버는 아주 잘 용납 하 고, 마우스 보여줄 정상 동작 합니다. 개별 주택 창 챔버 다른 쥐로 인 한 손상을 방지 하 고 높은 온도/습도 냉각 방지 다운 및의 탈수는 피부 집계. - 정기적으로 말하지 오프 봉합, 느슨한 볼트/너트, 또는 깨진된 커버 유리에 대 한 마우스를 확인 하십시오. 즉시 수리 하 고이 대체 합니다. 가벼운 소재로 만들어진 커버 윈도우를 보호 하기 위해 사용할 수 있습니다.
5. intravital 이미징
참고:이 절차에서는 multiphoton 현미경과 적절 한 제어 소프트웨어 사용 됩니다. 여기는 현미경에와 함께 제공 된 소프트웨어 패키지 사용 됩니다. 교장, 그 현미경 현미경 제어에 대 한 의미는 이미지 캡처에 대 한 모든 소프트웨어 패키지에서는 스위트룸이이 목적.
- 시스템에 스위치: PC/현미경, 공초점 제어 장치, 전력 파워, 레이저 및 레이저 방출. 예를 들어이 소프트웨어와 함께 소프트웨어를 시작 하 고 현미경 테이블 (1E는 그림 1E-c) "테이블을 초기화 합니다."를 클릭 하 여 초기화 시스템에 전환 하 고 현미경, xy 테이블, z 위치, 및 이미지 캡처 제어 하는 PC를 사용 하는 모드를 설정 합니다.
- (그림 1E-b) 형광 조명에 전환 합니다.
참고:이 밝은 필드 함께 눈을 통해 형광 이미지를 평가 하는 데 사용 됩니다. - 주문 품, 온도 제어 플랫폼에 스위치 (그림 1 C-c; 자세히 토론에 설명 된) 37 ° c.에 설정
- Isoflurane/O2 (그림 1E-d)를 사용 하 여 마 취 단위에 전환 합니다. 현미경 단계 (그림 1 C-e)에 마 취 튜브를 탑재 합니다. 마 취 주 둥이 부분을 해결 하기 위해 xy 스테이지에는 클램프를 설치 합니다.
- 사전 평가 동물 종양 혈관 개발의 단계를 설정 하 이 종양의 성장 속도에 따라 달라 집니다 하지만 그것은 개별 쥐 사이 다를 수 있습니다.
- 진정 마 취 실에서 흡입 마 취약 (isoflurane/O2)를 사용 하 여 마우스 (단계 2.6 참조).
- 현미경 단계;에 장착 된 온도 제어 플랫폼에 동물을 배치 이렇게 하면 냉각 동물의 마 취는 때. 마우스의 주 둥이 마 취 콘에 위치 하 고 있는지 확인 하 고 평가 5 분 보다 더 오래 걸릴 것입니다 경우 눈 연 고를 적용.
참고: 평가 1 시간 이상 줄일 isoflurane 흐름 2%. - 챔버 볼트를 사용 하 여 주문 품 챔버 홀더 (그림 1 C a)에 (그림 1 C-b, 전체 화살표) 챔버를 수정. 열띤 플랫폼 (그림 1 C-c) 나사이 홀더 (그림 1 C d, 점선된 화살표).
참고:이 조합은 동물 자유롭게 호흡 하면서 창 보기 영역에서 운동 아티팩트를 방지 합니다. - 모호한 이미지와 외부는 유리의 파편에서 오는 방해를 방지 하기 위해 물에 담근 면 팁 창 보기 영역의 유리를 청소 있는지 확인 합니다. 현미경 단계 (그림 1D)에 플랫폼 및 마우스를 놓습니다.
참고: 꼬리 플랫폼과 현미경 단계 사이 붙어 얻을 하지 않습니다 돌 봐. - 시각적으로 10 X 렌즈, 밝은-필드 및 형광등을 사용 하 여 종양 혈관 개발의 단계를 확인 하십시오.
참고: 형광 혈관에 초점에 있어야 하 고 혈액 흐름 밝은 필드를 사용 하 여 표시 해야 합니다. 맥 관 구조는 명확 하 게 볼 때, 종양 혈관 개발의 단계를 평가 합니다. 예를 들어, 발병 초기 신생 성장 팁 셀 또는 약물 전달에는 이미 설립 맥 관 구조 인지 확인 합니다. 같은 동물을 다시, 평가 될 수 있다 그리고 종양으로 개발은 지속적인 과정 이다. 여러 단계를 동시에 단일 종양에서 관찰할 수 있습니다.- 맥 관 구조에 초점, 무대에서 동물을 제거할 수 없는 경우 마우스 복구, 그리고 장소는 동물 기후 제어 공간에서 다시 하자. 나중에 다시 확인 합니다. 마우스 평가 대 한 준비가 되 면, 아래에 설명 된 프로세스를 계속 합니다.
- Confocal 레이저, "레이저"를 클릭 하 여 제어판 구성 탭에서 "Ctrl 패널"에 전환
참고:이 좋습니다 레이저 전원 낮은 특히 표백, 조직, 그리고 photodamage의가 열을 방지 하기 위해 아르곤 레이저에 대 한 설정. 제어판의 개인 환경 설정에 설정할 수 있습니다. Intravital 이미징 여러 fluorophores를 사용 하 여 것이 좋습니다 다음 설정을 적용 하려면: "이득, 차례, 당 100 V 스마트" "스마트 오프셋, 차례, 당 10%" "줌, 중간," "X 위치, 중간," "Y 위치, 매체," 및 "Z 위치, 회전 당 100 µ m입니다." 이미징, 전에 소음을 최소화 하 고 신호 대 잡음 비율을 최적화에 대 한 오프셋을 조정 합니다. Confocal 줌 기능 렌즈를 변경 하지 않고 더 높은 확대에 대 한 수 있습니다. X, Y, 및 Z 제어 관심 분야를 찾을 필요가 있다. Intravital 현미경 검사 법에 대 한 Z-포지셔닝 해야 차례 당 약 100 µ m 틱 조직 평가 합니다. - "수집" 취득 탭에서 클릭 하 고 설정을 변경 합니다: "XYZ 또는 XYZT, 수집 모드" "형식 (512 x 512 또는 1024 x 1024)"와 "속도 (400 Hz 또는 200hz)." "작은 구멍"에 클릭 하 고 1 공기 단위를 설정 합니다. "양방향 X"를 클릭 하십시오.
참고: 이미지를 최적화 하려면 레이저 전력, 이득, 및 작은 구멍 사이의 균형 해야 당할 토론에서 언급 되는. - 때 여러 fluorophores, 선택 "순차 스캔" 및 "프레임" 사이 출혈-통해, 토론에서 언급 되는 방지 하기 위해. 선택 "선 평균 4" 좋은 소음 감소를.
참고:에 따라 본질적인 형광 유전자 변형 동물에, 다른 형광 표식 처럼 dextrans, Hoechst, FITC BSA, 형광 chemotherapeutics 또는 0.9 %NaCl 수 원하는 농도를 희석 하는 나노 입자 관리 및 종양에 평가. 이러한 꼬리 또는 음 경 정 맥을 통해 주입 됩니다. - "실험"에 인식 탭에서 클릭 하 고 새 데이터 베이스 만들기 위해 "새로 만들기"를 선택 합니다.
- 동물 사용 하 여 평가, 연구 질문에 따라, 10 배, 20 X, 또는 40 X 객관적 렌즈. 눈을 통해 평가할 수 있는 위치를 찾아.
참고:이 나 만큼 가능 하 고, 건조 렌즈는 비교적 긴 작업 거리 고 하지 필요 침수 액체와 건조 렌즈를 사용 하 여 좋습니다. 토론에서 물 침수 렌즈의 사용은 언급 했다. - 빠른 라이브 스캔을 사용 하 여 적절 한 이득 및 오프셋 과도 방지 하 고 신호 대 잡음 비율을 최적화. 중 고 실험 양적 비교 필요 사이 또한, 동일한 이미징 설정을 유지 합니다.
참고: 최적의 이미징에 대 한 추가 고려 사항 토론에서 언급 된다. XYZ 위치 및 확대/축소 컨트롤 패널을 사용 하 여 라이브 검색 중 최종 수 있습니다. - Z-스택을 선택 "Z-스택" 취득 탭 만들기에에서는 빠른 Z-스캔 컨트롤 패널에서 Z-위치를 사용 하 여 "시작 µ m"와 "끝 µ m"를 클릭 하 여 시작 및 끝 검색 설정 작은 구멍 크기에 관련 된 Z 스텝 크기를 설정 합니다.
- "시작 합니다."를 클릭 하 여 이미지를 캡처
참고: intravital 현미경 검사 법은 모든에 대해 속도 및 따라서 동적 프로세스 관찰 된다, 이미지를 획득 하는 데 필요한 시간 사이 타협 및 생물 학적 과정의 속도 만들 수 있어야 합니다. 일반적으로, 더 높은 해상도, 더 형광 채널을 스캔 하 고 더 검색 필드, 이미지 당 더 많은 픽셀. 두꺼운 Z-스택 더 이상 영상 시간으로 번역합니다. 더 이상 이미징 시간 운동 유물의 기회를 증가 하 고 몇 군데 조직에 손상을 줄 수 있습니다. 또한, 그 특정 형광 라벨 검사 원인과 표백 독성, 레이저 파워와 축적 된 염료의 농도 의해 영향을 유의 하십시오. - Z-스택 검사 후 평가할 수 있습니다 신속 하 게 "최대 투영"를 클릭 하 여. Z-스택 자동으로 데이터 베이스에 저장 하 고 이름을 바꿀 수 있습니다.
6. 데이터 분석
- 원래 연구 질문에 따라 데이터 분석을 위해 하나 ImageJ5, Matlab11또는 Amira, 등 여러 소프트웨어 프로그램을 사용 합니다. 정확한 분석은 중요 합니다.
결과
Intravital 이미징의 주요 특성은 침략 적 개입 없이 세포질 과정의 경도 시각화. 이 대 한 관심의 셀에 제정 또는 유도할 수 있는 형광 마커를 표현 하는 유전자 변형 동물 사용 됩니다. 그림 2 에서는 eNOStag 녹색 형광 단백질 (GFP)9 과 사 mTmG 마우스 라인10에서 형광 라벨의 식을 보여 줍니다. ENOStag-GFP는 자체적으로 사용 하 여 잘린된 eNOS 유전자 태그 GFP에 대 한 만들어진 마우스 선입니다. 중요 한 것은, 노스는 높은 내 피 세포에 표현 하 고 명확 하 게 일 eGolgi 및 세포 막 (그림 2A)에서 GFP 신호를 볼. 로 사 mTmG 마우스는 2 색 형광 막 대상 Cre 기자 대립 유전자. 이 라인과 광범위 한 셀에 mTomato 형광과 Cre recombinase 표현 셀에 mGFP을 표현 하 고 크게 혈통 추적에 사용 됩니다. 빨간색 형광 stromal 파트는 종양에 의해 주로 표현으로 종양 조각 비 유전자 변형 기증자에서 이주, (예를 들어, 순환 세포, 혈관 세포의 막에 혈액 세포, 침투 및 종양 관련 섬유 아 세포 (그림 2B)).
혈관 형성 단단히 통제 되 고 이것을 공부 하는 우수한 모델은 개발 망막12,13. 또한, 종양 혈관의 성장 망막 혈관 개발의 원리와 비슷한 운동 과정 이다. 그러나, 종양 혈관 조직 부족과, 종양은 지속적으로 개장 하 고, 그래서 종양 관련 맥 관 구조 이다. 이 있을 수 있습니다 장점을 종양 신생 모델로 사용 하는 경우 있으 나 선박 개발의 모든 단계는 동시에 같은 종양에서 종종 찾을 수 있습니다. 이들은 종양 (그림 2C);의 취소 vascularized 부분으로 성장 하는 내 피 돋 아 앞 손상 된 혈관 (그림 2D); 그리고 설립된 혈관 침대 (그림 2E-난)와 성숙, 분기 선박 (그림 2E-II). 그러나, 신생 내 피 세포 또한이 지역에서 찾을 수 있습니다. 신생 자극에 의해 자극, 내 피 세포는 filopodia (그림 2E-III) 돌출 고 진행 팁 셀, 이러한 filopodia를 사용 하 여 스캔 및 방향 마이그레이션 (그림 2E-IV)으로. 팁 셀이 종양 interstitium로 마이그레이션합니다 그리고 줄기 세포를 분할 하 여 다음. 단일 내 피 팁 셀 여러 filopodia 확대, 축소 및 언제 든 지 갱신 있으며 intravital 현미경 검사 법 (그림 2F)를 사용 하 여 추적할 수 있습니다.
둘째, 신생 앞에서 루멘 형성 확인, 혈액 종양, 넘쳐 흐름에 걸쳐 흐름 intravital 현미경 검사 법을 사용할 수 있습니다. 이미 현재 동물에서 본질적인 형광 신호가, 다른 형광 화합물 관리 될 수 있습니다. 혈액의 흐름과 넘쳐 흐름 Hoechst, 형광 dextrans, 또는 FITC BSA를 사용 하 여 구상 될 수 있다. 혈액 흐름과 입자 넘쳐 흐름에 대 한 확장 된 연구, 대 한 긴 순환 붙일 라고 표시 된 100의 pegylated 나노 nm를 사용할 수 있습니다. 이러한 나노 입자의 준비에 자세한 이전 게시5를 참조 하십시오. 이 화합물의 고용은 그림 3에서 설명 했다. 로 사 mTmG 마우스에 내 피 팁 셀 수 있다 명확 하 게 볼 수 종양 조직에 침입. 기능 혈 관 튜브의 루멘에서 체계적으로 주입 된 나노 입자의 보라색 형광에 의해 설명 된다 (그림 3A-난). 나노 입자는 밀접 하 게 팁을 내 피 세포 줄기 셀 영역 (그림 3A-II)에서 루멘의 형성을 보여주는 도달. 체계적으로 관리 chemotherapeutics의 종양 interstitium에 도달 하기 위해서는 기능 맥 관 구조에 의존 하 고 에이전트, 그들의 크기의 독립적인 그림 3B에서와 같이, 영역 파괴 혈관 침투 하지 않는 압축 된 혈관 또는 혈액 스테이 시스와 혈관입니다.
대부분 기관에서 내 피 라이닝 혈액과 내부 조직 간의 기능적 장벽을 형성 하 고 분자의 통과 긴밀 하 게 규제. 그러나 종양 관련 맥 관 구조,, 알려져 있다 새, 그리고 기 공 크기 컷오프 종양 유형14에 크게 의존. 다른 크기를 가진 dextrans 형광 활용 혈액 흐름, 침투성, 넘쳐 흐름을 평가 주입 수 있습니다. Hoechst (615 다) 종양 조직으로 급속 하 게 확산 하 고 주변 세포에 의해 채택 (그림 3C-난). 주입 직후 dextran 10 KDa (그림 3CII)와 2 MDa (그림 3 C-III)의 혈액에서 발견 된다. 그러나, 10 KDa는 또한 본 종양 interstitium에 기능 더 작은 분자에 대 한 내 피 내 막의 침투성을 나타내는 dextran 종양 혈관을 관찰 작용. dextran 10 KDa 혈 류 (그림 3 C-V), 그리고 dextran 2MDa의 형광 강도에서 지워집니다 (그림 3 C-4), 주입 후 40 분 감소 뿐만 아니라 (그림 3 C-6). 그러나, 큰 dextrans는 찾을 수 없습니다이 시간 프레임 내에서 큰 분자에 침투성의 부족을 보여주는 종양 interstitium에.
그것의 높은 확산, 괴 사 성, 그리고 유엔 vascularized 영역, 종양 이상 수 있습니다 아주 유익한 종양 신생 모델로 사용 하는 경우. 그러나,이 효과적인 치료와 조사에 대 한 문제를 선물 한다. 종양 관련 맥 관 구조의이 전체 지역 마약 없는15를 떠나 관리 약물의 다른 유형의 배포를 하면 됩니다. 약물 전달 향상을 하 고 여러 전략 적용된15,,1617, 수 치료 진행이 intravital 디자인을 사용 하 여 시험 될 수 있다. 종양 관련 맥 관 구조 개선 마약 배달17vasoactive 에이전트를 사용 하 여 조작할 수 있습니다. Doxil 함께에서 vasoactive 에이전트로 종양 괴 사 알파 (TNF)를 사용 하 여 종양 혈관 조작의 결과,이 원고5, 화학요법 대리인으로 독 소 루비, 캡슐화 자주 수립 되 게 됩니다. 18 , 19. dextrans, 달리 pegylated 나노 혈액 순환20일 아니라면 몇 시간, 순환에 만들어집니다.
앞에서 설명 했 듯이 종양 영역 연구 질문에 따라 정확한 종양 분야를 식별 하기 위해 미리 스캔 수 있습니다. 마약 운명 이미 손상 된 혈관 침대 (데이터 표시 되지 않음) 지역 대 기능 맥 관 구조를 가진 지역에서 평가할 수 있습니다. 조사 없이 세포 독성 화학요법 에이전트의 운명, 치료 대리인으로 동일한 성분과 나노 모델 약물으로 사용할 수 있습니다. ENOStag-GFP 동물 이러한 나노 입자와 처리 i.v. 이었고 나중 24 h를 몇 군데. 나노 입자 종양 interstitium에 최소한의 넘쳐 흐름으로 맥 관 구조에 아직도 존재 했다 (그림 4A-난). 그러나, 나노 입자는 TNF와 함께에서 관리 되었다 때 넘쳐 흐름 증가 intratumoral 약물 전달 종양 interstitium (그림 4A-II)에 혈 류에서 관찰 되었다. 고해상도 렌즈를 사용 하 여 화합물의 세포내 지역화 인식할 수 있습니다, 녹색 내 피 세포 및 종양 interstitium (그림 4B)의 셀에 Hoechst의 핵 위치에 따라 그림과 같이. 또한, 독 소 루비, 같은 많은 화학요법 에이전트 dna intercalate로이 화합물의 지역화를 평가할 수 있습니다. 독 소 루비는 빨간 형광 속성, 그리고는 nanocarrier와 함께, 예를 들어, 과염소산염 tetramethylindotricarbocyanine (했 어) 표시 될 수 있습니다. ENOStag-GFP 동물 Doxil i.v. 주입 했다-TNF와 함께에서 했 고 이미지 처리 후 24 시간을 촬영 했다. Doxil-혈관에서 extravasated 했 고 찍은 주변 종양 조직 하 여 (그림 4C-난). 개별 셀 (그림 4 C-II)에 대 한 자세한 평가 보여주었다 세포 핵에서 나온된 독 소 루비 관찰 하는 동안 운반대는 세포질에서 찾을 수 있습니다.

그림 1: 악기, 등 피부 집계로 약 실, 및 장비 설치 절차에 필요한. (A) (a) 종양 조각 및 이식에 필요한 수술 기구. 비표준 악기 있으며 귀 뚫는 (b), 마이크로 스크루 드라이버 (c), (d) 구부러진된 바늘. (B) 지 피부 집계 창 챔버. (A) 앞면과 뒷면 (b) 창 (화살표: 봉합에 대 한 구멍, 화살촉: 볼트 구멍), 2 볼트 (c), 2 너트 (d), 1 필러 유리 (e), 2 커버 유리 (f), 그리고 유지 반지 (g) 2. 또한, 유지 고리 후크 (흰색 화살표) 없이 사용할 수 있습니다 필요한 경우. (C) 주문 품 챔버 홀더 (a), 볼트는 챔버 챔버 홀더 (b), 온도 제어 플랫폼 (c), 볼트는 플랫폼 (d), 챔버 홀더를 확보 하 고 마 취와 홀더 튜브 (e). (D) 동물에 플랫폼에 챔버 홀더 장착. B16BL6 종양 (화살표) 창 보기 영역에 표시 됩니다. (E) 장비 intravital 평가에 필요한. 컴퓨터와 영상 및 현미경 제어 소프트웨어 (a), 표준 형광 빛 (b), 현미경. 다 confocal 마 취 단위 (d)와 (c) 사용된 했다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
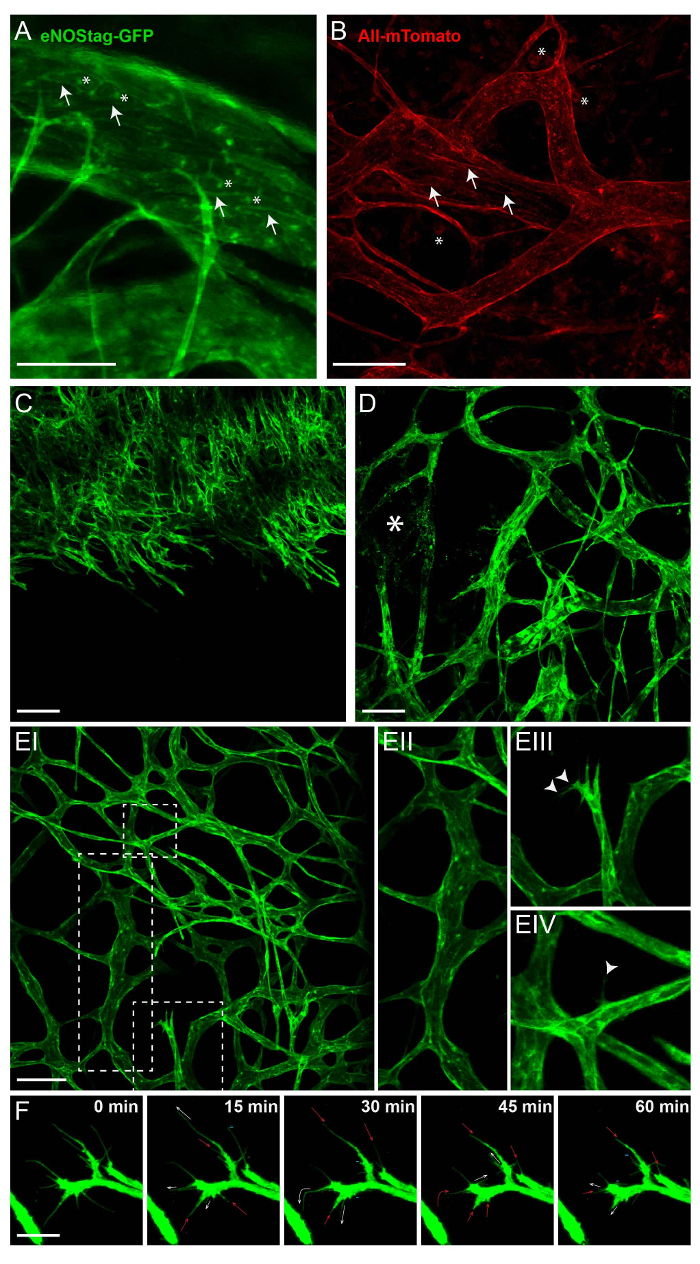
그림 2: 유전자 변형 동물의 본질적인 형광. 여기에 표시 된 모든 이미지는 50, 70 µ m 두께 Z 스택 예측. (A) eNOSGFP 태그 라인에 GFP 골 (별표) 및 내 피 세포의 세포 막 (화살표)에 표시 됩니다. 눈금 막대 = 100 µ m. (B) Intratumoral mTomato로 사 mTmG 라인의 표현은 주로 혈관 세포 (화살표)와 혈 (별표)의 세포 막에서 발견. 눈금 막대 = 100 µ m. (C) A의 투영 성장 신생 전면 취소 vascularized 종양으로. 눈금 막대 = 100 µ m. (D) A의 투영 설립 하 고 손상 된 혈관 (별표)와 종양의 일부. (E)의 투영 설립된 종양 맥 관 구조 (EI) 보여주는 성숙한 진드기 혈관 (EII); 신생 내 피 팁 셀 filopodia (EIII, 화살촉); 성숙한 선박는 하나의 내 피 세포는 interstitium에 filopodium (EIV, 화살촉)을 확장 하 고. 눈금 막대 = 100 µ m.는 filopodia의 (F) 움직임에 따라 1 시간. 모든 15 분, Z-스택 찍은; 최대 투영 여기 표시 됩니다. filopodia는 확장 (흰색 화살표), 정체 (=), 축소 (빨간색 화살표), 또는 심지어 완전히 사라지는 (-). 눈금 막대 = 25 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
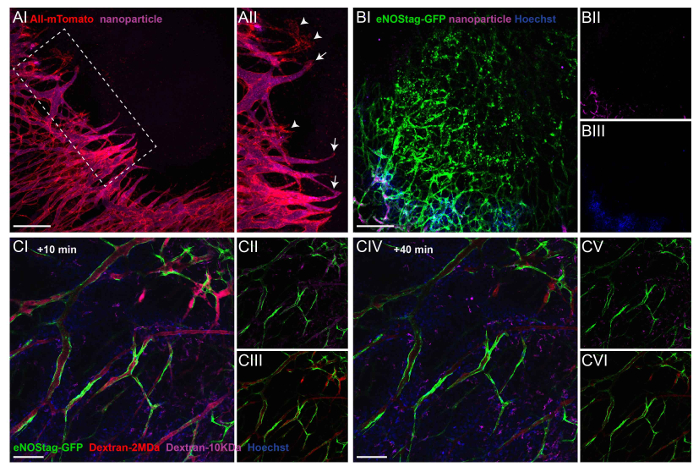
그림 3: 넘쳐 흐름 및 혈액 흐름을 설명 하기 위해 주사 레이블 관리. (A) A로 사 mTmG 마우스 보라색 형광 나노 입자와 함께 주입 했다 그리고 Z-스택 침입 팁 셀 앞의 10 분 후 (AI) 찍은. 가장 내 피 보여주는 프로젝션 콩나물 기능 루멘 (좋아, 화살표) 있다. 거의 내 피 콩나물 흐름 (좋아, 화살촉) 없이 볼 있습니다. 눈금 막대 = 250 µ m. (B)이 Z-스택 프로젝션 eNOStag GFP 동물 치료 (BI) 이전에 파괴 종양 혈관 영역 표시. 동물은 Hoechst (블루, BIII)와 나노 (보라색, BII) 주입 했다. 나노 입자와 Hoechst 파괴 분야, 아직도 GFP를 표현 하는 립된 세포 파편으로 표시를 도달 하지 않습니다. 눈금 막대 = 250 µ m. (C) 다른 크기의 2 개의 dextrans와 eNOStag-GFP 마우스 주입 했다 (빨간 Dextran 2 MDa = 자주색; dextran 10 = KDa) 및 Hoechst (블루 = 615 다), 단일 평면 이미지 여기에 제시 하 고. 주사 후 10 분, 혈액에 넘쳐 흐름 존재 같은 이미지에서 볼 수 있습니다. Hoechst 혈관에서 거의 즉시 extravasates 하 고 주변 셀 (CI)에 의해 촬영입니다. 혈관 및 종양 interstitium dextran 10 KDa (CII)를 볼 수 있습니다. Dextran 2 MDa (CIII) 혈관에서 찾을 수 있습니다. 그리고 사출 (CIV) 후 40 분, Dextran 10 KDa 사라집니다 (CV), 혈액에서 Dextran 2 MDa의 형광 강도 저하 (CVI) 또한. 눈금 막대 = 100 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
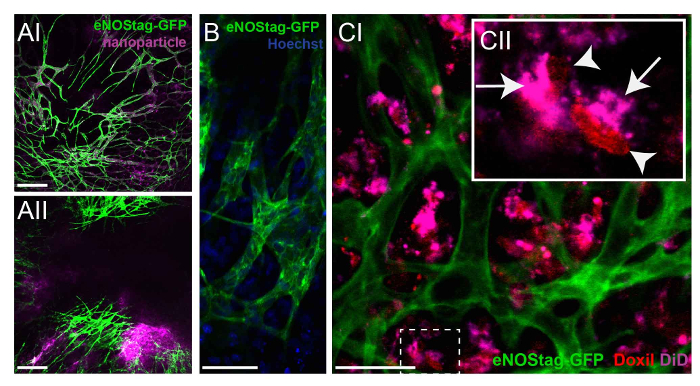
그림 4: 화학요법 에이전트의 운명을 조사. (A) eNOStag-GFP 동물 치료 i.v. 나노 입자와 고 후 24 h를 몇 군데. 나노는 종양 interstitium (AI)에 최소한의 넘쳐 흐름으로, 혈관에 여전히 존재 한다. 나노 입자는 TNF와 결합 되어 때 종양 interstitium (좋아)에 넘쳐 흐름 혈 류에서 관찰 된다. 눈금 막대 = 250 µ m. (B) 사용 하 여 고해상도 렌즈, 내 피 세포질 (녹색) 및 개별 셀의 핵 (파란색)를 인식 될 수 있다. 눈금 막대 = 50 µ m. (C) eNOStag-GFP 동물 주사 i.v. Doxil와-TNF, 함께에서 한 이미지 후 24 h 찍은. 여기, Doxil의 넘쳐 흐름-한 종양에 혈관 interstitium 분명 (CI) 이다. 개별 셀 (CII)에 대 한 자세한 평가 나온된 독 소 루비 (레드)는 세포 핵 (화살촉)에서 관찰 하는 동안 보라색 캐리어 (화살표), 세포질에서 찾을 수 있습니다 보여줍니다. 눈금 막대 = 50 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
종양 및 종양 선박 개발 뿐만 아니라 종양 치료 효과 매우 동적 프로세스, intravital 평가 시간 및 공간-종속 방식으로 이러한 프로세스의 올바른 평가 만들기 위해 우아한 도구입니다. 라이브 셀 마커, 유전자 변형 동물의 창조 및 이미징 modalities의 발전의 증가 가용성, intravital 이미징 점점 더 인기가 되고있다. 조직학은 여전히 정기적으로 사용 하 고, 그리고 셀 및 구조를 식별 하는 다양 한 마커를 사용할 수 있습니다, 비록 조직 단면는 단점이 때 동적 프로세스를 조사 하 고 있습니다. 조직 해 부 필요한 정적 정보만을 제공 하는 고정에 영향을 미치는 조직 품질; 그리고 저 미 손상 세포 상호 작용입니다. 또한, 동적 프로세스를 조사할 때 다르고 자주 추정 시간 포인트에서 해 부 조직에는 동물의 대량을 필요 합니다. Intravital 영상과 XYZ 공간 차원과 시간의 여분의 차원을 만드는 다른 플레이어의 적절 한 위치 가능한 공간과 시간에서 동일한 동물에 평가할 수 있습니다. 따라서, 최적의 시간 포인트를 놓친 하지 고 실험 당 사용 동물 수는 크게 감소 합니다. 둘째, intravital 평가와 설립 시간 창 조직 추출을 최적화 하기 위해 추정 될 수 있습니다. 셋째, 선박 성장의 원하는 단계 intravitally 확인 하 고 전체 마운트 조직으로 스테인드 될 수 있습니다.
Intravital 디자인이이 원고에 언급 된 피부 집계 챔버 모델 및 전용된 다 confocal 현미경 등 변경된 된 내 피 세포에 형광 라벨을 표현 하는 유전자 변형 동물의 조합을 사용 합니다.
내 피 세포 신생, 중 단계21,22 의 숫자를 통해가 고 이러한 단계 종종 종양에서 동시에 볼 수 있습니다. ENOSTag-GFP 마우스 선을 사용 하 여, 개별 내 피 세포는 지켜질 수 있다, 그리고 심지어 filopodia 역학 추적 될 수 있다. 따라서 intravitally 선박 개발을 공부 하기 좋은 모델입니다. 이미 존재 하는 본질적인 라벨에 따라 형광 에이전트 루멘 형성, 혈액 흐름, 넘쳐 흐름, 그리고 혈액 클리어런스를 평가 하기 위해 사용할 수 있습니다. 마우스는 최대 5 h에 대 한 지속적으로 몇 군데. 동물의 장기 평가 가능한 동물의 마 취에 관한 몇 가지 예방 조치는 촬영 된 이전에 설명한23. 이 연구는 암에 초점을 맞춘로 종양 조직이 나 세포 이식 했다. 그러나, 우리는 또한 중반와 배아 폐 실험. 그러나, 연구 조직의 성장 속도 제한, 몇 주 후 피부 regrow, 시작으로 느린 성장 종양 또는 조직에 문제가 될 수 있는.
유효성 검사 단계 동안 피부 집계 창 챔버 상당히 수정 등 쪽에 비해 클래식 모델4. 프레임 멸 합성 물자의 건설 하 고 가볍고 작은, 큰 창 보기 영역. 고정 링 (그림 1Bg, 흰색 화살표)의 후크 링의 쉬운 제거를 위해 사용 됩니다. 리 테 이너 링 후크 없이 이러한 이미지를 방해 하는 경우 사용할 수 있습니다. 피부는 확장 되지 너무 많이 풀면이 모델에서 발생 하지 않습니다 하 고 감염만 거의 볼 수 있습니다. 이러한 수정 동물 불편을 감소 하 고 크게 동물 절차를 구체화. 또한, 금속 부품 종양 MRI24를 사용 하 여 이미징 때 쉽게 제거 될 수 있습니다.
모든 현미경 intravitally 이미지 등을 채택 수 있습니다 피부 집계로 약 실. 주요 요구 사항은 현미경 단계와 목표 렌즈 사이의 사용 가능한 공간입니다. 이미징에 영향을 미치는 중요 한 측면은 모션. 모션 아티팩트를 방지 하기 위해, (모든 삽입의 제거) 후 현미경 테이블에 맞는 마우스를 지 원하는 플랫폼을 사용 한다. 그것은 마 취, 그리고 자유롭게 마우스 숨을 수 있도록 더 나은 마우스를 묶을 필요는 없습니다. 그러나, 창 보기의 필드의 최적의 고정을 주는 플랫폼에 나올 (즉, 종양 창 챔버를 통해 표시 됩니다). 플랫폼은 동물 난방에 사용 되는 전자가 열 패드를 사용 하 여가 열. 이 플랫폼은 사내, 되었다 하 고 구체적인 요청 시 얻을 수 있습니다. 고해상도 렌즈 필요성 세포내 프로세스를 평가할 때 이며 세포질과 핵 사이 차별을 가능 하 게 합니다. 비교적 긴 하지만 좋은 광학 해상도 (높은 NA) 테이퍼 렌즈를 사용 하 여 작동 거리 (선호 2 m m 이상)는 것이 좋습니다. 영상에서 한계는 침투 깊이 라벨의 형광 강도 이다. 또한, photobleaching, phototoxicity, 및 채도 이미징 동안 피해 야 한다.
여기, 통합된 confocal 다 고 confocal 현미경 사용 되었다. 다는 직 립는 confocal는 거꾸로 현미경 이다. 똑바로 현미경의 장점은 물 침수 렌즈의 쉬운 사용입니다. 이 렌즈는 높은 없음 및 긴 작동 거리, (예를 들어, 20 또는 40 X) 높은 확대에도. 특히, 여러 회사에서 판매 되는 20 X 나 1.0 물 침수 렌즈를는 것이 좋습니다. 집중 렌즈를 사용 하면 렌즈와 침수 액체 필요가 37 ° c.에가 열 될 다는 것을 유의 최고의 이미지에 대 한 것이 좋습니다 최적의 confocal 설정을 사용 하려면 (즉, pinhole 1 공기 단위에 레이저 출력 가능, 이득 너무 높은 최저 (특히 도입 하는 경우는 이득 잡음), 최대, 및 아무 검사의 평균 속도 줄). 과다 노출, 채도 및 이미지 사이의 강도 차이 데이터 품질을 타협. 채도, 노출 과도 방지 하는 것이 좋습니다. 이 다른 이득 설정에서 이미지를 획득 하 여 피할 수 있습니다. 이득은 변경 이미지의 밝기를 변경 하는 쉬운 방법은 이다. 필요한 경우, 레이저 힘을 조정할 수 있습니다. 이미지 품질을 표준화, 슬라이드 고정된 형광 강도 사용할 수 있습니다. 하나는 현미경을 최적으로 설정 하는 경우에 이미지 품질 좋은 정도 의해 결정 됩니다 창 챔버와 조직의 품질 염두에 두어야 한다
여러 형광 마커를 동시에 검색 하는 경우 출혈-통해, 하나의 fluorophore의 또 다른 채널에 감지 피해 야 한다. 최소한의 겹치는 스펙트럼 fluorophores의 조합을 사용 하 여 도련 통해와 순차 프레임 사이의 검색 하지 마십시오. 여기에 제시 된 이미지 3 순차 스캔을 사용 하 여 스캔 했다 (트랙 1: GFP, DID 또는 488 고 633 레이저; fluor647 트랙 2: rhodamine, Doxil, 또는 543 레이저; mTomato 및 트랙 3: 405 레이저 Hoechst).
종양 혈관 개발, 팁 셀 역학, 루멘, 넘쳐 흐름, 형성과 혈관 손상의 몇몇 단계 평가의 가능성이 여기에 표시 됩니다. ENOStag GFP 라인을 사용 하 여, 종양 영역 파괴 혈관 침대와과 립된 세포 남은 여전히 GFP를 표현 하 여 쉽게 검색 됩니다. 아니 주사 에이전트 흐름의 부족을 나타내는이 지역에서 발견 되었다. 화학요법 에이전트 관리이 즉도이 지역에 도달 하지 것입니다. 그러나, 선박 파괴는 치료 결과 될 수 있습니다. 사전 평가 치료 전 혈관 파괴에 대 한 확인 하는 종양의 정확한 치료 평가 대 한 필수 이며이 실험 설계를 사용 하 여 쉽게 수행할 수 있습니다.
가능성 있는 intravital 현미경 검사 법을 사용할 수 있습니다의 과다 이며 자세한 내용은이 책의 범위를 벗어납니다. 가능한 응용 프로그램 간단한 통찰력을 주고, 종양 조직, 혈관 (예를 들어, 선박, 분 지, 및 교차로의 수)와 혈액의 흐름, 세포 세포 상호 작용의 개발에 chemotherapeutics의 축적에 대 한 연구를 포함 대상으로, 그리고 세포내 처리 뿐만 아니라 위에서 언급 한 하 고 여기에 표시 된 예제 셀. 형광에 분석을 기반으로, 강도 변동 창 또는 조직의 품질을 알고 있어야 합니다. 또한, 상대적으로 두꺼운 종양 조직으로, 형광 위에서 또는 보기의 비행기 아래 이미지에서 신호에는 영향을 있다. 객관적인 측정 양적 이미지 분석을 결합 하는 것이 최상 이다. 예를 들어, 약물 농도에 관심이 intravital 현미경 검사 법 후 창에서 종양 조직을 제거 고 약 confocal 이미지와 비교를 HPLC를 사용 하 여 콘텐츠를 확인 합니다.
이 모델을 사용 하 여 잘 하지만 몇 가지 주의와 종양 응답의 평가 수행할 수 있습니다. 하나는 종양도 성장 안쪽, 피부에 깨 달아야 한다. 3D 측정 침투 전체 종양을 충당 하기 위해 충분히 깊은 경우에 할 수 있다. 이러한 경우, 빨강 염료를 사용 해야 합니다. 창 상공으로 여기에 설명 된 종양 피부 환경에서 거래 하 고 지적 윈도우 일반 마우스 체온 보다 약간 낮은 온도 유지 하는 것이 중요 하다. 따라서, 공부 intravital 연구는 지를 확인 하는 바로 마이크로 환경 설정에서 종양 피부 집계 창 챔버 최상 이다. 중요 한 것은,는 등 피부 집계 챔버 프로세스와 치료의 개선을 위한 수단으로 제공 하는 메커니즘의 활동에 대 한 통찰력을 제공 합니다. 또한, biodistribution와 약물 동력 학에 대 한 추가 정보를 얻을 수 있습니다. 고전적인, 이러한 biodistribution 연구는 종양 방위 동물을 치료 하 고 해 부 종양/장기 약물 이해를 측정 하 여 수행 됩니다. Intravital이 모델을 사용 하는 약물 (즉, 혈관 내, intratumoral, 세포내, 또는 핵)의 intratumoral 위치5,,2526제공할 수 있습니다. 뿐만 아니라 또한 시간 창-의-기회 가장 최적의 통풍 관에 대 한 하지만, 밝혀 약물의 위치가 이다.
이 문서에서 설명 하는 실험 설계를 사용 하 여 다양 한 매개 변수는 시간적, 공간적 환경에서 평가할 수 있습니다. 특히, 여기 우리가 그 intravital 현미경 종양 혈관 개발 및 치료 응답의 역학에 중요 한 통찰력을 제공 보여줍니다.
공개
저자는 공개 없다.
감사의 말
우리는 그들의 개발 및 eNOSTag GFP 선, 주스 트 차적 Rens 동물 작품, 그의 기술 지원 및 그들의 도움에 대 한 동물 관리의 기부에 대 한 Rien 밴 Haperen와 Rini 드 크롬을 감사 하 고 싶습니다. 사용 하는 현미경 시설 에라스무스 광학 이미징 센터의 일부 이며, 우리는 그들의 서비스에 대 한 OIC의 직원을 감사 하 고 싶습니다. 이 연구는 "Stichting 에라스무스 Heelkundig Kankeronderzoek,", "Vereniging Trustfonds" 에라스무스 대학교 로테르 담, 네덜란드 암 협회에서 부여 DDHK 2000-2224에 의해 지원 되었다 그리고 우리는 그들의 관대 한 기부에 대 한 위원회의 회원을 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| DMEM | Sigma | D1145 | Supplemented with 10% FCS |
| Trypsin-versene (EDTA) | Lonza | BE17-161E | Make a 0.1% solution in PBS, sterile |
| PBS | |||
| Window frames | Costum made | ||
| Filler glass 10 mm, 0.55 mm | Abrisia technologies | ||
| Cover glass 12mm, #1 thickness | Thermo Scientific/VWR | 631-0713 | |
| Hear removal gel (veet) | for sensitive skin | ||
| Eye ointment | |||
| Buprenorfine hydrochloride | use 0.05 mg/kg | ||
| Anesthesia unit | O2/Isoflurane inhalation unit with an chamber and tubeing+cone | ||
| insulin syringe 0.5ml x 12.7mm 29g, green | BD | 324824 | |
| Needles 23G 1 1/4" | Braun | 4657640 | |
| Needles 25G 5/8" | Braun | 4657853 | |
| Sutures silkan 0.7 | Braun | 1134019 | |
| Nuts | Jeveka | 934 A2 1 | |
| Bolts | Jeveka | 84 A2 1 10 | |
| 0.9% NaCl | |||
| Microscope + software | The space between table and objective need to be wide enough to hold the animal | ||
| Heated temperature controlled platform | Costum made | ||
| Window holder | Costum made | ||
| tetramethylrhodamine 2,000,000 MW dextran | Invitrogen | D7139 | 100 µg/mouse |
| Alexa-fluor 647 10,000 MW dextran | Invitrogen | D22914 | 100 µg/mouse |
| Hoechst 33342 | Invitrogen | H1399 | 25 µg/mouse |
| Pegulated nanoparticles | ref 5 | ||
| LEICA TCS SP5 Multiphoton Microscope | Leica | ||
| LAS AF Software | Leica |
참고문헌
- Massoud, T. F., Gambhir, S. S. Molecular imaging in living subjects: seeing fundamental biological processes in a new light. Genes Dev. 17, 545-580 (2003).
- Ellenbroek, S. I., van Rheenen, J. Imaging hallmarks of cancer in living mice. Nat Rev Cancer. 14, 406-418 (2014).
- Brown, E., Munn, L. L., Fukumura, D., Jain, R. K. In vivo imaging of tumors. Cold Spring Harb Protoc. 2010 (7), (2010).
- Palmer, G. M., et al. In vivo optical molecular imaging and analysis in mice using dorsal window chamber models applied to hypoxia, vasculature and fluorescent reporters. Nat. Protocols. 6, 1355-1366 (2011).
- Seynhaeve, A. L., et al. Tumor necrosis factor alpha mediates homogeneous distribution of liposomes in murine melanoma that contributes to a better tumor response. Cancer Res. 67, 9455-9462 (2007).
- Schiffelers, R. M., et al. Ligand-targeted liposomes directed against pathological vasculature. J Liposome Res. 12, 129-135 (2002).
- Straetemans, T., et al. T-cell receptor gene therapy in human melanoma-bearing immune-deficient mice: human but not mouse T cells recapitulate outcome of clinical studies. Hum Gene Ther. 23, 187-201 (2012).
- Pittet, M. J., Weissleder, R. Intravital imaging. Cell. 147, 983-991 (2011).
- van Haperen, R., et al. Functional expression of endothelial nitric oxide synthase fused to green fluorescent protein in transgenic mice. Am J Pathol. 163, 1677-1686 (2003).
- Muzumdar, M. D., Tasic, B., Miyamichi, K., Li, L., Luo, L. A global double-fluorescent Cre reporter mouse. Genesis. 45, 593-605 (2007).
- Manzoor, A. A., et al. Overcoming limitations in nanoparticle drug delivery: triggered, intravascular release to improve drug penetration into tumors. Cancer Res. 72, 5566-5575 (2012).
- Pitulescu, M. E., Schmidt, I., Benedito, R., Adams, R. H. Inducible gene targeting in the neonatal vasculature and analysis of retinal angiogenesis in mice. Nat Protoc. 5, 1518-1534 (2010).
- Tual-Chalot, S., Allinson, K. R., Fruttiger, M., Arthur, H. M. Whole mount immunofluorescent staining of the neonatal mouse retina to investigate angiogenesis in vivo. J Vis Exp. , e50546 (2013).
- Hobbs, S. K., et al. Regulation of transport pathways in tumor vessels: role of tumor type and microenvironment. Proc Natl Acad Sci U S A. 95, 4607-4612 (1998).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat Rev Cancer. 6, 583-592 (2006).
- Koning, G. A., Eggermont, A. M., Lindner, L. H., Hagen, t. e. n., L, T. Hyperthermia and thermosensitive liposomes for improved delivery of chemotherapeutic drugs to solid tumors. Pharm Res. 27, 1750-1754 (2010).
- Seynhaeve, A. L., Eggermont, A. M., ten Hagen, T. L. TNF and manipulation of the tumor cell-stromal interface: "ways to make chemotherapy effective". Front Biosci. 13, 3034-3045 (2008).
- Brouckaert, P., et al. Tumor necrosis factor-alpha augmented tumor response in B16BL6 melanoma-bearing mice treated with stealth liposomal doxorubicin (Doxil) correlates with altered Doxil pharmacokinetics. Int J Cancer. 109, 442-448 (2004).
- Hoving, S., Seynhaeve, A. L., van Tiel, S. T., Eggermont, A. M., ten Hagen, L. T. Addition of low-dose tumor necrosis factor-alpha to systemic treatment with STEALTH liposomal doxorubicin (Doxil) improved anti-tumor activity in osteosarcoma-bearing rats. Anticancer Drugs. 16, 667-674 (2005).
- Gabizon, A., et al. Prolonged circulation time and enhanced accumulation in malignant exudates of doxorubicin encapsulated in polyethylene-glycol coated liposomes. Cancer Res. 54, 987-992 (1994).
- Bergers, G., Benjamin, L. E. Tumorigenesis and the angiogenic switch. Nat Rev Cancer. 3, 401-410 (2003).
- Eilken, H. M., Adams, R. H. Dynamics of endothelial cell behavior in sprouting angiogenesis. Curr Opin Cell Biol. 22, 617-625 (2010).
- Nakasone, E. S., Askautrud, H. A., Egeblad, M. Live imaging of drug responses in the tumor microenvironment in mouse models of breast cancer. J Vis Exp. , e50088 (2013).
- van Vliet, M., et al. MR angiography of tumor-related vasculature: from the clinic to the micro-environment. Radiographics. 25, S85-S97 (2005).
- Dicheva, B. M., et al. Cationic thermosensitive liposomes: a novel dual targeted heat-triggered drug delivery approach for endothelial and tumor cells. Nano Lett. 13, 2324-2331 (2013).
- Li, L., et al. Improved intratumoral nanoparticle extravasation and penetration by mild hyperthermia. J Control Release. 167, 130-137 (2013).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유