Method Article
그램 음성 박테리아에 필수 금속 통풍 관: 형광, Radioisotopes, x 선 및 세포 분별 법
요약
기본 바인딩 파트너, 컨텍스트 및 x 선 형광 및 radiometal 통풍 관을 제시 하 여 기판 내용물의 생물 특성 periplasmic 전이 금속 보호자의 추출에 대 한 프로토콜.
초록
우리는 세포질에서 세균성 periplasm의 분리에 대 한 확장 가능한 메서드를 보여 줍니다. 이 메서드는 생물 특성화 및 periplasmic 및 세포질 구획 사이 측정 기판 전송 목적 periplasmic 단백질을 순화 하는 데 사용 됩니다. 실험 신중 하 게 제한 함으로써는 periplasm 세포질에서 분리 된 시간, 관심사의 단백질을 추출 하 고 시험의 각 구획 구획 사이 이성 오염 없이 기판에 대 한 개별적으로 수 있습니다. 분류에서 추출 된 단백질 3 차원 구조 결정 또는 기질 바인딩 프로필에 대 한 추가 분석 수 있습니다 다음. 또는, 다른 세균 구획에 걸쳐 radiotracer 추적 프로그램의 배포 뿐만 아니라 총 % 이해, 결정 (및 그러므로 금속 전송)를 가진 외피 후이 메서드를 수행할 수 있습니다. radiotracer 실험 생리 적인 기질과 artefactual 기판, mismetallation에 의해 발생 하는 등 구분을 도울 수 있다.
X 선 형광 샘플, 금속 관의 유무를 발견 하 고 성장 조건, 정화 조건, 결정 화 조건의 제품으로 금속 관에 발생할 수 있는 변화를 측정에 사용할 수 있습니다. X 선 형광은 또한 변칙 엑스레이 분산 데이터 수집을 위해 사용 하는 최고의 금속 에너지 흡수 피크를 확인 하는 데 사용할 수 있습니다 각 금속에 대 한 풍부의 상대 측정을 제공 합니다. Radiometal 통풍 관 소설 기판의 발견을 지원 뿐만 아니라 x-선 형광에 의해 감지 하는 기판의 생리 적 특성의 유효성을 검사 하는 방법으로 사용할 수 있습니다.
서문
그램 음성 박테리아에 전이 금속 원자의 세포질 풀 증가 하 고 내부 막에 걸쳐 금속 전을 완화 하는 내부 막 ABC (ATP 묶는 카세트) 수입에 의해 보충. Periplasmic 클러스터-1 기질 의무적인 단백질 (SBPs) 금속 원자를 직접 바인딩할 하 고 동족 ABC 수입1에 게 전달 하 periplasm 통해 페리 보호자의 그룹을 작성 합니다. 다른 클러스터의 SBPs 기판, 킬레이트 화 된 금속 (클러스터 A-2), (클러스터 B와 D-1), 탄수화물과 아미노산 등의 전송에 전용 (클러스터 B, C, F-2, F-4); 그럼에도 불구 하 고, 기판에 SBPs c-클램프 배 진화론 보존2를 따릅니다. SBP 기판 전송에 대 한 일반적인된 제안 된 메커니즘에 c-클램프 금성 파리 통3닮은 contortions의 시리즈를 겪고 포함 됩니다. 일반적으로, 클러스터-1 SBPs 홀로 (금속 바인딩) 형태로 정화 하지만 이러한 SBPs의 연구는 apo (금속 무료) 형태의 실험4단백질 생성에 있는 어려움에 의해 제한 됩니다. 날짜 하려면, apo 공부 전략 클러스터-1 SBPs mutagenesis, 투 석, 및 ethylenediaminetetraacetic 산 (EDTA) chelator5,6,,78 부분 변성 되었습니다. , 9 , 10 , 11.이 실험에서 발생 하는 구조적 데이터 클러스터-1 SBPs 수 있습니다 정확 하 게 금성 파리 통 메커니즘을 수행 하지 것이 좋습니다. 현재 문학에서 누락 apo 클러스터-1 SBPs에 vivo에서 생리 바인딩 파트너를 사용 하 여 생산 하는 방법 이다.
YfeA, Yersinia pestis에서 클러스터 A-1 SBP, 그것의 생리 적인 동족 YfeBCDE ABC 가져오기 도구와의 상호 작용을 통해 apo 양식으로 개조 되었다 전염병의 etiological 대리인 정화 세포 분별 법을 사용 하 여 처음으로 시연 에 셀입니다. 우리 YfeA은 에너지 흩어진 엑스레이 분광학 (EDS), 일컬어 x 선 형광에 의해 apo 형태로 보여줍니다. 우리는 또한 외부 막에 걸쳐 금속 통풍 관 및 내부 막에 걸쳐 금속 가져오기 사이 구별을 매우 중요 한 방사성 금속 통풍 관 연구와 세포 분류를 결합 하 여 YfeBCDE 기능을 보여 줍니다. 방사성 트레이 서를 사용 하 여 pg/L 양의 금속, 탐지의 한계 보다 훨씬 낮은 검출 기법 등으로 유도 결합 플라즈마 질량 분석 (ICP-MS) 또는 원자 흡수 분 광 법 (AAS)에 대 한 수 있습니다. 공부 되 고 시스템의 최소한의 섭 동에 대 한 수 있습니다. 또한, 종종 나열 된 전통적인 방법 큰 샘플 볼륨, 추가 후 처리, 및 긴 차례-주위에 시간, radiotracer 분석 실험에 대 한 일반적인 되지 않은 필요 합니다. 따라서,는 radiotracer를 사용 하 여 금속 분포와 셀 내에 통풍 관을 모니터링 하기 위한 편리 하 고 간단한 방법을 제공 한다. 그것은 경우 클러스터 A-1 SBP이이 메서드를 사용 하 여 생산 하는 apo apo는 단백질을 생성 하는 데 사용 하는 현재 관행에서 구조 관찰 에코 것 이라고 하는 것을 확인할 수 있다.
세포 분별 법 격리12에 그들의 내용을 구체적으로의 암시적 목적에 대 한 세포질 구획을 분리 하기 위한 설정된 방법입니다. 세포 분별 법 세포 주기 동안 분자의 위치를 확인 하거나 특정 구획13의 활동을 측정에 주로 사용 됩니다. 예를 들어 금속 전송 활동 금속 기판에 대 한 세포질 구획 검색을 통해 분석 될 수 있습니다. 세포 분별 법 통합 구별 및 내부 막에 걸쳐 외부 막에 걸쳐 금속 통풍 관 및 금속 사이 비교 수 있습니다. 이 프로세스 후에 측정할 수 있습니다 시간이 지남에. 단백질 정화의 경우 세포 세포의 용 해의 가장 일반적인 방법 및 불용 성 구성 요소에서 가용성 구성 요소의 분리는 기계적 장애 (즉, 분쇄, 혼합), 고압 균질 (즉, 프랑스 압력 셀, 셀 disrupter), 그리고 초음파 주파수 (즉., 쥡니다)14. 세포를 lyse에 초음파 주파수의 사용은 일반적으로 가장 적합 작은 볼륨; 그러나, 쥡니다 단백질 변성 수 과도 한 열을 생성으로 알려져 있다. 과도 한 열 생성을 피하기 위해, 초음파 주파수 시간이 소요 될 수 있는 작은 파편으로 DNA 분자를 실수로 저하 순차적 짧은 파열에서 일반적으로 적용 됩니다. 각 프로브는 처리할 수 있는 샘플 볼륨에 대 한 제한 된 범위 또한 여러 비싼 쥡니다 프로브 대리점 및 분석 실험에 대 한 필요할 수 있습니다. 세포를 lyse를 높은 압력의 사용 방지 세포 이전 프랑스 압력 셀 프레스 구성 요소를 냉각 또는 차가운 룸 같은 추운 환경에서 셀 방해를 운영 하 여 세포 세포의 용 해 동안 과도 한 열을 생성 합니다. 쥡니다 프로브 처럼 프랑스 압력 셀 프레스 부품의 여러 다양 한 샘플 볼륨을 처리 하기 위해 구입할 필요가 있습니다. 어셈블리는 연결 하기 쉽지만 운영 하 고 청소 하 고, 어 색 한 프랑스 압력 셀 보도 고 이동 하는 무거운 수 밀도 샘플에서 막힘을 하는 경향이 있다. 사용 하 여 초음파 주파수 및 고압 시스템 세포를 lyse 장점 높은 샘플 복구, 최소한의 교차 오염, 여러 샘플을 처리 하는 능력 및 조정 가능한 힘을 기울이기, 될 수 있는 세포의 최적화에 대 한 적응 샘플 종류의 넓은 range. 최적화는 초음파 주파수를 조정 하 여 발생할 수 있는 버스트, 피스톤 압력 파운드 당 제곱 인치 (psi), 그리고 언론을 통해 전달의 수의 기간. 사용 기계 중단 lyse 세포의 세포 세포의 용 해에 대 한 가장 저렴 하 고 가장 기술적으로 사소한 전략 있을 수 있습니다. 기계 중단 샘플 복구에 과제를 제시할 수 있습니다 하 고 여러 샘플을 처리 하는 데 적합 하지 않습니다. 기계 중단 샘플을 높은 압력 또는 초음파 주파수 보다 gentler입니다 하지만 높은 처리량 이며 비효율적인 세포의 용 해 하는 경향이 있다. 기계, 고압 균질 있으며 초음파 주파수의 중요 한 실험적인 한계는 전체 세포 구조의 통제 중단 세포, 후 모든 수성 셀 구성 요소가 혼합 되어 함께. 또한, 모든 셀 구획; 동시에 중단 하지 않습니다. 따라서, 일찍 lyse 구획의 내용을 늦게 lyse 구획의 내용 보다 더 긴 지속적인 파괴 세력 대상이 될 수 있습니다. 세포 분별 분리에 대 한 저렴 한, 기술적으로 간단 하 고, 효율적인 구획 기반 셀 내용의 고가의 장비 및 가혹한, 파괴적인 힘에 샘플 노출에 대 한 필요성을 피하고 있는 동안 수 있습니다.
가져온된 기판 및 잠재적으로 apo 단백질 reintroduced 홀로 단백질 세포, 다운스트림 착 색 인쇄기 또는 다른 정화 기술을 이전 하는 동안 다시 생성, SBP의 경우. 세포 동안 EDTA chelator의 포함 어디 단백질 정화의 첫 단계로 금속 선호도 불가능 EDTA 크로마토그래피 수 지에서 금속 스트립 것 이기 때문에 단백질15바인딩 방지 추가 장애물을 선물 한다. 간단 하 고 저렴 한 솔루션은 삼투성 충격, 셀 분류 차등 원심 분리 및 일반적인 실험실 시 약 주의깊게 기능 분석에 대 한 충분 한 단백질을 추출 하는 탐정을 사용. 삼투성 충격 분별 세포 격실을 분리 하는 삼투성 압력에 2 단계 변화를 활용 합니다. 첫째, 고 버퍼 원인 세포를 crenate 물 잎 각 셀 하 고 둘째, 소형 버퍼 인해 팽창으로 물 다시 각 셀에 셀. 신중 하 게 제어 함으로써 세포가 팽창 하는 얼마나 오래, 외부 막 수 수 선택적으로 lysed (때문에 들어오는 물에서 삼투성 압력의 상승), 따라서 그들의 내용을 버퍼에 비우는. 내부 막의 보존 하면 세포질 내용을 spheroplasts에서 유지 되 고 원심 분리에 의해 periplasmic 내용에서 쉽게 분리 됩니다.
YfeA는 polyspecific SBP 철, 망간, 아연 원자16바인딩 수입니다. 통합된 금속의 상대적 비율 성장, 중 금속 보완에 따라 변경 될 수 있습니다 그리고 아르곤 국립 연구소의 고급 광자 소스16에서 구할 수 있다 엑스레이 형광에 의해와 같은 분석. X 선 형광 수 있습니다 신속 하 게 금속에 대 한 필요 없이 광범위 한 어셈블리를 프로 파일링 수 사관 큰 또는 회절 품질 결정, 고 단백질 촉진 또는 배치할 솔루션에서 데이터를 수집도 있습니다.
X 선 형광 밝힐 수 있습니다 신속 하 게 예기치 않은 결과 같은,이 경우에, 기본 YfeA 기판 아연 되 고 아니라는 문서화 된 생리 기판 철 또는 망간16. X-선 산란 데이터를 수집 하기 전에 사용 하는 경우 x 선 형광 실험 설계, 예 금속 에너지 edge(s) 변칙 엑스레이 분산 데이터 수집을 위해 사용 하는 조사를 알릴 수 있습니다. 금속, x 선 형광의 관계 되는 풍부는 금속 결 석 인지 확인할 수도 있습니다 결정으로 유용한 샘플, apo 홀로 단백질에서 단백질을 포함 하 고 추정 금속 결정을 분리 하는 빠른 방법 제공 신호 강도 없이 시간이 걸리는 데이터 처리에 대 한 필요 합니다. 강한 금속 신호 샘플을 식별, 시 다중 파장 변칙 분산 (매드) 검사에 의해 변칙 엑스레이 분산 데이터 수집을 위해 사용 하는 정확한 파장을 확인할 수 있습니다.
이 상세한 프로토콜 새로운 경험 성공적으로 셀 분류를 수행 하 고 싱크 로트 론 beamline 하드웨어 총 금속 콘텐츠를 프로 파일링 하 고 금속-바인딩 단백질의 연구를의 효과적인 사용을 만들 수 있도록 위한 것입니다.
프로토콜
1. 세균 스타터 문화 (1 일)
- 경사진된 플라스 크 200 mL에에서 접종 스트레인 대장균 BL21-CodonPlus (DE3)와 Luria Bertani 국물 (파운드)의 30 mL-RIPL 세포 포함 pYFE3 플라스 미드16.
- 피 펫 및 200 µ L 팁 발음 하 여 플라스 크에 50 mg/mL 암 피 실린의 30 µ L를 추가 합니다. 37 ˚C에서 225 rpm에서 밤새 흔들어.
2. 보충 M9 최소한의 미디어 준비 (주 2)
참고: 이것은 Amresco 설명서에서 적응입니다.
- 다음 절차에 의해 액체의 6 L를 준비 합니다. 2 L 경사진된 술병에 매우 순수한 H2O. 압력솥에서 20 분 동안 121 ˚C의 1 l M9 최소한의 미디어의 10.5 g을 추가 하 고 실내 온도에 냉각.
- Aseptically 다음 살 균 보충 솔루션 추가: 2 mL/L 1 M MgSO4, 20 %w / v 포도의 10 mL/L, 0.1 mL/L 1 M CaCl2, 및 1 mL/L 50 mg/mL 암 피 실린의. 생물학 안전 장은 무 균 환경을 유지 하기 위하여이 단계를 수행 합니다. 37 ˚C를 미디어 따뜻한.
3. 세균 2 차 배양
- 자동 피 펫과 5 mL 팁 발음으로 M9 최소한의 미디어를 하룻밤 스타터 문화의 5 mL/L를 추가 합니다. 9 h 37 ˚C에서 225 rpm에서 지속적으로 subculture를 흔들어.
참고:이 단계 동안 YfeABCDE는 overexpressed 그것의 기본에서 autoinduction에 의해 Y. pestis 발기인. - 4 ˚C에서 30 분 동안 4500 x g에서 원심 분리 하 여 세포를 복구. 피 펫 및 1 mL 팁, 발음으로 얼음 처럼 차가운 인산 염 버퍼 솔루션 (20 m m 나2HPO4 pH 7.6, 50 mM NaCl) 50 mL에 셀 resuspend 하 고 하룻밤-80 ˚C에 고정.
4. 세포 분별 법 (3 일)
- 4000 x g 4 ˚C에서 20 분에서 4 ° C와 펠 릿 세포에서 물의 resuspension 녹여 자동 피 펫과 25 mL 팁 발음 하 여 차가운 높은 소금 버퍼 (200 mM Tris HCl pH 8.0, 400 m m NaCl, 그리고 2 mM EDTA) 50 mL에 셀을 resuspend. 혼합에 대 한 가끔 반전으로 20 분 동안 얼음 정지를 품 어.
- 4 ˚C에서 20 분 동안 4500 x g에서 셀 작은 자동 피 펫과 25 mL 팁 발음 하 여 차가운 낮은 소금 버퍼 (10 mM Tris HCl pH 8.0) 50 mL에 셀을 resuspend. 혼합에 대 한 가끔 반전으로 20 분 동안 얼음 정지를 품 어.
- 4500 x g 4 ˚C에서 20 분 동안에 spheroplasts 작은 상쾌한 periplasm포함 복구. 자동 피 펫과 25 mL 팁 발음으로 버퍼링 하는 인산 염 (3.2 단계)에서 수송과 spheroplasts resuspend와 1500 psi에서 프랑스 압력 셀 보도의 3 주기에 의해 세포를 lyse.
참고: 프랑스 압력 셀 보도 운영 하기 까다로울 수 고 세포 세포의 용 해를 유압 펌프를 사용 합니다. 유압 펌프, 언론, 피스톤의 적절 한 맞춤을 보장 하 고 핸 즈 프리는 유압 펌프의 유지에 관여 하는 때 주의 사용 합니다. - 4 ˚C에서 20 분 50000 x g에서 세포질 파편 작은 세포질을 포함 하는 상쾌한을 복구 합니다. 필요한 경우, 외부 및 내부 막 수 더 분류 한16.
5. 단백질 정화 FPLC를 사용 하 여
- 분별, 직후 periplasmic 분수 0.45 μ 막 단위를 사용 하 여 필터링 합니다. 쉽고 빠른 여과 대 한 필터 주사기 Luer 잠금을 사용 합니다. 20 mM Tris pH 7.6, 0.05 %w / v 앤3 로드 5 mL/min의 flowrate에 버퍼를 사용 하 여 5 mL Q 음이온 교환 열 equilibrate
- 20 mM Tris pH 7.6, 0.05 %w / v 앤3 로드 2 mL/5 mL Q 음이온 교환 열 20 mM Tris pH 7.6를 사용 하 여 세척을 계속 분 flowrate에 버퍼를 사용 하 여 미리 equilibrated 5 mL Q 음이온 교환 열에 periplasmic filtrate 로드 0.05 %w / v 앤3 로딩 버퍼 A280의 초기 읽기 5 mL/min의 flowrate에 달성 될 때까지.
- 20 mM Tris pH 7.6를 사용 하 여 바인딩된 단백질을 elute 0.05 %w / v 앤3, 0-1 M NaCl 5 mL/분280 피크를 포함 하는 결합 분수 flowrate에 선형 그라데이션 10 열 볼륨에 의해. Apo YfeA 200 mM NaCl와 300 mM NaCl 사이 elutes.
- 볼륨 ~ 5 mL에 도달할 때까지 원심 집중 장치에 의해 eluate 집중.
- 20 mM 두번째-트리 스 ph 6.3, 50 mM NaCl, 2.5 mL/min의 flowrate에 0.05 %w / v3 앤 젤 여과 버퍼 Superdex 200 pg 젤 여과 열 equilibrate
- 부하 집중된 음이온 eluate 미리 equilibrated Superdex 200 pg 젤 여과 열에 교환 하 고 2.5 mL/분의 flowrate에 단계 5.5에서 젤 여과 버퍼를 사용 하 여 정화 결합 분수에 해당 하는 30 ~280 피크를 포함 하 kilodalton (kDa) 단백질입니다.
참고: 다음 참조 FPLC 실험 프로토콜17를 설명 하는 예제입니다.
6. 단백질 결정 화
- 젤 여과 eluate 원심 집중 장치 22 mg/mL의 최종 단백질 농도에 의해 집중.
- 1.276 mg/mL로 읽고 A280 을 나누어 단백질 농도 계산 합니다. 이 이론적인 소멸 계수 ExPASY ProtParam18에 의해 예언 되었다.
참고:는 A280 샘플 읽기 5.104의 AU 해당 4.000 mg/mL 해결책; 5.104 AU ÷ 1.276 mg/mL = 4.00 mg/mL.
- 1.276 mg/mL로 읽고 A280 을 나누어 단백질 농도 계산 합니다. 이 이론적인 소멸 계수 ExPASY ProtParam18에 의해 예언 되었다.
- 믹스 1.5 µ L 단백질의 30 %w / v 목이 4000, 50 mM NaCl, 20 m m 두번째-트리 스 pH 6.3, 0.05 %w / v 앤3 앉아 드롭 또는 드롭 설치는 피 펫 및 10 µ L 팁 발음 하 여 거에서 1.5 µ L로.
- 2-4 주 동안 293 K에서 결정 화 방울을 품 어.
- 플래시 동결 액체 질소는 싱크 로트 론을 선적을 위한 수영장에서 결정.
7. x 선 형광 (GM/CA Beamline 소프트웨어를 사용 하 여)
- 허 치 탭 10.0에 에너지를 설정 하려면 사용 에너지 부제목으로 이동 케빈.
- 인터랙티브 탭 마운트 샘플 스캔 탭 탐색 탐색.
- 최적화 형광 신호를 선택 합니다. 시간 하위 제목 아래 입력 4.00 s. 형광 스펙트럼을선택 합니다. 그림 탭을 사용 하 여 스펙트럼 보기
8. 매드 스캔 금속 에너지 흡수 피크 (GM/CA Beamline 소프트웨어를 사용 하 여)
- 빔에서 샘플을 이동 합니다. 표 탭을 스캔 탭 탐색 탐색 관심의 요소에 대 한 K 지 선택 합니다.
참고: 에너지 부제목에서 에너지 값은 eV입니다. - 허 치 탭 사용 에너지 부제목 에너지 단계 8.1 케빈에 값을 설정 하려면으로 이동 합니다.
- 빔으로 샘플을 이동 합니다. 자동 탭 입력 2.00의 시간 하위 제목 아래에 스캔 탭 탐색 탐색.
- 시작 검색을 선택 합니다. 그림 탭을 사용 하 여 매드 스캔 보기
참고: 피크 부제목에 에너지 값은 eV 보다는 케빈입니다. - 형광으로 완료를 선택 합니다.
- 빔에서 샘플을 이동 합니다. 허 치 탭 사용 에너지 단계 8.4에서 값을 설정 하려면 에너지 부제목 다음 eV 반올림으로 이동 (즉, 피크: 9658.3 eV, 9659 eV 에너지 설정).
- 빔으로 샘플을 이동 합니다. 데이터 집합을 수집 합니다. 관심의 모든 금속에 대 한 8.1 8.6 단계를 반복 합니다.
9. 분석 프로토콜 방사성 금속 통풍 관 분석 결과 대 한
- 14 mL 문화 관에서 접종 스트레인 대장균 BL21-CodonPlus (DE3)와 파운드의 5 mL-RIPL 세포 포함 pYFE3 플라스 미드16. 피 펫 및 10 µ L 팁 발음 여 50 mg/mL 암 피 실린의 5 µ L를 추가 합니다. 7 h 37 ˚C에서 225 rpm에 흔들.
- 탁상 원심 분리기를 사용 하 여 실 온에서 1 분 동안 15000 x g에서 셀 작은 피 펫과 1 mL 팁 발음 하 여 보충된 M9 최소 미디어의 1 mL에 셀을 씻어. 한 번 반복 합니다.
- 50 mL 원뿔 튜브에 30 mL로 subculture 셀 피 펫과 1 mL 팁 발음으로 M9 최소한의 미디어를 보충. 9 h 37 ˚C에서 225 rpm에 흔들.
- 분 (cpm) 당 약 100000 카운트를 달성 하는 데 필요한 하는 방사능의 양을 결정 합니다.
참고:이 방사성 동위 원소 및 검색에 사용 되는 악기에 따라 달라 집니다. 예를 들어 52Mn의 7.4 kilobecquerel (kBq) (0.2 microcurie (µCi))를 포함 하는 샘플 자동된 감마 검출기 (NaI)에 550000 cpm의 독서를 제공 합니다. 따라서, 100000 cpm의 카운트를 얻기 위해 필요한 방사능의 양을 확인할 수 있습니다 다음 수식을 사용 하 여: (100000 cpm/550000 cpm) * 7.4 kBq (0.2 µCi) = 1.35 kBq (0.036 µCi).
주의: 방사성 붕괴 결과 이온화 방사선의 방출에는 위험한. 방사능으로 작업할 때 항상 적절 한 차폐를 사용 하 고 거리 증가와 노출 시간을 줄이면서 차폐의 낮은으로 합리적으로 달성 가능 (ALARA) 원칙에 따라. 훈련 된 담당자만 방사성 물질의 사용에 대 한 허가 된 실험실에서 방사능을 처리 해야 합니다. - 총 볼륨의 subculture, 필요한 방사능의 총 금액을 확인 하 여 단계 9.4에서 계산 필요한 방사능을 곱하면 됩니다. 100000 cpm/mL, 그리고 30 대 잘 소용돌이 subculture 포함 된 튜브를 (가급적 이면 50-100 µ L의 작은 볼륨)에서이 금액을 추가 s.
참고: subculture의 31 Ml, 필요한 방사능의 총량은 31 mL = 41.3 kBq (1.12 µCi) x 1.35 kBq (0.036 µCi). - 약 1 mL 개별 1.5 mL 원심 분리기로 서브 컬쳐 (지금 방사성 추적 프로그램 포함)의 수 1 mL 및 피 펫 팁, 발음에 의해 튜브 및 1 × g. 포함 충분히 튜브는 3에서 vortexing와 37˚C thermomixer에서 각 복제 원하는 측정으로 표준으로 사용 하 여 3 개의 추가 복제 (옆으로 기준 설정, 수행 하지 않고 분류 분석 결과 기준에).
참고: 1, 2, 및 4 h에서 시 금 12 튜브 총 요구할 것입니다. - 부 화, 후 30 위한 15000 × g에서 튜브 원심 (선호 4 ˚C 냉각) 벤치탑 원심 분리기를 사용 하 여 s는 supernatants 폐기.
- 다시 얼음 감기, 높은 소금 및 1 mL 피 펫 팁, 발음 하 여 (단계 4.1)를 버퍼링 하 고 즉시 20 분 동안 얼음에 배치의 1 mL에 셀을 일시 중단 합니다.
- 30 위한 15000 × g에서 다시 셀 작은 벤치탑 원심 분리기 (선호 4 ˚C 냉각)를 사용 하 여 s는 supernatants 폐기.
참고:는 상쾌한 연결 되지 않은 무료 금속을 포함합니다. - 다시 얼음 추위에 셀을 일시 중지, 낮은 소금 및 1 mL 피 펫 팁, 발음 하 여 (단계 4.2)를 버퍼링 하 고 20 분 동안 얼음에 품 어.
참고:이 단계에 대 한 피 펫을 통해 부드럽게 발음 하는 게 중요 하다. - 30 위한 15000 × g에서 셀 작은 s 및 수집 각는 supernatants의 새로운 1.5 mL를 원심 관. 지금 시간 포인트 당 6 관 이어야 한다.
참고:는 상쾌한 포함 periplasmic 분수 와 펠 릿 포함는 막과 세포질 분수. 우리는 세포질 분수는 펠 릿을 참조 하십시오. - 표준 단계 9.6에서 곁에 뿐만 아니라 각 분수 (6 시간 마다), 튜브에서에서 방사능을 측정 합니다. 표준에 방사능의 금액을 사용 하 여 원래 모든 샘플에 추가 하는 방사능의 총 금액을 결정.
- periplasm에 방사성 통풍 관의 비율을 확인 하려면 다음 수식을 사용 하 여: (표준 periplasmic 분수/평균 cpm의 평균 cpm) x 100.
- 세포질에 방사성 통풍 관의 비율을 확인 하려면 다음 수식을 사용 하 여: (표준의 세포질 분수/평균 cpm의 평균 cpm) x 100.
- % 총 글귀를 확인 하려면 다음 식을 사용 하 여: ((periplasmic 분수 + 해당 세포질 분수의 평균 cpm의 평균 노출 당 비용) / (평균 기준의 cpm)) x 100.
결과
SDS 페이지 젤, 젤 여과 chromatograms 대리점 periplasm 분류에서 단백질 정화의 품질을 평가 하기 위해 수집 되었다. YfeA 이전 되었습니다 홀로의 정화 설명16; 그러나, apo YfeA의 정화 되지 보고 되었습니다. Apo YfeA이이 방법에 의해 설명 된 정화 전략 특히 한 단백질 immunoblot (즉, 그의 태그), 및 단일 클론 항 체 사용 될 수 있는 어떤 종류의 선호도 태그를 포함 하지 않는 재조합 야생 타입 생성자를 사용 하 여 그 YfeA 설명 되지 않은 인식 합니다. 따라서, 질량 분석 분석 YfeA의 정화를 확인 하기 위해 이용 되었다. 분별 하 여 YfeA를 정화, 음이온 교환 크로마토그래피 (그림 1)에 대 한 차입 선형 그라디언트를 사용 하는 것이 좋습니다. 선형 차입 그라데이션에는 YfeA 농축을 densitometry (그림 1C)에 의해 계산 된 음이온 교환 제품의 49%는 periplasm 분수의 약 8%에서 크게 향상 됩니다. 이 구성 젤 여과, 61%로 향상 됩니다 그리고 아 포 단백질의 차입 볼륨은 홀로 단백질 (그림 2)의 차입 볼륨에 동일. 질량 분석 분석 YfeA 아미노산 시퀀스, 246 총 YfeA polypeptide 스펙트럼, 24 고유 펩 티 드, 그리고 50 고유 polypeptide 스펙트럼의 92.5%의 검색을 통해 YfeA의 정화를 확인합니다. 또는 선형 그라데이션 제품 단계 그라데이션 차입에서 제품을 대조 하기 위해 YfeA 250 mm NaCl (그림 1D)는 차입으로 50 m m NaCl 뒤의 세척 단계를 사용 하 여 음이온 교환에 의해 순화 되었다. 단계 그라데이션 소폭 densitometry에 의해 계산한 음이온 교환 제품의 18%는 periplasm 분수의 17%를 구성에서 YfeA을 풍요롭게. 단계 그라데이션 차입도를 풍요롭게 단백질 오염 물질 밴드 포함 하는 유사한 분자량의 여러 대장균 SBPs로 식별 하는 질량 분석. HiLoad 26/600 Superdex 200 페이지, 분자 무게와 오염 SBPs의 구조에서 유사성의 해상도 제한으로 인해 젤 여과 marginally 젤 여과 제품의 20 %YfeA 농축 향상. 선형 차입 그라데이션 해야 음이온 교환에 대 한 달성, 이러한 오염 물질을 제거 하는 데 필요한 NaCl의 농도 식별 하기 위해 25-50 m m NaCl 단위로 여러 단계 세척을 탐구 하는 것이 좋습니다.
순화 apo와 홀로 YfeA apo와 홀로 YfeA 크리스탈 형태학의 이미지 차이 결정 성장에서 포 홀로 YfeA 상태 (그림 3)을 표시 하지만 같은 결정 화 조건에 구체화. 질량 분석 확인, 뿐만 아니라 x 선 회절 데이터 (표시 되지 않음)이이 방법에 의해 순화 하는 단백질에서 성장 하는 결정에서 수집 정화와 YfeA의 결정을 확인 했다. 구획 오염 (세포질 아연 홀로 단백질을 periplasm 분수에 apo 되돌리기)의 x 선 형광 스펙트럼 (그림 4)를 포착 하 여 평가 될 수 있습니다. X 선 형광 스펙트럼 홀로 YfeA (그림 4A), 십자가 표시와 알맞은 강한 아연 신호를 포함 하는 YfeA 샘플 사이 급속 하 게 분화 할 수 있다 아연은 재조합 YfeA16에 바인딩된 기본 기판, 오염, 또는 apo YfeA와 최소한의 교차 오염 (그림 4B)의 암시 약한 아연 신호. M9 최소한의 미디어의 ICP MS 분석 전이 금속 수준 확인 하위 micromolar 범위 (표시 되지 않음); 따라서, 최소한의 양의 전이 금속의 성공적인 분류에 따라 예상 되어야 한다. 분석 분류 (그림 5)는 radiometal 전송 속도 측정 기능 데이터 캡처를 사용할 수 있습니다. 스냅샷, 전체 YfeABCDE 운송업 자 및 YfeABCDE 구성 요소 중 아무도 periplasmic 및 세포질 분수 대장균 세포 표현 YfeA의 비교 계시는 단일 재조합 단백질을 표현 하는의 결과 60 분 또는 금속 통풍 관 (그림 6)에 복잡 한 단백질. 대장균 세포 표현 아니 재조합 단백질 수송 약 52는 periplasm에 최소한의 유지와 세포질을 미디어에 추가 하는 미네소타의 절반. 이 부정적인 제어 생 망간 전송을 나타냅니다. 대장균 세포 표현 재조합 YfeA 약 52만 다른 분기는 periplasm에 보관 세포질을 미디어에 추가 분기 수송. 망간 보존 periplasm 및 세포질에 제한 된 전송에서 대사 수요 병목 Yfe 전송의 부재에서 YfeA를 생산 하 여 부과 보여 줍니다. 대장균 세포 표현 재조합 YfeABCDE 전송 수송 52는 periplasm에 최소한의 유지와 세포질을 미디어에 추가 하는 미네소타의 거의 100%. 세포질에 증강된 망간 전송 망간 전송에서 Yfe 전송의 기여도를 보여 줍니다.

그림 1입니다. 분류에 의해 YfeA의 정화. A. Yfe 전송에 대 한 가상 모델. B. periplasm 분수, 음이온 교환에서 선형 그라데이션 차입을 사용 하 여에서 YfeA 정화의 SDS 페이지 젤. SDS 페이지 젤 보여준다 YfeA의 농축 (30 kDa) 정화 단계에 걸쳐. 검은색 화살표는 YfeA에 대 한 전기 이동 이동의 위치를 나타냅니다. 분자 무게 기준 오른쪽에 표시입니다. (1) periplasm 분수입니다. (2) Q 음이온 교환 통해 열 흐름. (3) Q 음이온 교환 열 피크 차입 (4) superdex 200 pg 젤 여과 열 피크. C. YfeA 농축-좋은 예. B 에서 SDS 페이지 젤의 이미지 처리 densitometry periplasmic 분수의 8%에서 61% 젤 여과 제품의 증가 의해 YfeA의 전반적인 풍부를 계산 합니다. 파란색 상자 densitometry 계산에 사용 되는 YfeA/총 신호를 나타냅니다. 레인 4에 박스형된 밴드의 질량 분석 분석 감지 259/280 YfeA 아미노산, 녹색 강조 표시. 아미노산 성숙한 polypeptide에 굵은 대문자 검정 텍스트로 표시 되 고 쪼개진된 신호 펩 티 드를 구성 하는 아미노산 기울임꼴 소문자 회색 텍스트로 표시 됩니다. D. YfeA 농축-나쁜 예. SDS 페이지 젤 periplasm 분수에서 YfeA 정화의 음이온 교환에서 단계 그라데이션 차입을 사용 하 여. SDS 페이지 젤 정화 단계에 걸쳐 YfeA의 농축을 보여줍니다. 검은색 화살표는 음이온 교환 크로마토그래피 중 향상 된 주요 단백질 오염 물질의 전기 이동 이동의 위치를 나타냅니다. 분자 무게 기준 오른쪽에 표시입니다. (1) superdex 200 pg 젤 여과 열 피크. (2) Q 음이온 교환 열 250 m m NaCl 단계 그라데이션 차입. (3) periplasm 분수입니다. SDS 페이지 젤 D 에서 이미지 처리 densitometry 젤 여과 제품의 20%의 최대에 의해 YfeA의 한계 전반적인 풍부를 계산합니다. 파란색 상자 densitometry 계산에 사용 되는 YfeA/총 신호를 나타냅니다. 질량 분석 분석은 레인에서 검은색 화살표로 표시 하는 밴드의 1 검색 LivJ의 26 독특한 펩 티 드 (39 kDa), 원동의 25 독특한 펩 티 드 (41 kDa), 및 LivK의 17 독특한 펩 티 드 (39 kDa). 모든 3 개의 오염 물질은 periplasmic 대장균 SBPs. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 2입니다. Apo YfeA와 홀로 YfeA 젤 여과 chromatograms. 검은색 화살표는 무효 볼륨의 위치를 나타냅니다. 젤 여과 apo YfeA (검은색 곡선)에 대 한 봉우리와 홀로 YfeA (파란색 곡선) 표시 두 단백질 같은 차입 볼륨을 나타내는 YfeA periplasm 분수에서 정화 하는 apo 비슷한 유체역학 반경 홀로 YfeA 총에서 정화로 elute 프랑스어 프레스 후 셀룰러 콘텐츠입니다.

그림 3입니다. Apo YfeA와 홀로 YfeA 크리스탈 형태학. 홀로 YfeA apo YfeA 일반적으로 동일한 결정 화 조건에 twinned 결정을 생성 하는 동안 단일 결정으로 결정 한다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 4입니다. Apo YfeA와 홀로 YfeA x 선 형광 스펙트럼. A. 홀로 아무 추가 전이 금속 보충, 녹색 곡선으로 M9 최소한의 미디어에서 정화 하는 YfeA의 x 선 형광 스펙트럼. 망간, 철, 아연에 대 한 독특한 봉우리 표시 됩니다. B. x 선 형광 스펙트럼 YfeA 샘플에서 YfeBCDE의 맥락에서 생산. 망간, 철, 아연에 대 한 독특한 봉우리 표시 됩니다. 파란 곡선입니다. YfeA YfeBCDE의 맥락과 세포질 전이 금속 홀로 YfeA 단백질의 최소한의 오염 periplasm 분수의 성공적인 분류에서 정화의 형광 스펙트럼 엑스레이 빨간 곡선. YfeA YfeBCDE의 맥락에서 과도 한 세포와 세포질 전이 금속 홀로 YfeA 단백질의 중요 한 오염에서 실패 한 분별과 정화의 형광 스펙트럼 엑스레이 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.

그림 5입니다. 분류에 대 한 워크플로 일반화. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
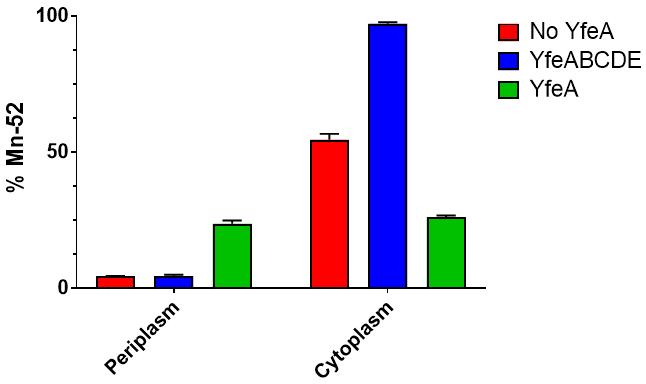
그림 6. 60 분 방사성 금속 통풍 관 분류 데이터. 각 실험 수행 세 번, 그리고 오차 막대는 표준 편차를 나타냅니다. 빨간 바. 대장균 세포 Yfe 전송기를 포함 하지 않는 60 분 후에는 52만 세포질으로의 약 50%를 수송 하 고 periplasmic 52Mn. 블루 바의 낮은 수준을 유지. 대장균 세포 Yfe 전송 전송 포함 된 >는 52만 60 후 세포질으로의 90% 분 고 periplasmic 52Mn. 녹색 막대의 낮은 수준을 유지. YfeA만을 포함 하는 대장균 세포는 52만 세포질으로의 약 25%를 수송 하 고 60 분 후 52Mn는 periplasm에서 25%를 유지.
이 작품에서는, 52만 사용 하는 radiometal (t1/2 = 5.59 d), 자연 Cr 대상에 양성자 사격에 의해 UAB 사이클 로트 론 시설 (버밍엄, 알)에서 생산 되었고 이전에 보고 된19로 정화. 주의: 52Mn은 양전자가 미터 (β+평균 242 = 케빈, 29.4%), 또한 강도 높은 여러 고 에너지 감마선을 방출 한다 (Eγ = 744.2, 935.5, 1434.0 케빈; 나 = 90.0%, 94.5%, 100%). 이러한 이유로, 실험 수행 되어야 합니다, ALARA의 방사선 보호 원칙에 따라 위에서 설명한 대로. 방사성 폐기물로 지정 하는 모든 항목이 적절 하 게 포함 한다 명확 하 게 표시 되며 설립된 절차에 따라 폐기.
토론
세포 분별 법 세포질 구획의 내용을 구체적으로 검색을 위한 유용한 도구 이며, 금속 원자와 같은 작은 분자는 물론 단백질 같은 고분자를 추출 하기 위한 유용한 도구가 될 수 있습니다. 그것은 그 세포 분류는 절대 기법 이며 혼합/물의 resuspension, 부 화 온도 및 보육 시간에 주의 하지 않고 경향이 오류가 있을 수 있습니다 지적 가치가 있다. 최소한의 액체로 세포에 따라서 무시할 수 분류 될 수 있습니다 불완전 한 혼합, 상 온에서 분별 두 막 세포질 내용, periplasmic 분수의 오염 결과의 급속 한 세포를 발생할 수 있습니다 및 연장된 보육 시간 또한 과도 한 세포에 따라서 분수 오염 발생할 수 있습니다. (내부 막 보존) 동안 효율적이 고 비교적 완전 한 외부 막 세포를 달성 하기 위한 합리적인 타협 당뇨 분별 버퍼에 얼음 20 분 부 화 이다. 또 다른 고려 사항은 떨고 또는 소용돌이 의해 가혹한 추출 추출 단백질 집계 되는 등의 품질을 손상 수 추출 방법입니다. 부드럽게와 같은 혼합 주걱, 반전 또는 피 펫 다운스트림 분석에 대 한 높은 품질의 재료를 유지 하 여 발음 하는 것이 좋습니다. 그림 1에 의해 입증으로 대리점 셀 분류에서 정화 가변 효율성 발생할 수 있습니다. 한 실험에서 YfeA의 추출된 periplasmic 콘텐츠 (그림 1C), 8%로 시작 하면서 또 다른 실험에서 YfeA periplasmic 콘텐츠 (그림 1D)의 17%로 시작. 이러한 차이의 반복된 사용 (추가 성장 매체에 EDTA Yfe 발기인의 모피 규제 등 기아 메커니즘에 의해 통제 하는 유전자의 표정을 증가 시킬 수 있습니다), 가변 식 조건 등 여러 가지 이유에서 발생할 수 있습니다 동결 영구 주식, 그리고 인간의 오류입니다. 보육 시간을 조정 하는 대신을 준비 하는 것이 좋습니다. Periplasm 분수에서 정화 음이온 교환 크로마 단계에서 선형 그라데이션 차입을 포함 하는 것이 좋습니다. 단계 그라데이션 차입은 차입 전략 모바일 단계 구성에서 사용 하는 개별 및 갑작스러운 변화 (즉., 0 mM NaCl, 50 mM NaCl, 150 mM NaCl, 등.). 선형 그라데이션 차입은 차입 전략 모바일에 점진적인 변화를 사용 하 여 (즉, 0 mM NaCl, 5 m m NaCl, 10 mM NaCl 등)구성 단계. 단계 기온 변화도 고정 단계에 대 한 다른 친 화력 있는 분자를 분리 하는 데 유용 하며 선형 그라데이션 차입 고정 단계에 대 한 비슷한 선호도가지고 분자 분리를 위한 유용 합니다. 태그로 없는 인공 정화 (고정 위상에 대 한 선호도 강화)에 독특한 단백질 종 풍부 셀 구획에서 단백질 정화의 경우 선형 그라데이션 차입 수 noninterest의 단백질을 분리 하는 것이 좋습니다. 관심사의 단백질으로 고정 단계를 비슷한 선호도 있다. 일반적으로, 순화 apo YfeA의 1-2 mg의 수확량의 내 생에서 YfeA을 표현 하는 문화의 각 리터에서 예상 된다 Y. pestis 발기인.
X 선 형광 하 신속 하 게 결정 샘플, 금속 콘텐츠 조사 것 그렇지 않으면 알 수 없는 예기치 않은 금속 관에 대 한 조사를 수 있도록 하는 기술입니다. EDTA는 느슨하게 연결 된 또는 자유 금속을 제거 하 고 분별 버퍼에 포함 된, 있지만 YfeA periplasm 분수에서 파생 된 일부 홀로 단백질을 포함할 수 있습니다. 금속 전송 동적 프로세스는, 아마도 홀로 단백질 콘텐츠는 여전히 기증 하지 YfeBCDE에 그것의 화물 YfeA에서 유래. 그것은 x-선 형광만 총 금속 콘텐츠를 측정 하는 금속 결정 격자에 정렬 또는 특히 단백질에 바인딩된 경우 나타내지 않습니다. 금속 결정 격자에 정렬 및 특히 단백질 분자를 바인딩할 경우를 확인 하려면 x 선 산란 데이터 수집 및 처리는 필요 합니다. 그럼에도 불구 하 고, x 선 형광 금속 오염 잔류 홀로 단백질 통합의 빠른 샘플 평가 할 수 있습니다. 싱크 로트 론 방사선 시간이 제한 됩니다 그리고 아니라 항상 모든 샘플에 x 선 산란 데이터 수집에 대 한 전략을 고안 하는 시간, 따라서 x 선 형광은 많은 결정을 검사 및 엑스레이 샘플에 대 한 우선 순위에 대 한 귀중 한 기술 분산 데이터를 수집 해야 합니다. 또한, x 선 형광 x-레이 diffract 하지 않을 수 있습니다 샘플에서 데이터 컬렉션을 수 있습니다. X 선 형광 데이터를 수집 하는 동안 때때로 신호 수 매우 약한 고 결과 스펙트럼 정보. 신호, x 선 형광 또는 미친 검색을 개선 하기 위해 노출 시간을 증가 또는 감소 하는 x 선 빔 감쇠를 고려 하십시오. 샘플 x 선 분산 데이터 수집을 식별 하면 것이 좋습니다 보다는 x 선 형광 및 미친 방사선 피해를 최소화, 데이터의 품질을 향상 검색 샘플의 다른 부분에 x 선 산란 데이터를 수집 하 컬렉션, 비정상적인 신호 감소에 대 한 가능성을 최소화 하는 고.
방사선 추적기의 탐지 nanomolar 수량 자료의 또는, 요구 하 고 분자 추적 요원으로 이러한 추적기를 사용 하 여 세포질 과정의 간단 하 고 매우 중요 한 메서드를 제공 합니다. 위에서 설명한 radiometal 분석 결과 총 금속 통풍 관, 세포질 구획으로 통풍 관의 속도 분포를 결정 하기 위해 사용할 수 있습니다. 실제로, 각 데이터 시간 포인트 필요 합니다 40 분 분류를; 그러나, 각 시간 지점에 도달 하면 세포는 즉시 수송과 고 높은 소금 버퍼 (그림 5단계 1)에서 알을 품을. (그림 53 단계) 후, 폐기 높은 소금 버퍼 (그림 51 단계), 언론과 periplasmic 및 세포질 분수의 Radiometal 측정 표시 높은 소금 버퍼 외피는 성공적으로 모두 제거 남은 시간 포인트 도달 후 초기 원심 분리에 따라 서 성 되지 않은 무료 금속. 또한 추가 나머지 연결 되지 않은 무료 금속을 제거 하는 높은 소금 버퍼에 부 화 후 초기 원심 분리는 연결 되지 않은 무료, 금속과 원심 분리의 대부분 (80%까지)를 제거 합니다. 어떤 느린 연결 되지 않은 무료 금속 하지 크게 금속 전송 40 분 분류 하는 동안 영향을 미칠 전망 이다. 세포내 금속 전송에 40 분 분별의 영향 신중한 데이터 해석에 대 한 또 다른 고려 사항은 이다. 사실상 전체 분류 프로토콜 얼음, 단계 사이 30 초 원심 분리를 제외 하 고 발생합니다. 전송 시간 과정 실험 그 금속 전송20,,2122; 되어있는 셀 4 ° C에서 유지 표명 금속 따라서, 실험 얼음 때문에, 40 분 분류는 하지 크게 세포질의 periplasm 금속 수준의 증대와 금속 수준의 셀 했다 시간 점의 대표 될 것으로 예상 된다 처음 centrifugalized.
다른 세포질 격실에서 상대 통풍 관의 결정은 뿐만 아니라 더 메커니즘의 분자 정보를 조사 하는 탐정을 활성화 XFS 데이터, 기판의 생리 적 특성을 확실 하 게 도움이 수 있습니다. 예를 들어 radiometal 통풍 관 실험 유전 mutagenesis의 추가 제공 키 기능 잔류물을 강화 하는 직접적인 방법 또는 분자에 관여 기판 전송. Radiometal 통풍 관 실험 및 분석의 장점은 신속한 처리, 높은 처리량, 높은 재현성 및 성장 조건과 유전적 구조를 비교 하는 실험의 병렬화를 포함 합니다.
공개
저자는 그들은 충돌의 관심을가지고 선언.
감사의 말
데이터 전체 또는 부분 국립 암 연구소 (ACB-12002)과 국립 연구소의 종합 의료 과학 (AGM-12006)에서 연방 자금 자금 하고있다 GM/CA@APS에서 또한 수집 했다. 이 연구 자원 고급 광자 소스 (AP)의 사용, 계약 번호 아래 Argonne 국립 연구소에 의해 과학의 암컷 사무실에는 미국 부서의 에너지 (도우) 사무실의 과학 사용자 시설 운영 드-AC02-06CH11357입니다. 고급 광자 소스 사용 에너지의 미국 학과, 과학의 사무실, 사무실의 기본적인 에너지 과학, 계약 번호 아래에 의해 지원 되었다 W-31-109-잉글랜드-38.
우리는 질량 분석 분석에 그들의 지원에 대 한 인정 UAB 종합 암 센터-질량 분석/Proteomics 공유 시설 (P30CA13148-38) 싶습니다.
C.D.R.는 버밍엄 사무실의 다양성, 자본과 포함에서 알라바 마의 대학에서 교부 금에 의해 지원 되었다. L.L.R.는 버밍엄에서 알라바 마의 대학 방사선학 부에 의해 지원 되었다. 과학, 에너지의 동위 원소 프로그램 지원 52만 생산 하 고 아래 A.V.F.M. DESC0015773를 부여 합니다.
자료
| Name | Company | Catalog Number | Comments |
| Chemicals | |||
| Polyethylene glycol 4000, EMD Millipore | Fisher | M1097270100 | |
| Ampicillin Sodium Salt (Crystalline Powder) | Fisher | BP1760-5 | |
| AMRESCO M9 Medium Broth | Fisher | NC9688886 | |
| Bis-Tris, Fisher BioReagents | Fisher | BP301-100 | |
| Calcium Chloride Dihydrate (Certified ACS) | Fisher | C79-500 | |
| Dextrose (D-Glucose) Anhydrous (Granular Powder/Certified ACS) | Fisher | D16-500 | |
| Ethylenediaminetetraacetic Acid, Disodium Salt Dihydrate (Crystalline/Certified ACS) | Fisher | S311-100 | |
| Fisher BioReagents Microbiology Media: LB Broth, Miller | Fisher | BP1426-500 | |
| Magnesium Sulfate Heptahydrate (Crystalline/Certified ACS) | Fisher | M63-500 | |
| Sodium Azide, White Powder | Fisher | BP922I-500 | |
| Sodium Chloride (Crystalline/Certified ACS) | Fisher | S271-500 | |
| Sodium Phosphate Dibasic Anhydrous (Granular or Powder/Certified ACS) | Fisher | S374-500 | |
| Tris Hydrochloride (Small White Flakes/Molecular Biology) | Fisher | BP153-500 | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| Cryschem Plate | Hampton | HR3-158 | |
| EMD Millipore Amicon Ultra-15 Centrifugal Filter Units | Fisher | UFC903024 | |
| EMD Millipore Millex Sterile Syringe Filters: Durapore PVFD Membrane | Fisher | SLHV013SL | |
| GE Healthcare HiLoad 26/600 Superdex 200 pg | Fisher | 28-9893-36 | |
| GE Healthcare HiTrap IEX HP Prepacked Columns | Fisher | 17-1154-01 | |
| Name | Company | Catalog Number | Comments |
| Cells | |||
| Agilent Technologies BL21-CODON PLUS RIPL CELLS | Fisher | 230280 |
참고문헌
- ter Beek, J., Guskov, A., Slotboom, D. J. Structural diversity of ABC transporters. J Gen Physiol. 143 (4), 419-435 (2014).
- Berntsson, R. P., Smits, S. H., Schmitt, L., Slotboom, D. J., Poolman, B. A structural classification of substrate-binding proteins. FEBS Lett. 584 (12), 2606-2617 (2010).
- Mao, B., Pear, M. R., McCammon, J. A., Quiocho, F. A. Hinge-bending in L-arabinose-binding protein. The "Venus's-flytrap" model. J Biol Chem. 257 (3), 1131-1133 (1982).
- Hoeppner, A., et al. Proteins and Their Ligands: Their Importance and How to Crystallize Them. Advanced Topics on Crystal Growth. , InTech. Rijeka, Croatia. (2013).
- Lee, Y. H., et al. The crystal structure of Zn(II)-free Treponema pallidum TroA, a periplasmic metal-binding protein, reveals a closed conformation. J Bacteriol. 184 (8), 2300-2304 (2002).
- Wei, B., Randich, A. M., Bhattacharyya-Pakrasi, M., Pakrasi, H. B., Smith, T. J. Possible regulatory role for the histidine-rich loop in the zinc transport protein, ZnuA. Biochemistry. 46 (30), 8734-8743 (2007).
- Yatsunyk, L. A., et al. Structure and metal binding properties of ZnuA, a periplasmic zinc transporter from Escherichia coli. J Biol Inorg Chem. 13 (2), 271-288 (2008).
- McDevitt, C. A., et al. A molecular mechanism for bacterial susceptibility to zinc. PLoS Pathog. 7 (11), e1002357(2011).
- Couñago, R. M., et al. Imperfect coordination chemistry facilitates metal ion release in the Psa permease. Nat Chem Biol. 10 (1), 35-41 (2014).
- Abate, F., et al. Apo, Zn2+-bound and Mn2+-bound structures reveal ligand-binding properties of SitA from the pathogen Staphylococcus pseudintermedius. Biosci Rep. 34 (6), e00154(2014).
- Ahuja, S., et al. Structural analysis of bacterial ABC transporter inhibition by an antibody fragment. Structure. 23 (4), 713-723 (2015).
- Alberts, B., et al. Fractionation of Cells. Molecular Biology of the Cell. , 4th edition, Garland Science. New York, NY. (2002).
- Zhao, H., Martinis, S. A. Isolation of bacterial compartments to track movement of protein synthesis factors. Methods. 113, 120-126 (2017).
- Brown, R. B., Audet, J. Current techniques for single-cell lysis. J R Soc Interface. 5, S131-S138 (2008).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods Enzymol. 326, 245-254 (2000).
- Radka, C. D., et al. Crystal structure of Yersinia pestis virulence factor YfeA reveals two polyspecific metal-binding sites. Acta Crystallogr D Struct Biol. 73 (7), 557-572 (2017).
- Elgundi, Z., Sifniotis, V., Reslan, M., Cruz, E., Kayser, V. Laboratory Scale Production and Purification of a Therapeutic Antibody. J Vis Exp. (119), e55153(2017).
- Gasteiger, E., et al. Protein Identification and Analysis Tools on the ExPASy Server. The Proteomics Protocols Handbook. Walker, J. N. , Humana Press. 571-607 (2005).
- Wooten, A. L., Aweda, T. A., Lewis, B. C., Gross, R. B., Lapi, S. E. Biodistribution and PET Imaging of pharmacokinetics of manganese in mice using Manganese-52. PLoS One. 12 (3), e0174351(2017).
- Inman, R. S., Wessling-Resnick, M. Characterization of transferrin-independent iron transport in K562 cells. Unique properties provide evidence for multiple pathways of iron uptake. J Biol Chem. 268 (12), 8521-8528 (1993).
- Makui, H., et al. Identification of the Escherichia coli K-12 Nramp orthologue (MntH) as a selective divalent metal ion transporter. Mol Microbiol. 35 (5), 1065-1078 (2000).
- Forbes, J. R., Gros, P. Iron, manganese, and cobalt transport by Nramp1 (Slc11a1) and Nramp2 (Slc11a2) expressed at the plasma membrane. Blood. 102 (5), 1884-1892 (2003).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유