Method Article
생체 외에서 타우 단백질 및 마약 검사의 집계를 공부에 대 한 분석 결과
요약
이 원고에 설명 된 타우 집계 분석 결과 vivo에서 타우 misfolding 및 집계의 예상된 기능을 모방 합니다.
초록
타우 단백질의 집계와 쌍을 이루는 나선형 필 라 멘 트의 형성은 Alzheimer의 질병 그리고 다른 tauopathies의 특징. 신경 퇴행 성 질환과 관련 된 다른 단백질에 비해, 타우 단백질에 대 한 보고 체 외에서 집계 속도 덜 일관 된 상대적으로 높은 가변성을 제시. 여기는 생체 외에서 집계 분석 결과 타우 misfolding 및 집계 비보와 관련 된 예상된 단계 개발에 설명 합니다. 분석 결과 N 맨끝 산 성 삽입 뿐만 아니라 4 개의 microtubule 바인딩 도메인 (MBD)는 긴 타우 isoform (huTau441)를 사용 합니다. 생체 외에서 집계는 덤플링의 추가 의해 트리거되는 96 잘 microplate 형식에서 thioflavin T 형광 지속적으로 선행 하 고. 타우 집계 분석 결과 매우 다른 우물, 실험 실행 및 단백질의 일괄 처리 사이 재현 이다. 집계 리드 타우 PHF 같은 형태학 시드 드 노 보 원 구조의 형성에 매우 효율적입니다. 타우 misfolding 및 집계의 기계 장치를 공부 하 고 응용 프로그램 뿐만 아니라 현재 분석 결과 심사 약물의 병 인을 방해할 수 있는 강력한 도구입니다.
서문
Alzheimer의 질병은 histopathologically 집계 된 아 밀 로이드 베타1 의 세포 외 치 플 라크의 축적에 의해 정의 된 치명적인 신경 퇴행 성 장애 및 포함 하는 세포내 neurofibrillary tangles 집계 hyperphosphorylated 타우 단백질2. 생리 타우 단위체 이며 6 독특한 isoforms를 포함 하는 0-2로 제시 N 터미널 삽입 및 3 또는 4 microtubule 바인딩 도메인3,4 평균 2-3 phosphorylations의 양자 택일 접합에서 발생. Hyperphosphorylation, misfolding 및 fibrillary 구조로 자체 집계 미친된 개인5,6병 적 평가로 타우 pathogenesis의 핵심 요소를 구성 하는 믿 었 다.
광고 뿐만 아니라 frontotemporal lobar 변성 (FTLD), 선택의 질병, 진보적인 supranuclear 마비 (PSP), fronto 일시적인 치 매 (FTD) 및 주를 포함 하 여 다른 tauopathies 집계 neurofibrillary 타우 tangles 특징은 나이 관련 된 tauopathy (부)2. 생 화 확 적인 관점에서 광고와 관련 된 병 적인 과정에 빛을 발산 수 타우 misfolding 및 집계의 메커니즘을 이해 하 고 다른 tauopathies. 과학적 측면 뿐만 아니라 강력한 생체 외에서 집계 분석 실험 약물 후보7,8,,910의 심사에 대 한 귀중 한 도구입니다. 타우의 aggregation nucleation 의존 중 합 프로세스 (NDP)11,12,,1314다음 믿어진다. 신 민 당 활동 자형 이며 빠른 정력적으로 내리막 집계 과정 뒤에 정력적으로 형편이 나쁜 nucleation 단계 시작.
다른 amyloidogenic 단백질, 프리온 단백질, 녹말 체 beta와 α-synuclein를 포함 하 여 달리 타우 자발적으로 생리 적인 조건 하에서 집계 되지 않습니다 그리고 심지어 극단적인 pHs 또는 높은 온도 비 집계15에 대 한 대조. 이것은 대부분의 아마 타우 집계 인터페이스에 hydrophylic 상호 작용입니다. 그러나, 타우 집계 효율적으로 생리 적인 농도에서 헤 파 린16 등 다른 polyanions17,18 inducers를 사용 하는 경우.
타우 집계 분석 생체 외에서 설정 하는 이전 노력 타우 misfolding 및 집계, 세부 사항에 도움이 되 거 있다 하지만 그들은 무슨 vivo에서 타우 집계 활동 여겨진다 흉내 낸의 짧은. 대부분의 경우, 타우 집계 활동 타우 nucleation와 관련 된 초기 지연 위상을 부족 했다. 이 결과 매우 높은 타우 단백질 농도 사용 하 여 집계 시작 타우 단백질 준비에서의 존재 및/또는 더 많은 생리 적 전체 길이 타우 보다 훨씬 더 높은 집계 성향으로 타우 조각의 사용 되었을 수 있습니다. 단백질19,20,21,,2223. 또한, 이전 연구는 재현성 및 타우 집계 활동의 견고성 측면을 해결 하지 않았다.
여기, 우리는 강력한 생체 외에서 타우 집계 분석 결과 해당 하는 지 수 성장 단계 다음 타우 nucleation 초기 지연 위상 nucleation 종속 합의 주요 특성을 모방을 설명 합니다. 또한, 생성 된 재조합 타우 집계 자연에서 원 고 매우 높은 시드 힘. 분석 결과 또한 타우 배치 사이 높은 재현성 이며 집계 억제제에 대 한 화면에 유용한 도구를 나타냅니다.
프로토콜
1. 시 약 준비
-
반응 버퍼
- 반응 버퍼 준비: 0.5 m m PBS, pH 6.7 TCEP 건조 분말을 용 해 하 여에 한 TCEP (MW = 286.65 g/mol) PBSstock 솔루션, pH 7.4에에서.
참고: TCEP의 존재 때문에 집계 연구 시스테인을 포함 하는 야생 타입 타우 단백질을 사용 하 여 브리지 이다. 현재 프로토콜에서 TCEP 6.7 7.4에서 PBS의 pH 조정에 사용 되 고 어떤 산화 환 원 반응 조절에 역할을 재생 합니다. - 철저 하 게 혼합 하 고 메 마른 0.22 μ m 기 공 크기 PES 멤브레인 필터를 통해 솔루션을 필터링 합니다.
- 약 수 그리고-80 ˚C에 게입니다.
- 벤치에 thaw 하 고 사용 하기 전에 RT에서 안정.
- 반응 버퍼 준비: 0.5 m m PBS, pH 6.7 TCEP 건조 분말을 용 해 하 여에 한 TCEP (MW = 286.65 g/mol) PBSstock 솔루션, pH 7.4에에서.
-
huTau441
- (자세한 단백질 표정과 정화 참조 Apetri 그 외 여러분 huTau441 제거 24)-80 ˚C 냉장고에서.
- 벤치에 thaw 하 고 실내 온도 (RT) equilibrate.
- 12000 x g 20-25 ˚C 공기 방울을 제거에 5 분의 단백질 재고와 튜브를 회전 합니다.
- 280에서 huTau441by 흡수의 농도 측정 nm 0.31 mL mg-1c m-1 의 소 광 계수를 사용 하 여
-
Thioflavin T
- 10mg ThT 건조 분말을 용 해 하 여 500 μ M thioflavin T (ThT) 재고 솔루션을 준비 (MW = 318.86 g/mol) 35 mL 반응 버퍼에.
- 철저 하 게, 소용돌이 3 번 최대 속도에서 20 초 동안 혼합 하 고 메 마른 0.22 μ m 기 공 크기 PES 멤브레인 필터를 통해 솔루션을 필터링.
- 411에서 흡수 측정 하 여 농도 결정 nm 22000 M-1 c m-1 의 소 광 계수를 사용 하 여 500 μ M ThT 농도 조정 하 고. 빛에서 보호 하는 RT에 저장 합니다. 2 개월 마다 준비 신선한.
-
헤 파 린
- HMW 덤플링 건조 분말의 1 mg를 용 해 하 여 신선한 55 μ M 덤플링을 솔루션 준비 (MW = 17-19 kDa) 1 mL 반응 buffer 실시간
- 적극적으로 악수 하 고 소용돌이 2 5 초 동안 시간.
- 살 균 0.20 μ m 기 공 크기 PES 멤브레인 필터 (주사기)를 통해 솔루션을 필터링 합니다.
2. 연속 모드 ThT 집계 분석 결과 다중 모드 Microplate 리더
참고: ThT 염료 연속 모드 (자동 측정) huTau441 집계 활동 모니터링에 대 한 반응에 추가 됩니다. 비록 반응 일반 fluorometer에 의해 지켜질 수 있다 기존의 cuvette을 사용 하 여 작업의 수동 자연 제한 측정 주파수 및 기록 된 운동 곡선의 정확도 손상. 이러한 이유로 자동 멀티 모드 microplate 리더 사용 됩니다.
-
악기 설정
- 컴퓨터와 다중 모드 microplate 리더를 켭니다. 10 분 동안 안정화 장비 하자.
- 소프트웨어를 시작 하 고 준비 하는 프로토콜.
- 프로토콜 종류 선택: 표준 프로토콜 (데이터 축소 수행 하지 독립적으로 각 접시).
- 37 ˚C에서 온도 설정 하 고 프로토콜을 계속 하기 전에 preheatment를 선택 합니다.
- 운동 실행 설정: 실행 시간 50 h / 측정 간격: 15 분.
- 연속 모드에서 425 cpm (3mm)에 떨고 궤도 설정 합니다.
- 읽기 방법 선택: 형광 강도 끝점/운동-Monochromators 파장: 여기 440 nm (20 nm 대역폭) / 방출 485 nm (20 nm 대역폭)-광학 위치: 탑-정상 읽기 속도-읽기 높이: 4.50 m m
- 만든된 프로토콜을 사용 하 여 실행을 시작 합니다. 실험의 이름을 새로 만든된 파일의 대상을 선택 하 고 원하는 온도를 사전 equilibrate 악기를 허용.
-
자발적인 huTau441 변환
- 1.5 mL 튜브에 반응 샘플을 준비 합니다. 반응 및 4 복제 사용 200 μ 믹스 (4에 대 한 반응 볼륨 복제 800 μ =).
- 800 μ 반응 샘플 (4 복제)의 경우 15 μ M huTau441, 8 μ M 헤 파 린 및 50 μ M 준비 ThT. 단백질 반응 버퍼와 혼합 하 여 시작 덤플링을 ThT을 추가 하 고 5 번 위아래로 pipetting으로 잘 혼합. 시 추가 대 한 표시 순서를 존중 합니다.
- 12000 x g, 공기 방울을 제거 하기 위해 5 분 동안 25 ˚C에서 샘플을 회전 합니다.
- 200 μ 당 96 잘 microplates에 잘 반응 샘플의 분배 (96-잘 블랙 솔리드 microplate, 잘-볼륨 360 μ, 편평한 바닥). 기포의 형성을 하지 마십시오.
- 증발을 피하기 위해 microplate 인감.
- 멀티 모드 microplate 리더에 미 판 놓고 측정을 시작 합니다.
- 실험의 완료 후 장비에서 플레이트를 제거 하 고 데이터 처리 소프트웨어를 데이터를 내보냅니다.
-
변환, 씨앗 수집 및 저장의 품질 확인 합니다.
- 접시에서는 마감재를 제거 하 고 1.5 mL 튜브에 다른 복제 수영장. 그것을 수집 하기 전에 2 번 아래로 pipetting으로 우물에서 집계 샘플 혼합 잘. 집계 우물의 바닥에 예금 해 경향이 있다.
- 믹스 철저 하 게에 1.5 mL 튜브 5 번 위아래로 pipetting으로 분배 (대 한 자세한 내용은 참조 Apetri 외. AFM에 의해 집계를 분석 하기 위한 운 모 표면에 10-20 μ 24)입니다.
- 1 시간 동안에 x g와 4 ˚C 20000 1.5 mL 튜브를 회전 하 여 집계를 수확. 집계는 펠 릿을 형성합니다.
- 분리 하 고 상쾌한 S-MALS 성공적인 변환 (자세한 내용은 참조 Apetri 그 외 여러분 에 대 한 집계를 나타내는 샘플에서 단위체의 부재를 확인 하 여 분석 24)입니다.
- 레이블을 나타내는 초기 huTau441 단백질 농도 및 샘플 볼륨 나머지 집계 (펠 릿)를 포함 하는 1.5 mL 튜브. 스냅 집계를 동결 하 고-80 ˚C에 저장 합니다.
-
시드 반응
- HuTau441 집계-80 ˚C 냉동 고에서 제거 합니다. 반응 버퍼의 볼륨 레이블 (초기 샘플 볼륨)에 표시 된 고 8 번 5 위아래로 pipetting으로 집계 실시간 Resuspend을 안정화 하는 튜브를 추가 합니다.
- 집계 샘플 sonicate 200 μ 샘플 (15 μ M huTau441), 1/8"microtip을 사용 하 여 얼음에 sonicate (100 μ에서 최대 10 mL) 15의 전체 기간에 대 한 s 1의 펄스와 2의 일시 중지를 사용 하 여 s 30% 진폭 (sonicator 250 와트)에서. 다시 실시간 샘플 equilibrate
참고: 고용된 쥡니다 조건 20-50 nm24의 길이와 타우 소의 균질 인구 이어질. - 1.5 mL 튜브에 반응 샘플을 준비 합니다. 반응 및 4 복제 사용 200 μ 믹스 (4에 대 한 반응 볼륨 복제 800 μ =).
- 15 μ M huTau441, 8 μ M 헤 파 린 및 50 μ M를 포함 800 μ 반응 샘플 준비 ThT. 단백질 반응 버퍼와 혼합 하 여 시작 덤플링을 ThT을 추가 하 고 5 번 위아래로 pipetting으로 잘 혼합. 시 추가 대 한 표시 순서를 존중 합니다.
- 12000 x g, 공기 방울을 제거 하기 위해 5 분 동안 25 ˚C에서 샘플을 회전 합니다.
- 200 μ 당 96 잘 (96-잘 블랙 솔리드 microplate, 잘-볼륨 360 μ, 편평한 바닥)에 잘 반응 샘플의 분배. 기포의 형성을 하지 마십시오.
- 균질 철저 하 게 미리 형성한 fibril 샘플 반복 의해 위아래로 pipetting (5 회) 고 각 잘 금액 씨앗의 원하는 비율에 추가 합니다. 200 μ 잘 총 볼륨에 대 한 미리 형성한 씨앗 추가의 2 μ 1% (v/v)입니다. 믹스를 위아래로 pipetting으로 3 우물에 추가할 때 시간 및 기포의 형성을 방지.
- 증발을 피하기 위해 microplate 인감.
- 멀티 모드 microplate 리더에 미 판 놓고 측정을 시작 합니다.
- 장비에서 플레이트를 제거 하 고 데이터를 스프레드시트로 내보내기.
결과
재조합 huTau44124설명 포함 하는 C291A 및 C322A 돌연변이 그의 C-터미널 C-태그 표현 되었고 이전 정화의 N 맨끝. HuTau441 배치는 SDS 페이지와 거의 100 %S-MALS (그림 1)에 의해 평가 단위체에 시각으로 매우 순수. 15 µ M huTau441의 집계 8 µ M HMW 덤플링의 추가 의해 유도 되었다 고 반응 계속 ThT 형광 다중 모드 microplate 리더를 사용 하 여 뒤를 이었다. 여기 파장은 440 nm (대역폭 20 nm) 방출 485에서 측정 했다 반면 nm (대역폭 20 nm). 분석 결과 거의 구별할 (그림 2A) 되 고 10 개인 우물에서 결과 함께 매우 재현. ThT 긍정적인 huTau441 집계의 형태학은 50 시간 후 AFM에 의해 평가 됐다. 집계 hutau441 보고 비보 전 형태학 (그림 2B)와 비슷한 다른 길이의 원 구조의 균질 혼합물 이다. 또한, 최종 반응 혼합물 S MALS 측정 (그림 2C)에서 같이 집계에 전체 변환을 제안 하는 모노 머를 포함 하지 않습니다. HuTau441 집계에서 독립적인 실험 실행의 활동 유사한 자형 커브와 분간 지연 및 성장 단계 (그림 3)에 의해 강조 매우 비슷합니다. 단백질의 다른 배치를 사용 하는 경우 재현성의 높은 수준 유지 됩니다 (그림 4). 또한, 미리 형성한 huTau441 집계는 타우 단위체를 보충 하 고 유도 하는 데 노 보 타우의 형성에 매우 효율적. 미리 형성한 타우 집계 0.0025% (v/v)의 낮은 양의 nucleation 및 트리거 드 노 보 소 (그림 5)의 생성을 무시할 수 있다.
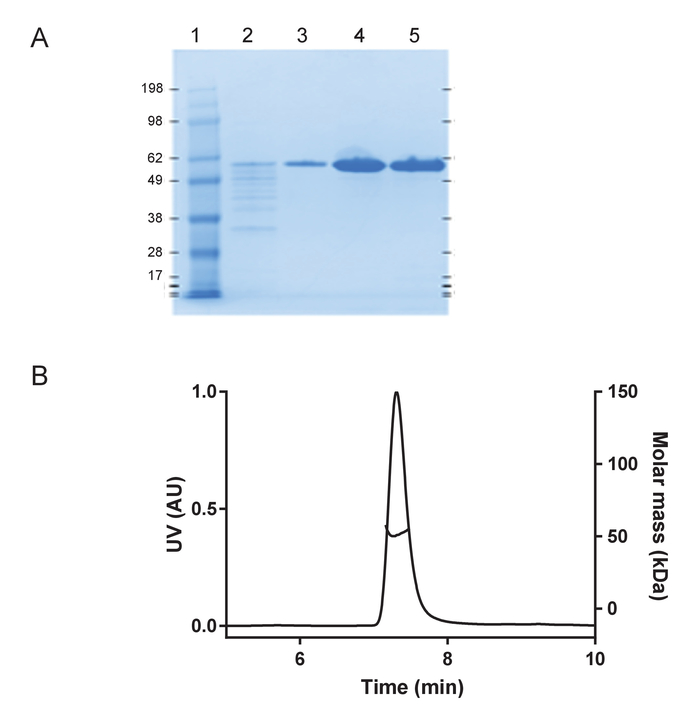
그림 1: 재조합 huTau441는 단위체와 매우 순수. 분자량 표준 단백질 사다리 (kDA)를 포함 하 여 4-12 %SDS 페이지 젤에 조건을 변성 시키기 아래 A) 순수성 평가 (레인 1); 마지막 C 태그 선호도 정화 단계 (레인 2);에서 통과 열 세척 분수 (3 차선), huTau441 단백질 피크 (4 차선) 전에 eluted 고 버퍼 후 교환 (5 레인), 각각). B) S-MALS는 huTau441의 분석. 단백질 > 99.9% 단위체 51 kDa의 분자량으로 표시 하 고 집계 또는 조각을 포함 하지 않습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
그림 2: 재조합 huTau441의 높은 재현성 이며 원 구조를 양적 리드. A) 헤 파 린의 활동 유도 huTau441 집계 ThT 형광에 의해 96 잘 microplate 형태로 지속적으로 모니터링 한다. HuTau441 및 헤 파 린 농도 각각 8 µ M 및 15 µ M입니다. 10 개별 곡선 같은 microplate의 10 우물에서 동일한 단백질 배치의 변환에 해당 하며 14.2의 평균 (SD)와 지연 단계를 특징으로하는 ± 0.38 h와 t50 18.8 ± 0.40 h. 운동 데이터의 5 매개 변수 logisti를 장착 했다 위 점근 선형 감소와 c 곡선입니다. 지연 위상 및 t50 선형 회귀에 의해 예측 된 값 사이 보간을 계산 했다. 지연 위상 ThT 형광 신호 3% 증가에 따라 계산 됩니다. 커브 피팅 및 요약 통계 IBM SPSS 통계 버전 20.0.0.2 사용 하 여 얻을 수 있습니다. B). 타우 집계 표시 PHF 같은 형태학 50 h;에서 AFM 이미지에 표시 된 대로 C). 단위체 huTau441의 S MALS 분석 (t = 0 h)과 반응의 완료에서 반응 혼합물의 상쾌한 (t = 50 h). 50 h 시간 지점에서 반응 혼합물 1 h g와 4 ˚C와 S MALS에 주입 결과 상쾌한 X 20000에 대 한 centrifuged 이었다. 모노 머의 실종의 완전 한 집합을 확인합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
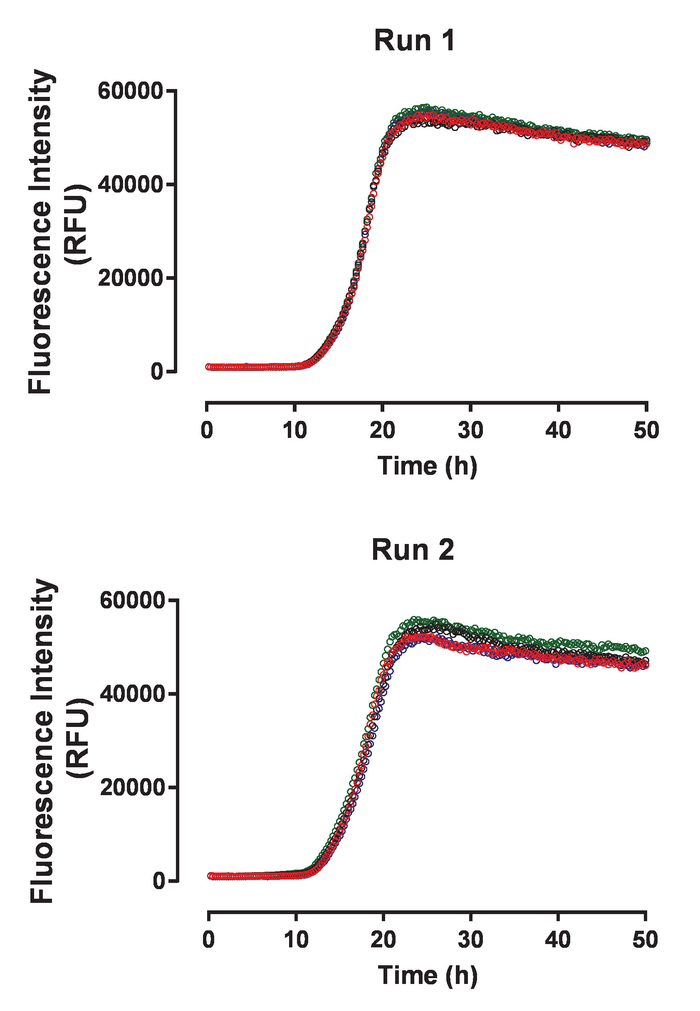
그림 3: 타우 집계 분석 결과 독립 실험 실행 사이 높은 재현성을 보여줍니다. 두 개의 패널 huTau441 단백질의 동일한 일괄 처리를 사용 하 여 두 개의 독립적인 실험에서 수집 하는 자발적인 huTau441 집계에 대 한 4 개의 개별 활동 추적을 표시 합니다. HuTau441 및 헤 파 린 농도 각각 8 µ M 및 15 µ M입니다. 속도 론 12.2 ± 0.18 h와 17.8 ± 0.8 h (실행 1)와 11.6 ± 0,52 h t50 의 (SD)와 평균 지연 위상과 t50 17.8 ± 0.23 h (실행 2)의 각각 특징입니다. 운동 데이터 위 우리에 선형 감소 5-매개 변수 로지스틱 곡선을 장착 했다. T50 은 선형 회귀에 의해 예측 된 값 사이의 보간에 의해 계산 되었다. 지연 위상 ThT 형광 신호 3% 증가에 따라 계산 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
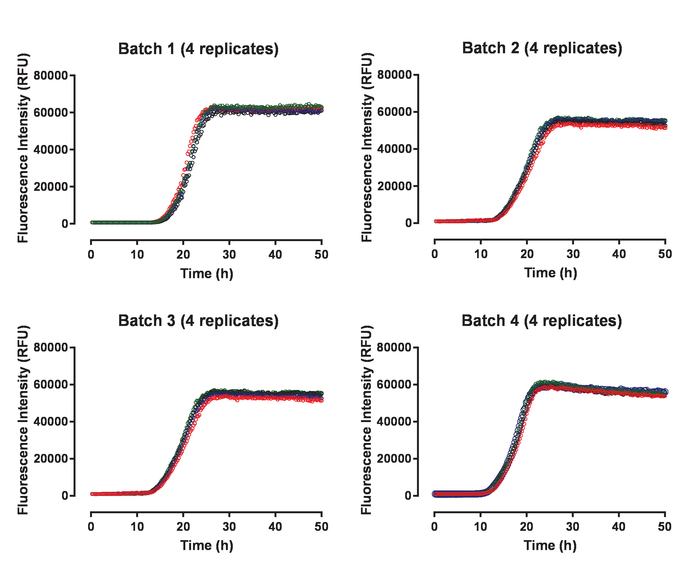
그림 4: 타우 집계 분석 결과 huTau441 단백질의 다른 배치 사이 높은 재현성을 보여줍니다. 각 패널 4에 해당 하는 특정 huTau441 일괄 복제 보여줍니다. 각 일괄 처리의 집계는 독립적인 실험에 선행 되었다. HuTau441 및 헤 파 린 농도 각각 8 µ M 및 15 µ M입니다. 일괄 처리 15.3 ± 0.38 h (SD)와 평균 지연 위상과 t50 21.1 ± 0.46 h (배치 1);의 특징은 4 개의 개별 타우 해당 집계 속도 론 래그 단계 12.5 ± 0.07 h와 t50 19.8 ± 0.34 h (배치 2); 15.1 ± 0.34 h의 단계와 t50 21.9 ± 0.86 h (일괄 3)의 지연 및 지연 11.5 ± 0.29 h의 단계와 t50 17.8 ± 0.29 h (일괄 4)의 각각. 운동 데이터 위 우리에 선형 감소 5-매개 변수 로지스틱 곡선을 장착 했다. 지연 위상 및 t50 선형 회귀에 의해 예측 된 값 사이 보간을 계산 했다. 지연 위상 ThT 형광 신호 3% 증가에 따라 계산 됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
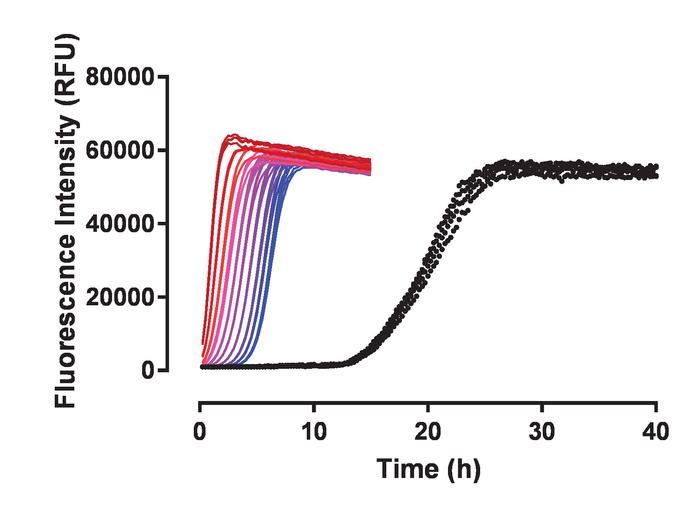
그림 5: 미리 형성한 hutau441 집계는 높은 활동 시드. 뿌리기 시작, sonicated 타우 집계 단위체 hutau441에 추가 되었습니다. 빨강에서 파랑, 다른 운동 곡선의 각 색상 추가 된 씨앗의 다른 금액을 나타냅니다: 1.25%, 0.63%, 0.31%, 0.16%, 0.08%, 0.04%, 0.02%, 0.01%, 0.005%와 0.0025% (v/v), 각각. Hutau441의 자발적인 변환 검정으로 표시 됩니다. 모든 조건 quadruplicate에서 테스트 되었습니다. 씨앗의 특정 농도와 관련 된 4 개의 운동 복제 높은 재현성 및 대부분 구별할 수 있습니다. Hutau441 및 헤 파 린 농도 각각 8 µ M 및 15 µ M입니다. 미리 형성 된 sonicated 원 구조의 작은 금액의 추가 초기 지연 위상 자발적인 변환에서 관찰 하 고 효과 씨앗의 양에 비례 합니다. 빨강에서 파랑, t50 관찰 (t50 spont.conv-t50 시드) 점은 18.9, 18.40, 17.8, 17.3, 16.6, 16.1, 15.4, 14.7, 14.2 13.7 시간, 각각. Hutau441의 자발적인 변환은 평균 t50 (SD) 19.85의 특징은 ± 0.54 h. 운동 데이터 위 우리에 선형 감소 5-매개 변수 로지스틱 곡선을 장착 했다. t50 은 선형 회귀에 의해 예측 된 값 사이의 보간에 의해 계산 되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
수많은 노력에도 불구 하 고 타우 집계 활동 날짜 부족 재현성의 원하는 수준 및/또는 nucleation 종속 합19,,2021 의 기능 중 일부를 문학에서 보고 , 22 , 23 , 25. 이것은 종종 지연 위상, 비효율적인 시드 및 타우의 원 비 자연의 부족에 의해 강조. 이러한 단점에 대 한 이유 다를 수 있습니다 고 최적의 타우 단백질 품질 (조각화, 집계, 낮은 순도, 등등의 존재.), 단백질 및 시 약 및 실험 조건 또는 유도 포함 한다. 또 다른 있느냐는 2 시스테인 잔류물 타우 집계 인터페이스 주위에 형성 내부-수 있는 인테르-산화 환 원 환경 및 영향 타우 집계의 효율성에 따라 분자 이황화 다리. 대부분의 방식에서 DTT 또는 TCEP 시스테인 잔류물 감소 형태로 유지 하 고 따라서 증가 재현성25레벨에 사용 된 시 약을 줄이고. 또한, 타우의 소멸 계수는 매우 낮은 단백질 농도의 정확한 측정에 어려움에 이르게.
우리는 몇 가지 매개 변수 및 타우 단백질에 대 한 강력 하 고, 재현 고 대표 집계 프로필에 대 한 중요 한 고려 하는 품질 특성에 특히 집중: 내부-의 가능성을 제거 하 고 간-분자 이황화 형성, 매우 순수한 타우 모노 머를 생성 하 고 농도 결정의 정확도 향상. 이러한 모든 시이 약 관련 된 질문은 최적의 분석 결과 개발에 대 한 중요 한 고려 하는 잠재적인 관심 포인트. 이러한 문제를 해결 하려면 두 개의 돌연변이, C291A 및 C322A, 그리고 N-C 터미널 태그 전체 길이 huTau441 표현 했다. 시스테인 잔류물의 돌연변이 달리 매우 통제 하기 어려운 이황화 다리 제거 하는 동안 타우 단백질에 최소한의 영향을 있다. 상대적으로 짧은 N와 C 맨끝 태그와 단백질을 표현 하 여 매우 높은 순도, 무결성 및 단위체 콘텐츠 주도 단계 선호도 정화 프로토콜을 추구 수 있었습니다. 또한, 우리는 단백질의 소멸 계수를 증가 하 고 훨씬 더 정확한 농도 측정24를 허용 하는 F8W 돌연변이 소개 했다.
높은-품질 단백질 시 약을 사용 하 여 다른 분석 결과 매개 변수 또한 최적화 했다. 최적의 타우: 헤 파 린 비율 이전 출판된 연구26은 0.5 (M/M) 주위에 확인 되었다. 또한, 기계 및 광학 경 음악 설정은 재현성 및 최적의 매개 변수를 제조 업체에 따라 어느 정도 달라질 수 있습니다 위해 중요 합니다.
이 분석 결과에서 설명의 집계 타우 pathogenesis 연관 광고에 및 tauopathies 관련 특성을 보여 줍니다. 프로세스는 해당 고 에너지 핵의 형성 하는 초기 지연 위상 시작 하 고에 해당 하는 급속 한 성장 단계 fibril 성장. 지연 시간은 충분히 긴 시드 프로세스 씨앗 농도 (그림 5) 동안 여전히 너무 오래 그래서 단백질 저하 및 일반적인 집계를 피할 수의 광범위 한 범위 (그림 자세히 공부 넓은 창을 열려면 2). 이러한 2 차 이벤트 huTau441 등 본질적으로 무질서 단백질 생리 적 조건에 시간의 오랜 기간 동안 노출 되 면 일이 특히 수. PHFs의 형태 광고 환자의 두뇌에서 격리 되며 모집 단위체 타우를 드 노 보 에서 매우 효율적인 획득된 타우 집계 표시 집계, 시드 라고 하는 프로세스를 생성. 분석 결과 사실상 우물, 실험 실행 및 단백질 일괄 처리 사이 구별 되 고 운동 곡선 높은 재현성. 현재 분석 결과 긴 타우 isoform, huTau441에 초점을 맞추고 있지만 응용 프로그램을 적용할 수 있습니다 또한, 다른 형태의 타우 (Ameijde 그 외 여러분, Acta Neuropathologica 통신, 언론에서)의 변환 연구 그것은 수 기계 연구 tau isoforms의 상호 작용에 초점을 맞춘 고 가능성이 있는 3R, 4R isoforms는 PHFs 및 선택의 질병 또는 치 매 Frontotemporal에 타우 병리학 주로 포함 되어 있는 광고에 타우 pathogenesis의 차이점에 빛을 발산 3R, 4R tau isoforms, 각각27.
분석 결과의 매우 높은 재현성 상대적으로 쉽게 그들의 특정 랩 설정에서 그것을 구현 하는 독자를 허용 해야 합니다. 분석 결과 믿어지는 무슨이 vivo에서 misfolding과 타우의 모방, 타우 pathogenesis 및 그것에 빛을 발산 하게된다 기계 연구 약물 후보를 심사 하기 위한 유용한 도구를 구성 및 그들의 간섭 평가 와 병 인 과정의 다른 단계.
공개
저자는 공개 없다.
감사의 말
저자는 한 나 Inganäs 및 우수한 기술 지원에 대 한 마 반 빈 센 마틴 Koldijk 데이터 분석에 대 한 표현과 huTau441의 정화에 대 한 헥 터 Quirante를 감사 하 고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| Thioflavin T | Sigma-Aldrich | T3516-5G | dry powder (Mw = 318.86 g/mol) |
| Heparin | Sigma-Aldrich | H3393-50KU | dry powder (Mw = 17-19 kDa) |
| TCEP | Sigma-Aldrich | 75259-1G | dry powder (MW= 286.65 g/mol) |
| PBS | Gibco-Life Technologies | 10010-015 | Sterile, pH 7.4 (1X) |
| 0.22 μm sterile filter | Corning | 431160 | PES membrane |
| 0.20 μm sterile serynge filter | Corning | 431229 | PES membrane |
| 96-well microplates | Thermo Scientific | 9502867 | Black, flat botton |
| Microplate sealers | R&D Systems | DY992 | Adhesive strips |
| Synergy Neo2 Multi-Mode Microplate Reader | Biotek | Synergy Neo2 | Hybrid Technology, Gen5 Software |
| Eppendorf Tubes | Eppendorf | 0030 120.086 | 1,5 ml tubes |
| Ultrasonics-Branson SFX250 | Branson | 101-063-966R | 1/2" Solid Horn and 1/8" microtip |
참고문헌
- Querfurth, H. W., LaFerla, F. M. Alzheimer's disease. The New England Journal of Medicine. 362 (4), 329-344 (2010).
- Lee, V. M., Goedert, M., Trojanowski, J. Q. Neurodegenerative tauopathies. Annual Review of Neuroscience. 24, 1121-1159 (2001).
- Goedert, M., Wischik, C. M., Crowther, R. A., Walker, J. E., Klug, A. Cloning and sequencing of the cDNA encoding a core protein of the paired helical filament of Alzheimer disease: identification as the microtubule-associated protein tau. Proceedings of the National Academy of Sciences of the United States of America. 85 (11), 4051-4055 (1988).
- Himmler, A., Drechsel, D., Kirschner, M. W., Martin, D. W. Tau consists of a set of proteins with repeated C-terminal microtubule-binding domains and variable N-terminal domains. Molecular and Cellular Biology. 9 (4), 1381-1388 (1989).
- Mandelkow, E., von Bergen, M., Biernat, J., Mandelkow, E. M. Structural principles of tau and the paired helical filaments of Alzheimer's disease. Brain Pathology. 17 (1), 83-90 (2007).
- Lee, V. M., Balin, B. J., Otvos, L., Trojanowski, J. Q. A68: a major subunit of paired helical filaments and derivatized forms of normal Tau. Science. 251 (4994), 675-678 (1991).
- Wischik, C. M., Harrington, C. R., Storey, J. M. Tau-aggregation inhibitor therapy for Alzheimer's disease. Biochemical Pharmacology. 88 (4), 529-539 (2014).
- Pickhardt, M., et al. Identification of Small Molecule Inhibitors of Tau Aggregation by Targeting Monomeric Tau As a Potential Therapeutic Approach for Tauopathies. Current Alzheimer Research. 12 (9), 814-828 (2015).
- Paranjape, S. R., et al. Azaphilones inhibit tau aggregation and dissolve tau aggregates in vitro. ACS Chemical Neuroscience. 6 (5), 751-760 (2015).
- Seidler, P. M., et al. Structure-based inhibitors of tau aggregation. Nature Chemistry. 10 (2), 170-176 (2018).
- Apetri, A. C., Vanik, D. L., Surewicz, W. K. Polymorphism at residue 129 modulates the conformational conversion of the D178N variant of human prion protein 90-231. Biochemistry. 44 (48), 15880-15888 (2005).
- Crespo, R., Rocha, F. A., Damas, A. M., Martins, P. M. A generic crystallization-like model that describes the kinetics of amyloid fibril formation. Journal of Biological Chemistry. 287 (36), 30585-30594 (2012).
- Holmes, B. B., et al. Proteopathic tau seeding predicts tauopathy in vivo. Proceedings of the National Academy of Sciences. 111 (41), E4376-E4385 (2014).
- Surewicz, W. K., Jones, E. M., Apetri, A. C. The emerging principles of mammalian prion propagation and transmissibility barriers: Insight from studies in vitro. Accounts of Chemical Research. 39 (9), 654-662 (2006).
- Jeganathan, S., von Bergen, M., Mandelkow, E. M., Mandelkow, E. The natively unfolded character of tau and its aggregation to Alzheimer-like paired helical filaments. Biochemistry. 47 (40), 10526-10539 (2008).
- Goedert, M., et al. Assembly of microtubule-associated protein tau into Alzheimer-like filaments induced by sulphated glycosaminoglycans. Nature. 383 (6600), 550-553 (1996).
- Kampers, T., Friedhoff, P., Biernat, J., Mandelkow, E. M., Mandelkow, E. RNA stimulates aggregation of microtubule-associated protein tau into Alzheimer-like paired helical filaments. FEBS Letters. 399 (3), 344-349 (1996).
- Wilson, D. M., Binder, L. I. Free fatty acids stimulate the polymerization of tau and amyloid beta peptides. In vitro evidence for a common effector of pathogenesis in Alzheimer's disease. American Journal of Pathology. 150 (6), 2181-2195 (1997).
- Barghorn, S., Mandelkow, E. Toward a unified scheme for the aggregation of tau into Alzheimer paired helical filaments. Biochemistry. 41 (50), 14885-14896 (2002).
- Friedhoff, P., Schneider, A., Mandelkow, E. M., Mandelkow, E. Rapid assembly of Alzheimer-like paired helical filaments from microtubule-associated protein tau monitored by fluorescence in solution. Biochemistry. 37 (28), 10223-10230 (1998).
- Morozova, O. A., March, Z. M., Robinson, A. S., Colby, D. W. Conformational features of tau fibrils from Alzheimer's disease brain are faithfully propagated by unmodified recombinant protein. Biochemistry. 52 (40), 6960-6967 (2013).
- Ramachandran, G., Udgaonkar, J. B. Mechanistic studies unravel the complexity inherent in tau aggregation leading to Alzheimer's disease and the tauopathies. Biochemistry. 52 (24), 4107-4126 (2013).
- Sui, D., Liu, M., Kuo, M. H. In vitro aggregation assays using hyperphosphorylated tau protein. Journal of Visualized Experiments. (95), e51537 (2015).
- Apetri, A., et al. A common antigenic motif recognized by naturally occurring human VH5-51/VL4-1 anti-tau antibodies with distinct functionalities. Acta Neuropathologica Communications. 6 (1), 43 (2018).
- Barghorn, S., Biernat, J., Mandelkow, E. Purification of recombinant tau protein and preparation of Alzheimer-paired helical filaments in vitro. Methods Mol Biol. 299, 35-51 (2005).
- Zhu, H. L., et al. Quantitative characterization of heparin binding to Tau protein: implication for inducer-mediated Tau filament formation. Journal of Biological Chemistry. 285 (6), 3592-3599 (2010).
- Buee, L., Delacourte, A. Comparative biochemistry of tau in progressive supranuclear palsy, corticobasal degeneration, FTDP-17 and Pick's disease. Brain Pathology. 9 (4), 681-693 (1999).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유