Method Article
단백질 분리 및 특성에 대 한 다 각 산란 (MALS)를 결합 하는 이온 교환 크로마토그래피 (전류 구동)
요약
이 프로토콜에는 단백질, 단백질 복합물, 및 다른 유형의 샘플에 펩 티 드의 정확한 어 금 니 질량 결정에 대 한 다 각 산란과 높은 특이성 이온-교환 크로마토그래피를 사용 하 여를 설명합니다. 이 메서드는 네이티브 올리고, 충전 변종 및 혼합 단백질 견본 특성에 관해서는 품질 평가 대 한 귀중 한.
초록
다 각 산란 (전류 구동-MALS)와 이온-교환 크로마토그래피는 단백질 분리 및 특성에 대 한 강력한 방법입니다. 전류 구동 MALS 함으로써 정확한 어 금 니 질량 분석 수 매우도 oligomeric 형태 또는 단백질 인구의 혼합물을 포함 한 다른 유형의 단백질 견본의 특성 높은 특이성 분리 기술의 조합 비슷한 어 금 니 대 중입니다. 따라서, 전류 구동 MALS 단백질 특성의 추가 수준을 제공 하 고 다 각 산란 (초-MALS) 기술 표준 크기 배제 크로마토그래피에 무료입니다.
여기 기본 전류 구동 MALS 실험 하 고 소 혈 청 알 부 민 (BSA)에 대해이 메서드를 설명 하는 프로토콜을 설명 합니다. 전류 구동 oligomeric 형태의 MALS 각 개별 양식으로 어 금 니 질량 분석 허용에 BSA를 구분 합니다. 전류 구동 MALS 실험의 최적화 또한 제시 하 고 BSA 단위체와 더 큰 올리고 우수한 구분을 달성 하는 BSA에 설명. 전류 구동 MALS 제공 합니다 잘 분리 샘플에 존재 하는 여러 단백질 종의 어 금 니 질량 결정 이후 단백질 품질 평가 위한 귀중 한 기술 이다.
서문
규제 목적 의약품 산업에서 고 신뢰성 및 생명 과학의 무결성을 보장 하기 위해1 연구 양적 특성 단백질 제품의 품질 관리 (QC)의 수단으로 점점 더 필수적 이다 , 2. 단백질의 웹사이트에 설명 된 대로 네트워크 단백질 생산 및 유럽 (P4EU) 및 협회의 자원 정화 파트너십 유럽에서 생물 연구 및 유럽 (아 흐 브 흐-MOBIEU)에서 분자 생물 물리학 (https://p4eu.org/protein-quality-standard-pqs와 https://arbre-mobieu.eu/guidelines-on-protein-quality-control, 각각), 단백질 품질 관리 뿐만 아니라 최종 제품, 하지만 또한 oligomeric 상태로, 동질성, 정체성, 순도 특성화 해야 합니다 형태, 구조, posttranslational 수정와 다른 속성3,4.
하나는 가장 일반적인 QC 특성화 방법의 초 MALS입니다. 이 방법에서는, 분석 SEC 열 MALS 및 spectrophotometric 및 refractometric 감지기, 각 피크5의 단백질 분자량의 정확한 측정을 사용 결합 이다. 초 MALS 차입 볼륨 별도로 eluted 봉우리의 어 금 니 질량을 결정 하 고 열 보정을 사용 하 여 분석 SEC의 부정확성을 극복. 동적 빛 분산 (DLS) 모듈의 추가 허용 유체역학 반경 결정 크기 측정 기능을 추가 합니다. 학술 연구, 초 MALS 일반적으로를 사용 하는 단백질, 그것의 구조, 순도, 집계, 그리고 수정 된 단백질, glycoproteins 등 지질 solubilized 막 단백질의 레벨의 레벨의 oligomeric 상태를 확인 (확인은 단백질의 분자량 및 구성 요소를 개별적으로 켤레)6,,78.
많은 경우에, 정화 과정의 최종 단백질은 잘 defined 분자 종 하지만 오히려 구성 하는 일부이 성분. 이러한 혼합물에 있는 단백질 구조 (예를 들어 다른 oligomeric 형태), conformations, 또는 단백질 isoforms는 다양 한 될 수 있습니다. 단백질이 C 터미널 lysine 처리 또는 변형9,10충전 선도 아스파라긴/글루타민 탈으로 인 한 사소한 화학 차이의 결과 영향을 수도 있습니다. Glycosylation 같은 posttranslational 수정 차이 또한 충전 유사9이기종 샘플 발생할 수 있습니다. 이러한 서로 다른 유형의 단백질의 생물 특성에 반영 하 고 안정성과11대상 단백질 생물 학적 활동에 영향을 줄 수 있습니다.
같은 다른 유형의 샘플의 신뢰할 수 있는 품질 관리 분석 매우 resolutive 분석 분리 기술이 필요로합니다. 좋은 분리 분석 초 열, 그들의 제한 된 해상도 분리 능력12, 결함이 초 MALS 분석 결과로 인해 달성 하기 위해 도전 하는 수 있는 경우가 있습니다. 전류 구동 MALS와 같은 높은 특이성 분리 기술을 결합 하 여 다른 유형의 샘플에 초 MALS의 한계를 극복 하 고 단백질 특성 (Amartely 외.12표 1)에 대 한 보완 방법을 제공 수 있습니다. 그들의 유체역학 크기13에 의해 고분자를 분리, 초 달리 전류 구동 그들의 표면 충전14에 의해 고분자를 분리 합니다. 음이온 교환 (AIEX) 및 양이온 교환 (CIEX) 행렬 bind 부정적인 긍정적으로 청구 변종, 각각. 상대적으로 가까운 질량 또는 모양 공유 하는 단백질 인구 사이 좋은 별거, 전류 구동 MALS 성공적으로 혼합 샘플12에서 각 개별 단백질의 분자량을 결정 합니다.
여기 선물이 같은 샘플에는 분리와 존재 BSA oligomeric 형태의 분석에 대 한 전류 구동 MALS 실험을 실행 하기 위한 표준 프로토콜. 특정 단백질에 대 한 전류 구동 열의 선택은 중요 하 고 논의 하 고, 버퍼의 pH 및 전도도 조건 뿐만 아니라. 전류 구동 MALS 실험 데이터의 분석 또한 단계적으로 설명 되어 있습니다. BSA 올리고의 분리는 좋은 초 MALS에서 충분 한, BSA 전류 구동 MALS 기능을 게재 하 고 실험의 최적화를 보여주는 좋은 예입니다. 초 MALS 및 적절 한 분리 및 분석 전류 구동 MALS로 활성화 함으로써 가난한 분리의 예는 이전 연구12에서 설명 합니다.
프로토콜
1입니다. 시스템의 준비
- 고속 단백질 액체 착 색 인쇄기 (FPLC) 시스템 및 MALS/굴절 인덱스 (RI) 검출기 ( 재료의 표참조) 컨트롤, 데이터 수집, 및 제조 업체는 당 분석에 대 한 그들의 각각 소프트웨어 패키지와 함께 설치 지침입니다.
- FPLC의 UV와 전도도 검출기의 하류 아니라 MALS 및 RI 검출기를 연결 합니다. UV와 MALS 감지기 사이 interdetector 볼륨을 최소화 하기 위해 pH 기울기에 대 한 절대적으로 필요한 경우가 아니면 전화 탐지기를 우회. 0.25-0.5의 모 세관 튜브를 사용 하 여 m m 내경 (아이디) 열 탐지기와 폐기물 또는 수집기에 RI 검출기의 출력 0.75 m m i.d. 모 세관 배관 사이.
- 그 FPLC과 감지기 사이 필요한 신호 연결 설립 되었습니다, MALS Aux 입력에 FPLC 검출기에서 UV 아날로그 출력 및에 MALS Autoinject, I/O 상자 통해는 FPLC에서 디지털 출력을 포함 하 여 확인 합니다.
2입니다. 샘플 및 버퍼의 준비
- 0.1 µ m 필터 세척 및 차입 버퍼를 포함 하 여 모든 시 약을 필터링 합니다. 건조 필터에서 입자를 제거 하기 위해 폐 병으로 버퍼의 첫 번째 50-100 mL를 필터링 하 고 필터링 된 물으로 철저 하 게 세척 되 고 입력에서 먼지를 방지 하기 위해 출장 청소, 살 균 병에 버퍼의 나머지를 유지.
- PH, 이온 강도에 BSA 샘플 조정 (예를들면, pH = 8, 50 mM NaCl) 희석, 한, 또는 버퍼 교환 절차 동안 전류 구동 열 바인딩 수 있도록.
참고: 것이 좋습니다 관심의 자료를 제거 하지 않는 작은 기 공 크기로 단백질 샘플 prefilter (0.02-0.1 µ m). 또는, 큰 입자의 강 수 있도록 10 분 샘플 고속 (13000-16000 x g) centrifuged 될 수 있습니다. - 적어도 0.3-0.5 준비 BSA의 mg ( 재료의 표참조) 좋은-품질 MALS 분석을 달성 하기 위한 1 mL 열 (5/50 m m)에 삽입. 참고 주입의 볼륨 제한 되지 않습니다.
3. 선택과 단백질에 대 한 전류 구동 방법의 개발
- Protparam 도구 는 ExPASy에 있는 서버에 대 한 웹사이트 사용된15수 기본 시퀀스에 따라 단백질의 전자 점 (pI)을 계산 합니다. 참고 BSA의 pI 5.8입니다.
- 열 유형 및 버퍼 매개 변수를 선택 합니다.
- pK는는 버퍼와 버퍼의 이온 특성에 따라 AIEX와 CIEX, 다른 버퍼를 사용 합니다. AIEX 열과 음이온 버퍼 작은 counterions CIEX 열에서 실행할 때 실행할 때 양이온 버퍼를 사용 합니다. 이 예제에서 20 mM Tris HCl 버퍼, pH 8, AIEX 열에 BSA의 분석을 사용 합니다.
- BSA, 등 7 보다 낮은 pI와 단백질에 대 한 두 개 이상 단위에 의해 파이 보다 더 높은 ph는 AIEX 열 및 버퍼를 사용 합니다. 7 보다 높은 pI와 단백질에 대 한 두 개 이상 단위에 의해 단백질 pI 보다 낮은 ph CIEX 열 및 버퍼를 사용 합니다.
- 바인딩 단백질 사이의 열 매트릭스의 강도 따라 버퍼 pH 최적화. 단백질 잘 열에 바인딩되지 않습니다, pI에서 pH를 사용 합니다. 단백질 사용된 pH에 안정 되어 있는지 확인 합니다.
- 낮은 염 농도 사용 하 여 바인딩에 고 단백질 바인딩 로드 샘플의 이온 강도에 따라 달라 집니다 이후 행렬에 단백질의 바인딩을 허용 하는 버퍼를 씻어. 단백질의 안정성에 대 한 몇 가지 소금 필요 따라서, 단백질 로드 및 열 세척 단계 동안 50 m m NaCl (또는 대체 소금)을 사용 합니다.
- 차입 버퍼에 대 한 최대 0.5 M NaCl 사용 하 여 열에서 단백질을 분리.
참고: 높은 소금 농도 표준 모델 RI 굴절 계 악기의 범위 제한 때문에 작업할 때 권장 하지 않습니다. 그러나, 고 농도 모델 사용 될 수 있다 그리고 2 M NaCl을 수용할 것입니다.
- 초기 메서드를 다음과 같이 수행 합니다.
- BSA의 1 mg 로드 (6 mg/mL의 170 µ L) 20 mM Tris HCl 버퍼, pH 8의 로딩 버퍼의 ~0.5 mL에서 50 mM NaCl을 포함 하. 빛 산란 (LS), UV 때까지 바인딩되지 않은 분자 및 입자 시스템에서의 완전 한 차입을 허용 하는 10-15 열 (CV) 볼륨에 대 한 동일한 버퍼 열 세척 하 고 RI 신호는 완전히 안정.
- 20-30 이력서, 20 mM Tris HCl, pH 8의 차입 버퍼를 사용 하 여, 포함 하는 열에서 단백질을 분리 하 0.5 M NaCl의 짧은, 선형 솔트 그라디언트를 수행 합니다. 차입 버퍼의 0%-100% (또는 대체 광범위 한 그라데이션)의 그라디언트를 수행 하거나 두 그라디언트를 분할: 차입 버퍼의 0%-50%는 추가 그라데이션 차입 버퍼, 10-20 이력서에 대 한 각 그라디언트의 50%-100%의 뒤에. BSA, 30에 대 한 광범위 한 그라데이션 15%-70%의 사용 초기 방법에 대 한 이력서.
참고: 어떤 경우에, 초기 방법을 제공할 수 있습니다 신뢰할 수 있는 MALS 분석에 대 한 분리 그리고 추가 실행이 필요 하지 않습니다. 대부분의 경우, 초기 메서드 추가 방법 최적화에 대 한 지침을 제공합니다.
- 해상도 증가 하 고 다른 매개 변수를 변경 하 여 피크 분리를 개선 하는 전류 구동 메서드를 최적화 합니다.
- 그라데이션 경사와 길이 변경 합니다. 높은 슬로프와 짧은 그라디언트 가벼운 슬로프와 긴 그라디언트 제공 더 나은 분리 낮은 봉우리 적은 분리와 함께 강렬한 봉우리를 제공 합니다. 최적의 MALS 분석에 대 한 최대 해상도 및 신호 강도 사이의 균형을 찾아.
참고: LS, UV, 증가할 수 있다 단백질의 높은 수량을 로드 하 고 RI 신호 하지만 해상도 비용 않습니다. - 차입에 대 한 단계적 소금 농도 프로 파일을 사용 합니다. 단계 및 선형 그라데이션의 조합 일반적으로 사용 되는 기억 하십시오.
- 피크 분리 개선 흐름 속도 감소.
참고: 아주 작은 입자와 함께 행렬에 대 한 이건 매우 중요 한입니다. - 샘플에서 단백질 인구 사이 충전 편차를 증가 하 고 그 변종 사이의 분리를 향상을 버퍼 pH를 변경 합니다. 참고 한 pH에서 제대로 분리 되지 단백질 다른 pH에서 분리 될 수 있다.
- 그라데이션, 선형 또는 stepwise, pH를 사용 하 여 전류 구동 열 로부터 단백질을 분리. PH 및 소금 농도 변화가 필요한 경우 결합 하는 차입 그라디언트를 사용 합니다.
- 강한 염, MgCl2또는 약한 소금 나트륨 아세테이트, 등 등을 사용 하 여 감도 및 해상도16증가.
- 분리 능력을 향상 시키는 작은 입자와 더 이상 전류 구동 열 또는 다른 열 매트릭스를 사용 합니다.
- 열 (AIEX/CIEX) 분리의 다른 패턴을 제공 하기의 형식을 변경 합니다. 참고는 강한, 약한, 또는 결합 된 (혼합 모드) ligands와 행렬도 사용할 수 있으며 일부 샘플의 해상도 향상 시킬 수 있습니다.
- 다른 매트릭스 수 지에 연결 된 동일한 ligand와 다른 공급 업체에서 열을 사용 합니다. Ligand, 별도로 수 지 자체, 단백질와 다르게 상호 작용 하 고 분리 프로필에 영향을 미칠 수 있습니다.
- 단백질 안정성 향상 및 전류 구동 실험을 개선 하기 위해 단백질 집계를 피하기 위해 버퍼에 첨가제 (안정화 솔루션에서 단백질 분자)를 포함 합니다.
참고: 이러한 첨가제는 설탕, 알콜, 우 레 아, 비 또는 zwitterionic 세제, 그리고 chaotropic 및 kosmotropic 소금17,18.
- 그라데이션 경사와 길이 변경 합니다. 높은 슬로프와 짧은 그라디언트 가벼운 슬로프와 긴 그라디언트 제공 더 나은 분리 낮은 봉우리 적은 분리와 함께 강렬한 봉우리를 제공 합니다. 최적의 MALS 분석에 대 한 최대 해상도 및 신호 강도 사이의 균형을 찾아.
4. 전류 구동 MALS 실험
- New\Experiment 메서드에서 MALS 소프트웨어에서 열고 빛 산란 시스템 방법 폴더에서 온라인 메서드를 선택 합니다. DLS 모듈 사용할 수 있는 DL 데이터 취득 하는 경우에, 빛 Scattering\With QELS 하위 폴더에서 온라인 메서드를 선택 합니다.
- 구성 섹션에서 실행의 매개 변수를 설정 합니다.
- FPLC (1.5 mL/min)에서 사용 하는 유량에 일반적인 펌프 섹션에서 실행의 흐름 속도 설정 하 고 입력 하거나 용 매 섹션에서 버퍼 매개 변수를 확인 합니다.
- 단백질 이름 (BSA), 굴절률 증가 입력 (dn/dc; 표준 단백질에 대 한 값은 0.185 mL/g), 280의 파장에 UV 소멸 계수 (0.66 g/L-1·cm-1), 및에서 단백질 견본 (6 mg/mL)의 농도 인젝터 섹션 아래 샘플 탭. 같은 섹션에서 또한 주입 (170 µ L)에 대 한 샘플 볼륨을 삽입 합니다.
- 프로시저 섹션에서 기본 컬렉션 탭에서 Autoinject에 트리거 확인란을 선택 하 고 그라디언트에 도달 하면 적어도 5 분 동안 데이터 수집을 계속 것 이다 있도록는 실행 기간을 설정의 최종 값입니다.
- FPLC 소프트웨어에서 실험 매개 변수를 설정 합니다.
- 메서드 편집기 탭에서 새 실험을 만듭니다. 초기 실험 소금 또는 산도의 선형 그라데이션 됩니다 (단계 3.3 참조). 최적화 방법에 대 한 좀 더 구체적인 그라데이션 또는 차입 결과 단계적 프로그램 동안 만드는 초기 메서드 (3.4 단계 및 그림 1참조). MALS 소프트웨어에서 데이터 수집을 트리거하는 방법에는 펄스 신호를 포함 합니다.
- 열과 관련 된 버퍼와 밸브 세척: 세척 버퍼 (밸브)와 500 m m NaCl 차입 버퍼 (B 밸브)에 대 한 동일한 버퍼에 대 한 50 m m NaCl 20 mM Tris HCl, pH 8. 마지막 열 세척이 낮은 소금 농도 포함 하는 바인딩 버퍼를 사용 하 여 열 매트릭스에 단백질의 바인딩을 활성화는 다는 것을 확인 하십시오. 강력 하 게 바인딩된 불순물의 대규모 세척, 중화 버퍼 세척 뒤 관련 버퍼와 세척 하기 전에 0.5 M NaOH를 사용 합니다.
- 주사기를 사용 하 여 루프에서 단백질 견본을 놓습니다. 샘플의 10 mL 이상의 로드 하는 경우 필터 펌프와 믹서는 FPLC의 무시 하면서는 superloop 또는 FPLC 악기의 펌프 밸브를 사용 합니다.
- 실험 처음 시작 MALS 소프트웨어에서 그리고 FPLC 소프트웨어에서 실행 버튼을 클릭 하 여. MALS 검출기를 통해 FPLC 악기에서 펄스 신호를 받은 후 데이터를 수집 합니다.
- 실행 및 독립 실행형 메서드 대신 연속 흐름 모드 전류 구동 MALS 수동으로 수행 하는 경우 단계 4.1-4.4에서에서 설명 하는 지침의 동일한 매개 변수를 적용 합니다.
- 마지막 방법은 확인 되 고 실행 후 빈 주입 (샘플 대신 로딩 버퍼)를 사용 하 여 정확 하 게 같은 방법을 수행 합니다. Autoinject 펄스 사이의 빈 실행의 그라데이션 타이밍 실행 하는 샘플의 동일은 중요 하다.
5. 전류 구동 MALS 실험 데이터의 분석
- MALS 소프트웨어에서 분석 절차 섹션 아래 단계를 수행 합니다. 기본 컬렉션 뷰 실험의 원시 데이터 컬렉션을 표시합니다.
- Despiking 탭을 사용 하 여 그들은 소음을 많이 전시 하는 경우는 chromatograms를 부드럽게. 일반적으로, 정상적인 수준을 사용 합니다.
- 모든 신호를 위한 기준 정의 (모든 LS, UV, 그리고 RI 검출기) 기본 보기에서.
- 분석에 대 한 봉우리 봉우리 보기 정의 합니다. 각 피크에서 단백질을 위한 UV 소멸 계수 및 dn/dc의 올바른 값을 확인 합니다.
참고: 단백질, 그것은 0.185 mL/g 표준 RI 증분 값을 사용 하 여 일반적인 하지만 다른 고분자에 대 한 다른 dn/dc 값 사용 해야, 분자의 특성에 따라. Polynucleotides (DNA/RNA)의 평균 dn/dc는 0.17 mL/g19, saccharides, 자당, 같은 0.145 mL/g20 의 평균 dn/dc 값 있고 지질과 세제 범위 0.1-0.16의 dn/dc 값 mL/g21. - 어 금 니 질량 및 반지름 피팅 매개 변수 그리고 분자량 및 LS에서 반경 및 QELS에서 Rh 보기 아래에서 상관 함수를 사용 하 여 분석 합니다.
- 전류 구동 MALS 동안 크게 RI 신호 변경 소금 농도 증가로 인해 실행합니다. 따라서 RI 데이터를 필요로 하는 대량 계산에 대 한 빈 주입에서 기준 신호를 뺍니다.
- 단백질 및 빈 전류 구동 MALS 실험을 엽니다. 단백질 실험 이름을 마우스 오른쪽 단추로 누릅니다, 그리고 적용 방법, 고 기준 빼기 폴더 파일 대화 상자에서 선택 하십시오. 표준 어 금 니 질량 분석에 대 한 메서드 (예: 온라인)의 올바른 유형을 선택 합니다. 참고 매개 변수 및 설정 단백질 실험에 대해 정의 된 새 열된 방법에 저장 됩니다.
- 초기 빼기 보기 가져오기 빈 빈 실행의 신호를 가져오려면 클릭 합니다. 악기 (옆 빈 가져오기 버튼)에서 모두 뺄 검출기의 선택 합니다.
- 솔루션의 RI12실행된 동안 변경 이후 봉우리 보기에서 단백질 피크 지역에 해결책의 전도도 때문 dn/dc 값 (필요한 경우)를 조정 합니다.
- BSA 단위체와 전류 구동 MALS 시스템 보정.
참고: 일반적으로, 전류 구동 MALS 시스템은 주기적으로 보정 피크 정렬, 밴드 확대, 및의 선회 (Rg)의 반경 가진 단 분산 단백질을 사용 하 여 90 °의 검출기 각도 검출기의 < 10 nm, BSA 단위체 등. 이 예제에서는 BSA 모두 교정 분자 하며 자체 어 금 니 질량 분석의 주제 이다.- 절차 에 따라 봉우리 정렬 > 구성 보기.
- 3.0 입력 정규화 보기 아래 정규화 수행 Rg 값으로 nm.
- 동일한 구성 탭에서 밴드 확대 를에서 피크를 선택 하 고 맞는 수행 버튼을 사용 하 여 RI 신호에는 UV 및 LS 신호를 일치 합니다.
- 결과의 그래프 결과 피팅 보기에 표시 됩니다. 그래프를 마우스 오른쪽 단추로 클릭, 편집을 선택한 다음 고급 버튼을 클릭 하 여 축 비늘과 다른 그래프 매개 변수를 변경 합니다. 더 많은 디스플레이 옵션 그래프 그림은 또한 EASI 그래프 탭에서 사용할 수: 윈도우의 상단에 표시 하는 드롭 다운 메뉴에서 선택 하는 어 금 니 질량 .
- 참고 어 금 니 질량, 반지름, 순도의 수준 및 다른 사람를 포함 하 여 모든 결과 결과 섹션에서 보고서 보기 요약 (세부)에서 사용할 수 있습니다. 보고서 디자이너 단추를 사용 하 여 보고서에 더 많은 결과 또는 매개 변수를 뿐만 아니라 숫자, 추가.
결과
BSA는 크로마토그래피 실험 시스템22 의 교정에 대 한 사용 되 고 높은 전류 구동 MALS 뿐만 아니라 초 MALS 연습에 적합 한 일반적인 단백질 이다. 그것은 주로 66.7 kDa의 이론적인 단위체 질량으로 단위체 이며 일반적으로 이합체 및 더 높은 올리고23의 작은 숫자를 포함.
BSA에 전류 구동 MALS 음이온 교환 분석 열을 사용 하 여 분석 ( 재료의 표참조). 넓은 선형 그라데이션 30의 구성 된 350 mm NaCl 75 m m에서 CV 높은 올리고에서 BSA 단위체를 분리. 다운스트림 MALS 분석 결과 66.8 ± 0.7 kDa의 계산 된 단위체의 어 금 니 질량 및 130 ± 5 kDa (그림 1A)의 계산된 이합체 어 금 니 질량.
Eluted 봉우리에서 버퍼 전도성을 바탕으로, 그라데이션 다른 프로그램으로 변경 되었습니다: 175 m m NaCl의 긴 단계 다음에 선형 그라데이션 175 m m에서 500 m m NaCl. 새로운 그라데이션 크게 향상 된 해상도 우수한 (66.1 ± 0.7 kDa의 계산 된 어 금 니 질량)와 BSA 단위체와 (132 ± 2 kDa의 계산 된 평균 질량)와 높은 oligomeric 종 구분 (그림 1B). 또한 높은 oligomeric 종에 집중 하 고 각 개별 oligomeric 형태의 BSA의 어 금 니 질량을 계산, 200 mM와 250mm NaCl의 stepwise 프로그램 적용 되었습니다. 이 실험 결과 우수한 BSA (62.4 ± 0.4 kDa의 계산 된 질량)으로 단위체, 이합체 (130 ± 10 kDa의 계산 된 질량)와 삼합체 (170 ± 10 kDa의 계산 된 질량)으로 구분 (그림 1C). 모든 전류 구동 MALS 실험 BSA BSA 단위체 8512의 순도 함께 elute 초 MALS 결과와 80%의 순수성을 가진 모노 머로 주로 elutes 보여줍니다.
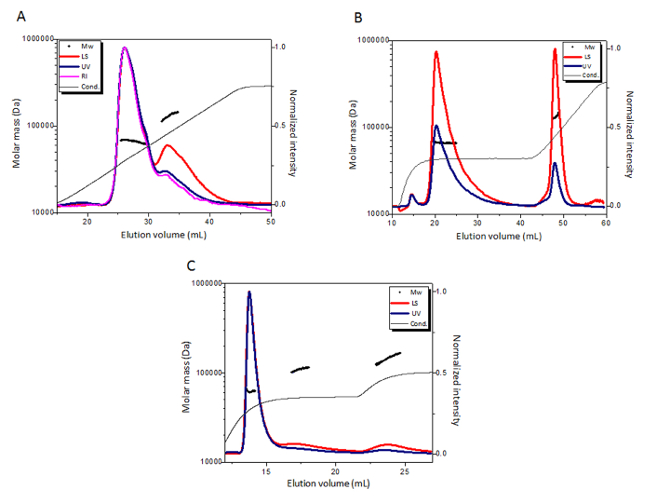
그림 1 : 전류 구동 MALS BSA에 대 한 실험의 최적화. (A) 전류 구동 MALS 75-350 m m NaCl의 그라데이션 프로그램 BSA의 실험. (B) 전류 구동 MALS 175 m m NaCl 단계 뒤에 175-500 m m NaCl의 선형 그라데이션 프로그램의 프로그램 BSA의 실험. (C) 전류 구동 MALS 200 mM와 250mm NaCl의 단계 프로그램 BSA의 실험. chromatograms 280 nm (파란색), 빛 (빨간색), 90 ° 각도 굴절률 (핑크) MALS (검정)에 의해 계산 된 각 피크의 어 금 니 질량 함께 전도도 (회색) 곡선에서 비 산에 UV를 표시 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
전류 구동 MALS 네이티브 올리고, nonnative 집계, 화학식 및 noncovalent 특성화 단백질 분리 및 이기종 샘플으로 뿐만 아니라 순수 단백질의 정확한 어 금 니 질량 결정 수 있도록 특성화에 대 한 강력한 방법입니다. 단지, 그리고 conjugated 단백질입니다. 선형 그라데이션 또는 일련의 소금 농도 단계 구성 된 프로그램 단백질 인구의 좋은 분리를 달성 하 고 각 개별 피크는 MALS에서의 적절 한 분석을 허용 수 있습니다. 그라데이션 같은 다른 매개 변수를 변경 하 여 추가 최적화 경사 (프로토콜의 3.4 단계 참조), 더 나은 해상도 필요한 경우 수행할 수 있습니다. 전류 구동 MALS 이후 단백질 특성 분석, 보완 초 MALS 같은 다른 방법에의 한 추가, 중요 한 수준을 제공 하는 귀중 한 단백질 품질 관리 분석 결과 될 수 있습니다.
초 MALS 단백질 어 금 니 질량 결정에 대 한 표준 및 일반적인 기술 이다, 하는 동안 표준 분석 초 열의 상대적으로 낮은 해상도 MALS12달성 정확한 어 금 니 질량 측정을 제한할 수 있습니다. 일부 SEC MALS의 한계 등 연속 올리고, 단위체 피크, 그리고 수정 된 단백질 등 비슷한 어 금 니 질량을 가진 이질적인 인구에서 완전히 분리 되지 집계의 높은 수준을 포함 하는 솔루션.
전류 구동 설계 하 고 수행 초, 보다 더 복잡 한 크로마토그래피 방법 이지만 전류 구동 MALS 실험에서 얻은 정보 보완 하 고 때로는 초 MALS 분석 보다도 더 유익 될 수 있다. 전류 구동 MALS는 성공적으로 항 체 변형 하지 완전히 분리 된 초, 및 짧은 펩 티 드 분석 하기 어려운 초12,24같은 어 금 니 질량, 올리고 공유 하는 특징 이다. 또한, 너무 커서 전체 (포함 하 바이러스 성 DNA) 및 adeno 관련 바이러스 (AAV)의 빈 입자 등 초,으로 구분 하는 고분자 어셈블리 전류 구동25 MALS 분석 이전에 의해 해결할 수 있습니다. 초에 비해 전류 구동은 더 다양 한 분리 기능14 그리고 그것이 버퍼 pH, 소금, 유형 및 길이 열, 그리고 다른 유형의 최대 해상도 높이기 위해 여러 매개 변수를 조정의 유연성. 초, 달리는 샘플 주입 전류 구동에 대 한 볼륨 제한이 없습니다 그리고 어떤 분자 크기의 독립적인 분석 될 수 있다 (Amartely 외.12의 Table 1 참조). 이것은 주로 아주 작은 단백질 또는 희석된 단백질 농도 따라 집계를 위한 추세와 같은 낮은 LS 강도, 샘플에 대 한 전류 구동 MALS의 큰 장점은. 분석 전류 구동 열 더 안정 되어 있기 때문에 초 열 보다 적은 입자를 분리 하는 경향이, 전류 구동 MALS 매우 짧은 평형은 시간이 필요, 그리고 LS 신호는 매우 빠르게 안정화. 이 프로토콜에서 설명 된 대로 개별 실험의 실행 및 필요에 따라 실행의 중지 수 있습니다.
초, 달리는 일반적으로 제공 합니다 좋은 결과 단 1 개 (오른쪽 분류 범위 열 사용) 실험, 전류 구동 메서드 매개 변수를 조정 하 여 최적의 해상도 달성 하기 위해 몇 가지 실험 필요할 수 있습니다. 전류 구동 MALS 실험에는 솔트 그라디언트, 버퍼 전도도 수행 되 고, 따라서, RI는 극적으로 RI 신호에 따른 변화, 실행 하는 동안, 변경 합니다. 이 농도 분석은 UV 탐지 (멸종의 선험적 지식이 필요로 제한 기준선 빼기 (5.2 프로토콜의 단계에서와 같이)와 각 전류 구동 MALS 실험 및 분석에 대 한 실행 하는 추가 빈 필요 각 피크에 대 한 계수)입니다. 추가 방법의 개발은 여전히 필요 소금 stepwise 프로그램의 성공적인 초기 빼기에도 기준선 빼기와 분석 선형 그라디언트에 대 한 강력한입니다. 각 피크의 dn/dc 값 특정 버퍼 전도도 eluted 피크 (계산 문학12에서 찾을 수 있습니다)에 따라 조정 되어야 한다. 단백질이이 조정 200 mM (BSA 예제에서 같은), 보다 낮은 NaCl 농도에 eluted 무시할 수입니다.
상대적으로 많은 양의 단백질 초 MALS에 비해 (단계로 2.3 프로토콜의) 전류 구동-MALS에서 사용 되는 소금 기온 변화도의 불완전 한 혼합으로 인해 RI 변동으로 인 한 RI 신호의 극적인 변화를 극복 하는 것이 중요 합니다 그라데이션 완충기입니다. UV 탐지 질량 측정을 위해 사용 하는 경우에 작은 금액을 사용할 수 있습니다. 주입 하는 단백질의 양을 단백질, 균질 성, 순수성, 및 UV 소멸 계수의 분자량에 따라 달라 집니다. 필요한 주입 된 질량 더 작은 단백질을 위해 더 높은 더 큰 단백질 (150 kDa 단백질에 대 한 20 kDa 단백질 및 ~0.2 밀리 그램에 대 한 ~ 1 mg)에 대 한 낮은 해야 합니다. 다른 유형의 샘플 수량 여러 인구 사이 분할 된다 이후 더 많은 샘플의 주입이 필요 합니다. 분석 고성능 액체 크로마토그래피 (HPLC) FPLC 시스템 보다 더 적은 자료를 요구할 수 있습니다.
최근, 정화 절차 동안 MALS를 사용 하 여 인라인 분석 보고 되었습니다. 이러한 실시간 분석은 정화26후 단백질의 어떤 추가 분석에 대 한 필요성을 제거할 수 있는 정화 하는 동안 발생 하는 집계 제품에 대 한 매우 효율적. 전류 구동 크로마토그래피는 자주 중간 정화 단계;로 사용 따라서, 대리점 전류 구동 열 MALS의 조합 뿐만 아니라 대규모 정화 절차에 대 한 실시간 분석으로 뿐만 아니라 분석 특성화 방법으로 유용할 수 있습니다. Nonanalytical 전류 구동 열 입자 방출의 낮은 정도 가진 안정 되어 있으며, 따라서 MALS 함께 사용할 수 있습니다. 친화성 크로마토그래피 또는 소수 교환 크로마토그래피 등 다른 분리 기법 또한 MALS 비교적 순수한 견본을 복종 될 때 (MALS 및 RI 검출기의 오염 방지)을 결합 수 있습니다. 이것은 적응 필요와 최적화 방법 뿐만 아니라 좋은 피크 분리 하지만 또한 충분히 깨끗 한 LS 및 RI의 성공적인 MALS 분석 신호.
공개
D.S.는 와이어 기술 주식 회사, 누구의 제품은이 프로토콜에서 활용의 직원입니다. A.T.는 다니엘 생명 공학, 와이어 및 ÄKTA 악기 대리점의 직원입니다.
감사의 말
저자는 그녀의 조언과 협력 박사 Tsafi Danieli 적용 구조 생물학, 히브리 대학 (울프 센터) 감사합니다. 저자는 또한 지원과이 연구에서 분석 FPLC MALS 시스템의 구축에 대 한 다니엘 생명 공학 회사 (Rehovot, 이스라엘) 감사 합니다.
자료
| Name | Company | Catalog Number | Comments |
| ÄKTA pure | GE Healthcare | 29-0182-26 | FPLC |
| 0.02 µm Anotop Whatman Filter 10 mm | GE Healthcare | 6809-1002 | Sample Filter |
| 0.1 µm Anotop Whatman Filter 10 mm | GE Healthcare | 6809-1012 | Sample Filter |
| 0.1 µm Anotop Whatman Filter 25 mm | GE Healthcare | 6809-2012 | Mobile phase filter |
| BSA (purity >97%) | Sigma | A1900 | Bovine serum albumin |
| miniDAWN TREOS | Wyatt Technology | WTREOS | MALS |
| mono Q HR 5/50 GL | GE Healthcare | 17-5166-01 | Anion exchange analytical column |
| Optilab T-rEX | Wyatt Technology | WTREX | Refractometer |
| 0.1 mm PES 1000 mL Stericup | Millipore | SCVPU11RE | Mobile phase filter |
| Sodium chloride | Sigma | 71382 | HPLC grade NaCl |
| TRISMA base | Sigma | T-1503 | TRIS buffer |
참고문헌
- Lebendiker, M., Danieli, T., de Marco, A. The Trip Adviser guide to the protein science world: a proposal to improve the awareness concerning the quality of recombinant proteins. BMC Research Notes. 7, 585 (2014).
- Raynal, B., Lenormand, P., Baron, B., Hoos, S., England, P. Quality assessment and optimization of purified protein samples: why and how. Microbial Cell Factories. 13, 180 (2014).
- Oliveira, C., Domingues, L. Guidelines to reach high-quality purified recombinant proteins. Applied Microbiology and Biotechnology. 102 (1), 81-92 (2018).
- Manta, B., Obal, G., Ricciardi, A., Pritsch, O., Denicola, A. Tools to evaluate the conformation of protein products. Biotechnology Journal. 6 (6), 731-741 (2011).
- Minton, A. P. Recent applications of light scattering measurement in the biological and biopharmaceutical sciences. Analytical Biochemistry. 501, 4-22 (2016).
- Sahin, E., Roberts, C. J. Size-Exclusion Chromatography with Multi-angle Light Scattering for Elucidating Protein Aggregation Mechanisms. Methods in Molecular Biology. 899, 403-423 (2012).
- Ogawa, T., Hirokawa, N. Multiple analyses of protein dynamics in solution. Biophysical Reviews. 10 (2), 299-306 (2018).
- Rebolj, K., Pahovnik, D., Žagar, E. Characterization of a Protein Conjugate Using an Asymmetrical-Flow Field-Flow Fractionation and a Size-Exclusion Chromatography with Multi-Detection System. Analytical Chemistry. 84 (17), 7374-7383 (2012).
- Liu, H., Gaza-Bulseco, G., Faldu, D., Chumsae, C., Sun, J. Heterogeneity of Monoclonal Antibodies. Journal of Pharmaceutical Sciences. 97 (7), 2426-2447 (2008).
- Hintersteiner, B., et al. Charge heterogeneity: Basic antibody charge variants with increased binding to Fc receptors. mAbs. 8 (8), 1548-1560 (2016).
- Wei, B., Berning, K., Quan, C., Zhang, Y. T. Glycation of antibodies: Modification, methods and potential effects on biological functions. mAbs. 9 (4), 586-594 (2017).
- Amartely, H., Avraham, O., Friedler, A., Livnah, O., Lebendiker, M. Coupling Multi Angle Light Scattering to Ion Exchange chromatography (IEX-MALS) for protein characterization. Scientific Reports. 8 (1), 6907 (2018).
- Goyon, A., et al. Evaluation of size exclusion chromatography columns packed with sub-3μm particles for the analysis of biopharmaceutical proteins. Journal of Chromatography A. 1498, 80-89 (2016).
- Fekete, S., Beck, A., Veuthey, J. -. L., Guillarme, D. Ion-exchange chromatography for the characterization of biopharmaceuticals. Journal of Pharmaceutical and Biomedical Analysis. 113, 43-55 (2015).
- Gasteiger, E., et al. ExPASy: the proteomics server for in-depth protein knowledge and analysis. Nucleic Acids Research. 31 (13), 3784-3788 (2003).
- Kopaciewicz, W., Regnier, F. E. Mobile phase selection for the high-performance ion-exchange chromatography of proteins. Analytical Biochemistry. 133 (1), 251-259 (1983).
- Lebendiker, M., Danieli, T. Production of prone-to-aggregate proteins. FEBS Letters. 588 (2), 236-246 (2014).
- Lebendiker, M., Maes, M., Friedler, A. A screening methodology for purifying proteins with aggregation problems. Methods in Molecular Biology. 1258, 261-281 (2015).
- Fu, D., et al. Ultraviolet refractometry using field-based light scattering spectroscopy. Optics Express. 17 (21), 18878-18886 (2009).
- Scafati, A. R., Stornaiuolo, M. R., Novaro, P. Physicochemical and Light Scattering Studies on Ribosome Particles. Biophysical Journal. 11 (4), 370-384 (1971).
- Berthaud, A., Manzi, J., Pérez, J., Mangenot, S. Modeling Detergent Organization around Aquaporin-0 Using Small-Angle X-ray Scattering. Journal of the American Chemical Society. 134 (24), 10080-10088 (2012).
- Umrethia, M., Kett, V. L., Andrews, G. P., Malcolm, R. K., Woolfson, A. D. Selection of an analytical method for evaluating bovine serum albumin concentrations in pharmaceutical polymeric formulations. Journal of Pharmaceutical and Biomedical Analysis. 51 (5), 1175-1179 (2010).
- Hirano, A., Arakawa, T., Kameda, T. Effects of arginine on multimodal anion exchange chromatography. Protein Expression and Purification. 116, 105-112 (2015).
- Avraham, O., Bayer, E. A., Livnah, O. Crystal structure of afifavidin reveals common features of molecular assemblage in the bacterial dimeric avidins. The FEBS Journal. , (2018).
- Lock, M., Alvira, M. R., Wilson, J. M. Analysis of Particle Content of Recombinant Adeno-Associated Virus Serotype 8 Vectors by Ion-Exchange Chromatography. Human Gene Therapy Methods. 23 (1), 56-64 (2012).
- Patel, B. A., et al. Multi-angle light scattering as a process analytical technology measuring real-time molecular weight for downstream process control. mAbs. 10 (7), 945-950 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유