Method Article
Detection of vascular pathways of oral mucosa influencencing soft- and hard tissue surgeryries by 라텍스 우유 주입에 의한 연조직 및 경조직 수술에 영향을 미치는 구강 점막의 혈관 경로 감지
요약
여기에서는 라텍스 우유 주사를 사용한 혈관 염색에 대해 설명합니다. 이 절차는 구강 점막의 상세한 거시적 혈관 매핑을 위한 구강 혈액 공급에 대한 해부학적 지식을 제공할 뿐만 아니라 합병증을 예방하고 수술 후 상처 치유를 촉진하기 위한 적절한 플랩 설계에 대한 이해를 제공합니다.
초록
이 방법론적 연구의 목적은 구강 점막의 거시적 혈관 경로를 시각화하는 것이었습니다. 시체를 주입하고 방부 처리를 위해 Thiel의 용액으로 고정하여 조직의 자연스러운 색, 신선한 질감 및 탄력성을 유지했습니다. 라텍스 우유 주사는 혈관을 염색하는 데 사용되는 기술입니다. Thiel의 방부 처리 방법과 라텍스 우유 주입의 조합을 통해 외과의는 원시 표본에 대해 작업하고 치주 및 악안면 수술에서 피판/절개 설계를 위해 구강 점막에서 혈관의 분포 및 문합을 거시적으로 식별할 수 있습니다. 라텍스 우유에는 임상의가 혈관의 경로를 방사선 사진으로 시각화할 수 있는 방사선 불투과성 물질이 포함되어 있습니다. Thiel 방부 처리 및 라텍스 우유 주입의 올바른 조정을 위한 단계별 프로토콜이 설명되어 있습니다. 두 가지 방법을 함께 적용하면 임상의가 해부학적 구조를 실질적으로 이해할 수 있습니다. 결과적으로 적절한 절개 부위와 피판을 설계할 수 있어 환자 수술 중 신경혈관 손상, 수술 중 출혈 및 수술 후 이환율을 방지할 수 있습니다.
서문
임플란트, 치조포, 치주 수술에서 적절한 절개 또는 피판을 설계하기 위해서는 해부학적 지식이 중요하다 1,2. 구강 점막은 외부 경동맥(ECA)의 하위 가지에서 발생하는 복잡한 혈관 패턴을 가지고 있습니다. 상악골과 하악골은 주변 결합 조직과 함께 주로 상악동맥(MA), 안면 동맥(FA) 및 설측 동맥(LA)의 가지에 의해 관류됩니다.3,4,5. 임상적 관점에서 볼 때, 혈관 경로의 시각화는 임상의가 수술 중 출혈과 수술 후 이환율을 줄이는 데 필요하다6. 구강 외과 중재술을 시행하는 임상의는 상처 치유 및 혈관 신생을 위한 최적의 조건을 확립하기 위해 혈관 경로의 위치를 알고 있어야 한다7. 구강 점막의 동맥 및 정맥 분포에 대한 자세한 설명은 구강 외과 의사와 치주 전문의가 최적화된 계획을 통해 수술 중 합병증의 위험을 최소화할 수 있도록 합니다.
구강 점막의 혈관을 염색하는 다양한 방법이 있으며, 예를 들어 인도 잉크 주입 및 부식 주조 8,9,10. 선호되는 염색 방법 중 하나는 라텍스 우유 7,8,9,10,11,12를 사용합니다. Haenssgen12 의 정의에 따르면, 라텍스 우유는 탄닌, 단백질, 수지, 설탕, 오일, 알칼로이드 및 잇몸으로 형성된 액체 복합 에멀젼으로 공기에 노출되면 응고됩니다12. 라텍스는 일반적으로 적색제와 혼합되어 총경동맥(CCA) 또는 ECA에 주입되어 가지와 하위 가지의 경로를 시각화합니다. 혈관은 빨갛게 염색되어 해부 중에 더 두드러집니다. 이 방법은 확실한 생체 외 거시 및 현미경 분석을 통해 혈관의 시각화를 통해 임상의에게 귀중한 데이터를 제공하여 견고한 해부학적 기초를 확립합니다. 라텍스 우유에 방사선 불투과성 물질이 존재하기 때문에 이 방법은 기존 X선과 3D 컴퓨터 단층 촬영(CT)5 모두에서 뛰어난 시각화를 보여줍니다.
머리 표본 13,14,15을 방부 처리하는 데 사용할 수 있는 몇 가지 유형의 정착 용액이 문헌에 설명되고 비교됩니다. Walter Thiel은 1992 년에 Thiel의 솔루션을 도입했습니다16,17. 이 솔루션은 조직과 혈관 16,17,18,19,20의 자연스러운 색상을 보존합니다. 감지할 수 있는 냄새가 없고 신체 부위의 조직 탄력성을 유지하고 시체의 항균 보존을 유지하며 새로운 수술 기구의 개발 또는 외과 의사의 기술 평가에 유용할 수 있습니다 16,17,18,19,20.
프로토콜
라텍스 우유 주입 방법은 인체 시체에 양측으로 사용되었으며, 오스트리아 그라츠 의과 대학의 거시 및 임상 해부학과에 기증되었으며, 부서의 기부 프로그램과 스티리아 장례법에 따라 기증되었습니다. 10구의 신선한 시체(남성 5명-여성 5명, 43-90세)가 선택되었습니다. 구강 점막의 혈관 경로를 층별 박리 프로토콜 및 CT와 함께 사용하여 분석했습니다.
구강 점막의 혈관 검사와 함께 라텍스 우유 주입 (그림 1 및 그림 2)
- 드릴(재료 표 참조)로 두정골 사이의 시상 봉합사 중심을 관통하여 상시상동에 도달합니다.
- 흉쇄유돌근과 평행한 경동맥 삼각형을 Nr. 20 또는 Nr. 15 수술용 칼날로 절개합니다. 그런 다음 바이틀라이너 견인기(140mm, 3/4 치아)로 피부의 가장자리, 지방 조직 및 근육을 분리하여 수술 부위를 노출시킵니다.
- Nr. 15 수술용 칼날을 사용하여 CCA를 부드럽게 드러내고 톱니 모양의 드레싱 집게를 사용하여 끝을 막습니다.
- 그런 다음 금속 카테터로 CCA와 상시동을 조심스럽게 캐뉼링합니다.
- CCA의 양쪽에 교대로 매듭이 있는 결찰자를 사용하여 카테터를 분리합니다. 압력을 가해 주입할 때 Thiel의 혈관 내 용액 또는 라텍스 우유가 누출되는 것을 방지하기 위해 카테터를 매우 단단히 고정하십시오.
- 그 후, ~10-15분 동안 공기압 펌프 시스템(0.25–0.5bar)을 사용하여 혈관 내 용액(예: Thiel 또는 인산염 완충 용액)과 함께 CCA와 상시동을 통해 시체 조직을 관류합니다.
참고 : 혈관 내 및 방부 처리 Thiel의 용액의 주요 구성 요소는 질산 암모늄 (고정제), 질산 칼륨 (고정제), 4- 클로로 -3- 메틸 페놀 (고정제), 아황산 나트륨 (고정제), 붕산 (소독), 에틸렌 글리콜 (조직 가소성 보존), 뜨거운 물 (조직의 연화), 포르말린 (소독, 조직 고정제 및 방부 처리) 16 , 17 , 18 , 19 , 20. - (선택 사항) 라텍스 우유를 주입하기 전에 20-30mL의 희석된 암모니아를 주입하여 혈관을 청소합니다.
- 붉은 색제와 라텍스 우유 150mL를 조심스럽게 혼합합니다( 재료 표 참조).
- 공기압 펌프 시스템을 사용하여 약 10-15분 동안 혼합물을 CCA에 주입합니다.
알림: 라텍스 우유를 혼합하고 주입하는 동안 가능한 한 거품이 없도록 주의하십시오. 기포가 있으면 혈관 내부에 틈이 생겨 시체에 외과적 개입을 수행하는 동안 동맥이 파열될 수 있습니다. - 주사하는 동안 동일한 압력 또는 약간 더 높은 압력을 사용하여 라텍스 우유를 구강 안면 영역의 더 미세한 혈관으로 완전히 분배합니다.
- CCA와 하위 가지를 완전히 채우고 염색한 후 주입된 라텍스 우유가 빠져나가는 것을 방지하기 위해 수술용 혈관 클램프로 막습니다.
- 크롬 바나듐 부식 방지 강철 탱크 내부의 Thiel 용액에서 약 6-8 개월 동안 표본을 방부 처리합니다.
- 시체를 지퍼가 달린 폴리에틸렌 비닐 봉지에 넣어 클로로크레졸과 같은 항진균제 및 방부제와 함께 6개월 동안 더 보관한다. 이 기간 동안 과도한 양의 세포 외 액체가 몸 밖으로 밀려나고 표본은 해부할 준비가 됩니다.
참고: 고정 기간이 완료되면 악안면 부위의 조직과 혈관이 준비되고 해부의 강성을 견딜 수 있습니다. 염색된 동맥은 CT 스캔으로 분석할 수 있습니다. 입천장, 전정, 혀 및 악안면 영역의 일부 하위 가지는 점막을 제거하지 않고도 관찰할 수 있습니다. 마지막으로, 2.5배 확대경과 Nr. 15C 수술용 칼날을 사용하여 표본을 해부합니다. 점막 융기는 염색된 동맥을 층별로 절개하여 수행할 수 있으며, 혈관의 경과와 그 변화를 거시적으로 평가할 수 있습니다.
결과
Thiel의 솔루션을 인간 시체의 고정제로 사용하면 수술 기술 및 침습적 임상 절차에 대한 교육이 가능해집니다. Thiel의 솔루션의 중요한 장점 중 하나는 연조직과 경조직의 자연스러운 색상을 유지한다는 것입니다. Thiel의 용액은 포름 알데히드와 같은 다른 많은 정착제에 비해 덜 자극적입니다. 이를 사용하면 턱관절과 저작 및 상악근의 유연성을 얻을 수 있어 치조 사체 수술을 용이하게 합니다. 또한 신경혈관 다발의 질감이 훼손되지 않도록 하여 외과의가 수술 기법을 보다 편리하게 연습할 수 있도록 도와줍니다. Thiel의 방부 처리 방법과 후속 라텍스 우유 주입을 결합하는 것은 악안면 부위의 동맥, 특히 구강 전정과 입천장에 붉은 색 라텍스를 주입하는 자연스러운 일관성으로 냄새가 없고 신선한 시체를 준비하는 명확하고 간단한 접근 방식입니다(그림 3, 그림 4). 라텍스 우유에 방사선 불투과성 물질이 존재하기 때문에 임상의는 머리 표본에 대한 방사선 분석(CT) 분석을 수행할 수 있습니다(그림 5). 그 후, 혈관의 경로를 거시적으로 관찰하여 임플란트 식립, 부비동 바닥 높이기 또는 치주 및 악안면 수술 중에 절개 또는 피판을 만드는 위치와 방법을 이해할 수 있습니다. 기본적인 고형 해부학적 구조를 이해한 결과, 수술을 수행할 때 수용 가능한 수술 후 혈관 신생 및 1차 상처 치유를 달성할 수 있습니다.
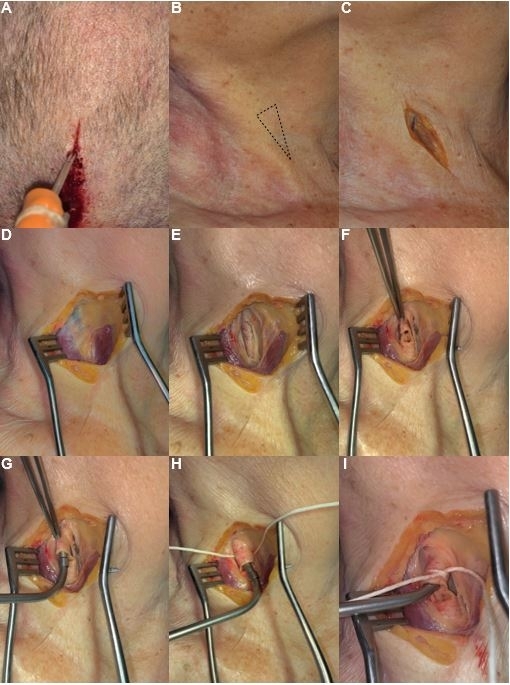
그림 1: Thiel의 용액 및 라텍스 우유 주입을 위한 단계별 프로토콜. (A) Thiel's solution의 주입을 위해 상시상동에 카테터를 삽입하는 것. (B) 경동맥 삼각형의 국소화. (C) 흉쇄유돌근과 평행한 절개를 설계하는 것. (D) 피부 접촉의 분리 및 자궁 경부 지방 조직의 제거. (E) 흉쇄유돌근(측면)과 동모근(omohyoid muscle)의 하복부(내측) 사이의 경동맥초와 경추 근막의 절개. (F) 절개된 총경동맥의 준비. (G) 총경동맥의 카테터 조정. (H) 카테터의 고정 및 격리. (I) Thiel's 용액 주입 및 적색 라텍스 우유 주입 준비가 된 분리된 카테터. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
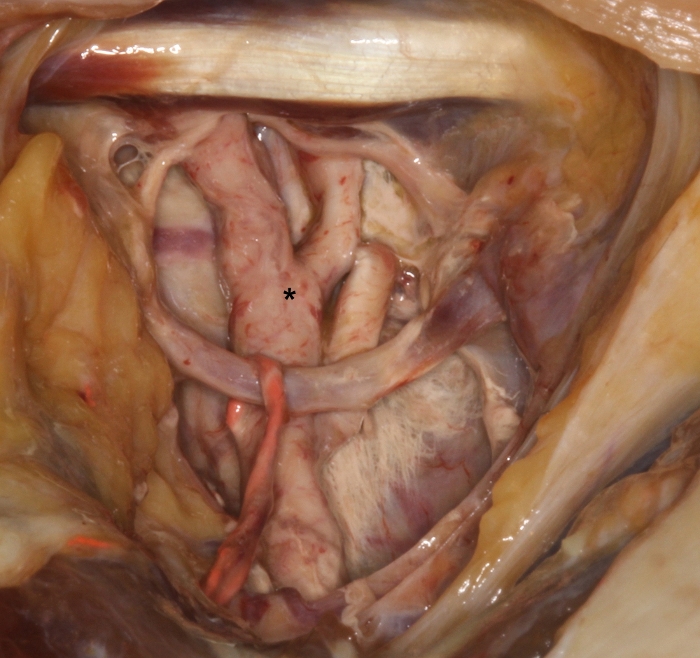
그림 2: 경동맥 삼각선의 상부에 있는 하위 분지가 있는 외부 경동맥(*)에서 경화된 붉은색 라텍스 우유의 시연. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
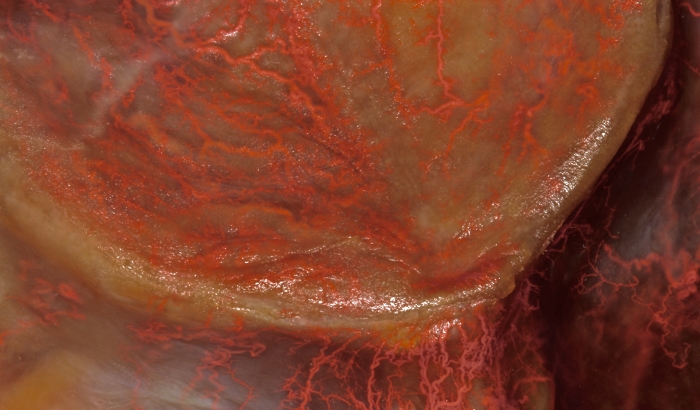
그림 3: 입천장의 혈관 조사. 더 큰 구개(greater palatine)와 비구개(nasopalatine) 분지의 구개 점막 분포는 거시적으로 볼 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
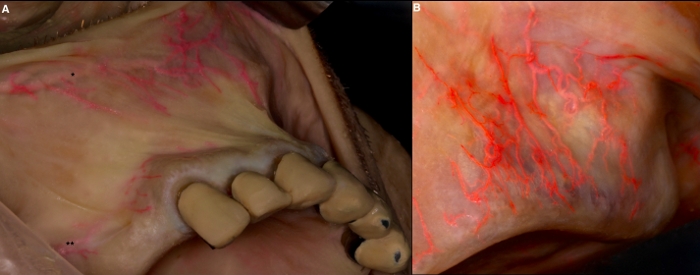
그림 4: 구강 전정의 혈관 조사. (A) 상순(*) 및 후부 상폐포(**) 동맥의 수평 경로와 상부 전정 점막에 공급하는 하위 분기. (B) 상악 현관에 있는 동맥의 수직 방향. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
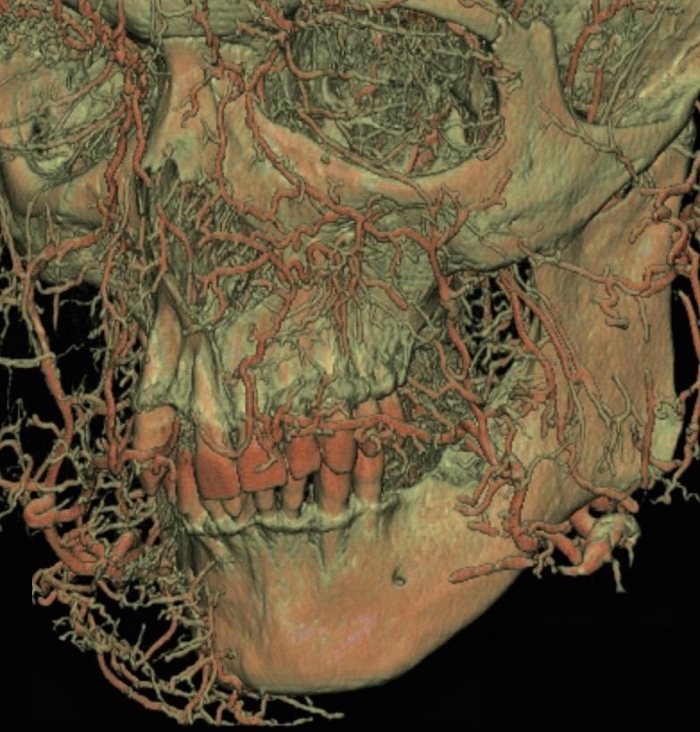
그림 5: 악안면 부위에 붉은색 라텍스 우유를 주입한 다양한 동맥 경로의 CT 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
Thiel의 방부 처리 및 라텍스 우유 주입 방법의 독특한 조합을 통해 구강-악안면 외과 의사와 치주 전문의는 다른 혈관 4,19,20의 방향을 관찰하면서 신선한 표본으로 연습할 수 있습니다. 그러나 혈전으로 인한 막힘 또는 시술 중에 재료를 작은 동맥으로 밀어 넣을 수 있는 충분한 압력을 사용하지 않기 때문에 직경이 작은 혈관의 염색에 몇 가지 제한이 있을 수 있습니다.
Thiel 방부 처리 방법에는 중요한 중요한 이점이 있습니다. 예를 들어, 시체는 자연색 16,17,20으로 보존됩니다. 조직의 탄력성과 탄력성 유지로 인해20,21, 이는 수술 및 구강 수술 중재를 입증하는 훌륭한 방법이다 19,22,23. Thiel 방법은 포름 알데히드와 같은 다른 고정 방법에 비해 무취이며 독성이 적기 때문에 표본 준비가보다 편리합니다 16,17,18,20. 2011년, Benkhedra는 Thiel의 용액과 포르말린24를 비교하여 고정되지 않은 골격근 섬유와 고정된 골격근 섬유의 조직학적 특징을 조사했습니다. 틸(Thiel) 방법으로, 콜라겐 섬유의 배열과 근육의 무결성은 다른 방법에 비해 정렬된 상태로 유지되었다24. 또한, 초음파 유도 연구는 Thiel 방부 처리 방법이 방사선 전문의와 마취과 의사에게 보다 현실적인 결과를 제공한다고 보고했습니다25.
구강 점막에 있는 혈관의 정확한 경로와 문합에 대한 정보가 충분하지 않아 수술 시 부적절한 피판 디자인이 발생할 수 있습니다. 라텍스 우유 주입은 혈관을 염색하고 결과적으로 혈관이 보이게 됩니다 4,11. 이것은 혈관에 대한 해부학적, 생리학적 관계를 발견함으로써 연조직과 경조직의 해부를 용이하게 합니다. 라텍스 우유의 또 다른 필수 특성은 산화납(II,IV)의 존재로 인해 방사선 불투과성이라는 것입니다. 따라서 CT 분석을 통해 혈관의 경로를 3차원으로 관찰할 수 있으며, 이를 통해 작업자는 해부학적 및 혈관 검사에 따라 수술 계획을 세울 수 있습니다. 결과적으로, 다양한 구강 외과 수술에서 신경 손상, 과도한 출혈26 및 조직 괴사 및 1차 상처 치유 지연27과 같은 수술 후 합병증을 예방할 수 있는 적절한 절개를 설계할 수 있다.
공개
저자는 이해 상충이 없습니다.
감사의 말
저자는 그라츠 대학의 거시경 및 임상 해부학과의 모든 동료들에게 특별히 감사를 표하고 싶습니다. Semmelweis University의 해부학, 조직학 및 발생학과의 동료들; 뿐만 아니라 Semmelweis University 치주학과의 Péter Windisch 교수의 연구와 지원에 감사드립니다.
자료
| Name | Company | Catalog Number | Comments |
| Nr. 20 surgical blade | Braun, Tuttlingen, Germany | ||
| 2.5x magnification loupes | Harmonycom | ||
| 4-chloro-3-methylphenol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Air pressure pump system | Heiz-Hofstätter, Graz, Austria | ||
| Ammonium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Block End Serrated Dressing Forceps | VETisco, Chesterfield, England | ||
| Boric acid | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chlorocresol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Chrome Vanadium Corrosion Resistant Steel tanks | |||
| Computed tomography (CT) | Siemens, Emotion, Munich, Germany | ||
| Diluted ammonia | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Drill (PSR, 10.8,LI-2) | Bosch AG, Gerlingen, Germany | ||
| Ethylene glycol | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Formalin | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Hot water | ——————— | ||
| Latexmilch (latex milk) | Creato, Zitzmann Zentrale, Baden, Germany | ||
| Metal catheter | Grall Enterprise, Graz, Austria | ||
| Nr. 15 surgical blade | Braun, Tuttlingen, Germany | ||
| Nr. 15C surgical blade | Braun, Tuttlingen, Germany | ||
| Pintasol red E-L3 mix paste | Mixol-products Diebold GmbH, Kirchheim, Germany | Color agent | |
| Potassium nitrate | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Sodium sulfite | Jäckle Chemie Austria GmbH, Vienna Austria Lactan Chemicals, Graz Austria Brenntag Austria GmbH, Vienna, Austria | ||
| Surgical vessel clamp | Grall, Graz Austria | ||
| Weitlaner Retractor (Self-Retaining) 140mm 3/4 Teeth | VETisco, Chesterfield, England | ||
| Zipper polyethylene bags (plastics) | Wettlinger, Kunststoffe, Vienna, Austria |
참고문헌
- Kleinheinz, J., Büchter, A., Kruse-Lösler, B., Weingart, D., Joos, U. Incision design in implant dentistry based on vascularization of the mucosa. Clinical Oral Implants Research. 16 (5), 518-523 (2005).
- Koymen, R., et al. Flap and incision design in implant surgery: clinical and anatomical study. Surgical and Radiologic Anatomy. 31 (4), 301-306 (2009).
- Choi, J., Park, H. S. The clinical anatomy of the maxillary artery in the pterygopalatine fossa. Journal of Oral and Maxillofacial Surgery. 61 (1), 72-78 (2003).
- Shahbazi, A., et al. Analysis of blood supply in the hard palate and maxillary tuberosity-clinical implications for flap design and soft tissue graft harvesting (a human cadaver study). Clinical Oral Investigations. 23 (3), 1153-1160 (2019).
- Pilsl, U., Anderhuber, F., Neugebauer, S. The Facial Artery-The Main Blood Vessel for the Anterior Face. Dermatologic Surgery. 42 (2), 203-208 (2016).
- Akolkar, A. R., et al. Bleeding control measures during oral and maxillofacial surgical procedures: A systematic review. Journal of Dental Research and Review. 4 (4), 79-89 (2017).
- Arnold, F., West, D. C. Angiogenesis in wound healing. Pharmacology & Therapeutics. 52 (3), 407-422 (1991).
- Yu, Q. X., et al. The microvasculature of human oral mucosa using vascular corrosion casts and India ink injection. I. Tongue papillae. Scanning Microscopy. 6 (1), 255-262 (1992).
- Yu, Q. X., Pang, K. M., Ran, W., Philipsen, H. P., Chen, X. H. The microvasculature of human infant oral mucosa using vascular corrosion casts and india ink injection. II. Palate and lip. Scanning Microscopy. 8 (1), 133-139 (1994).
- Bergeron, L., Tang, M., Morris, S. F. A review of vascular injection techniques for the study of perforator flaps. Plastic and Reconstructive Surgery. 117 (6), 2050-2057 (2006).
- Alvernia, J. E., Pradilla, G., Mertens, P., Lanzino, G., Tamargo, R. J. Latex injection of cadaver heads: technical note. Neurosurgery. 67, 362-367 (2010).
- Haenssgen, K., Makanya, A. N., Djonov, V. Casting Materials and their Application in Research and Teaching. Microscopy and Microanalysis. 20 (2), 493-513 (2014).
- Jaung, R., Cook, P., Blyth, P. A comparison of embalming fluids for use in surgical workshops. Clinical Anatomy. 24 (2), 155-161 (2011).
- Balta, J. Y., Lamb, C., Soames, R. W. A pilot study comparing the use of Thiel- and formalin-embalmed cadavers in the teaching of human anatomy. Anatomical Sciences Education. 8 (1), 86-91 (2015).
- Hayashi, S., et al. Saturated salt solution method: a useful cadaver embalming for surgical skills training. Medicine. 93 (27), 196 (2014).
- Thiel, W. The preservation of the whole corpse with natural color. Annals of Anatomy. 174 (3), 185-195 (1992).
- Thiel, W. An arterial substance for subsequent injection during the preservation of the whole corpse. Annals of Anatomy. 174 (3), 197-200 (1992).
- Thiel, W. Ergänzung für die Konservierung ganzer Leichen nach W. Thiel. Annals of Anatomy. 184 (3), 267-269 (2002).
- Okada, R., et al. Thiel's method of embalming and its usefulness in surgical assessments. Nihon Jibiinkoka Gakkai Kaiho. 115 (8), 791-794 (2012).
- Ottone, N. E., Vargas, C. A., Fuentes, R., Del Sol, M. Walter Thiel's Embalming Method. Review of Solutions and Applications in Different Fields of Biomedical Research. International Journal of Morphology. 34 (4), 1442-1454 (2016).
- Peuker, E. T., Werkmeister, R., Pera, F., Joos, U., Filler, T. J. Surgical procedures in mouth, jaw and facial surgery in Thiel embalmed body donors. Mund Kiefer Gesichtschir. 5 (2), 141-143 (2001).
- Wolff, K. D., Kesting, M., Mücke, T., Rau, A., Hölzle, F. Thiel embalming technique: a valuable method for microvascular exercise and teaching of flap raising. Microsurgery. 28 (4), 273-278 (2008).
- Hölzle, F., et al. Thiel embalming technique: a valuable method for teaching oral surgery and implantology. Clinical Implant Dentistry and Related Research. 14 (1), 121-126 (2012).
- Benkhadra, M., et al. Flexibility of Thiel's embalmed cadavers: the explanation is probably in the muscles. Surgical and Radiologic Anatomy. 33 (4), 365-368 (2011).
- Benkhadra, M., et al. Comparison of fresh and Thiel's embalmed cadavers according to the suitability for ultrasound-guided regional anesthesia of the cervical region. Surgical and Radiologic Anatomy. 31 (7), 531-535 (2009).
- Lamas Pelayo, J. Intraoperative complications during oral implantology. Medicina Oral, Patología Oral y Cirugía Bucal. 13 (4), 239-243 (2008).
- Lim, G., Lin, G. H., Monje, A., Chan, H. L., Wang, H. L. Wound Healing Complications Following Guided Bone Regeneration for Ridge Augmentation: A Systematic Review and Meta-Analysis. The International Journal of Oral & Maxillofacial Implants. 33 (1), 41-50 (2018).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유