Method Article
미세 소관 선인장체의 자체 조립
요약
이 기사는 MAP65, 식물 기반 미세 소관 가교제 및 PEG를 크라우밍 제로 사용하여 촉각제 모양의 미세 소관 어셈블리를 형성하기위한 프로토콜을 제시합니다.
초록
세포 골격은 세포 내에서 주요 내부 조직 및 재구성을 담당하며, 모두 변화를 지시 할 관리자없이 이루어집니다. 이것은 특히 유사분열 또는 meiosis 동안 미세 소관이 세포 분열 중에 스핀들을 형성하는 경우입니다. 스핀들은 세포 분열 중에 유전 물질을 분리하는 데 사용되는 기계입니다. 시험관 내에서 자체 조직 된 스핀들을 만들기 위해 우리는 최근에 미세 소관 관련 단백질 및 군중 제제의 최소 세트로 스핀들 모양의 어셈블리로 미세 소관을 재구성하는 기술을 개발했습니다. 구체적으로, MAP65가 사용되었는데, 이는 식물로부터의 항평행 미세소관 가교결합제이며, 효모로부터의 Ase1 및 포유동물 유기체로부터의 PRC1의 상동체이다. 이 가교제는 미세 소관을 길고 얇고 스핀들과 같은 미세 소관 자체 조직 어셈블리로 자체 조직화합니다. 이 어셈블리는 또한 액정 촉각과 유사하며, 미세 소관은 메조 스케일 메조겐으로 사용될 수 있습니다. 여기에서는 이러한 미세 소관 촉각을 만들 뿐만 아니라 형광 현미경을 사용하여 어셈블리의 모양을 특성화하고 광표백 후 형광 회수를 사용하여 구성 요소의 이동성을 특성화하기 위한 프로토콜이 제시됩니다.
서문
유사분열을 통한 세포 분열은 생명을 유지하는 가장 중요한 생물학적 과정 중 하나입니다. 튜불린 이량체로 구성된 미세 소관 필라멘트는이 과정의 필수 구조 요소입니다. 염색체가 세포 중심에서 정렬될 때 메타페이즈에서 생성된 과도 기계류는 실로 덮인 직조기의 스핀들과 같은 모양 때문에 유사분열 스핀들이라고 불립니다(그림 1A). 많은 유기체에 걸쳐 미세 소관이 메타 페이즈에서 응축 된 염색체를 세포의 중심으로 밀어 넣고 당겨서 정렬하고 아나 페이즈에서 분리되는 미세 소관에 연결하는 데 사용된다는 것은 잘 알려져 있습니다 (그림 1B, C). 스핀들은 meiosis (그림 1B)와 유사 분열 (그림 1C) 모두에서 형성되며, 스레드처럼 중심축을 감싸지 않고 인터페이스와 평행하게 실행되는 많은 겹치는 미세 소관에서 생성됩니다. 이러한 미세 소관 기반 구조를 만들려면 가교 결합 된 관련 단백질과 염색체1을 밀고 당기는 데 도움이되는 모터 역할을 할 수있는 관련 효소가 필요합니다.
meiotic spindles 에 대한 연구에 따르면 미세 소관은 짧고 동적이며 가교 된 배열 2,3,4,5,6 에서 겹치는 것으로 나타났습니다 (그림 1Di). 이러한 짧은 미세 소관의 물리적 조직으로 인해 meiotic 스핀들은 액정 선탠토이드와 유사합니다 (그림 1E). 실제로, 스핀들은 액정 촉각제5에서 기대할 수 있듯이 합체되고 병합되는 것으로 나타났습니다.
1960 년대로 거슬러 올라가는 많은 연구에서는 고정, 직렬 섹션 및 전자 현미경을 사용하여 유사 분열 스핀들 7,8,9,10 내부에 두 가지 유형의 미세 소관이 있음을 확인했습니다. 첫 번째 유형은 스핀들 극을 키네토코레에 연결하는 kinetochore microtubules라고합니다. 두 번째 유형은 염색체를 지나서 자라며 중간 영역에서 겹치는 극간 또는 극성 미세 소관이라고합니다 (그림 1Dii) 8,9,10. 세 번째 유형은 스핀들 외부에 있고 극을 세포 가장자리에 연결하는 아스트랄 미세 소관이라고합니다. 이러한 미세 소관 조직은 현재 논의의 범위를 벗어납니다. 오그민6과 감마-튜불린 고리 복합체 사이의 상호작용에 대한 최근의 연구가 미세소관의 핵형성 중심에 영향을 미치며, 그 결과 도 1D와 같이 더 짧은 미세소관을 갖는 유사분열 스핀들을 초래한다.
미세 소관은 넓은 것보다 길기 때문에 높은 종횡비와 높은 강성을 가지고 있기 때문에 액정 분자의 확장 된 버전과 같습니다. 연질 물질 물리학에서, 원자와 분자는 핵형성 및 결정(11)의 용융을 포함하는 상전이의 물리적 메카니즘을 추론하기 위해 최소한의 상호작용을 사용하여 근사화되었다. 마찬가지로, 미세 소관은 액정 분자의 확장 된 버전 인 중규모 객체로, 등방성 물질로부터 네마틱 상들의 핵화 및 성장을 포함하여 액정 역학의 물리학에 대한 통찰력을 제공합니다. 또한, 상기 논의된 바와 같이, 마이오틱 스핀들은 액정 분자 3,4,5의 등방성 상태로부터 핵을 형성하고 성장하는 네마틱 상태인 액정 촉각의 것과 같은 특성을 나타낸다. 촉각의 경우, 핵형성 및 성장은 다른 결정의 핵과 같다(즉, 비교적 높은 농도의 메조겐[액정을 형성하는 분자]를 필요로 함). 선인장의 독특한 "스핀들" 모양은 네마틱 상에 정렬되는 액정 메조겐의 국부적 정렬에서 비롯됩니다(그림 1E). 분자가 매우 비대칭적이기 때문에 둥근 결정을 형성 할 수 없습니다. 미세 소관의 특성을 감안할 때, 미세 소관의 높은 국소 농도로 만들어진 유사 분열 스핀들 - 기계가 선인장 또는 스핀들이라고하는 것과 같은 모양이라는 것은 놀라운 일이 아닙니다. Tactoids는 양극성일 수 있으며, 극은 테이퍼 끝(그림 1Ei)에 있거나 균질할 수 있으며, 극은 무한대에서 효과적으로 나타납니다(그림 1Eii).
스핀들 형성의 중요성을 감안할 때, 이온성 종 12,13, 고갈 상호작용을 생성하는 크라우드 제제 14,15, 및 특정 미세 소관가교 단백질 13,16,17,18,19를 통해 다발로 미세소관 축합을 시연함으로써 시험관 내에서 자체 조직화된 스핀들 형성을 향한 노력이 진행되고 있으며, 21. 놀랍게도,이 약제는 모두 미세 소관의 국소 농도를 증가시키기 위해 노력하지만, 종종 긴 미세 소관 다발을 초래하지만 촉각제는 아닙니다. 이러한 번들이 긴 한 가지 이유는 그들을 구성하는 미세 소관도 길기 때문일 수 있습니다. 더 짧은 미세 소관을 사용한 최근의 연구는 또한 끝15에서 테이퍼되지 않는 더 긴 번들을보고했다. 이 경우, 번들은 번들의 확장을 일으키는 모터 단백질과 함께 유지되어 더 길어집니다. 비인장 가교결합제를 갖는 짧은 미세세관은 여기에 설명된 바와 같이 테이퍼링된 스핀들형 어셈블리에 필요하다.
최근에, 우리는 핵을 형성하는 안정한 미세소관(22)의 존재 하에, 항평행 가교결합제인 MAP65를 사용하여 미세소관 촉각의 생성을 가능하게 하는 기술을 개발하였다. 미세소관은 짧을 필요가 있었지만, 미세소관 길이의 알려진 조절제는 거의 없으며, 미세소관은 동적 불안정성 또는 종단간 어닐링에 대항하여 미세소관을 캡핑할 수 있다. 대신, GMPCPP는 성장 후 필라멘트를 핵으로 만들고 안정화시키기 위해 사용되었다. 이것은 촉각으로 자체 조직 할 수있는 짧은 미세 소관의 고밀도를 만들 수있었습니다. 이들 촉각제는 복굴절 하에서 볼 때 동질적이었다. 짧은 미세소관 이외에, 특정 항평행 가교결합제인 MAP65가 촉각을 형성하기 위해 사용되었다(도 2). MAP65는 유사분열성 가교결합제(23)의 PRC1/Ase1 패밀리 내의 식물 미세소관-관련 단백질이다. MAP65는 이량체로서 존재하며, 미세소관(24)뿐만 아니라 그 자체에 결합하는 강한 친화력을 갖는다. 양극성이고 액정의 액체 유사 특성을 갖는 액틴 필라멘트 25,26,27 로 관찰된 마이오틱 스핀들 및 촉각과는 달리, 미세소관 촉각은 고체형22,28인 것으로 관찰되었다.
여기에서는 미세 소관 촉각을 만들고 형광 기반 기술을 사용하여 어셈블리의 모양과 구성 요소의 이동성을 특성화하기위한 프로토콜이 제시됩니다.
프로토콜
참고: 달리 명시되지 않는 한, 실험의 일부는 적절한 보호 장비(장갑)를 착용하면서 실험실 벤치에서 수행할 수 있습니다.
1. 커버슬립 실란화
참고: 커버슬립은 이러한 실험에 사용된 폴리머 브러시 코팅과 함께 사용하려면 실란화되어야 합니다. 이것은 소수성 실란화 처리로 소수성 중앙 블록과 블록 공중합체가 결합하고 폴리머 브러시를 만들 수 있습니다. 장갑을 착용하는 동안 독성 증기에 노출되는 것을 방지하기 위해 흄 후드에서 다음 단계를 수행해야합니다. 디메틸 디클로로실란은 독성이 강하므로 최대한의주의를 기울여 다루어야합니다.
- 커버슬립을 ddH2O, 70% 에탄올 및ddH2O로 순서대로 헹구십시오. 각 헹굼 사이에 보풀이없는 실험실 물티슈로 말리십시오. 이것은 처리 전에 표면에서 먼지와 수용성 또는 유기 입자를 제거합니다.
- 커버슬립을 금속 커버슬립 홀딩 랙에 넣고 랙을 UV-Ozone(UVO) 기계로 옮깁니다. 커버슬립을 UVO로 20분 동안 조사하여 배경 형광을 제거합니다. UVO 대신 플라즈마 챔버를 사용할 수 있습니다.
- 핀셋을 사용하여 UVO 처리에 사용되는 금속 랙에서 실란화에 사용되는 다른 금속 랙으로 커버슬립을 옮깁니다. UVO를 적용할 때 높은 수준의 산화를 일으킬 수 있으므로 두 랙 모두에 동일한 랙을 사용하지 마십시오. 랙을 물과 에탄올로 미리 청소하여 이전 사용에서 잔류 화학 물질이 남아 있지 않도록하십시오.
- 커버슬립으로 랙을 100% 아세톤이 있는 용기에 담그고 1시간 동안 담그십시오. 용기를 수돗물로 3x 헹구고ddH2O로 3x를 헹구어 아세톤을 모두 제거하였다.
- 커버슬립으로 랙을 100% 에탄올에 10분 동안 담그십시오. 용기를 수돗물로 3x 헹구고ddH2O로 3x를 헹구어 에탄올을 모두 제거하십시오.
- 랙을 커버슬립 3x를ddH2O에 각각 5분 동안 담그십시오.
- 커버슬립을 0.1 M KOH (450 mL의ddH2O중 50 mL의 1 M KOH)에 15분 동안 침지시킨다. 용기를 수돗물로 3x 헹구고ddH2O로 3x를 헹구어 모든 KOH를 제거하십시오.
- 랙을 커버슬립 3x ddH2O에 각각 5분 동안 담그십시오.
- 커버슬립으로 랙을 흄 후드 또는 층류 후드에서 하룻밤 사이에 공기 건조시킵니다.
- 랙과 커버슬립을 완전히 건조시킨 후, 실란에 특별히 사용되는 다른 용기에 취한 2% 디메틸디클로로실란(DDS)에 5분 동안 담그십시오. 건조하지 않은 것이 실란과 접촉하지 않도록하십시오.
- 랙을 담그고 커버슬립을 2x 100% 에탄올이 든 용기에 담가 5분 동안 담그십시오. 용기를 수돗물로 3x 헹구고 ddH 2 O로3x를헹구십시오.
- 랙을 담그고 커버슬립을 각각 5분 동안ddH2O에 3배 담그십시오.
- 커버슬립으로 랙을 흄 후드 또는 층류 후드에서 하룻밤 사이에 공기 건조시킵니다.
- 이 마지막 건조 단계가 끝나면 핀셋을 사용하여 커버 슬립을 커버 슬립 박스로 다시 옮깁니다. 이 커버 슬립은 향후 1-2 개월 동안 사용할 수 있습니다. 오래된 커버 슬립은 코팅을 잃기 시작하므로 폐기해야합니다.
2. 투불린 준비
참고 : 구입 한 튜불린은 라벨이 없거나 형광단으로 표시된 동결 건조 된 분말로 제공됩니다. 동결건조된 튜불린은 -80°C 냉동고에 보관된다. 다음 절차는 시각화에 좋은 비율로 레이블이 지정되지 않은 튜불린과 레이블이 지정된 튜불린을 혼합하는 데 사용됩니다.
- 동결건조된 튜불린 분말 1mg을 함유하는 표지되지 않은 튜불린의 분취량을 -80°C 냉동고에서 제거하고 얼음 위에 보관한다. 튜브에 차가운 PEM-80 200 μL를 첨가하여 튜불린 농도를 5 mg/mL로 높입니다. 모든 동결 건조물을 용해시키기 위해 10 분 동안 얼음 위에 보관하십시오.
- 동결건조된 튜불린 분말 20 μg을 함유하는 로다민 표지된 튜불린의 한 분취량을 -80°C 냉동고에서 제거하고 얼음 위에 보관한다. 튜브에 차가운 PEM-80 4μL를 첨가하여 튜불린 농도를 5mg/mL로 높입니다. 동결 건조물을 완전히 용해시키기 위해 10 분 동안 얼음 위에 보관하십시오.
- 일단 용해되면, 100 μL의 표지되지 않은 재현탁된 튜불린 용액을 로다민 표지된 튜불린의 4 μL 용액에 첨가한다. 피펫 6x-7x는 매우 천천히 혼합됩니다. 응집체가 보이는 경우, 가용화된 튜불린을 90,000 x g 에서 10분 동안 원심분리하여 펠렛을 버리고 상청액을 유지함으로써 응집체를 제거한다. 이 튜불린 믹스는 ~ 4 % 라벨링 된 튜불린을 초래할 것입니다.
- 나머지 100 μL의 표지되지 않은 튜불린을 액체 질소(LN2)로 적가하고, 이를 -80°C에서 저장하여 추가적인 튜불린 믹스에 사용한다.
- 표지된 튜불린 믹스 및 분취량을 각각 15 μL의 일곱 개의 튜브로 취한다. 각각의 분취량은 단일 실험 챔버에 사용될 수 있다. 나머지 분취량을 적하하고 향후 실험을 위해 -80°C에 보관한다.
3. MAP65 정제
참고 : MAP65는 상업적으로 이용 가능하지 않으므로이 작업을 위해 정제해야합니다. 이 프로토콜은 이전에 여러 간행물23,29에서 정교하게 설명되었습니다.
- MAP65 플라스미드 및 GFP-MAP65 플라스미드를 단백질 발현을 위해 BL21 박테리아 균주로 형질전환시킨다.
- BL21 박테리아를 600 nm에서 0.6-1의 광학 밀도로 성장시킨다. lac 오퍼레이터를 사용하여 단백질 생산을 유도하고 박테리아를 밤새 성장시킨다.
- 배양물을 펠릿화하고 박테리아를 용해시킨다.
- 원심분리 후 용해물을 수집하고 6x-히스티딘 태그에 결합할 수 있는 니켈 이온이 있는 비드와 함께 인큐베이션한다.
- 이미다졸을 사용하여 단백질을 제거하고 탈염하십시오.
- 단백질을 액체 질소로 적하하고 -80 °C에서 보관하여 1 년 이내에 사용하십시오.
4. 유동 챔버의 조립
참고: 실험은 유리 슬라이드와 실란화 커버 글래스로 만든 유동 챔버에서 수행됩니다(그림 3).
- 유리 슬라이드를 가져 와서 ddH2O, 에탄올 및ddH2O를순서대로 사용하여 청소하십시오. 각 헹굼 사이에 보풀이없는 실험실 닦음으로 말리십시오.
- 양면 테이프를 사용하여 흐름 경로를 만듭니다. 장갑을 낀 손을 사용하여 테이프를 ~ 25-30mm 길이로 자릅니다. 테이프를 길이 방향으로 분할하여 두 개의 더 얇은 스트립을 만듭니다. 두 테이프 스트립을 슬라이드 사이에 약 5-8mm로 놓습니다.
참고: 테이프의 두께가 약 80-100 μm로 표준화됨에 따라 테이프 조각 사이의 경로 폭이 챔버의 부피를 결정합니다. - 실란화된 커버슬립을 유동 경로 위에 놓습니다. 펜 뒷면으로 테이프 영역을 부드럽게 눌러 슬라이드와 커버슬립을 양면 테이프 스트립에 밀봉합니다. 전체 지역에 걸쳐 좋은 인감을 확보하십시오. 씰이 잘 만들어지면 테이프가 반투명에서 투명으로 바뀌어야합니다.
- 가장자리에 있는 여분의 테이프를 제거하고 면도날로 테이프를 절단하여 유동실 입구에서 1mm만 남겨 둡니다.
- 필요에 따라 챔버에 실험 매개 변수에 대한 정보를 표시하십시오.
5. 선탠토이드 실험
참고 : 일단 모든 시약과 공급품이 생성되면, 그들은 유동 챔버에서 미세 소관 촉각을 핵화하고 중합하는 데 사용될 수 있습니다.
- 사용할 모든 시약을 수집합니다. 얼음 위에 해동하고 작업하는 동안 얼음 위에 보관하십시오. 실험을위한 여러 개의 흐름 챔버를 만듭니다.
- 각 실험에 대해 하나의 유동 챔버를 사용하십시오. PEM-80에 용해된 5% 비이온성 블록 공중합체 계면활성제(Table of Materials)의 20 μL를 유동 챔버 표면으로 흘려서 폴리머 브러시로 코팅하고, 챔버의 양쪽 말단에 작은 방울을 넣어 내부에 기포가 형성되는 것을 방지한다. 이것을 사용할 준비가 될 때까지 습한 챔버 (즉, 젖은 보풀이없는 실험실 닦아낸 페트리 접시)에 보관하십시오 (적어도 5-7 분).
- 멸균 튜브에서, 다음을 혼합하여 투불린-MAP 믹스를 생성한다: 9.5 μL의 PEM-80; 4 μL의 10 mM GMPCPP; 4 μL의 5% 플루로닉-F127; 1 μL의 1M DTT; 1 μL의 글루코스; 2 μL의 폴리에틸렌 글리콜 (PEG); 단계 2.5로부터 12 μL의 5 mg/mL 튜불린 믹스 (13.6 μM 최종 농도); MAP65의 작업 재고 5.5 μL를 10 %는 시각화를위한 GFP-MAP65입니다. 혼합하는 동안 얼음 위에 보관하십시오.
참고 : 점성 PEG 용액을 처리하기 위해 포지티브 변위 피펫을 사용하는 것이 좋습니다. 일반 피펫은 개구부를 더 크게 만들기 위해 팁을 절단 한 후에 사용할 수 있습니다. 그러나이 방법은 덜 정확합니다. - 피펫팅으로 5x-6x를 혼합하십시오.
- 챔버에 첨가하기 직전에 글루코스 옥시다제 (0.5 mg / mL)와 카탈라제 (0.15 mg / mL) (데옥시)의 사전 혼합 용액 1 μL를 Tubulin-MAP 믹스에 넣고 7x-8x를 혼합하십시오. 용액 (40 μL)의 총 부피를 두 부분으로 나누어 별도의 챔버에 사용하십시오.
- Tubulin-MAP 믹스를 챔버로 흐르십시오. 챔버에는 이미 비이온성 블록 코폴리머 계면활성제가 있기 때문에 오래된 액체를 제거하지 않고는 더 많은 액체를 첨가 할 수 없습니다. 이렇게하려면 챔버의 다른 쪽 끝에있는 여과지 또는 보풀이없는 실험실 닦아내기를 사용하여 모세관 작용을 통해 액체를 제거하십시오.
- 샘플이 챔버 내부에 완전히 들어가면 5 분 에폭시를 사용하여 챔버의 두 끝을 밀봉하고 ~ 30 분 동안 37 °C에서 유지하여 미세 소관 촉각을 핵으로 만들고 성장시킵니다.
6. 형광현미경 검사
- 촉각을 이미징하기 위해 형광 현미경을 사용하십시오.
참고 : 총 내부 반사 형광 현미경 또는 회전 디스크 공초점 현미경은 자유 튜불린에서 배경 형광을 제거하는 것이 좋지만 촉각은 정기적 인 에피 형광 및 심지어 투과 광 현미경으로 볼 수 있으므로 특수 장비없이이 절차를 수행 할 수 있습니다. - 1.2 NA 이상의 수치 개구(NA) 목표를 60x 이상의 배율로 사용하여 형광에서 충분한 광을 수집하십시오. 이러한 목표는 종종ddH2O또는 오일에 침지해야합니다.
- CMOS 또는 CCD 카메라로 이미지를 녹화합니다. 108nm 카메라에서 유효 픽셀 크기를 사용합니다.
참고: 픽셀 크기는 카메라와 사용된 배율에 따라 다르며, 이 경우 수치가 높은 조리개(1.2 또는 1.49 NA)의 경우 60x 또는 100x입니다. 필요한 픽셀 크기를 얻기 위해 카메라 전에 추가 이미지 확장기를 사용할 수 있습니다. - 샘플을 이 온도로 설정된 환경 챔버를 사용하여 37°C에서 보관하십시오. 또는 열풍 스테이지 히터 및 순환하는 따뜻한 물이있는 객관적인 온도 제어 칼라를 포함한 다른 스테이지 히터를 사용하십시오.
- 필요한 형광에 맞는 여기 소스를 사용하십시오. 로다민 튜불린의 경우 샘플에서 최소 1mW의 전력을 가진 561nm 레이저를 사용하고 GFP-MAP65의 경우 샘플에서 최소 1mW의 전력을 가진 488nm 레이저를 사용하십시오.
참고: 광역 에피형광 현미경을 사용하는 경우 여기가 있는 로다민 필터 큐브를 사용합니다: 540 ± 12.5nm, 이색성: 545nm ± 12.5nm 컷오프 및 방출: 575nm 길이 패스, 여기가 있는 GFP 필터 큐브: 480 ± 15nm, 이색성: 505nm ± 15nm 컷오프, 방출: 515nm 길이 패스. - 서로 다른 영역의 최소 10 개의 이미지를 가져 와서 100 개 이상의 촉각을 이미지화하십시오. 빨간색과 녹색 채널 모두에서 이미지를 가져와 분석을 위해 16비트 tiff 이미지로 저장합니다. 조명 전원과 노출 시간이 카메라의 강도 척도가 포화되지 않도록 해야 합니다.
7. 광표백 후 형광 회복 (FRAP)
참고 : 촉각의 내부 구성 요소의 이동성을 연구하기 위해 FRAP가 사용되었습니다. FRAP는 로다민 표지된 튜불린 및 GFP 표지된 MAP65 선석의 선택된 부분을 광표백한 다음, 그 부위에서 시간에 따른 형광의 회복을 관찰함으로써 작용한다. 회복 속도는 광표백되는 종의 회전율에 달려 있습니다. 이러한 턴오버 속도는 확산 및 결합 반응에 의존할 수 있다. 촉각제에 대한 MAP65 결합의 경우, 결합 환율을 추정 할 수 있습니다. FRAP는 모든 형태의 레이저를 스캔 할 수있는 추가 405nm 레이저 시스템을 사용하여 수행됩니다. FRAP을 수행하기 위한 많은 가능성들이 존재하는데, 여기에는 광 표백제를 로컬 영역(14)에 송신된 램프 및 개구를 사용하는 것을 포함한다.
- 챔버에서 격리 된 선탠토이드를 선택하여 촉각과 주변 용액의 일부를 덮는 관심 영역 (ROI)을 만듭니다.
- FRAP용 추가 405nm 레이저가 있는 현미경을 사용하여 튜불린과 MAP65를 동시에 광표백합니다. 대안적으로, 밝은 램프가 홍채(14)의 필드 스톱을 통해 사용될 수 있다. 표백 중에 단백질이 손상되지 않도록 광표백 시스템의 특정 강도를 경험적으로 조정하십시오.
- 광표백 전에 30-60 초 동안 시계열 영화로 전술을 기록하여 표백 전의 강도에 대한 정보를 얻으십시오. 빨간색과 녹색 채널을 모두 기록합니다.
- 촉각을 손상시키지 않고 광표백제에 필요한 기간 동안 레이저 또는 램프로 ROI를 노출시켜 선인장체를 표백합니다. 강도와 시간을 경험적으로 결정하십시오.
- 포토 표백 후 5-10 분 동안 또는 회복이 평형에 도달 할 때까지 두 색상 채널에서 동영상을 계속 녹화하십시오.
- 복구를 위해 GFP-MAP65 채널을 육안으로 검사합니다.
8. 데이터 분석
참고 : 촉각제 이미지의 정량적 분석은 다른 혼잡 제제, 이온 조건 및 다른 요인의 첨가를 통해 부과 된 환경 변화의 영향에 대해 배우기 위해 수행되었습니다.
- 선인장 모양 특성화
- 공초점 현미경으로 촬영한 적색 및 녹색 이미지에서 촉각의 길이와 너비를 정량화합니다.
- FIJI/ImageJ를 사용하여 이미지를 엽니다.
- 원시 데이터를 16비트로 가져오는 경우 필요한 경우 밝기와 대비를 조정합니다. 이미지 > 밝기 및 대비 조정> 선택하여 선탠토이드를 명확하게 볼 수 있도록 이미지를 조정합니다. 실수로 강도 데이터를 변경하지 않도록 설정을 적용하지 않고 밝기와 대비를 조정합니다.
- 촉각이 명확하게 보이면 측정할 좋은 촉각을 선택합니다(그림 4Bi). 촉각이 다른 선인장이나 응집체와 겹치지 않고 명확하게 보이고, 직선 측정 도구를 사용할 수 있도록 구부러지거나 구부러지지 않았는지 확인하십시오.
- 그런 다음 이미지에 대해 올바른 픽셀 크기가 설정되어 있는지 확인하십시오. 현미경 이미지에는 픽셀 크기에 대한 메타데이터가 함께 제공됩니다. 메타데이터가 없는 다른 카메라 또는 예상되는 유효 픽셀 크기를 변경할 수 있는 외부 이미지 확장 시스템을 사용하는 경우 픽셀 크기를 수동으로 조정하십시오. FIJI/ImageJ에서 분석 > 배율 설정 으로 이동하여 올바른 픽셀 변환을 설정합니다.
- FIJI/ImageJ의 도구 모음에서 직선 도구를 사용하여 선토이드의 한쪽 끝을 클릭하고 커서를 선탠토이드의 다른 쪽 끝으로 끕니다(그림 4Bii). 라인 ROI가 선택되면 분석 > 측정을 선택하여 길이를 측정합니다. 길이가 기본적으로 측정되지 않는 경우 측정 분석 > 설정 대화 상자에 길이를 포함하도록 측정값을 설정해야 합니다.
참고: 일반적으로 직선 도구를 사용하여 측정할 때 그려진 선의 길이와 각도를 제공합니다. 예를 들어, 그림 4Bii 는 선인장의 측면에 그려진 직선을 보여 주어 후자를 볼 수 있지만 촉각에서 직접 측정하도록합니다. - 측정을 수행한 후 도구 모음의 텍스트 도구를 사용하여 촉각에 레이블을 지정합니다. 텍스트 상자를 만들고, 숫자 레이블을 추가하고, 그리기 편집> 선택하여 레이블을 이미지에 고정합니다. 이미지를 별도의 ROI 파일로 저장합니다.
참고: 이 파일에 레이블을 지정하고 저장하면 조사자가 원시 데이터에서 어떤 tactoid에 해당하는 측정값을 알 수 있습니다. 각 선인장을 한 번 측정하십시오. - 전체 이미지에 대한 촉각을 측정한 후 결과 창의 데이터를 쉼표 또는 탭으로 구분된 텍스트 파일( 파일 >는 다른 이름으로 저장 사용)에 저장하고 스프레드시트 프로그램에서 데이터를 열어 데이터를 숫자로 구문 분석합니다. 모든 데이터(원시 이미지 데이터, ROI 이미지 및 결과의 텍스트 파일)를 적절한 명명 규칙이 있는 폴더로 수집하여 모든 것을 체계적으로 유지합니다.
참고: 선인장 길이 측정은 손으로 수행되지만 선인장 폭이 좁은 경우 측정 오류를 줄이기 위해 선탠토이드 너비를 측정하는 다른 방법(아래 참조)을 사용하는 것이 좋습니다. - ImageJ/FIJI를 사용하여 직선 도구를 사용하여 선 영역을 그립니다. 선착장 장축에 수직인 이섹터로 선을 그립니다(그림 4Bii).
- 플롯 프로파일 분석> 선택하여 선형 이섹터의 강도 프로파일을 생성합니다(그림 4Biii). 플롯이 나타납니다. 플롯에서 데이터를 검색하고 저장하려면 왼쪽 하단의 목록 단추를 선택합니다. 이렇게 하면 그려진 선의 길이에 따라 강도 데이터의 텍스트 파일 목록이 생성됩니다. 텍스트 파일을 .csv 또는 .txt 파일로 저장합니다.
- MatLab, Python (sciPy) 또는 기타 프로그램과 같은 적합한 프로그램에서 텍스트 파일을 엽니 다. 강도 데이터를 형태의 가우시안 함수에 맞 춥니 다:
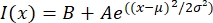 여기서 I (x)는 길이, x를 따른 회색조 값이다. B는 배경 수준입니다. A는 가우시안의 진폭이다; μ는 가우시안의 평균 또는 중심이다; σ은 가우시안의 표준 편차입니다.
여기서 I (x)는 길이, x를 따른 회색조 값이다. B는 배경 수준입니다. A는 가우시안의 진폭이다; μ는 가우시안의 평균 또는 중심이다; σ은 가우시안의 표준 편차입니다. - 보고서 2σ 촉각의 폭으로. 가우시안 (배경을 포함하지 않음) 아래의 면적을 계산하여 선인장체에서 미세 소관의 강도를 추정하십시오.
참고: 이미지가 카메라의 선형 강도 범위 내에 있고 동일한 노출 시간 및 여기 강도로 촬영된 경우, 통합 강도를 비교하여 촉각의 미세 소관의 상대적 수를 추정할 수 있습니다.
- FRAP 분석
참고: 미세소관과 MAP65의 이동성을 테스트하기 위한 실험에서는 FRAP를 사용하여 분자 운동으로 인한 특정 광표백 및 강도 회복을 기록했습니다(그림 5A). 데이터는 ImageJ/FIJI를 사용하여 이미지 시계열 데이터로부터 정량화되었다.- ImageJ/FIJI를 사용하여 동영상 데이터를 엽니다.
- 드리프트를 제거하기 위해 시간에 따른 스택(시계열 데이터)을 등록합니다. 보조 TurboReg 플러그인과 함께 StackReg 플러그인을 사용하십시오. 플러그인 사용에 대한 지침은 자료 표에 제공된 웹 링크를 참조하십시오. 번역을 선택하여 프레임의 위치를 이동한 다음 이미지를 등록합니다.
- 드리프트를 제거하기 위해 이미지가 등록되면 이미지 > 변환 > 회전을 선택하여 선탠토이드가 프레임에서 수직 또는 수평이 되도록 이미지를 회전합니다. 회전할 각도를 선택하고 미리보기 를 사용하여 트랙토이드가 충분히 회전하는지 확인합니다. 미리 보기에 선인장이 세로 또는 수평인 것으로 표시되면 확인을 선택하여 동영상의 모든 이미지를 회전합니다.
- 도구 모음의 사각형 선택 도구를 사용하여 촉각의 광표백 영역 위에 직사각형 단면을 만듭니다. 이미지 > 스택 > 측정 스택을 사용하여 각 프레임에 대한 ROI 영역의 통합 강도를 기록합니다. 측정 분석 > 세트 측정을 사용하여 측정 유형을 통합 밀도로 설정합니다. 결과 창에 표시된 분석된 강도 데이터를 다른 이름으로 파일을 선택하여 .csv 또는 .txt 형식> 텍스트 파일로 저장합니다.
참고: 도 5B 는 표백제 영역에서 미세소관 및 GFP-MAP65 채널에 대해 측정된 원시 16비트 강도 데이터의 예를 도시한다. - 이미지의 전체 강도는 이미징으로 인한 광표백으로 인해 시간이 지남에 따라 전 세계적으로 퇴색하기 때문에이 글로벌 광 표백을 수정해야합니다. 이렇게 하려면 동일한 ROI 크기(단계 8.2.4.)를 사용하고 미세 소관이나 MAP65가 표시되지 않는 이미지 배경의 영역으로 이동합니다. 단계 8.2.4에 설명된 대로 스택의 통합 강도를 측정합니다. 결과를 두 번째 텍스트 파일로 저장합니다.
참고: 도 5B 는 배경 영역에서 미세소관 및 GFP-MAP65 채널에 대해 측정된 원시 16비트 강도 데이터의 예를 도시한다. - 배경 페이딩을 수정하려면 선인장의 신호 강도를 동일한 시점의 배경 강도로 나눕니다. I보정(t)을 다음과 같이 계산한다:
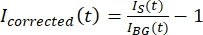 여기서 I S(t)(신호)는 표백 영역에서 이루어진 측정이고 IBG(t)(노이즈)는 배경 영역에서 이루어진 측정이다(도 5C). 이렇게 하면 각 프레임의 신호 대 잡음비를 계산하고 노이즈도 뺍니다.
여기서 I S(t)(신호)는 표백 영역에서 이루어진 측정이고 IBG(t)(노이즈)는 배경 영역에서 이루어진 측정이다(도 5C). 이렇게 하면 각 프레임의 신호 대 잡음비를 계산하고 노이즈도 뺍니다. - 그런 다음, 를 사용하여
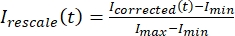 0과 하나 사이의 범위로 데이터의 크기를 다시 조정합니다. 여기서 I min 및 Imax는 전체 시간에 걸쳐 I 보정된 데이터의 전역 최소값과 최대값을 각각 나타냅니다(그림 5C).
0과 하나 사이의 범위로 데이터의 크기를 다시 조정합니다. 여기서 I min 및 Imax는 전체 시간에 걸쳐 I 보정된 데이터의 전역 최소값과 최대값을 각각 나타냅니다(그림 5C). - 이 데이터를 양식의 감소하는 지수에 맞춥니다:
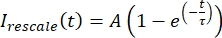 여기서 A 는 회복의 진폭이고 τ는 회복의 시간 척도입니다(그림 5C).
여기서 A 는 회복의 진폭이고 τ는 회복의 시간 척도입니다(그림 5C).
결과
소수의 성분, 튜불린 이량체 및 미세소관 가교결합제만 있으면 미세소관 촉각제가 형성될 수 있습니다(그림 2A). 이 프로토콜은 인큐베이터에서 미세 소관을 핵으로 만들고 성장시키기 위한 인큐베이션을 설명하지만, 핵형성 및 성장은 현미경으로 직접 관찰할 수 있습니다(30분 이내에 완료됨)(그림 2B). 튜불린의 농도는 13.6 μm에서 일정하게 유지되고 MAP65-MT 결합은 10 %에서 일정하게 유지된다.
그림 4는 성공적인 데이터를 나타냅니다. 촉각제는 튜불린 채널의 561nm 레이저와 MAP65 채널의 488nm 모두에서 볼 수 있어야 하며, 이는 서로 완벽하게 겹쳐집니다(그림 4A). 이 시스템의 한 가지 수수께끼는 촉각의 폭이 미세 소관 길이, MAP65 농도 및 크라우밍 제제의 변화를 포함한 다양한 실험 변화 하에서 변하지 않는 것으로 보인다는 것입니다 (그림 4B)22,28. 길이는 훨씬 더 가변적이며 미세 소관 길이와 MAP65 농도 (그림 4B)22,28에 따라 다릅니다.
FRAP를 수행할 때 MAP65 신호는 복구되지만 미세소관 신호는 복구되지 않는 것으로 관찰되었습니다(그림 5). FRAP에서의 회복은 표지되고 광표백된 물체의 이동성 및 움직임에 기인한다. MAP65의 경우, 어두워진 분자는 해리되어 미세 소관에서 멀어지고 새로운 분자는 영역으로 이동합니다 (그림 5). MAP65 결합은 평형에 있으므로 결합 및 결합 해제 속도는 동일합니다 (초당 분자로 측정). 미세소관의 경우, 미세소관이 선인장을 떠날 수 없다는 것을 암시하는 회복이 보이지 않았다(도 5A, Bi, C). 또한, 어두워진 영역의 확산이 보이지 않았으며, 이는 미세 소관이 국부적으로 움직이지 않고 선탠토이드 모양 내의 유체가 아니라는 것을 암시합니다.
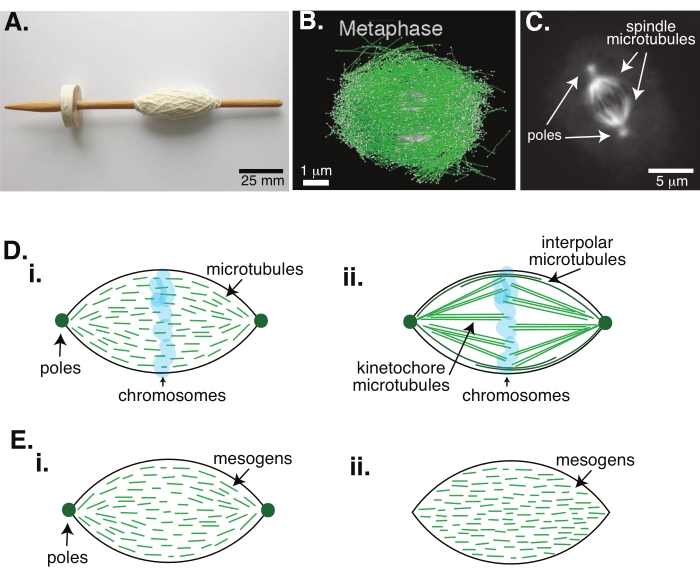
그림 1 : 스핀들 형성의 다른 모델. 유사분열 스핀들은 미세소관과 그 관련 단백질과 효소로 만들어진 기계로, 세포 분열 동안 염색체를 두 개의 새로운 딸 세포로 정렬하고 분리합니다. (A) 초기 중세 시대의 이미지는 네덜란드의 고급 원사가있는 스핀들 복제본을 떨어 뜨립니다. 이 그림은 Peter van der Sluijs30에 의해 위키미디어 이미지에서 수정되었습니다. (B) 야생형 meiosis II의 다른 단계에서 미세 소관의 입체 재구성. 미세 소관은 녹색으로 표시되고 염색체는 회색으로 표시됩니다. 스케일 바 = 1 μm. 이 그림은 Lantzsch et al.31에서 수정되었습니다. (c) 분할된 Sf9 세포의 유사분열 스핀들에서의 미세소관의 현미경 이미지. 스핀들 극과 스핀들의 미세소관은 녹색 형광 단백질로 표지된다. 스케일 바 = 5 μm. 이 그림은 Advani et al.32에서 수정되었습니다. (D) 유사분열 및 meiotic 스핀들 미세소관이 어떻게 조직되는지에 대한 상이한 모델. (i) 제노푸스 달걀 추출물로부터 생성된 meiotic 스핀들에 대해 이전에 관찰된 바와 같이, 미세소관(녹색)은 스핀들 전체에 걸쳐 짧고 역동적인 것으로 추론되었다. 이것은 액정 내부의 양극성 선인장 조직과 유사합니다. (ii) 유사분열 스핀들 내부의 미세소관 조직에 대한 정준 모델에는 두 가지 유형의 미세소관이 있습니다: 염색체 주위의 중간 영역에서 교차하는 극간 또는 극성 미세소관(짙은 녹색)과 극에서 키네토코레까지 묶여서 뻗어 염색체를 밀고 당기는 키네토코레 미세소관(연한 녹색)이 있습니다. 모든 이미지에서 염색체는 투명한 파란색으로 표시되고 스핀들 극은 짙은 녹색으로 표시됩니다. (e) (i) 양극성 및 (ii) 균질 촉각에 대한 액정 선에서 메조겐 (녹색 선)의 개략도. 양극성 촉각제는 촉각의 끝에 두 개의 극을 가지고 있으며, 메조겐은 그 극을 가리키기 위해 방향을 바꿉니다. 균질 촉각제는 무한대에서 극을 가지며, 메조겐은 촉각의 길이를 따라 방향을 변화시키지 않는다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
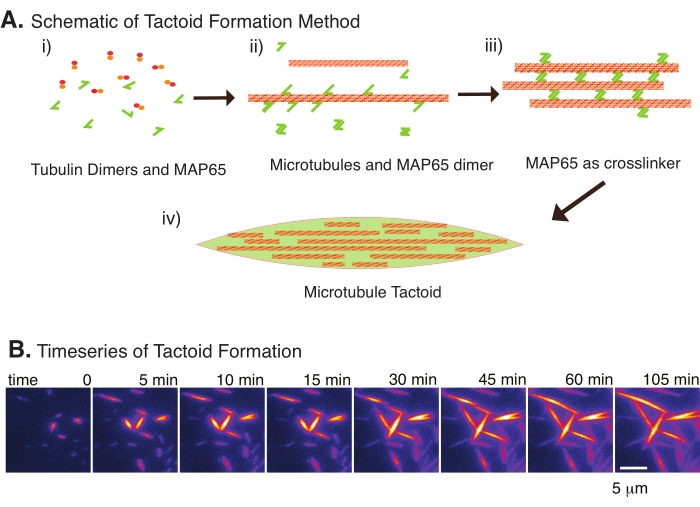
그림 2: 미세소관 축합. (A) 미세소관은 이온성 종, 집요제에 의한 고갈력, MAP65와 같은 특정 미세소관 가교제를 포함한 다양한 방법에 의해 번들링되고 가교될 수 있다. (i) 투불린 이량체와 MAP65 단백질이 혼합되어 미세소관을 핵으로 만들고 성장시킨다. (ii) 미세소관은 튜불린으로부터 핵을 형성하고 성장하며, MAP65는 즉시 미세소관, 또 다른 MAP65 단량체, 또는 둘 다에 결합하고 번들링을 일으킨다. (iii) 가교결합된 다발의 미세소관은 핵을 형성하고 성장한다. (iv) 최종 구성은 스핀들과 유사한 미세소관 전술이다. (B) 105 분 이상 핵을 형성하고 성장하는 미세 소관 촉각의 시계열. 스케일 바 = 5 μm. Edozie et al.22에서 적응한 그림. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
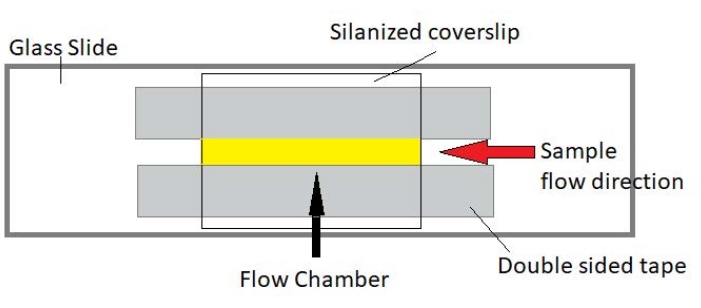
그림 3: 유동 챔버 어셈블리. 유동 챔버는 유리 슬라이드, 실란화 된 커버 유리 및 영구적 인 양면 테이프를 사용하여 만들어집니다. 노란색으로 강조 표시된 영역은 샘플이 흐르고 관찰되는 흐름 경로입니다. 유동 챔버의 부피는 ∼20 μL이다. 에폭시는 몇 시간에 걸쳐 장기 이미징 동안 샘플이 증발하는 것을 방지하기 위해 챔버의 끝을 밀봉하는데 사용되었다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
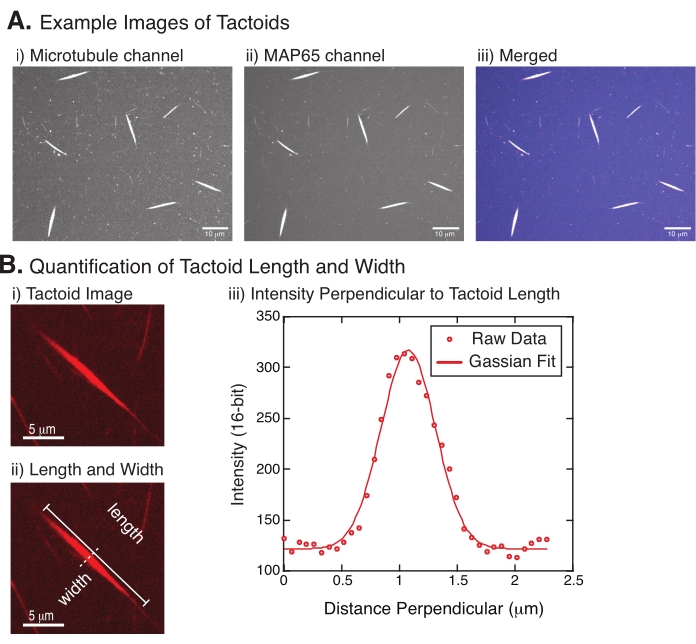
그림 4: Tactoid 이미지 및 길이 및 너비 분석. (a) 실시예 기재된 바와 같이 형성된 촉각의 데이터는 (i) 561 nm 레이저를 사용하여 로다민 표지된 튜불린을 미세소관 채널 이미징, (ii) GFP-MAP65 채널 488 nm 레이저를 사용하여 GFP를 이미징하고, (iii) 미세소관 채널(마젠타) 및 GFP-MAP65 채널(cyan)로부터의 병합된 오버레이 이미지를 보여주는 방사 디스크 공초점 이미지를 사용하여 이미지화한다. 겹침 영역은 흰색으로 표시되며 미세 소관과 MAP65가 정확하게 공동 지역화되었음을 보여줍니다. 스케일 바 = (A)의 모든 이미지에 대해 10μm. (B) 선인장 길이와 폭의 정량화. (i) 라벨 없이 분석될 선인장의 이미지. 배율 막대 = 5μm. (ii) (i)에서와 동일한 이미지로, 여기서 길이(선 캡이 있는 실선) 및 너비(점선) 측정값이 표시됩니다. 스케일 바 = 5 μm. (iii) 폭은 (ii)에 표시된 수직 이섹터(점선)에서 선탠토이드를 가로지르는 강도 프로파일을 취함으로써 측정되었다. 강도 프로파일은 촉각의 진폭과 폭을 드러내기 위해 가우시안 함수에 적합했습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
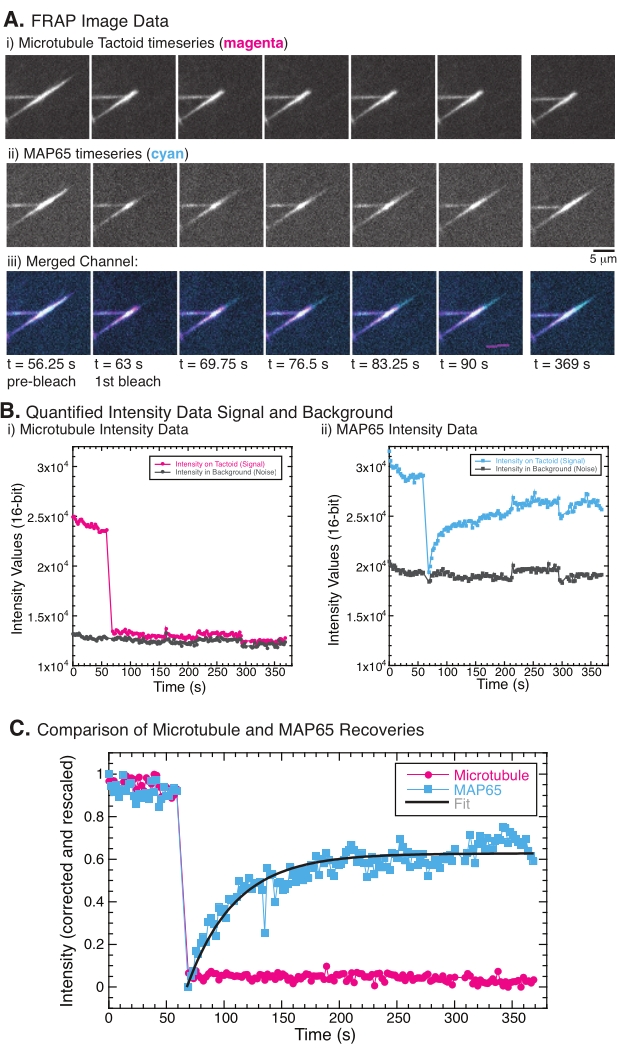
도 5: 대표적인 FRAP 데이터 및 분석. (A) (i) 미세소관 선탠토이드 및 (ii) GFP-MAP65의 현미경 시계열 데이터, 및 (iii) 63 s에서 광표백시킨 시안 중의 마젠타 및 GFP-MAP65에서 미세소관을 갖는 두 채널의 오버레이 이미지, 및 추가적인 5분 동안 관찰된 (i) 정량화된 강도 (i) ) 표백 영역 (마젠타 원) 및 배경 (진한 회색 원) 및 (ii) 표백 영역 (시안 사각형) 및 배경 (진한 회색 사각형)의 GFP-MAP65 채널에서의 미세 소관 채널. (c) 데이터는 배경 잡음에 대해 보정되고 미세소관 채널(마젠타 원) 및 GFP-MAP65 채널(시안 사각형)에 대해 재스케일링되었다. 미세 소관은 회복되지 않지만 GFP-MAP65는 회복의 진폭과 시간 척도를 찾기 위해 상승하는 지수 붕괴에 적합하고 적합 할 수 있습니다 (진한 회색 선). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
여기에 설명 된 방법은 미세 소관 촉각을 만들기 위해 여러 논문에서 사용되었습니다 (그림 2) 22,28. 이러한 실험은 대부분의 세포 유형에서 유사분열 또는 마이오틱 스핀들의 형태와 안정성을 조절하는 조직 원리를 밝히는 데 도움이 되는 생물학적으로 관련이 있다. 또한, 미세 소관은 액정이 등방성 상으로부터 핵을 형성하고 네마틱 상을 성장시키는 방법에 대해 더 많이 배우는 데 도움이되는 모델 액정 메조겐입니다.
여기에 설명 된 절차는 미세 소관 자체 조직을 탐구하기위한 몇 가지 장점이 있습니다. 첫째, 실험실에서 시작하기 전에 예지력이나 훈련이 거의없는 고등학생을 포함한 많은 학생들이 실험실에서 수행 한 것으로 재현 가능성이 높습니다. 촉각은 복굴절성(birefringent)(22)으로, 형광 현미경 검사 이외에 투과광에서 볼 수 있게 되어, 이 방법을 많은 실험실에서 이용할 수 있게 하고, 이 실험 절차는 하이엔드 연구 외에도 교육 목적에 적응할 수 있다. 마지막으로,이 과정은 제거 된 환원 주의적 접근 방식으로 생물학적 시스템을 계속 이해하고 조사 할 수있는 길을 열어 각 추가 조건, 단백질 또는 첨가제가 촉각제의 자체 조직을 어떻게 바꿀 수 있는지, 그리고 궁극적으로 스핀들을 어떻게 바꿀 수 있는지 이해할 수있게합니다. 더 나은 생체모방을 위한 표적은 활성, 유동성 및 필라멘트 극성 분류를 포함한다.
예기치 않은 결과를 제공하는 실험에 영향을 미치는 몇 가지 요인이있을 수 있습니다. 예를 들어, 촉각이 형성되지 않지만(그림 2) 팬형 패턴이 관찰되는 경우, MAP65는 미세소관(22,28)에 존재하지 않거나 결합하지 않을 가능성이 높다. 이것은 GFP-MAP65가 미세소관에 결합하지 않기 때문에 MAP65 형광 채널에서도 명백해야합니다.
촉각이 형성되지 않고 배경이 유리에 얼룩으로 나타나면 표면 코팅 때문일 수 있습니다. 일단 수행되면, 실란화는 커버 슬립에서 1 개월 만 지속됩니다. 그것이 마모 될 때, 튜불린은 노출 된 표면에 비특이적으로 결합 할 수있을 것입니다. 이 바인딩은 이상한 패턴에서 발생합니다.
촉각이 형성되지 않고 튜불린이 다양한 모양과 크기의 응집체에서 관찰된다면, 이것은 품질이 좋지 않은 튜불린 때문일 수 있습니다. 투불린은 미세소관 중합 대신에 이러한 오프 경로 응집을 구동할 수 있는 초기 응집체를 제거하기 위해 원심분리될 수 있다. 표면이 튜불린에 결합하면 용액의 튜불린을 고갈시킬 수도 있습니다. 미세 소관을 중합하는 데 중요한 농도보다 낮은 농도의 튜불린은 응집체를 초래할 수 있습니다.
FRAP 실험에서, MAP65 채널이 어떠한 회복도 나타내지 않으면(도 5), 광표백이 미세소관을 광손상시켰을 가능성이 있다. 광손상은 필라멘트의 국부적 인 파괴를 일으 킵니다. 이것은 전송 된 채널에서 검사에 의해 확인 될 수있다. 미세소관 촉각은 주변 물과의 높은 굴절률 불일치를 통해 투과된 채널에서 볼 수 있다. 광-유도된 광손상은 광표백을 실시한 ROI의 위치에서 투과된 광 이미징에서 화상 마크 또는 콘트라스트 손실로 나타날 것이다. 이런 일이 발생하면 단백질의 광손상을 억제하기 위해 레이저 또는 광력을 줄여야합니다.
이 절차와 접근 방식에서 몇 가지 문제가 발생했습니다. 한 가지 문제는 길이 측정이 현재 이미지를 클릭하여 손으로 수행된다는 것입니다. 이 방법은 간단하지만 불확실성이 높아질 수 있습니다. 횡단면과 가우시안에 피팅을 사용하는 폭 측정은 크기를 정량화하는 더 좋은 방법입니다. 길이에 대해서도 비슷한 방법을 사용할 수 있습니다. 두 번째 문제는 때로는 촉각제가 너무 길고 얇기 때문에 구부러질 수 있다는 것입니다. 이로 인해 길이를 정량화하는 것이 더 어려워집니다. 윤곽선 길이는 세그먼트 선을 사용하여 정량화 할 수 있지만 세그먼트가 추가 될 때마다 불확실성이 추가됩니다.
과학적 관점에서 볼 때,이 접근법은 액정 또는 스핀들의 모델로 사용하기위한 몇 가지 다른 과제를 가지고 있습니다. 첫 번째 과제는 미세 소관이 만드는 촉각의 길고 얇은 모양이었습니다 (그림 3 및 그림 4). 이전 간행물22에서 언급된 바와 같이, 미세소관 촉각제는 양극성이 아닌 균질한 촉각이다. 이것은 모양을 구성하는 미세 소관이 구조의 끝을 가리키도록 방향을 바꾸지 않는다는 것을 의미합니다. 대신, 모든 미세 소관은 장축에 평행하고 "극"은 무한대에 위치합니다. 이것은 분자 액체 결정 또는 액정 메조겐으로도 작용할 수있는 액틴 또는 DNA에 대해 관찰 된 촉각제와 매우 다릅니다. 이러한 다른 시스템에서, 촉각제는 양극성이며, 교차 편광자에서 볼 때, 그들은 막대의 재방향의 명백한 징후를 보여줍니다.
이 시스템의 두 번째 주요 과제는 미세 소관이 촉각 내부에서 움직이지 않는다는 것입니다. 이것은 미세소관의 회수율이 매우 낮기 때문에 FRAP 실험 및 분석으로부터 명백하다. 그들의 고체와 같은 성질은 미세 소관 촉각을 대규모 액정 유사체로서 덜 가치있게 만듭니다. 액정의 네마틱 상은 액체 (유체) 및 결정 (조직화) 특성을 모두 가져야합니다. 모양이 스핀들에 적합한 것처럼 보이지만, 부동성으로 인해 시스템은 모델 유사 분열 스핀들로서 덜 흥미 진진합니다. 반면에이 문제는 시스템에서 더 많은 유동성을 창출하기 위해 실험을 수정하는 방법을 조사 할 수있는 기회를 제공합니다.
이러한 과학적 도전은 시스템에 대한 새로운 지식을 허용하는 흥미로운 기회를 제공합니다. 미세 소관 촉각을 더 양극성으로 만들기 위해, 하나는 더 짧은 미세 소관을 사용할 수 있습니다. 그러나 미세 소관에는 액틴처럼 길이를 조절하는 잘 특성화 된 캡핑 단백질이 많지 않기 때문에 추가적인 도전이 있습니다. 핵형성과 성장의 사용은 짧은 미세 소관을 만들기 위해 매우 높은 농도의 튜불린과 GMPCPP를 사용해야합니다. 높은 튜불린 농도는 시스템에 더 많은 수의 필라멘트를 초래하여 타크토이드를 서로 분리하기가 더 어려워집니다. DARPin33과 같은 새로운 미세 소관 캐퍼의 추가는이 상황에 도움이 될 수 있습니다. 움직이지 않는 미세 소관의 두 번째 문제는 유사 분열에 사용되는 모터의 사량체 인 kinesin-534와 같은 운동 단백질의 첨가에 의해 완화 될 수 있습니다. 대안적으로, 이량체 키네신-1의 인공 이량체(15)가 사용될 수 있다.
더 많은 유동성을 추가하는 또 다른 방법은 미세 소관이 동적 불안정, 미세 소관의 성장 및 수축을 수행 할 수있게하는 것입니다. 현재, 안정한 GMPCPP 필라멘트로 시드되고 동적 불안정을 겪는 미세 소관은 스핀들 또는 촉각을 형성하기 위해 원하는 것보다 훨씬 길며, 이는 팬이나 번들과 같은 매우 긴 조직을 초래할 것입니다. 따라서 미세 소관 동적 불안정성을 추가하는 것은 선인장 모양을 보존하기 위해 신중하게 수행되어야합니다. 길이를 조절할 수 있는 관련 단백질 및 효소의 첨가는 이러한 문제를 완화시킬 수 있다. 예를 들어, kinesin-1335와 같은 탈중합 키네신이나 katanin36과 같은 효소를 절단하는 것이 필요할 수 있습니다. 이 실험은 복잡하고 어렵지만 결과가 밝혀 지더라도 매우 통찰력이 있습니다. 미래의 실험이 어떤 방향으로 나아가든, 미세 소관 촉각을 만들기 위해 여기에서 개발 된 플랫폼은 미세 소관 조직의 물리적 기초에 새로운 정보를 노출 할 수 있습니다.
공개
저자들은 경쟁적인 재정적 이익이 없다고 선언합니다.
감사의 말
저자는 2021 년 여름 Ross Lab 회원, 특히 K. Alice Lindsay의 도움에 감사드립니다. 이 작업은 NSF BIO-2134215의 보조금으로 S. Sahu, N. Goodbee, H.B. Lee 및 J.L. Ross를 지원했습니다. KECK 재단 (Rae Anderson, USD, lead PI)의 보조금은 R. Branch와 P. Chauhan을 부분적으로 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 2% Dichlorodimethylsilane | GE Healthcare | 118945 | A hydrophobic silane surface treatment. This can be resused upto three times and kept at room temperature for one year. |
| 5-minute epoxy | Bob Smith Industries | For sealing experimental chambers | |
| Acetone | Fisher | 32900HPLC | 100% |
| BL21 cells | Bio Labs | C2527I | Competent bacterial cells used to express MAP65 |
| Catalase | Sigma | C30-500MG | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C for upto one year. |
| Coverslips (22 mm x 22 mm or 22 mm x 30 mm) | Fisher | 12544-AP | For experimental chambers |
| Dithiothreitol | Sigma | 43815-5G | A small molecule that is used to break disulfide bonds and scavenge oxygen. A 1 M stock is made from powder (Sigma) in ddH2O. The solution is aliquoted and stored at -20C for upto one year. The aliquots are used 7-8 times then discarded. |
| EGTA | Sigma | E3889-10G | Tubulin buffer base ingredient |
| Eppendorf 0.5 ml tubes | Eppendorf | 05 402 18 | For holding experimental solutions |
| Ethanol | Fisher | 111000200 | 200 proof |
| Filter paper | Whatman | 1004-110 | For cleaning and for pulling solutions through experimental chambers |
| Fluorescence microscope with high NA objectives | Nikon | Ti-E, W2 Confocal | For imaging experiments |
| Freezer -20°C | Fisherbrand | 13986148 | For storing reagents |
| Freezer -80°C | Thermo scientific | 328223H01-C | For storing proteins. |
| Glass containers for silanization | Michaels | For preparing experimental chambers - treating cover glasses | |
| Glass slides | Fisher | 12544-4 | For experimental chambers |
| Glucose | Sigma | G7528-250G | Part of the oxygen scavenging system. A 300 mg/ml stock is made in ddH2O and stored in 10 μl aliquots in -20°C. |
| Glucose oxidase | Sigma | G2133-250KU | Part of the oxygen scavenging system. This is stored at 4°C for upto one year. |
| GMPCPP | Jenna Bioscience | NU-4055 | Slowly hydrolyzable analog of GTP used to polymerize and stabilize the microtubules by reducing the dynamic instability and spontaneous critical concentration for microtubule nucleation to get a consistent length. We purchase a 10 mM stock from Jena Biosciences and store it at -20°C for upto one year. |
| Heating element for microscope | Okolab stage top incubator | For imaging experiments | |
| Imidizole | Sigma | I2399 | Used to elute MAP65 protein from Nickel beads to purify MAP65 |
| Kimwipes | Fisher | 34155 | For cleaning and for pulling solutions through experimental chambers. |
| KOH | Sigma | P250-500 | 1 M in ddH2O, made fresh to prevent acidification over time. |
| Liquid Nitrogen | Airgas | NI 230LT22 | To drop freeze aliquots. This can also be used for storage (not recommended) |
| MAP65 protein | Ram Dixit | A microtubule-associated protein (MAP) with a molecular weight of 65 kD that is an antiparallel microtubule crosslinker. We have purified an unlabeled and GFP-labeled version of MAP65-1 from Arabidopsis thaliana. We mix the GFP-MAP65 with the unlabeled MAP65 such that 10% of the protein is labeled. The working stock is a 10.8 μM solution. This working solution is stored at 4°C and remade fresh every week. The protocol for purifying the MAP65 and GFP-MAP65 is given in our prior methods chapter (26). | |
| MgSO4 | Sigma | MKCJ940 | Tubulin buffer ingredient |
| NTA-Nickel beads | Qiagen | 30210 | Beads required to purify 6xHis tagged MAP65 proteins |
| Optomicroscan | Nikon | 405 nm laser system which can focus the laser in any desired shape of region of interest | |
| PEM80 | Neutral tubulin polymerizing base buffer for solution made from 80 mM K-PIPES, pH 6.8, 1 mM MgSO4, 1 mM EGTA, stored at 4°C for upto one year. | ||
| Permanent double-sided tape | 3M - Scotch | 34-8724-5691-7 | For experimental chambers |
| Petri dish | Fisher | FB0875713 | For humid chamber |
| PIPES | Sigma | P7643-100G | Tubulin buffer base ingredient |
| Pluronic-F127 | Sigma | P2443-250G | A block-copolymer with two hydrophilic polyethylene oxide (PEO) blocks on the ends and a hydrophobic center block of polyphenylene oxide (PPO) hydrophobic surface coating we use to prevent protein binding to the surface. Pluronic-F127 is purchased as a powder (Sigma) and dissolved to a 5% (w/v) solution in ddH2O overnight. Once dissolved, the solution can be stored at room temperature for upto one year. |
| Polyethylene Glycol | Affymetrix Inc | 19966 500 GM | A crowding agent used to create depletion forces to bring tactoids to the surface and help to organize microtubules. We create a 5% (w/v) solution of 100 kDa PEG in PEM80. The solution is stored in 4°C for upto one year and placed on the rocker before use. It is viscous, so we recommend using a positive displacement pipette to work with it. |
| Positive displacement pipette | Eppendorf | For pipetting viscous liquids | |
| Racks for coverslips | Electron Microscopy Sciences | 72240 | For preparing experimental chambers - treating cover glasses |
| Refrigerator 4°C | Fisherbrand | For storing reagents | |
| Tubulin Labeled | Cytoskeleton | TL590M | lyophilized rhodamine-labeled tubulin from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| Tubulin protein | Cytoskeleton | T240 | lyophilized tubulin 99% pure unlabeled from pig brain is purchased (Cytoskeleton) and stored in -80°C until hydrated in PEM80 and used for upto one year. |
| UV-Ozone | Jelight | Model 342 | For preparing experimental chambers - treating cover glasses |
| Stackreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/stackreg/ | plugin for registering time series data to remove drift |
| Turboreg | Biomedical Imaging Group | http://bigwww.epfl.ch/thevenaz/turboreg/ | plugin for registering time series data to remove drift |
참고문헌
- Bodakuntla, S., Jijumon, A. S., Villablanca, C., Gonzalez-Billault, C., Janke, C. Microtubule-associated proteins: structuring the cytoskeleton. Trends in Cell Biology. 29 (10), 804-819 (2019).
- Severson, A. F., von Dassow, G., Bowerman, B. Oocyte meiotic spindle assembly and function. Current Topics in Developmental Biology. 116, 65-98 (2016).
- Brugués, J., Needleman, D. Physical basis of spindle self-organization. Proceedings of the National Academy of Sciences of the United States of America. 111 (52), 18496-18500 (2014).
- Brugués, J., Nuzzo, V., Mazur, E., Needleman, D. J. Nucleation and transport organize microtubules in metaphase spindles. Cell. 149 (3), 554-564 (2012).
- Gatlin, J. C., et al. Spindle fusion requires dynein-mediated sliding of oppositely oriented microtubules. Current Biology. 19 (4), 287-296 (2009).
- Goshima, G., Mayer, M., Zhang, N., Stuurman, N., Vale, R. D. Augmin: A protein complex required for centrosome-independent microtubule generation within the spindle. Journal of Cell Biology. 181 (3), 421-429 (2008).
- Inoue, S., Sato, H. Cell motility by labile association of the nature of mitotic spindle fibers and their role in chromosome movement molecules. Journal of General Physiology. 50 (6), 259-292 (1967).
- Allenspach, A. L., Roth, L. E. Structural variations during mitosis in the chick embryo. Journal of Cell Biology. 33 (1), 179-196 (1967).
- Theg, D. E. Cytoplasmic microtubules in different animal cells. Journal of Cell Biology. 23 (2), 265-275 (1964).
- Mcdonald, K., Pickett-Heaps, J. D., Mcintosh, J. R., Tippit, D. H. On the mechanism of anaphase spindle elongation in Diatoma vulgare. Journal of Cell Biology. 9, 377-388 (1977).
- Chaikin, P. M., Lubensky, T. C. . Principles of Condensed Matter Physics. , (1995).
- Hamon, L., Savarin, P., Curmi, P. A., Pastré, D. Rapid assembly and collective behavior of microtubule bundles in the presence of polyamines. Biophysical Journal. 101 (1), 205 (2011).
- Needleman, D. J., et al. Higher-order assembly of microtubules by counterions: From hexagonal bundles to living necklaces. Proceedings of the National Academy of Sciences. 101 (46), 16099-16103 (2004).
- Ross, J. L., Fygenson, D. K. Mobility of taxol in microtubule bundles. Biophysical Journal. 84, 3959-3967 (2003).
- Sanchez, T., Welch, D., Nicastro, D., Dogic, Z. Cilia-like beating of active microtubule bundles. Science. 333 (6041), 456-459 (2011).
- Brandt, R., Lee, G. Functional organization of microtubule-associated protein tau. Identification of regions which affect microtubule growth, nucleation, and bundle formation in vitro. Journal of Biological Chemistry. 268 (5), 3414-3419 (1993).
- Hirokawa, N. Microtubule organization and dynamics dependent on microtubule-associated proteins. Current Opinion in Cell Biology. 6 (1), 74-81 (1994).
- Kanai, Y., et al. Expression of multiple tau isoforms and microtubule bundle formation in fibroblasts transfected with a single tau cDNA. The Journal of Cell Biology. 109 (3), 1173 (1989).
- MacRae, T. H. Microtubule organization by cross-linking and bundling proteins. Biochimica et Biophysica Acta (BBA). Protein Structure and Molecular Enzymology. 1160 (2), 145-155 (1992).
- She, Z. Y., Wei, Y. L., Lin, Y., Li, Y. L., Lu, M. H. Mechanisms of the Ase1/PRC1/MAP65 family in central spindle assembly. Biological Reviews. 94 (6), 2033-2048 (2019).
- Walczak, C. E., Shaw, S. L. A MAP for Bundling Microtubules. Cell. 142 (3), 364-367 (2010).
- Edozie, B., et al. Self-organization of spindle-like microtubule structures. Soft Matter. 15 (24), 4797-4807 (2019).
- Tulin, A., McClerklin, S., Huang, Y., Dixit, R. Single-molecule analysis of the microtubule cross-linking protein MAP65-1 reveals a molecular mechanism for contact-angle-dependent microtubule bundling. Biophysical Journal. 102 (4), 802-809 (2012).
- Chan, J., Jensen, C. G., Jensen, L. C. W., Bush, M., Lloyd, C. W. The 65-kDa carrot microtubule-associated protein forms regularly arranged filamentous cross-bridges between microtubules. Proceedings of the National Academy of Sciences of the United States of America. 96 (26), 14931-14936 (1999).
- Scheff, D. R., et al. Tuning shape and internal structure of protein droplets via biopolymer filaments. Soft Matter. 16 (24), 5659-5668 (2020).
- Weirich, K. L., et al. Liquid behavior of cross-linked actin bundles. Proceedings of the National Academy of Sciences of the United States of America. 114 (9), 2131-2136 (2017).
- Weirich, K. L., Dasbiswas, K., Witten, T. A., Vaikuntanathan, S., Gardel, M. L. Self-organizing motors divide active liquid droplets. Proceedings of the National Academy of Sciences of the United States of America. 166 (23), 11125-11130 (2019).
- Sahu, S., Herbst, L., Quinn, R., Ross, J. L. Crowder and surface effects on self-organization of microtubules. Physical Review E. 103 (6), 062408 (2021).
- Stanhope, K. T., Ross, J. L. Microtubules, MAPs, and motor patterns. Methods in Cell Biology. 128, 23-38 (2015).
- Early Middle Ages drop single.jpg. Wikimedia Commons Available from: https://commons.wikimedia.org/wiki/File:Early_middle_ages_drop_spingle.jpg (2022)
- Lantzsch, I., et al. Microtubule reorganization during female meiosis in c. Elegans. eLife. 10, 58903 (2021).
- Advani, S., Maresca, T. J., Ross, J. L. Creation and testing of a new, local microtubule-disruption tool based on the microtubule-severing enzyme, katanin p60. Cytoskeleton. 75 (12), 531-544 (2018).
- Pecqueur, L., et al. A designed ankyrin repeat protein selected to bind to tubulin caps the microtubule plus end. Proceedings of the National Academy of Sciences of the United States of America. 109 (30), 12011-12016 (2012).
- Valentine, M. T., Fordyce, P. M., Krzysiak, T. C., Gilbert, S. P., Block, S. M. Individual dimers of the mitotic kinesin motor Eg5 step processively and support substantial loads in vitro. Nature Cell Biology. 8 (5), 470-476 (2006).
- Wagenbach, M., Domnitz, S., Wordeman, L., Cooper, J. A kinesin-13 mutant catalytically depolymerizes microtubules in ADP. Journal of Cell Biology. 183 (4), 617-623 (2008).
- McNally, F. J., Vale, R. D. Identification of katanin, an ATPase that severs and disassembles stable microtubules. Cell. 75 (3), 419-429 (1993).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유