Method Article
포르말린 고정, 파라핀 포매 세포 펠릿 면역조직화학 대조군을 위한 표준화된 공정
요약
여기에 제시된 것은 면역 조직 화학을위한 포르말린 고정, 파라핀 내장 세포 펠릿 제어를 생성하기위한 프로토콜입니다.
초록
표적 단백질의 발현이 알려진 양성 및 음성 대조군은 면역조직화학(IHC) 분석의 개발에 필수적입니다. 조직 대조군은 정의된 조직 및 세포 발현 패턴을 갖는 잘 특성화된 단백질에 유익하지만, 신규하거나 특성이 낮거나 유비쿼터스 발현된 단백질에 대한 IHC 분석의 초기 개발에는 적합하지 않습니다. 대안적으로, 표준화된 특성으로 인해, 정의된 단백질 또는 전사체 발현 수준(예: 고발현, 중간, 저발현)을 갖는 암 세포주, 형질감염된 과발현 세포주 또는 CRISPR과 같은 세포 공학 기술을 통해 결실된 유전자를 갖는 세포주를 포함한 세포 펠릿은 특히 초기 항체 특성화 및 선택에 유용한 대조군으로 작용할 수 있다. 이러한 세포 펠릿이 포르말린 고정, 파라핀 포매 조직에 대한 IHC 분석 개발에 사용되려면 조직 처리에 사용되는 절차를 요약하는 방식으로 처리 및 매립되어야 합니다. 이 프로토콜은 IHC 방법 개발에 사용할 수 있는 포르말린 고정, 파라핀 포매 세포 펠릿 제어를 만들고 처리하는 프로세스를 설명합니다.
서문
면역조직화학(IHC)은 조사 및 진단 병리학에서 가장 일반적으로 사용되는 분석 중 하나입니다. 문맥과 분석에 따라 IHC는 암 진단1,2, 치료 반응예측 3,4, 병원체 식별5, 병든 조직의 세포 유형 특성화6, 생물학적 경로 및 조직 반응 연구 7,8에 사용됩니다. 모든 상황에서, IHC 분석의 기본 원리는 항체가 관심있는 표적, 가장 일반적으로 단백질에 특이적으로 결합하고, 이러한 결합 사건은 후속적으로 조직 섹션9에서 가시화된다는 것이다. 그러나 IHC 분석의 가장 큰 과제 중 하나는 항체가 관심 대상10을 특이적으로 검출하는지 확인하는 것입니다. 항체 특이성은 대부분의 면역분석법에서 어려운 과제이지만, 면역조직화학은 특이적 표지와 비특이적 표지를 구별하기 위한 분자량과 같은 2차 측정이 없다는 점에서 고유한 과제를 제시합니다. 이는 잘 정의된 세포 국소화 패턴이 없는 특성화가 불량하거나 유비쿼터스하게 발현된 표적을 평가할 때 특히 문제가 됩니다. 따라서, 결합 특이성을 특성화하는 것을 도울 수 있는 강력한 대조군은 새로운 IHC 분석법10을 개발할 때 매우 중요하다.
특징적인 세포 발현 패턴으로 잘 정의된 표적의 경우, 조직 제어는 IHC 방법 개발에 자주 활용됩니다. 풍부한 선행 데이터에 기초하여, 항체가 발현되는 것으로 알려진 조직, 세포 및 세포하 구획을 표지하고 있는지, 그리고 그것이 존재해서는 안 되는 조직 성분을 표지하고 있지 않은지를 결정할 수 있다(11). 그러나, 조직 대조군은 알려진 발현 패턴이 없는 잘 특성화되지 않은 신규한 표적 또는 널리 발현되고 뚜렷한 발현 패턴이 없는 단백질에 대해서는 제한적으로 사용된다. 이 두 시나리오 모두에서 잘 정의된 발현 패턴이 없기 때문에 조직에서 특이적 표지와 비특이적 표지를 구별하는 것이 불가능합니다. 이러한 상황에서, 세포 펠릿은 가치 있는 대안적 IHC 제어를 제공한다. 세포 펠릿 대조군은 다음을 포함할 수 있다: 관심 단백질의 내인성 또는 내인성/비유도 발현 수준을 갖고, 그의 단백질 발현이 웨스턴 블로팅, 유세포측정 분석에 의해 특성화될 수 있거나, 또는 전사 프로파일링으로부터 외삽될 수 있는 암 또는 다른 세포주; 관심있는 단백질을 과발현하거나 관심있는 암호화 유전자가 삭제 된 조작 된 세포주; 또는 관심 있는 단백질 발현 또는 신호 전달 이벤트(예: 인산화)를 유도하기 위해 특정 조건에서 처리된 세포10,12. 세포주에서 잘 특성화된 단백질 발현 수준은 또한 단백질 발현이 높은, 중간, 낮은, 없는 세포주의 패널을 사용하여 분석의 민감도를 평가할 수 있습니다. 부가적으로, 조작된 세포 펠릿은 수의학 종에 대한 가치 있는 종 특이적 대조군일 수 있으며, 이에 대해 제한된 특성화 또는 이용가능한 조직 대조군(13)이 있을 수 있다. 세포 펠릿은 조직에서 다양한 프로테옴을 반영하지 않는 세포주에 존재하는 제한된 프로테옴과 같은 그들의 한계를 가지고 있지만, 이들은 항체가 관심 표적을 검출할 수 있음을 확인하고 분석10에서 1차 항체, 2차 항체 또는 다른 리젠트에 의한 무차별 결합을 배제하기 위한 적절한 대조군으로서 기능한다.
진단 및 조사 병리학의 대부분의 조직은 중성 완충 포르말린에 고정되고 일련의 알코올로 탈수되고 크실렌에서 제거되고 파라핀 왁스에 가공 및 매립됩니다. 포르말린 고정 가교 단백질, 및 조직 처리의 고정 및 각 추가 단계는 단백질 및 이를 검출하는 항체의 능력에 직접적인 영향을 미칠 수 있습니다 9,14. 따라서 IHC 분석에 사용되는 모든 대조군이 동일한 고정, 조직 처리 및 매립 절차를 거치는 것이 중요합니다. 이 기사에서는 포르말린 고정 파라핀 포매 조직에서 IHC 분석을 개발하기 위한 대조군으로 사용하기 위해 배양된 세포를 처리하고 내장하기 위한 고유한 고려 사항을 설명하며, 방법론은 주로 조직학 실험실에서 세포 펠릿의 취급 및 처리에 중점을 둡니다.
프로토콜
1. 세포 펠릿 준비
- 4-8개의 150mm2 또는 8개의 x T175 플라스크에서 세포주를 80%-90% 합류하도록 권장되는 배지 및 조건에서 세포를 성장시킵니다. 예를 들어, Dulbecco의 변형 독수리 배지 (DMEM)에서 293T 세포를 10 % 태아 소 혈청 및 2mM L- 글루타민15로 성장시킵니다.
참고: 세포는 관심 세포주16에 필요한 조건 및 배지를 사용하여 성장해야 합니다. 이러한 조건은 세포주에 따라 다를 수 있지만 다운스트림 펠릿화 방법은 배양 조건에 관계없이 세포주에 적용할 수 있어야 합니다. - 세포가 합류(80%-90%)에 가까워지면 진공 피펫으로 성장 배지를 흡인하고 인산염 완충 식염수(PBS)로 세포를 헹굽니다.
- 각 플라스크에 5-10mM EDTA 5mL를 추가하고 플라스크를 37°C에서 5-10분 동안 배양합니다. 플라스크의 측면을 부드럽게 두드려 세포를 제거합니다.
참고: 트립신은 일부 항원에 악영향을 미칠 수 있는 표면 에피토프를 절단할 수 있으므로 사용하지 마십시오.- 세포가 제거되면 세포주에 사용되는 5mL의 성장 배지(예: 293T 세포의 경우 DMEM)를 각 플라스크에 추가한 다음 세포를 50mL 원뿔형 튜브로 옮깁니다.
- 원뿔형 튜브를 실온에서 930 x g 에서 5분 동안 원심분리합니다. 원심분리 후, 배지를 제거하고 진공 피펫 흡인으로 EDTA를 제거한다.
- 10-20mL의 1x PBS에서 세포 펠릿을 세척하고 여러 플레이트 또는 플라스크를 사용하는 경우 플레이트 또는 플라스크(그림 1에 표시된 실험에서 약 175개의 T175 플라스크)에서 세포를 단일 50mL 원뿔형 튜브에 넣습니다.
- 튜브를 930 x g 에서 5분 동안 원심분리합니다. 진공 피펫으로 원심분리 후 PBS를 흡인합니다.
- 고정될 때까지 셀 펠릿 튜브를 젖은 얼음 위에 보관하십시오.
참고: 세포는 분해 효소 활성을 제한하고 단백질 국소화의 변화를 포함하여 세포의 자가 분해 및 관련 단백질 변화를 최소화하기 위해 냉장 상태로 유지됩니다.
2. 세포 펠릿의 고정
- 3mL 세포 펠릿에 10% 중성 완충 포르말린 30mL를 추가하여 고정을 수행하여 세포 대 10:1(vol:vol) 고정액을 만듭니다.
- 세포가 완전히 현탁될 때까지 단단히 뚜껑을 덮은 50mL 튜브를 반복적으로 뒤집습니다.
참고: 완전한 고정 전에 응축된 세포 펠릿을 형성하면 고르지 않은 고정이 발생하여 이후 염색 및 면역 표지 절차 중에 인공물이 발생할 수 있습니다. - 세포 현탁액을 실온에서 밤새 침전시킵니다.
- 다음날 튜브를 다시 뒤집어 세포를 다시 부유시키고 표면 대 부피 비율을 증가시켜 고정을 개선합니다.
알림: 셀 펠릿을 볼텍싱하는 것은 셀 손상을 초래할 수 있으므로 필요하거나 권장되지 않습니다.
3. 세포 펠릿의 트리밍 및 가공
- 24시간 고정 후 50mL 코니컬 튜브를 5°C에서 930 x g 로 10-15분 동안 원심분리합니다. 튜브가 단단히 캡핑되고 균등하게 분배되며 원심 분리기에서 균형을 이루는지 확인하십시오.
참고: 고정 시간은 실험실에서 사용하는 조직 고정 시간 또는 특정 실험 조건의 요구 사항을 반영하도록 수정할 수 있습니다. - 원심분리 후 세포가 가시적인 펠릿을 형성하는지 확인하십시오. 디캔팅 및/또는 멸균 이송 피펫으로 조심스럽게 흡인하여 정착액을 제거합니다.
- 용융된(40-60°C) 하이드록시에틸 아가로스 기반 겔( 재료 표 참조)을 셀 펠릿에 1:4(vol:vol) 겔 대 셀 펠릿 비율로 추가합니다.
- 깨끗한 5인치, 2mm 팁 스털링 프로브를 사용하여 수돗물로 눈을 헹구고 용융 젤을 고정 셀 펠릿에 부드럽게 저어줌으로써 50mL 원뿔형 튜브 바닥의 용융 젤에 고정 셀의 균일한 현탁액을 만듭니다(그림 1A).
- 고정된 셀 펠릿과 혼합된 용융 겔이 있는 캡핑된 50mL 원뿔형 튜브를 젖은 얼음에 5-10분 동안 놓아 겔화된 세포 펠릿을 응고시킵니다.
- 깨끗한 마이크로 주걱을 사용하여 튜브 측면을 따라 주걱을 놓고 펠릿을 뚫지 않고 부드럽게 활용하여 원뿔형 튜브에서 펠릿을 조심스럽게 제거합니다. 펠릿을 생검 용지에 놓습니다.
- 깨끗한 마이크로 주걱을 사용하여 셀 펠릿을 4-5mm 두께의 조각으로 잘라 각 슬라이스가 26mm x 26mm x 5mm 조직 카세트에 들어갈 수 있도록 합니다(그림 1B).
- 개별 젤 펠릿 조각을 생검 용지 중앙에 놓습니다. 생검 종이의 반대쪽 두 끝을 펠릿 위로 접어 포장합니다. 포장된 펠릿을 26mm x 26mm x 5mm 티슈 카세트에 넣습니다. 덮개를 닫고 조직 카세트 덮개로 생검 랩의 펼쳐진 측면을 압착합니다(그림 1C).
- 트리밍된 셀 펠릿 카세트를 10% 중성 완충 포르말린으로 채워진 티슈 프로세서 레토르트에 넣고 짧은 처리 일정으로 실행합니다.
참고: 짧은 처리 일정은 10% 중성 완충 포르말린에서 시작하여 점점 더 등급이 매겨지는 일련의 알코올을 통해 탈수되고, 세 번의 크실렌 변경으로 제거되고, 60°C 용융 침투/매립 파라핀(56°C 융점)의 두 가지 변경으로 파라핀 침투로 끝나는 각 레토르트에서 30분으로 구성됩니다.
4. 세포 펠릿 매립
- 처리된 카세트를 임베딩 센터의 고정 영역에 놓습니다.
- 티슈 카세트 뚜껑을 열고 생검 용지를 조심스럽게 펼칩니다.
- 셀 펠릿을 15mm x 15mm의 작은 일회용 매립 몰드에 넣고 면이 아래로 향하게 합니다.
참고: 작은 매립 몰드는 IHC 분석을 위해 하나의 염색되지 않은 조직 슬라이드에 최대 3개의 세포 펠릿 섹션을 맞출 수 있습니다. - 집게로 금형 바닥에 셀 펠릿을 부드럽게 잡고 62°C 조직 침투/매립 파라핀을 금형에 추가하여 셀 펠릿을 덮습니다.
- 몰드를 차가운 블록으로 이동하여 파라핀을 응고시키기 시작합니다. 파라핀이 응고되는 동안 셀 펠릿을 조정하여 금형 바닥의 적절한 위치에 고정합니다.
- 카세트에서 뚜껑을 제거합니다. 카세트를 바닥이 아래로 향하게 하여 매립 몰드 위에 놓고 용융 파라핀을 추가하여 카세트를 덮습니다.
- 파라핀이 티슈 카세트 위에 채워지면 몰드를 콜드 블록으로 되돌려17,18을 응고시킵니다.
5. 세포 펠릿의 절편
- 20μm의 단면 두께로 설정된 회전식 마이크로톰을 사용하여 파라핀 블록과 세포 펠릿의 전체 면이 파라핀 섹션 리본에 포착될 때까지 셀 펠릿 블록을 트리밍합니다. 이를 블록을 "직면"이라고 합니다.
- 단면을 식히고 얼음 목욕 트레이에 직면한 펠릿 블록을 5-15분 동안 담가 절단하기 전에 블록을 식히고 수분을 공급합니다.
알림: 블록이 수화되면 세포 펠릿이 파라핀 리본에서 반투명해집니다. 불투명하면 더 많은 담금질이 필요하며 아티팩트가 있을 수 있습니다. - 회전 마이크로톰을 사용하여 연속 절단 모드에서 4 μm 또는 다른 원하는 두께의 두께로 셀 펠렛 블록의 파라핀 리본을 절편화한다.
- 파라핀 리본을 42°C로 설정된 물 부양 수조에 놓습니다.
- 회전식 마이크로톰을 사용하여 준비된 파라핀 섹션을 부유조에서 양전하를 띤 슬라이드로 들어 올립니다.
- 슬라이드 상단의 첫 번째 섹션을 커버슬립 및 염색 경계 내에 놓고 두 번째 섹션을 그 아래에 배치하고 세 번째 셀 펠릿 섹션을 그 아래에 배치합니다(그림 1D).
- 절편화 후 슬라이드를 실온(약 23°C)에서 24시간 동안 건조시킨 다음 60°C에서 30분 동안 건조시킵니다.
참고: 슬라이드를 60°C에서 베이킹한 후, 세포 펠릿 절편은 열 유도 및 효소 기반 항원 검색9을 사용하는 프로토콜을 포함하는 임의의 표준 IHC 프로토콜과 함께 사용될수 있다.
결과
아가로스계 겔의 첨가에 이어서, 세포 펠렛은 취급하기 쉬운 고체 젤라틴 덩어리를 형성해야 한다(도 1B). 일단 매립되면 펠릿은 고체 조직과 유사한 일관성을 가지며 마이크로톰에서 일상적으로 절단하기가 비교적 쉬워야 합니다. 세포 펠릿이 내장되면 포르말린 고정, 파라핀 포매 조직과 동일한 방식으로 조직학 및 IHC 실험에 사용할 수 있습니다. 여기에는 상업적 IHC 플랫폼 9을 사용하여 간접 발색 검출 방법(예를 들어, 도 2 및 도 3에 도시된 바와 같이 양고추냉이 퍼옥시다제 및 디아미노벤지딘 검출과 함께 2차 항체 사용)과 함께 열 유도 에피토프 또는 효소 항원 검색의 사용이 포함된다9. 조직학적으로, 부착 세포는 펠릿에서 세포-세포 상호작용을 유지할 수 있지만 세포는 최소한의 세포 응집으로 섹션 전체에 고르게 분산되어야 합니다. 이 분산은 개별 세포 간의 구별을 허용하지만, 이러한 구별은 겔 펠릿 내의 세포 크기와 상대 밀도에 의해 크게 영향을받습니다. 핵, 세포질 및 세포막은 더 뚜렷하고 분산 시 시각화하기 쉽습니다(그림 2). 도 2에서, 3개의 세포주는 TEAD 전사 인자에 대해 면역표지된다. 면역표지는 갈색 디아미노벤지딘(DAB) 발색원으로 시각화됩니다. 세포주는 TEAD 전사 인자의 발현 수준이 다양하며, 발현 없음(그림 2A)에서 약한 발현(그림 2B), 강한 발현(그림 2C)에 이르기까지 다양합니다. 이 예에서 전사 인자에서 예상되는 것처럼 핵에서 표지가 관찰되고 눈에 보이지만 표지가 부족한 세포질과 세포막에는 없습니다(그림 2). 세포 펠릿은 표준 23mm x 75mm x 1mm 슬라이드의 세포 펠릿 마이크로어레이(그림 3)에 통합할 수 있습니다. 세포 펠릿을 마이크로어레이에 통합하면 동일한 슬라이드에서 다양한 발현 수준을 가진 대조군을 평가할 수 있습니다. 이 예에서 PEG10 결핍 마우스 배아 줄기 세포(왼쪽)는 음성 대조군 역할을 하고 PEG10을 과발현하는 293T 세포(오른쪽, 갈색 면역표지)는 마이크로어레이에서 양성 대조군 역할을 합니다(그림 3). 마이크로어레이에 포함될 세포 펠릿에 대한 조직 및 매립 절차에는 변동이 없으며, 마이크로어레이는 조직(19)에 사용되는 것과 유사한 방법을 사용하여 생성될 수 있다.

그림 1: 세포 펠릿 처리. (A) 세포를 50mL 원추형 튜브에서 펠릿화하고 겔과 혼합합니다. (B) 일단 응고되면, 펠릿은 26 mm x 26 mm x 5 mm 조직 카세트에 맞도록 직렬로 슬라이스된다. (C) 세포 펠릿은 조직 프로세서에 넣기 전에 생검 종이로 싸여 있습니다. (D) 최대 3개의 세포 펠릿을 단일 25mm x 75mm 유리 조직학 슬라이드에서 직렬로 수집할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
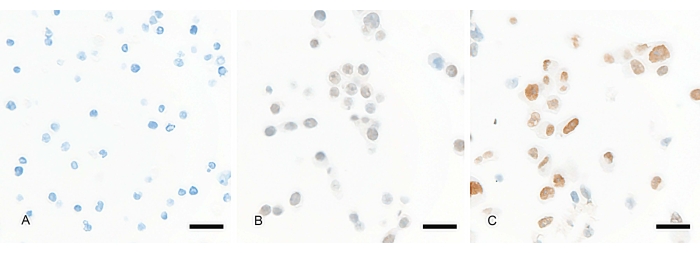
그림 2: 단백질 또는 전사체 발현 수준이 다른 세포 펠릿을 사용하여 분석의 동적 범위를 평가할 수 있습니다. 세포 펠릿은 TEAD 전사 인자에 대해 면역표지되며 다양한 수준의 TEAD 발현을 보여줍니다. (A) DAUDI 세포는 TEAD 발현이 부족하고 세포질 또는 핵에 면역 표지가 없습니다. 청색 얼룩은 핵의 헤마톡실린 대조 염색이다. (B) 293T 세포는 TEAD 전사 인자의 약한 핵 표지 (갈색 디 아미노 벤지딘 (DAB) 발색)를 나타낸다. (c) 디트로이트 562 세포는 핵에서의 강렬한 갈색 표지에 의해 입증된 바와 같이 TEAD를 강하게 발현한다. 세포질이 아닌 핵 내 표지 (갈색 핵 주위의 회백색에서 회색 영역)는 면역 조직 화학 분석의 적절한 표지를 보여줍니다. 세 세포주 모두에서 세포가 분산되어 핵 및 세포질 형태를 포함한 개별 세포의 시각화가 가능합니다. 스케일 바 = 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
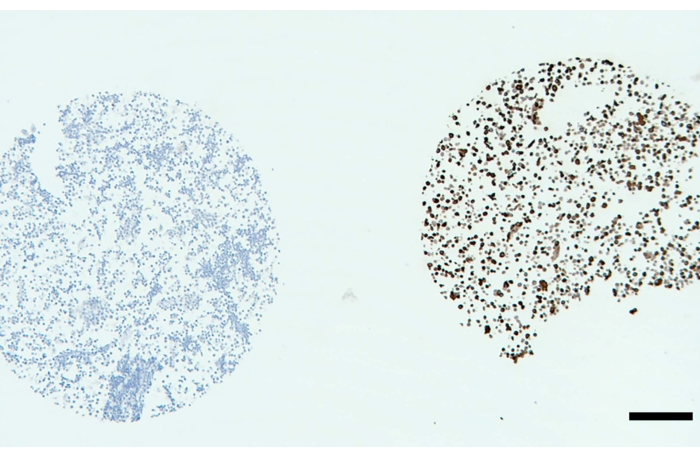
그림 3: 다양한 단백질 발현 수준을 가진 여러 세포 펠릿을 사용하여 만든 세포 펠릿 마이크로어레이를 사용하면 단일 슬라이드에서 대조군을 동시에 평가할 수 있습니다. PEG10 결핍 마우스 배아 줄기 세포 (왼쪽) 및 PEG10을 과발현하는 293T 세포 (오른쪽)는 PEG10에 대해 면역 표지됩니다. PEG10을 과발현하는 293T 세포에서 강력한 표지(갈색 DAB 크로모겐)가 관찰되는 반면, PEG10 결핍 세포에서는 표지가 나타나지 않습니다. 파란색은 헤마톡실린 카운터스테인을 나타냅니다. 스케일 바 = 200 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 다운스트림 면역조직화학 및 현장 혼성화 연구를 위한 대조군으로 사용할 수 있는 포르말린 고정, 파라핀 포매 세포 펠릿을 생성하는 방법론을 설명합니다. 이 프로토콜에 기술된 조직학 방법론은 다양한 범위의 암 및 1차 세포주에 적용가능하며, 주로 이들 펠릿(17,18)을 생산하기 위해 일상적인 조직학 기술을 적응시킨다. 가공 및 매립될 때, 펠릿은 조직과 유사한 방식으로 사용될 수 있다. 여기에는 면역조직화학 실험을 위한 열 유도 및 효소 항원 검색 프로토콜과 함께 사용하는 것이 포함됩니다. 이 프로토콜에 사용되는 방법론의 한 가지 목표는 과정 전반에 걸쳐 세포의 형태와 항원성을 보존하는 것입니다. 따라서 형태와 항원 성 모두의 변화 측면에서 비교적 완만 한 EDTA는 세포를 분리하는 데 사용됩니다. 이것은 물리적 중단과 같은 다른 접근 방식이 실행 가능하지 않다는 것을 말하는 것이 아닙니다. 그러나 세포를 분리하는 모든 접근 방식은 그 과정에서 세포가 손상되지 않도록 해야 합니다. 이 프로토콜의 두 번째 목표는 동일한 고정제, 고정 비율, 처리 일정 (고정, 탈수, 제거 및 파라핀 침윤) 및 임베딩 기술을 사용하여 조직과 유사한 방식으로 세포를 고정하고 처리하여 다운 스트림 분석을위한 비교 가능한 제어 역할을 할 수 있도록하는 것입니다. 따라서 세포 펠릿을 생성하는 데 사용되는 고정 및 처리 접근법은 조직에 사용되는 접근법을 모방해야합니다.
이 보고서에 설명된 프로토콜은 고정 전에 세포를 분리, 수집 및 원심분리하기 때문에 병원성 박테리아 또는 바이러스에 감염된 세포와 같은 감염원이 있는 세포를 처리하는 데 적합하지 않습니다. 조사관은 분리 전에 세포를 고정하는 프로토콜을 고려할 수 있지만 세포 형태를 방해하지 않고 세포를 수집하려면 추가 최적화가 필요합니다. 또한 감염원이 있는 세포의 고정 시간 및 취급 조건은 감염원 및 관련 기관 생물안전 프로토콜에 따라 추가 고려 사항이 필요합니다.
포르말린 고정, 파라핀 포매 세포 펠릿은 잘 정의된 단백질 발현 수준10을 갖는 데 독특하게 유리합니다. 암 및 내인성 세포주는 다양한 수준의 단백질 발현을 가진 세포를 선택하지만, 유전 공학 기술을 통해 과학자들은 관심 단백질을 과발현하고 CRISPR 기술을 사용하여 관심 유전자를 절제하거나 삽입함으로써 단백질 발현을 모델링할 수 있습니다.20,21 . 세포주에서 과발현된 단백질의 단점은 내인성 단백질 수준22를 나타내지 않을 수 있기 때문에 분석의 민감도에 대한 측정이 좋지 않다는 것입니다. 대조적으로, 내인성 세포주와 암 세포주 모두 내인성 발현 수준을 더 잘 나타낼 수 있으며, 동족 계통에서 암호화 유전자의 CRISPR 매개 결실은 상응하는 음성 대조군으로 작용할 수 있습니다. 또한 다양한 수준의 단백질 발현을 가진 내인성 세포주 또는 암 세포주는 최종 항체 희석액을 선택하고 분석의 민감도를 가장 잘 이해하기 위한 적정 실험에 이상적입니다(그림 2). 사용할 세포주를 둘러싼 결정은 개별 실험 요구 사항을 기반으로 해야 하며 종종 접근 방식의 조합을 활용합니다.
항체가 관심 단백질을 검출할 수 있는지 여부를 평가하는 것 외에도 세포주 패널을 사용하여 항체의 특이성을 정의할 수 있습니다. 예를 들어, 밀접하게 관련된 단백질 패밀리를 개별적으로 발현하는 세포주 패널을 사용하여 항체가 개별 단백질에 특이적인지 또는 밀접하게 관련된 다른 단백질도 검출하는지 여부를 테스트할 수 있습니다. 보다 정교한 대조군은 CRISPR 녹인 또는 과발현을 통해 검출되고 있는 특정 신호 전달 이벤트(예: 인-특이적 항체를 평가할 때 특정 인산화 부위의 돌연변이)를 겪을 수 없는 점 돌연변이를 갖는 단백질을 발현하는 세포주를 사용하는 것을 포함할 수 있습니다. 이들은 더 복잡한 접근법이지만, 항체가 특정 상황10 하에서 표지만을 사용했음을 확인하는 데 필요할 수 있습니다.
세포주의 유전자 조작은 균질한 세포 집단을 생성하지 않을 수 있다는 점에 유의하는 것이 중요합니다. 예를 들어, 과발현하는 세포주에서의 형질감염 효율은 전형적으로 100%가 아니며, 일부 세포는 관심있는 단백질을 과발현하지 않을 수 있다. 표준 방법으로 검출될 수 있는 형질감염 내에 FLAG 또는 관련 태그의 포함은 세포주(23)의 형질감염 효율을 평가하는데 도움이 될 수 있다. 이는 형질감염이 성공적이었는지 여부를 결정하고 단백질 발현으로 인한 검출 부족을 배제하고 관심 단백질을 발현해야 하는 세포의 예상 비율에 대한 참조 역할을 하는 데 도움이 될 수 있습니다.
계내 혼성화(ISH)는 또한 세포 펠릿에서 표적 유전자 발현을 특성화하고 IHC 방법 개발10을 알리는 유익한 도구가 될 수 있습니다. 항체를 스크리닝할 때 전사체와 잠재적 단백질이 언제 검출될 수 있는지 아는 것은 유익할 수 있습니다. 또한 세포 펠릿 ISH 스크리닝은 ISH 방법 개발에 도움이 될 수 있습니다. 특이성은 ISH 분석에서 덜 자주 문제가되지만 ISH 연구에 적용 할 수있는 대조군의 개발 및 활용에 대해 적절한 대조군 및 유사한 고려 사항을 갖는 것이 여전히 중요합니다.
조직 마이크로어레이는 공여체 블록에서 코어를 제거하고 종종 그리드 패턴으로 이러한 코어를 수용자 파라핀 블록으로 전달하여 생성됩니다. 결국, 수용자 블록은 단일 블록 내에 샘플들의 스펙트럼을 포함하여, 블록 내의 모든 샘플들이 동일한 IHC 절차를 거치도록 하고, 동일한 슬라이드(24, 25) 상의 다수의 샘플들의 직접 비교를 허용한다. 세포 펠릿은 비교적 균일한 집단이기 때문에 1mm 코어로 정확하게 나타낼 수 있어 유사한 어레이에 포함하기에 이상적인 후보입니다. 세포 펠릿 어레이를 사용하면 다양한 수준의 발현을 갖는 세포 펠릿, 관련 단백질을 고유하게 발현하는 세포 펠릿, 다양한 종의 관심 단백질의 오르토로그를 발현하는 세포 펠릿을 단일 슬라이드에 포함할 수 있습니다(그림 3). 이는 모든 세포 펠릿이 신속한 방식으로 균일한 조건 하에서 동시에 평가될 수 있게 하고, 시약(25)의 사용을 최소화한다.
이 프로토콜에는 8개의 T175 플라스크에서 수집한 2mL의 최소 시작 세포 펠릿 부피가 권장됩니다. 이 부피는 여러 세포 펠릿 블록의 생산 및 보관을 허용하므로 세포 펠릿 제어를 장기간에 걸쳐 표준화하고 주어진 펠릿에서 여러 세포 펠릿 어레이를 만들 수 있습니다. 더 낮은 세포 펠릿 부피는 1차 환자 유래 세포주, 느리게 성장하는 세포주를 다룰 때 또는 조건이 샘플의 부피를 제한할 때 사용할 수 있습니다. 물론, 더 낮은 시작 부피는 펠릿의 고정 및 준비 중 세포 손실로 인한 부정적인 영향을 강화하고 다운스트림 공정에 사용할 수 있는 재료를 제한합니다. 원심분리 후 정착액을 제거할 때 관련 손실을 최소화하기 위해 주의하는 것이 특히 중요합니다. 시료량을 줄이려면 1.5mL 캡이 있는 원심분리 튜브를 사용하여 세포를 펠릿화할 수 있습니다. 이 튜브는 가공을 위해 블레이드로 세로로 이등분될 수 있습니다.
조직 고정과 유사하게, 이 펠릿 내의 세포 고정은 다운스트림 IHC 평가에 매우 중요합니다. 완전한 고정을 달성하기 위해 최소 10:1 포르말린 대 세포 펠릿 비율을 사용하고 원추형 튜브를 반전시켜 세포를 현탁액으로 유지합니다. 고정 시 세포가 현탁 상태에 있지 않으면 불완전하거나 부적절한 고정의 위험이 있으며, 이는 다운스트림 면역표지에 영향을 미칩니다. 종종 이것은 주변부의 강력한 라벨링과 펠릿 중앙의 라벨링 손실 또는 펠릿 전체에 걸쳐 다양한 강도의 라벨링으로 나타납니다.
이 프로토콜은 주로 하이드록시에틸 아가로스로 구성된 히스토겔을 사용하여 세포 펠릿에 결합하고 세포가 세포 펠릿 전체에 고르게 분포되도록 합니다. 그것 없이는 세포가 압축되어 세포 형태 학적 세부 사항을 잃게됩니다. 이러한 세포형태학적 세부사항은 항체가 적절한 세포내 구획(예를 들어, 핵, 세포질 또는 원형질막)에 표지되고 있는지에 관한 추가 정보를 제공하기 때문에 항체 스크리닝 중에 종종 중요하다. 대조적으로, 너무 많은 젤은 펠릿 내의 세포 밀도를 낮추어 세포가 널리 분포되고 섹션당 세포 수를 감소시킬 수 있습니다.
이 프로토콜은 IHC 제어를 개발하는데 일상적으로 사용될 수 있다. 이러한 펠릿을 만드는 데 필요한 재료는 조사 생물학 및 조직학 실험실에서 일반적이며 방법은 간단하고 적응하기 쉽습니다. 세포 펠릿은 IHC 대조군으로서 한계가 있지만 초기 항체 스크리닝을 위한 훌륭한 도구 역할을 하고 다른 조직 대조군을 보완합니다.
공개
모든 저자는 Genentech / Roche의 직원이므로 Roche의 주주입니다.
감사의 말
우리는 Genentech의 연구 조직, 특히 수년 동안 이러한 방법의 개발에 기여한 병리학 핵심(P-코어) 실험실의 동료들의 협력을 인정하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10% Neutral Buffered Formalin | VWR | 16004-128 | |
| 50 mL Conical Tube | Becton Dickinson Labware | #0747-1886 | |
| 70% Ethanol | Koptec | V1401 | |
| 95% Ethanol | Koptec | V1101 | |
| Biopsy Wraps | Surgipath Medical Industries, Inc | #01090 | |
| Costar Stripette serological pipette 10mL | Corning | CLS4101 | |
| Flex 100 | Epredia | 8101 | |
| Flex 95 | Epredia | 8201 | |
| Histogel | Thermo Scientific | #R904012 | |
| Leica Automated Rotary Microtome | Leica | RM2255 | |
| Micro Spatula, rounded and tapered ends | Tedd Pella | #13510 | |
| NanoZoomer 2.0 HT whole slide imager | Hamamatsu | ||
| Paraplast Tissue Infiltration/Embedding Paraffin | Surgipath | 39601006 | |
| Pipette Controller | CAPP | PA-100 | |
| Reagent Alcohol | Epredia | 9111 | |
| Sterling Probe 5” 2mm Tip with Eye | Roboz Surgical Instrument Co., Inc | #RS-9522 | |
| Superfrost Plus positively charged microscope slides | Thermo Scientific | 6776214 | |
| Tissue cassettes; PrintMate Slotted Cassette | Epredia | B851120WH | |
| TMA Tissue Grand Master | 3DHistech LTD | ||
| Xylenes | VWR | 89370-088 |
참고문헌
- Wennerberg, A. E., Nalesnik, M. A., Coleman, W. B. Hepatocyte paraffin 1: a monoclonal antibody that reacts with hepatocytes and can be used for differential diagnosis of hepatic tumors. American Journal of Pathology. 143 (4), 1050-1054 (1993).
- Chu, P. G., Ishizawa, S., Wu, E., Weiss, L. M. Hepatocyte antigen as a marker of hepatocellular carcinoma. American Journal of Surgical Pathology. 26 (8), 978-988 (2002).
- Cobleigh, M. A., et al. Multinational study of the efficacy and safety of humanized anti-HER2 monoclonal antibody in women who have HER2-overexpressing metastatic breast cancer that has progressed after chemotherapy for metastatic disease. Journal of Clinical Oncology. 17 (9), 2639-2648 (1999).
- Vogel, C. L., et al. Efficacy and safety of trastuzumab as a single agent in first-line treatment of HER2-overexpressing metastatic breast cancer. Journal of Clinical Oncology. 20 (3), 719-726 (2002).
- Webster, J. D., Miller, M. A., DuSold, D., Ramos-Vara, J. A. Effects of prolonged formalin fixation on the immunohistochemical detection of infectious agents in formalin-fixed, paraffin-embedded tissues. Veterinary Pathology. 47 (3), 529-535 (2010).
- Havnar, C., et al. Characterization of tumor-immune microenvironment by high-throughput image analysis of CD8 immunohistochemistry combined with modified Masson's trichrome. Journal of Histochemistry and Cytochemistry. 69 (9), 611-615 (2021).
- Newton, K., et al. RIPK1 inhibits ZPB1-driven necroptosis during development. Nature. 540 (7631), 129-133 (2016).
- Webster, J. D., Solon, M., Haller, S., Newton, K. Detection of necroptosis by phospho-RIPK3 immunohistochemical labeling. Methods in Molecular Biology. 1857, 153-160 (2018).
- Ramos, J. A., Miller, M. A., et al. When antibodies and antigens get along: revisiting the technical aspects of immunohistochemistry-the red, brown, and blue technique. Veterinary Pathology. 51 (1), 42-87 (2014).
- Webster, J. D., Solon, M., Gibson-Corley, K. N. Validating immunohistochemistry assay specificity in investigative studies: consideration for a weight of evidence approach. Veterinary Pathology. 58 (5), 829-840 (2021).
- Ramos-Vara, J. A., et al. American association of veterinary laboratory diagnosticians subcommittee on standardization of immunohistochemistry suggested guidelines for immunohistochemical techniques in veterinary diagnostic laboratories. Journal of Veterinary Diagnostic Investigation. 20 (4), 393-413 (2008).
- Dominguez, S., et al. Genetic inactivation of RIP1 kinase does not ameliorate disease in a mouse model of ALS. Cell Death and Differentiation. 28 (3), 915-931 (2021).
- Lean, F. Z. X., et al. Differential susceptibility of SARS-CoV-2 in animals: evidence of ACE2 host receptor distribution in companion animals, livestock and wildlife by immunohistochemical characterization. Transboundary and Emerging Disease. , 14232(2021).
- Dunstan, R. W., Wharton, K. A., Quigley, C., Lowe, A. The use of immunohistochemistry for biomarker assessment-can it compete with other technologies. Toxicologic Pathology. 39 (6), 988-1002 (2011).
- Atcc.org. , Available from: http://www.atcc.org (2022).
- Thermo Fisher Scientific. Cell Culture Basics Handbook. , Gibco. (2020).
- Carson, F. Histotechnology: A Self-Instructional Text, 2nd Ed. , ASCP Press. Chicago, IL. (1997).
- Suvarna, S. K., Layton, C., Bancroft, J. D. Tissue Processing. Bancroft's Theory and Practice of Histological Techniques, 7th Ed. Spencer, L. T., Bancroft, J. D. , Churchill Livingstone-Elsevier. China. (2013).
- Dancau, A. M., Simon, R., Mirlacher, M., Sauter, G. Tissue Microarrays. Cancer Gene Profiling. , Humana Press. New York. 53-65 (2016).
- Jinek, M., et al. Programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 337 (6096), 816-821 (2012).
- Jinek, M., et al. RNA-programmed genome editing in human cells. eLife. 2, 00471(2013).
- Hewitt, S. M., Baskin, D. G., Frevert, C. W., Stahl, W. L., Rosa-Molinar, E. Controls for immunohistochemistry: The Histochemical Society's standards of practice for validation of immunohistochemical assays. Journal of Histochemistry and Cytochemistry. 62 (10), 693-697 (2014).
- Ferrando, R., Newton, K., Chu, F., Webster, J., French, D. Immunohistochemical detection of FLAG-tagged endogenous proteins in knock-in mice. Journal of Histochemistry and Cytochemistry. 63 (4), 244-255 (2015).
- Kononen, J., et al. Tissue microarrays for high-throughput molecular profiling of tumor specimens. Nature Medicine. 4 (7), 844-847 (1998).
- Moch, H., Kononen, J., Kallioniemi, O. P., Sauter, G. Tissue microarrays: what will they bring to molecular and anatomic pathology. Advances in Anatomic Pathology. 8 (1), 14-20 (2001).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유