6.7 : Equações Termoquímicas
Para uma reação química (o sistema) realizada a uma pressão constante – com o único trabalho feito por expansão ou contração – a entalpia da reação (também chamada de calor da reação, ΔHrxn) é igual ao calor trocado com as imediações (qp).
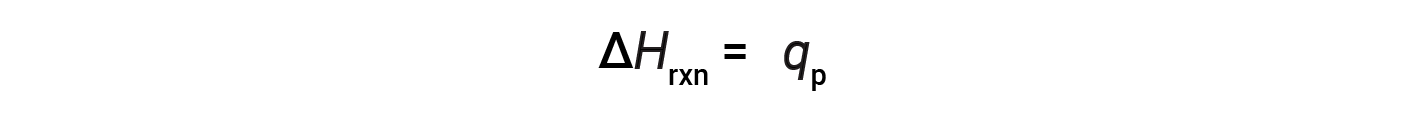
A alteração na entalpia é uma propriedade extensiva, e depende das quantidades dos reagentes que participam da reação (ou do número de moles dos reagentes). A alteração na entalpia é específica da reação, e os estados físicos das espécies de reagentes e produtos são importantes. Uma reação exotérmica é caracterizada por um valor de −ΔHrxn, enquanto que uma reação endotérmica tem um valor de +ΔHrxn.
Uma vez que a quantidade de calor libertada ou absorvida por uma reação corresponde à quantidade de cada substância consumida ou produzida pela reação, é conveniente utilizar uma equação termoquímica para representar as alterações na matéria e na energia. Em uma equação termoquímica, a alteração na entalpia de uma reação é mostrada como ΔHrxn, e é geralmente fornecida a seguir à equação para a reação. A magnitude de ΔHrxn indica a quantidade de calor associada à reação mostrada na equação química. O sinal de ΔHrxn indica se a reação é exotérmica ou endotérmica, conforme escrito. Na equação seguinte, 1 mole do gás hidrogénio e 1/2 mole do gás oxigénio (a alguma temperatura e pressão) reagem para formar 1 mole de água líquida (à mesma temperatura e pressão).
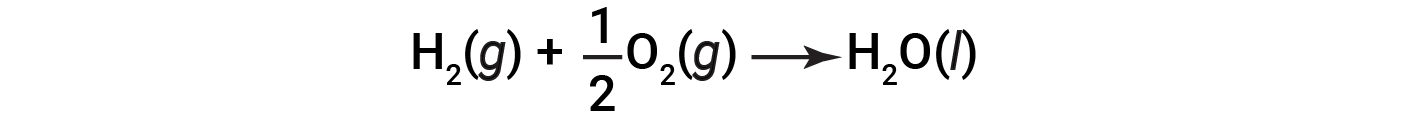
Esta equação indica que 286 kJ de calor são libertados para as imediações. Por outras palavras, 286 kJ de calor são libertados (a reação é exotérmica) por cada mole de hidrogénio que é consumido ou por cada mole de água que é produzida. Portanto, a entalpia da reação é um factor de conversão que pode ser usado para calcular a quantidade de calor que é libertada ou absorvida durante reações que envolvem quantidades específicas de reagentes e produtos.
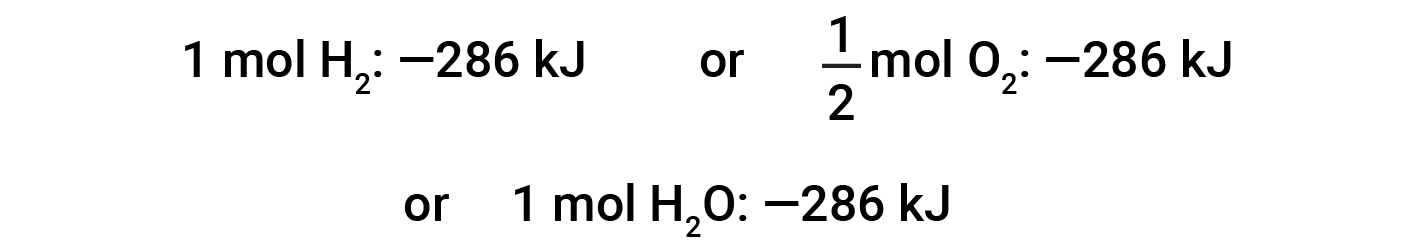
Se os coeficientes da equação química forem multiplicados por algum factor (ou seja, se a quantidade de uma substância for alterada), a alteração da entalpia deve ser multiplicada por esse mesmo factor.
(aumento em duas vezes nas quantidades)
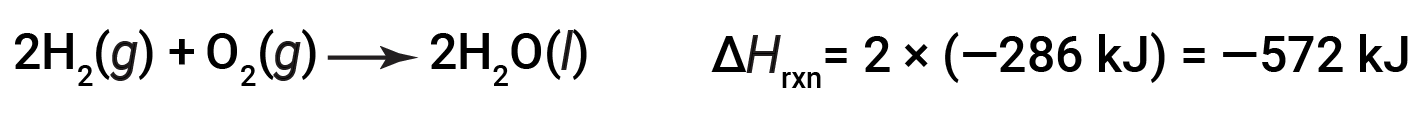
(diminuição em duas vezes nas quantidades)
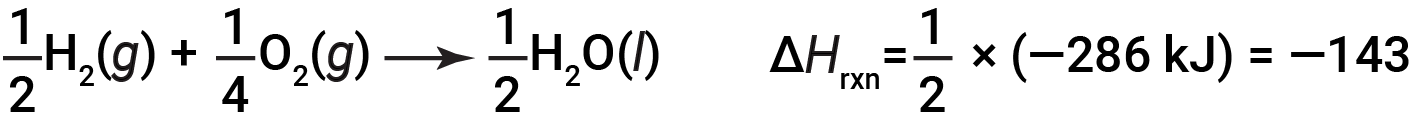
Para ilustrar que a alteração da entalpia de uma reação depende dos estados físicos dos reagentes e produtos, considere a formação de água gasosa (ou vapor de água). Quando 1 mole de gás hidrogénio e ½ mole de gás oxigénio reagem para formar 1 mole de água gasosa, apenas são libertados 242 kJ de calor, em oposição a 286 kJ de calor, que é libertado quando se forma água líquida.
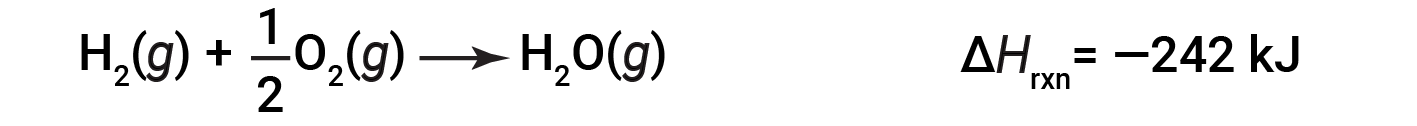
Do Capítulo 6:

Now Playing
6.7 : Equações Termoquímicas
Termoquímica
28.1K Visualizações

6.1 : Princípios Básicos de Energia
Termoquímica
36.7K Visualizações

6.2 : Primeira Lei da Termodinâmica
Termoquímica
31.3K Visualizações

6.3 : Energia Interna
Termoquímica
28.7K Visualizações

6.4 : Quantificação do Calor
Termoquímica
53.6K Visualizações

6.5 : Quantificação do Trabalho
Termoquímica
18.9K Visualizações

6.6 : Entalpia
Termoquímica
34.6K Visualizações

6.8 : Calorimetria de Pressão Constante
Termoquímica
84.5K Visualizações

6.9 : Calorimetria de Volume Constante
Termoquímica
26.8K Visualizações

6.10 : Lei de Hess
Termoquímica
44.3K Visualizações

6.11 : Entalpia de Formação Padrão
Termoquímica
40.8K Visualizações

6.12 : Entalpias de Reações
Termoquímica
31.4K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados