O estado de uma reação reversível é convenientemente avaliado através do seu quociente de reação (Q). Para uma reação reversível descrita por m A + n B ⇌ x C + y D, o quociente de reação é derivado diretamente da estequiometria da equação equilibrada como
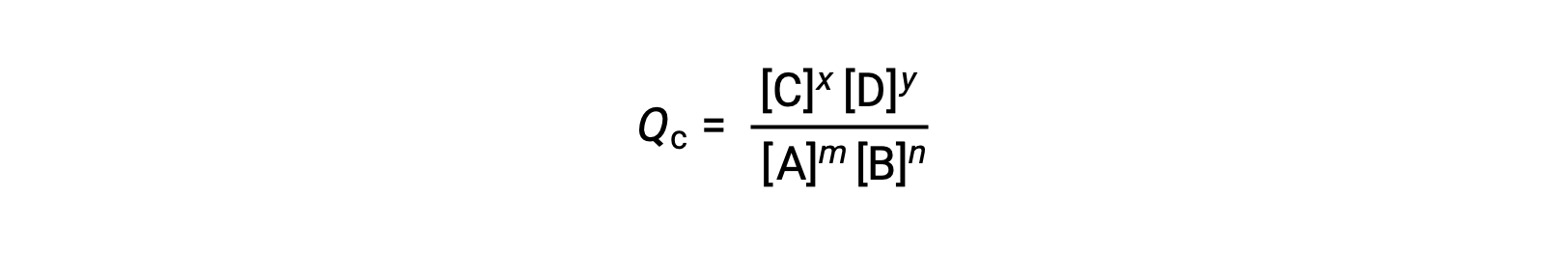
onde o subscrito c denota o uso de concentrações molares na expressão. Se os reagentes e os produtos forem gasosos, um quociente de reação pode ser derivado de forma semelhante utilizando pressões parciais:
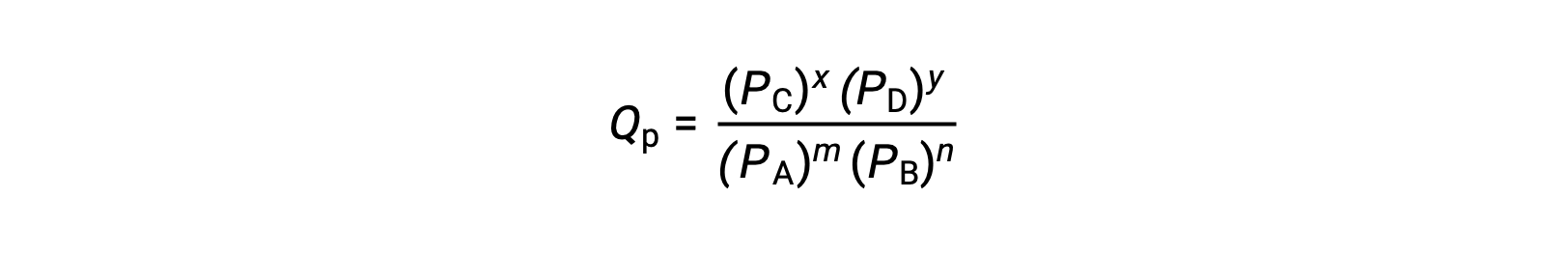
Observe que as equações de quociente de reação acima são uma simplificação de expressões mais rigorosas que usam valores relativos para concentrações e pressões em vez de valores absolutos. Estes valores relativos de concentração e pressão são não dimensionáveis (não têm unidades); consequentemente, também os quocientes de reação.
O valor numérico de Q varia à medida que uma reação prossegue em direção ao equilíbrio; portanto, pode servir como um indicador útil do estado da reação. Para ilustrar este ponto, considere a oxidação do dióxido de enxofre:
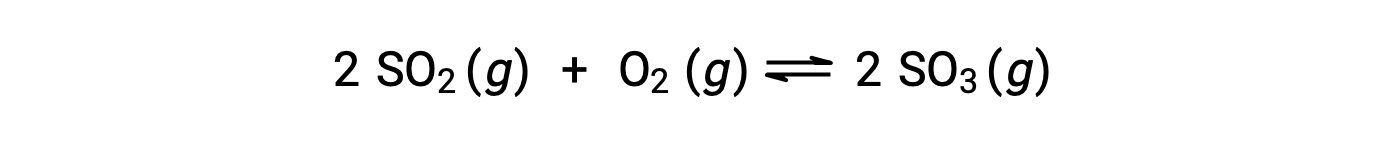
Dois cenários experimentais diferentes são possíveis aqui, um em que essa reação é iniciada apenas com uma mistura de reagentes, SO2 e O2, e outro que começa apenas com produto, SO3. Para a reação que começa apenas com uma mistura de reagentes, Q é inicialmente igual a zero:
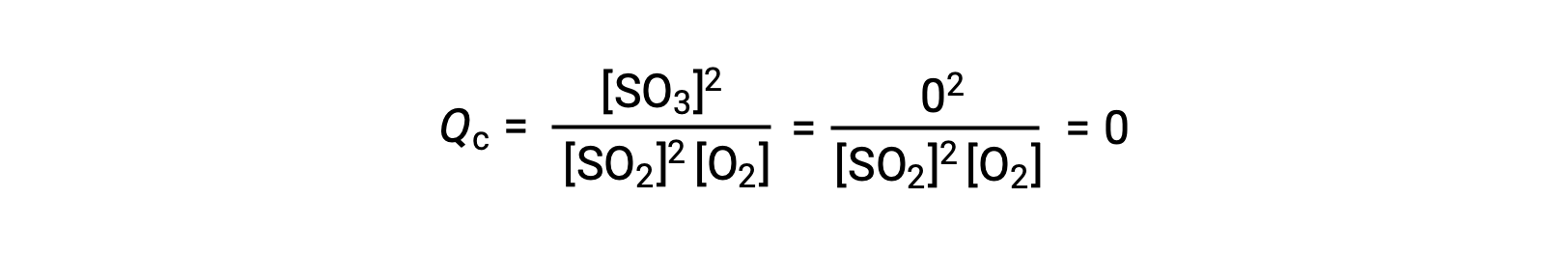
À medida que a reação prossegue para o equilíbrio na direção direta, as concentrações de reagentes diminuem (tal como o denominador de Qc), a concentração do produto aumenta (tal como o numerador de Qc), e o quociente de reação consequentemente aumenta. Quando se atinge o equilíbrio, as concentrações de reagentes e produto permanecem constantes, assim como o valor de Qc.
Se a reação começar apenas com o produto presente, o valor de Qc é inicialmente indefinido (incomensuravelmente grande, ou infinito):
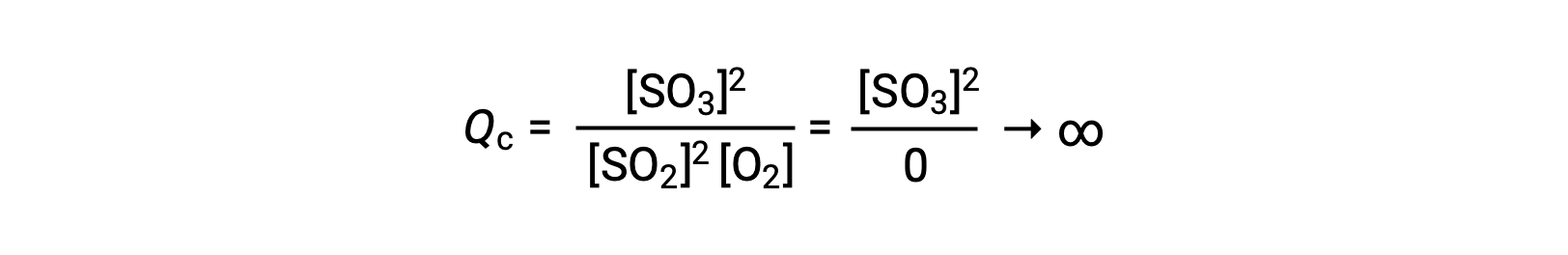
Neste caso, a reação prossegue para o equilíbrio na direção inversa. A concentração do produto e o numerador de Qc diminuem com o tempo, as concentrações de reagentes e o denominador de Qc aumentam, e o quociente de reação consequentemente diminui, até que se torna constante em equilíbrio. O valor constante de Q exibido por um sistema em equilíbrio é chamado de constante de equilíbrio, K:
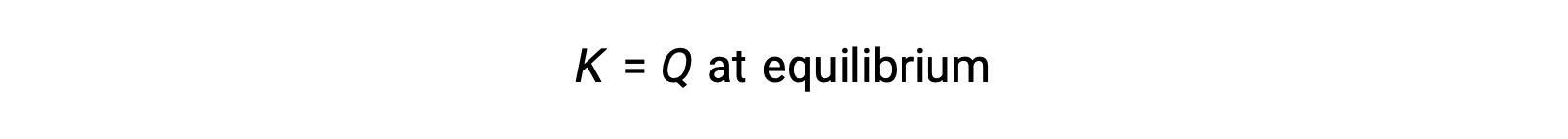
Avaliação de um Quociente de Reação
O dióxido de nitrogénio gasoso forma tetróxido de dinitrogénio de acordo com esta equação:
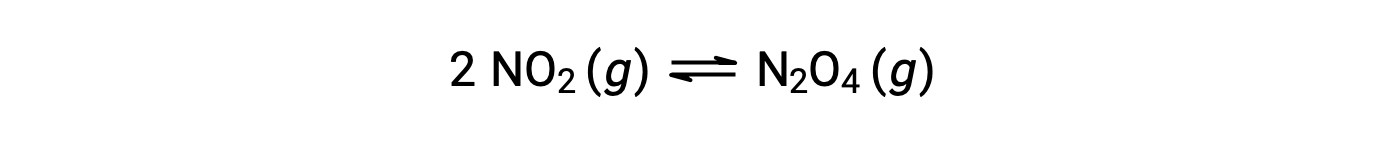
Quando se adiciona 0,10 mol de NO2 a um frasco de 1,0 L a 25 °C, a concentração muda de modo a que, em equilíbrio, [NO2] = 0,016 M e [N2O4] = 0,042 M. Antes da formação de qualquer produto, [NO2] = 0,10 M e [N2O4] = 0 M. Assim,
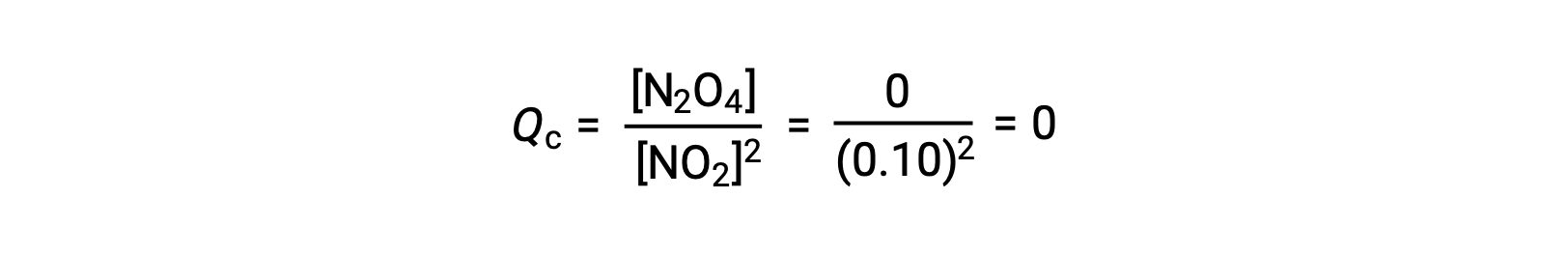
Em equilíbrio,
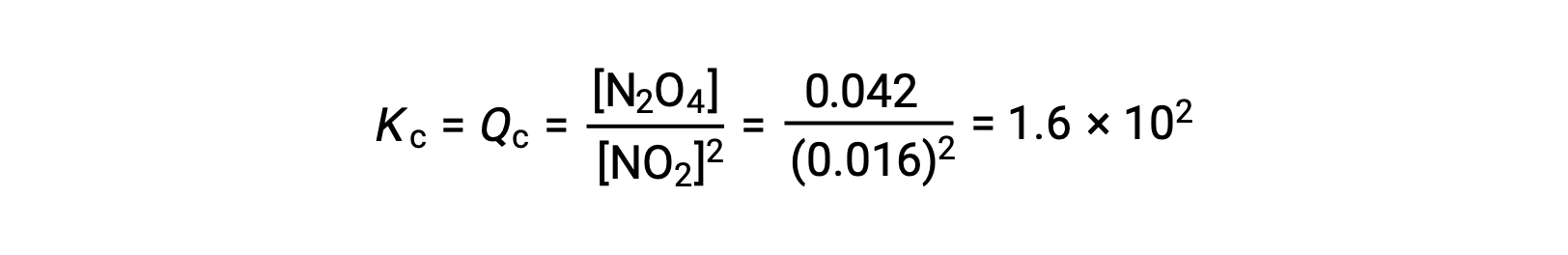
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.2 Equilibrium Constants.
Do Capítulo 14:

Now Playing
14.5 : Quociente da Reação
Equilíbrio Químico
47.1K Visualizações

14.1 : Equilíbrio Dinâmico
Equilíbrio Químico
48.5K Visualizações

14.2 : A Constante de Equilíbrio
Equilíbrio Químico
45.0K Visualizações

14.3 : Equilíbrio para Reações Gasosas e Reações Heterogêneas
Equilíbrio Químico
23.2K Visualizações

14.4 : Cálculo da Constante de Equilíbrio
Equilíbrio Químico
29.7K Visualizações

14.6 : Cálculo das Concentrações de Equilíbrio
Equilíbrio Químico
46.0K Visualizações

14.7 : O Princípio de Le Chatelier: Alteração da Concentração
Equilíbrio Químico
56.3K Visualizações

14.8 : O Princípio de Le Chatelier: Alteração do Volume (Pressão)
Equilíbrio Químico
33.2K Visualizações

14.9 : O Princípio de Le Chatelier: Alteração da Temperatura
Equilíbrio Químico
28.2K Visualizações

14.10 : A Aproximação do x Pequeno
Equilíbrio Químico
45.3K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados