16.3 : Equação de Henderson-Hasselbalch
A expressão da constante de ionização para uma solução de um ácido fraco pode ser escrita como:
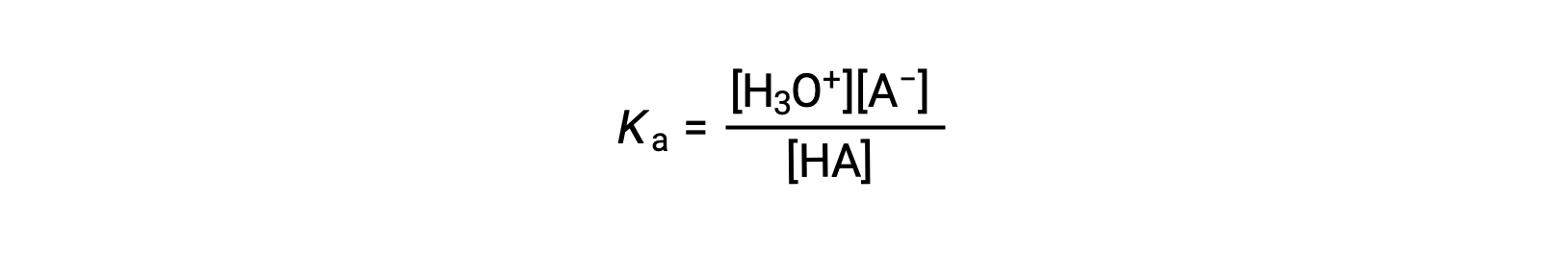
Reorganizando para resolver para [H3O+] obtemos:
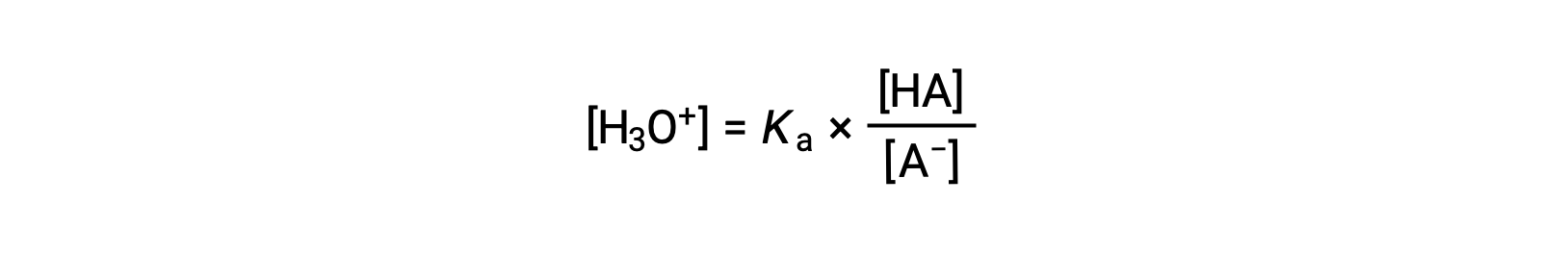
Tomando o logaritmo negativo de ambos os lados desta equação obtemos
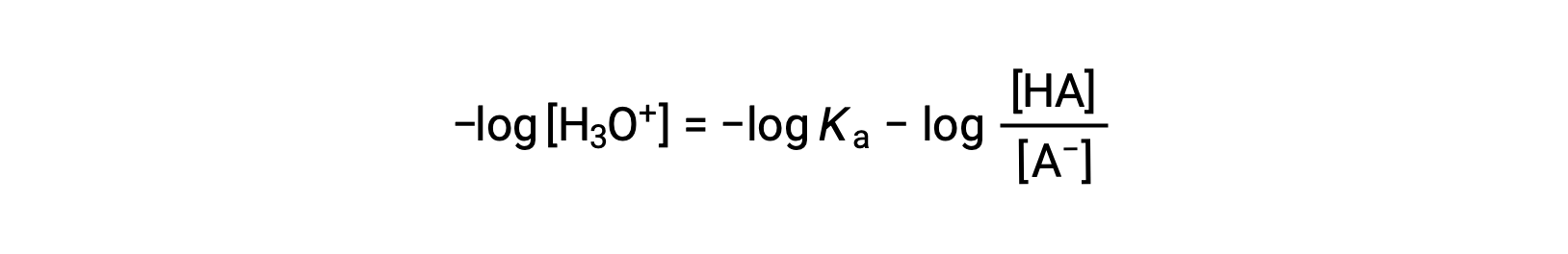
que pode ser escrita como
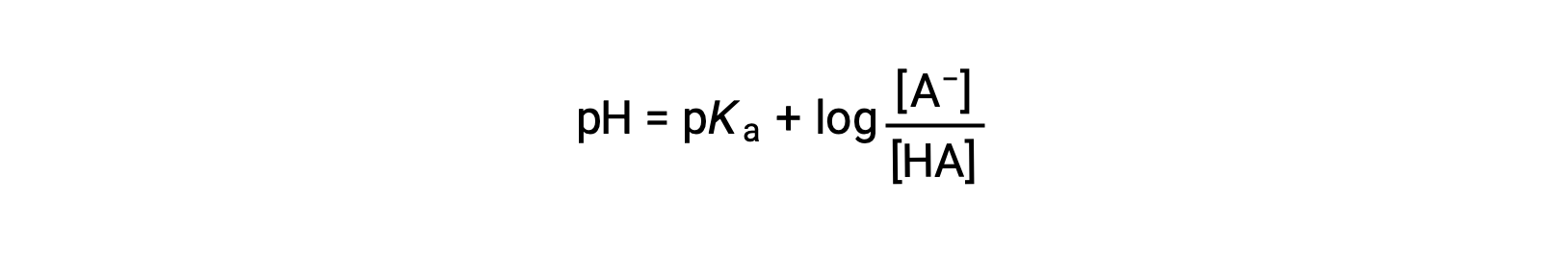
onde pKa é o negativo do logaritmo da constante de ionização do ácido fraco (pKa = −log Ka). Esta equação relaciona o pH, a constante de ionização de um ácido fraco, e as concentrações do par ácido-base conjugado fraco em uma solução tampão. Os cientistas muitas vezes usam essa expressão, chamada de equação de Henderson-Hasselbalch, para calcular o pH de soluções tampão. É importante notar que a suposição “x é pequeno” deve ser válida para usar esta equação.
Lawrence Joseph Henderson e Karl Albert Hasselbalch
Lawrence Joseph Henderson (1878–1942) foi um médico, bioquímico e fisiologista Americano, para nomear apenas algumas das suas muitas carreiras. Ele obteve um diploma de medicina em Harvard e, em seguida, passou dois anos a estudar em Estrasburgo, depois em uma parte da Alemanha, antes de regressar a uma posição de professor em Harvard. Ele eventualmente tornou-se professor em Harvard e trabalhou lá toda a sua vida. Ele descobriu que o equilíbrio ácido-base no sangue humano é regulado por um sistema tampão formado pelo dióxido de carbono dissolvido no sangue. Ele escreveu uma equação em 1908 para descrever o sistema tampão carbonato-ácido carbónico no sangue. Henderson era amplamente conhecedor; além da sua importante investigação sobre a fisiologia do sangue, ele também escreveu sobre as adaptações de organismos e a sua adequação aos seus ambientes, sobre sociologia e sobre educação universitária. Ele também fundou o Laboratório de Fadiga na Harvard Business School, que examinou a fisiologia humana com um foco específico no trabalho na indústria, exercício, e nutrição.
Karl Albert Hasselbalch (1874–1962), um médico e químico Dinamarquês, compartilhou autoria em um artigo com Christian Bohr em 1904 que descreveu o efeito de Bohr, que mostrou que a capacidade da hemoglobina no sangue para se ligar ao oxigénio estava inversamente relacionada com a acidez do sangue e com a concentração de dióxido de carbono. A escala de pH foi introduzida em 1909 por outro Dinamarquês, Sørensen, e em 1912, Hasselbalch publicou medições do pH do sangue. Em 1916, Hasselbalch expressou a equação de Henderson em termos logarítmicos, consistente com a escala logarítmica do pH, e assim nasceu a equação de Henderson-Hasselbalch.
Este texto é adaptado de Openstax, Chemistry 2e, Section 14.6: Buffers.
Do Capítulo 16:

Now Playing
16.3 : Equação de Henderson-Hasselbalch
Equilíbrio Ácido-Base e Solubilidade
67.9K Visualizações

16.1 : Efeito de Íon Comum
Equilíbrio Ácido-Base e Solubilidade
40.8K Visualizações

16.2 : Tampões
Equilíbrio Ácido-Base e Solubilidade
163.2K Visualizações

16.4 : Cálculo de Alterações de pH em uma Solução Tampão
Equilíbrio Ácido-Base e Solubilidade
52.4K Visualizações

16.5 : Eficácia dos Tampões
Equilíbrio Ácido-Base e Solubilidade
48.3K Visualizações

16.6 : Cálculos de Titulação: Ácido Forte - Base Forte
Equilíbrio Ácido-Base e Solubilidade
28.9K Visualizações

16.7 : Cálculos de Titulação: Ácido Fraco - Base Forte
Equilíbrio Ácido-Base e Solubilidade
43.7K Visualizações

16.8 : Indicadores
Equilíbrio Ácido-Base e Solubilidade
47.6K Visualizações

16.9 : Titulação de um Ácido Poliprótico
Equilíbrio Ácido-Base e Solubilidade
95.5K Visualizações

16.10 : Equilíbrio de Solubilidade
Equilíbrio Ácido-Base e Solubilidade
51.8K Visualizações

16.11 : Fatores que Afetam a Solubilidade
Equilíbrio Ácido-Base e Solubilidade
32.9K Visualizações

16.12 : Formação de Íons Complexos
Equilíbrio Ácido-Base e Solubilidade
23.0K Visualizações

16.13 : Precipitação de Íons
Equilíbrio Ácido-Base e Solubilidade
27.4K Visualizações

16.14 : Análise Qualitativa
Equilíbrio Ácido-Base e Solubilidade
20.0K Visualizações

16.15 : Curvas de Titulação Ácido-Base
Equilíbrio Ácido-Base e Solubilidade
126.0K Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados