19.9 : Diagrama de Fase
The phase of a given substance depends on the pressure and temperature. Thus, plots of pressure versus temperature showing the phase in each region provide considerable insights into the thermal properties of substances. Such plots are known as phase diagrams. For instance, in the phase diagram for water (Figure 1), the solid curve boundaries between the phases indicate phase transitions (i.e., temperatures and pressures at which the phases coexist).
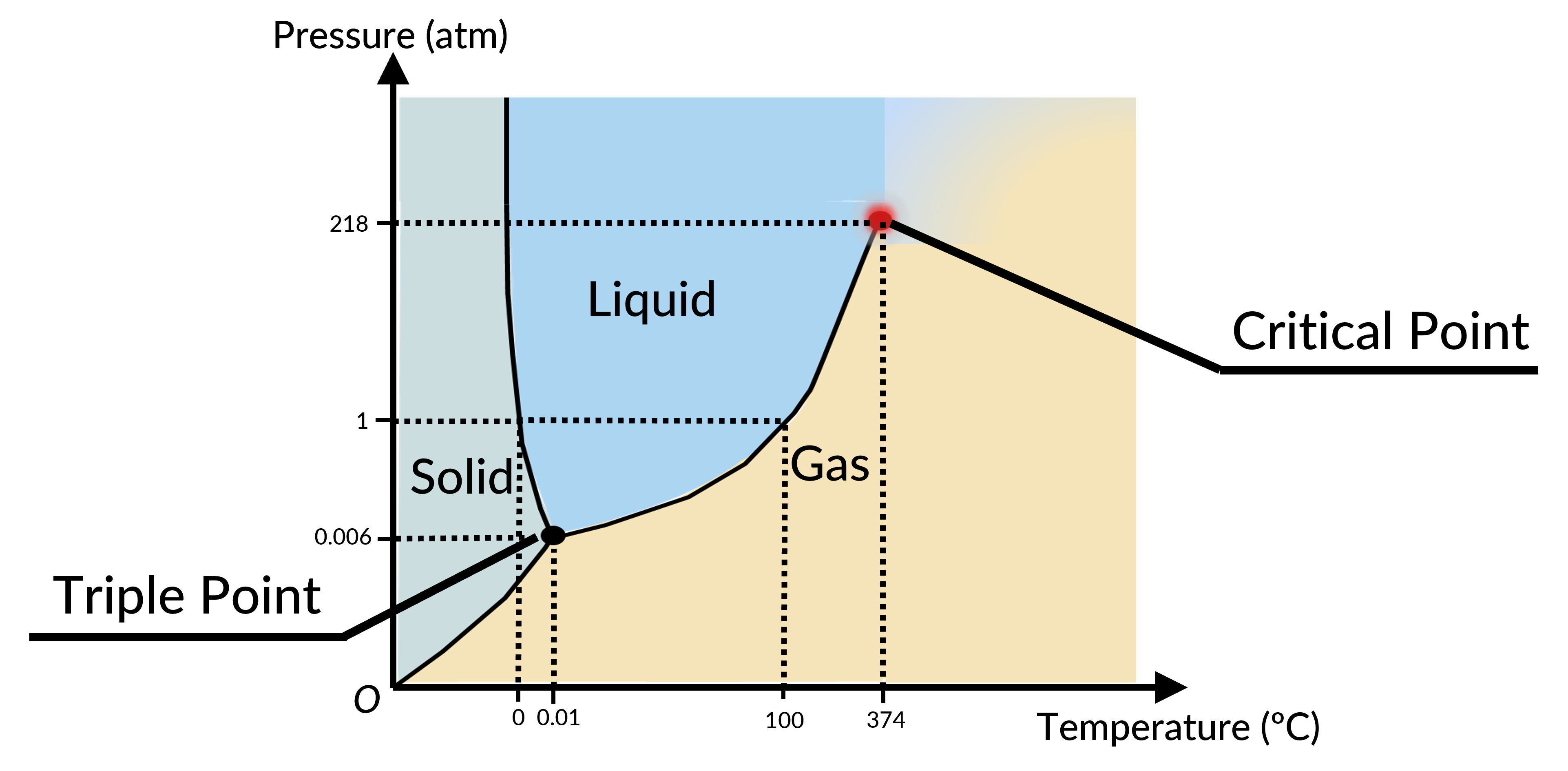
As the pressure increases, the boiling temperature of water rises gradually to 374 °C at a pressure of 218 atm. This can be demonstrated in a pressure cooker, which cooks food faster than an open pot, because the water can exist as a liquid at temperatures greater than 100 °C without all boiling away. The boiling point curve ends at a certain point called the critical point, the temperature above which the liquid and gas phases cannot be distinguished; the substance is called a supercritical fluid. At a sufficiently high pressure above the critical point, a gas has the density of a liquid but does not condense. The pressure at this critical point is known as the critical pressure. Carbon dioxide, for example, is supercritical at all temperatures above 31.0 °C, the point at which all three phases exist in equilibrium. For water, the triple point occurs at 273.16 K (0.01 °C) and 611.2 Pa; this is a more accurate calibration temperature than the melting point of water at 1.00 atm, or 273.15 K (0.0 °C).
Do Capítulo 19:

Now Playing
19.9 : Diagrama de Fase
Teoria Cinética dos Gases
5.7K Visualizações

19.1 : Equação de Estado
Teoria Cinética dos Gases
1.6K Visualizações

19.2 : Equação do Gás Ideal
Teoria Cinética dos Gases
6.6K Visualizações

19.3 : Equação de Van der Waals
Teoria Cinética dos Gases
3.9K Visualizações

19.4 : Diagrama pV
Teoria Cinética dos Gases
4.0K Visualizações

19.5 : Teoria Cinética de um Gás Ideal
Teoria Cinética dos Gases
3.4K Visualizações

19.6 : Energia Cinética Molecular
Teoria Cinética dos Gases
5.0K Visualizações

19.7 : Distribuição de Velocidades Moleculares
Teoria Cinética dos Gases
3.9K Visualizações

19.8 : Distribuição de Maxwell-Boltzmann: Resolução de Problemas
Teoria Cinética dos Gases
1.4K Visualizações

19.10 : Caminho e Tempo Médio Livre
Teoria Cinética dos Gases
3.4K Visualizações

19.11 : Capacidade Térmica: Resolução de Problemas
Teoria Cinética dos Gases
487 Visualizações

19.12 : Lei das Pressões Parciais de Dalton
Teoria Cinética dos Gases
1.3K Visualizações

19.13 : Velocidades de Escape de Gases
Teoria Cinética dos Gases
888 Visualizações
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados