É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Eletrofiação Andaimes Polymer fibrosos para Engenharia de Tecidos e Cultura de Células
Neste Artigo
Resumo
O processo de eletrofiação polímeros para engenharia de tecidos e de cultura de células é abordada neste artigo. Especificamente, o electrospinning de macromers fotorreativas com capacidades de processamento adicional de photopatterning e multi-polímero eletrofiação é descrito.
Resumo
Como o campo da engenharia de tecidos evolui, há uma enorme demanda para a produção de materiais mais adequados e técnicas de processamento, a fim de atender aos requisitos (por exemplo, mecânica e vascularização) de órgãos e tecidos mais intrincados. Eletrofiação é uma técnica popular para criar andaimes fibroso que imitam a arquitetura ea escala de tamanho da matriz extracelular nativa. Estes andaimes fibroso também são úteis como substratos de cultura de células já que as fibras podem ser usadas para orientar o comportamento celular, incluindo a diferenciação de células-tronco (ver extensas revisões por Mauck
Protocolo
A. Único Polymer Electrospinning
- Antes de preparar a solução de eletrofiação, faça uma solução 0,5% em peso do fotoiniciador, IRGACURE 2959 (I2959), em água deionizada, dissolvendo a 37 ° C por vários dias. Este passo não é necessário se um polímero fotorreativas não está sendo usado.
- Combine ácido hialurônico methacrylated (MEHA, ver Burdick et al. Para a síntese), poli (óxido de etileno) (PEO, 900 kDa), e I2959 em água deionizada para preparar uma solução com uma concentração final de 2% em peso MEHA, 3% em peso PEO, e 0,05% em peso I2959. Use um vórtice para misturar a solução até que fique claro. O tipo de polímero e concentração, bem como o solvente usado pode ser modificado nesta etapa, dependendo das propriedades desejadas andaime.
- Transferir a solução para uma seringa e anexar uma calibre 18, seis polegadas de comprimento, agulha de ponta cega até o fim.
- Bomba de programa de uma seringa para ejetar a uma taxa de 1,2 mL / hr. Inserir a seringa ea agulha para o dispositivo.
- Anexar a liderança fundamentada de uma fonte de alta tensão para o aparelho de coleta. Para coletar aleatoriamente distribuídos fibras usar uma placa de metal lisa, ou usar um mandril girando a ~ 10 m / s para coletar fibras alinhadas. Anexar a liderança com carga positiva para a agulha. Veja a Figura 1 para um esquema do aparelho eletrofiação.
- Ajustar a agulha ou dispositivo de recolha, de modo que há uma distância de 15 cm entre os dois.
- Iniciar o fluxo da bomba de seringa. Quando o fluido é visualizada na ponta da agulha, ligue a fonte de alimentação e definir a tensão de 22 kV.
- Após a coleta é completo (a partir de vários minutos para filmes finos, com até 24 horas para um mais grosso tapete), remova o andaime do aparelho de coleta e armazená-lo sob vácuo durante a noite para garantir a remoção completa do solvente.
- Visualizar a morfologia da fibra através de microscopia eletrônica de varredura (MEV), representante de um andaime é mostrado na Figura 1 para ambas as estruturas alinhadas e não-alinhados.
Nota: O caudal da amostra, a distância para o dispositivo de recolha e de tensão dependem da combinação de polímero e solvente e devem ser otimizados para cada sistema, normalmente por meio da observação da morfologia andaime com SEM.
B. Photocrosslinking e Photopatterning
- Cortar amostras 5 milímetros X 5mm do tapete andaime.
- Prepare-se para crosslinking, colocando cada um andaime em uma folha de lâmina de vidro coberta, colocando a fotomáscara diretamente no cadafalso, cobrindo com uma lâmina de vidro limpa e clipping ambas as extremidades com grampos da pasta. Nota: quatro amostras pode ser feito de uma só vez, e uma transparência sem um padrão pode ser usado para crosslinking se um padrão não é desejada.
- Purge andaime montado em uma câmara de nitrogênio. É importante manter a construir livre de oxigênio, que pode inibir a reticulação.
- Configuração local andaime na câmara de nitrogênio em ~ 10 mW / cm 2 luz de 365 nm com um adaptador de colimação por 5 minutos. Ver esquema na Figura 2.
- Retire cada scaffold e coloque em um prato de 12 poços.
- Adicionar 2 mL de água deionizada em cada poço, a placa de parafilme para evitar a evaporação da água e coloque a 37 ° C por 24 horas. Troque a água três vezes.
- Visualize formação de poros em microscópio de luz (ver exemplo na Figura 2). Os andaimes estão agora prontos para uso.
Nota: Photocrosslinking não é necessário para muitos tipos de polímeros, no entanto photopatterning só pode ser usado com polímeros fotorreativas.
C. Dupla Polymer Electrospinning com Fluorescente Visualization Fiber
- Prepare uma solução 5% em peso de PEO (200 kDa) em etanol 90%. Mexa a 700 rpm a 50 ° C por pelo menos 2 horas antes da eletrofiação.
- Transferir a solução PEO a uma seringa e adicionar DAPI para uma concentração final de 10 concentração mg / mL na solução eletrofiação. Enrole a seringa na folha de alumínio para proteger da luz.
- Prepare a mesma solução descrita na etapa A2, com exceção também adicionar methacryloxyethyl thiocarbamoyl rodamina B (MeRho, 683,24 g / mol) para uma concentração final de 25 mM na solução eletrofiação. Enrole a seringa na folha de alumínio para proteger da luz.
- Com cuidado, use fita adesiva para garantir lamínulas de vidro methacrylated (ver Khademhosseini et al.) Para a superfície do mandril. Nota: as fibras ficarão amarrados em lamínulas de vidro methacrylated.
- Conecte uma extremidade de um pedaço 5 mm de comprimento de tubo de silicone com anexos luer lock para uma das seringas e anexar a outra extremidade a uma agulha. Inserir a seringa na bomba de seringa e colocar a agulha através do orifício na fazendeiro. Repita com a outra seringa e fazendeiro no lado oposto do mandril. Os lavradores traduzir o llength do mandril e são usados para garantir uma distribuição igual dos dois polímeros no andaime resultante. Ver esquema na Figura 3.
- Ajustar os parâmetros descritos na secção A forma adequada de acordo com a Tabela 1. Garantir que as pontas de agulha são centradas no mandril.
Tabela 1. Dupla Polymer Parâmetros ElectrospinningSeringa Fazendeiro a ponta da agulha (cm) Dica agulha para Mandril (cm) Vazão (mL / hr) Tensão aplicada (kV) MEHA 6 15 1,2 22 PEO 6 10 1,2 15 - Depois que tudo estiver alinhado corretamente, desligue as luzes e ligar o mandril e as bombas de seringa. Remova o papel alumínio do seringas. Quando o fluido é visível nas pontas de ambas as agulhas, simultaneamente ligar as fontes de alimentação e conecte os fazendeiros.
- Quando a coleta for concluída, desligue a fontes de alimentação e desconecte o mandril e lavradores. Remova cuidadosamente as lamelas e fita usando uma lâmina de barbear.
- Visualize as fibras utilizando um microscópio de fluorescência equipado com filtros para rodamina e DAPI. Veja o exemplo na Figura 3. Nota: fibras fluorescentes são mais claros para ver quando electrospun por curtos períodos de tempo (<3 minutos), no entanto, este processo pode ser prorrogado por uma quantidade ilimitada de tempo para criar construções mais espesso, especialmente sem o uso do lamínulas de vidro .
Células Seeding D. em Andaimes
- Coloque cada lamela com electrospun polímero anexado em um indivíduo bem de uma placa de tamanho adequado também. Nota: interações celulares com as fibras são facilmente visíveis por eletrofiação em lamínulas de vidro methacrylated. Além disso, MeRho pode ser novamente utilizado para a visualização de fibra.
- Incubar os andaimes em PBS durante a noite para garantir a remoção completa do solvente e qualquer lixiviável possíveis subprodutos.
- Remover o PBS dos poços.
- Para esterilizar os andaimes, colocá-los sob uma lâmpada germicida de uma capela de fluxo laminar por 30 minutos. Se um andaime completo está sendo semeada, flip do andaime e coloque sob uma lâmpada germicida por mais 30 minutos.
- Realizar cultura de células padrão e preparar uma suspensão de células concentradas na densidade de célula desejada (por exemplo, 6.000 células cm -2). Por exemplo, usar um 100 mL de suspensão celular por um 22 mm X 22 mm lamela. Lugar na incubadora por 1 hora.
- Adicionar a quantidade adequada de meios de cultura de células em cada poço. Coloque o andaimes de volta para a incubadora.
- Mancha as células usando um kit comercialmente disponível Live / Dead. Nota: outros tipos de coloração de células, tais como DAPI (núcleos celulares) e phalloidin fluorescente etiquetado (fibras de actina estresse) pode ser aplicado para visualizar as células.
- Visualize as células e fibras usando um microscópio de fluorescência equipado com filtros para TRITC e FITC. Veja o exemplo na Figura 4.
Resultados representativos:
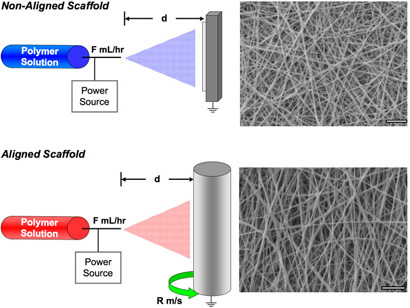
Figura 1. Esquemático ilustrando a configuração do dispositivo para não-alinhados formação andaime (superior) e formação alinhada andaime (parte inferior). Exemplo, imagens de microscopia eletrônica de varredura de cada tipo de andaime são mostrados. Barra de escala = 5m. Por favor, clique aqui para ver uma versão ampliada da figura 1.
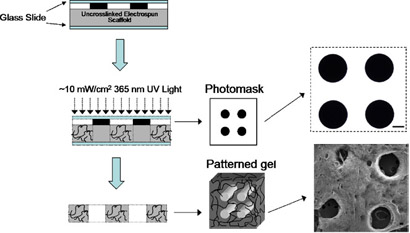
Figura 2. Esquemática do método de padronização. Padrões são formadas pela colocação de um fotomáscara entre a fonte de luz e andaimes durante photocrosslinking e depois lavar polímero não reagiu. Fotomáscara e SEM imagem de andaimes após a formação dos poros e liofilização. Barra de escala = 100 mm. Por favor, clique aqui para ver uma versão ampliada da figura 2.

Figura 3 Esquema da configuração electrospinning multi-polímero e parâmetros de processamento necessários, bem como uma imagem representativa fluorescentes de uma mistura de duas populações de fibra (exemplo: vermelho e azul MEHA PEO). Qual foram simultaneamente electrospun para formar um andaime multi-polímero . Barra de escala = 100 mm. Por favor, clique aqui para ver um maior version da figura 3.
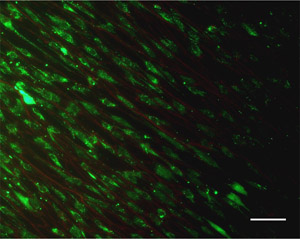
Figura 4. Um exemplo de imagem coloração Live / Dead of células-tronco mesenquimais e suas interações com as fibras electrospun. Barra de escala = 100 mm. Por favor, clique aqui para ver uma versão ampliada da figura 4.
Discussão
Eletrofiação foi usado para preparar andaimes fibroso a partir de polímeros. Photocrosslinkable andaimes à base de ácido hialurônico foram usadas como um exemplo ilustrativo, onde a exposição à luz é necessário para a reticulação. Com o uso de macromers reativa, como MEHA, canais que já demonstrou melhor distribuição celular foram incorporados ao andaimes com o uso de uma máscara durante photocrosslinking andaimes para formar macro e micro-porosa. Além disso, dois polímeros distintos foram simultaneam...
Agradecimentos
Este trabalho foi financiado por um americano Fellowship Heart Association Predoctoral para JLI e National Institutes of Heath conceder R01AR056624.
Materiais
| Name | Company | Catalog Number | Comments | |
| DAPI | Reagent | Invitrogen | D1306 | |
| I2959 | Reagent | Ciba Specialty Chemicals | ||
| PEO 200 kDa | Polysciences, Inc. | 17503 | ||
| PEO 900 kDa | Reagent | Sigma-Aldrich | 189456 | |
| Methacryloxethyl thiocarbamoyl rhodamine B | Reagent | Polysciences, Inc. | 23591-100 | Prepare stock solution in DMSO |
| Live/Dead Stain Kit | Reagent | Invitrogen | L3224 | Contains Calcein (stains live cells green) and ethidium homodime (stains red dead cells) |
| Syringe Pump | Equipment | KD Scientific | KDS100 | Two are needed for dual polymer spinning |
| Power Source | Equipment | Gamma High Voltage | ES30P-5W | Two are needed for dual polymer spinning |
| Motor | Equipment | Triem Electric Motors, Inc | 0132022-15 | Must attach to a custom built mandrel |
| Tachometer | Equipment | Network Tool Warehouse | ESI-330 | Use to monitor mandrel speed |
| Omnicure UV Spot Cure System with collimating adapter | Equipment | EXFO | S1000 | |
| Silicone Tubing | Equipment | McMaster-Carr | 51135K151 | |
| Luer Lock Female Adapter | Equipment | McMaster-Carr | 51525K293 | |
| Luer Lock Male Adapter | Equipment | McMaster-Carr | 51525K143 | |
| Needles | Equipment | Fisher Scientific | 14-825-16H | |
| Coverslips | Equipment | Corning | 2875-22 |
Referências
- Burdick, J. A., Chung, C., Jia, X., Randolf, M. A., Langer, R. Controlled degradation and mechanical behavior of photopolymerized hyaluronic acid networks. Biomacromolecules. 6, 386-391 (2005).
- Baker, B. M., Gee, A. O., Metter, R. B., Nathan, A. S., Marklein, R. A., Burdick, J. A., Mauck, L. R. The potential to improve cell infiltration in composite fiber-aligned electrospun scaffolds by the selective removal of sacrificial fibers. Biomaterials. 29, 2348-2358 (2008).
- Ifkovits, J. L., Burdick, J. A. Review: Photopolymerizable and degradable biomaterials for tissue engineering applications. Tissue Engineering. 13, 2369-2385 (2007).
- Khademhosseini, A., Eng, G., Yeh, J., Fukuda, J., Blumling, J., Langer, R., Burdick, J. A. Micromolding of photocrosslinkable hyaluronic acid for cell encapsulation and entrapment. J. Biomed Mater Res A. 79A, 522-532 (2006).
- Mauck, R. L., Baker, B. M., Nerurkar, N. L., Burdick, J. A., Li, W. J., Tuan, R. S., Elliott, D. M., M, D. Engineering on the Straight and Narrow: The Mechanics of Nanofibrous Assemblies for Fiber-Reinforced Tissue Regeneration. Tissue Engineering B. 15, 171-193 (2009).
- Sill, T. J., Von Recum, H. a. v. o. n. Electrospinning: applications in drug delivery and tissue engineering. Biomaterials. 29, 1989-2006 (2008).
- Sundararaghavan, H. G., Metter, R. B., Burdick, J. A. Electrospun fibrous scaffolds with multi-scale and photopatterned porosity. , (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados