É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Biologicamente fabricação de materiais derivados injetável para Engenharia de Tecidos do Miocárdio
Neste Artigo
Resumo
Métodos para a preparação de um gel matriz injetável a partir de tecido decelularizado e injetá-lo em rato miocárdio In vivo São descritos.
Resumo
Este protocolo fornece métodos para a preparação de um gel injetável matriz extracelular (ECM) para aplicações de engenharia de tecidos do miocárdio. Resumidamente, o tecido é decelularizado liofilizada, moída, enzimaticamente digerido, e então levadas ao pH fisiológico. A liofilização remove todo o conteúdo de água do tecido, resultando em ECM seco que podem ser moídos em um pó fino com um pequeno moinho. Depois da moagem, o pó ECM é digerida com pepsina para formar uma matriz de injetáveis. Após o ajuste para pH 7,4, o material da matriz líquido pode ser injetado no miocárdio. Resultados de ensaios de caracterização prévios mostraram que os géis matriz produzida a partir de decelularizado pericárdio e miocárdio conservar os componentes ECM nativa, incluindo diversas proteínas, peptídeos e glicosaminoglicanos. Dada a utilização deste material para engenharia de tecidos, na caracterização vivo é especialmente útil, aqui, um método para a realização de uma injeção intramural para o ventrículo esquerdo (VE) da parede livre é apresentado como um meio de analisar a resposta do hospedeiro ao gel matriz em um modelo animal de pequeno porte. Acesso à cavidade torácica é adquirida através do diafragma ea injeção é feita um pouco acima do ápice na parede livre do VE. O andaime biologicamente derivada pode ser visualizado por biotina rotulagem antes da injeção e, em seguida, coloração secções de tecido com um rabanete de cavalo conjugado com peroxidase neutravidin e visualização através de coloração diaminobenzidina (DAB). Análise da região de injeção também pode ser feito com coloração histológica e imuno-histoquímico. Desta forma, o gel previamente examinadas matriz de pericárdio e miocárdio foram mostrados a forma fibrosa, redes porosas e promover a formação de vasos na região da injeção.
Protocolo
1. Pré-processamento de preparação dos tecidos
- Antes de utilizar este protocolo, é preciso ter já decelularizado o tecido de escolha. Para este exemplo, suína fresca e as amostras de pericárdio humanos são decelularizado usando lavagens hipotônica e hipertônica em água deionizada (DI) e dodecil sulfato de sódio (SDS).
- Especificamente, primeiro lave o pericárdio suíno em água DI por 30 minutos, em seguida, agitar continuamente em SDS 1% em tampão fosfato salino (PBS) por 24 horas, seguido de água a 5 horas DI enxaguar. Para pericárdio humano, primeiro lave em água DI por 30 minutos, em seguida, agitar continuamente em SDS 1% em PBS durante 60-65 horas, seguido de uma noite DI enxaguar. Remova todas as amostras de sua solução final e enxaguar novamente sob execução DI água 1.
- Para verificar decelularização, remover um pequeno pedaço fresco, congelá-lo em outubro médio de congelamento, e demorar 10 secções de tecido mM cada 100 mm em toda a amostra para exame através de análise histológica, conforme relatado anteriormente 34-36.
- Use hematoxilina e eosina (H & E) as manchas de examinar o tecido para a ausência de núcleos. Pode-se também usar um Hoescht fluorescentes 33342 mancha (1,0 mcg / mL) para DNA para verificar a H & resultados E; brevemente, corrigir as seções, hidratar e enxaguar em água, mancha por 10 minutos e depois enxágüe bem e armazenar no escuro. Alternativamente, pode-se usar um kit como o sangue Dneasy Qiagen e kit de tecidos, que é projetado para quantificar o conteúdo de DNA total de uma amostra.
2. Preparação de ECM injetável
- Liofilização
- Após preparação adequada, congelar as amostras decelularizado com nitrogênio líquido ou por meio do armazenamento a -80 ° C. Lyophilize as amostras até que esteja completamente seco. Dependendo do seu sistema e do conteúdo de água das suas amostras, isso pode demorar de 12 a 72 horas.
- Moagem
- Uma vez completamente seca, um moinho Wiley Mini é usado para moer o ECM seco em um pó fino. Escolha o tamanho da peneira adequada para seus propósitos, aqui, a malha calibre 40 é usado. Uma vez que a maioria da amostra veio através do filtro, remova a jarra de coleta com o pó ECM moído. Se houver apenas uma pequena amostra, o resto da amostra pode ser extraído da fábrica em uma variedade de maneiras, aqui, um Q-ponta é usada para remover a ECM preso atrás das lâminas estacionárias do moinho.
- Certifique-se sempre que a usina está limpo e livre de detritos. Também é importante certificar-se que tanto a usina e sua amostra são totalmente seca; toda a umidade fará com que o ECM para agregar e se aglutinarem, evitando moagem de sucesso. A ECM pode pegar a umidade do ar e assim deve ir diretamente do liofilizador à fábrica.
- Digestão
- Para formar a ECM injetável, o pó é digerido pepsina. O seguinte protocolo foi modificado a partir Freyetes, et al. (2).
- É importante manter como um produto estéril possível, já que serão injetados in vivo e contaminação podem causar complicações. Assim, use frascos estéreis e pesar colheres e filtrar todas as soluções antes de usar. Um passo após moagem e liofilização, antes da digestão também irá ajudar a manter a esterilidade.
- Pesar a quantidade desejada de pó ECM em um frasco de cintilação apropriado. Para volumes totais menores que 1 mL, recomenda-se utilizar um frasco de 2 ml e para volumes maiores, um frasco de 20 mL. Isso garante que há bastante líquido no fundo do frasco para misturar de forma eficaz.
- Pesar a quantidade desejada de pepsina em um frasco de cintilação. Adicionar 0,1 M HCl de modo que a pepsina é a uma concentração de 1 mg / mL. Certifique-se que a pepsina é totalmente dissolvido (sem partículas) antes de usar este pode ser acelerada por vórtex a solução de pepsina.
- Adicione a solução de pepsina / HCl para o frasco de cintilação com o pó ECM para que o MEC está em uma concentração de 10 mg / mL.
- Mexa solução continuamente por 60-65 horas, periodicamente, raspando as laterais do frasco com uma colher ou espátula pesar.
- Ajuste de pH
- Esta etapa é realizada para trazer o material da matriz líquido para pH fisiológico e para inativar a pepsina, mantendo-o de clivagem da ECM mais. Novamente, certifique-se de usar as soluções feitas com água filtrada Millipore.
- 1 M NaOH é adicionado a 1 / 10 do volume original. Teste o pH neste ponto e adicione pequenas quantidades (2-10 L) de NaOH ou HCl tal que o pH desejado (7,4) é atingido. Mantenha o controle de todas as pequenas quantidades adicionadas para a neutralização ou removidas para testes de pH. Uma vez que a solução foi neutralizada, adicione PBS 10x de ser 1 / 10 do volume final (09/01 o volume atual). Determinar a concentração do ECM injetáveis e em seguida, adicione 1x PBS para alcançar desejado co finaisncentration, aqui 6 mg / mL.
- Caracterização da ECM injetável pode ser feito via SDS-PAGE, Ensaio GAG Blyscan colorimétrico, e espectroscopia de massa.
- Neste ponto, o material da matriz pode ser injetado in vivo para formar um andaime para engenharia de tecidos do miocárdio.
- Biotina-Labeling
- A ECM pode ser marcado com biotina antes da injeção para fácil visualização da ECM injetado.
- Prepare uma solução 10mM de Biotina e adicionar à ECM injetável na proporção de 0.3mg/mg. O ECM deve estar na concentração desejada para a injecção. Se injetar em uma concentração de 6 mg / mL, adicionar 40 mL Biotina por 1 mL de ECM. Antes da injecção, mantenha a solução biotina-ECM no gelo por pelo menos 1 hora.
- Todas as etapas de processamento pode ser realizado à temperatura ambiente. Para manter a matriz injetável de gelificação, o passo de ajuste de pH pode ser feito em gelo.
3. Miocárdio Injeções
- Preparação da injecção
- Para as fêmeas (225-250 g) usado aqui, 75 injeções mL de pH 7,4 ECM injetável foram preparadas em 0,1 mL seringas derrubado com 30 agulhas. Se ratos machos (375-400 g) foram utilizados, 90 mL pode ser injetado.
- Todos os materiais cirúrgicos devem ser esterilizados antes da cirurgia, aqui usamos um pacote autoclavado cirúrgica que contém todas as ferramentas necessárias.
- No dia da cirurgia, um Harlan ratos Sprague-Dawley anestesiados com isoflurano é de 5%, intubados, utilizando um otoscópio, e depois mantida em 2,5% de isoflurano durante todo o procedimento.
- Adicionar pomada lágrima artificial para os olhos do animal para se proteger contra o ressecamento e cabelo. Administrar 3 ml de solução de Ringer Lactato para hidratação durante a cirurgia. Isto deve ser feito através de injecção subcutânea na área abdominal inferior.
- Colocar o animal em decúbito dorsal na mesa cirúrgica e suavemente para baixo fita membros. Use tesouras para remover os pêlos no abdômen e cabelos vácuo livre antes da lavagem.
- Fazer uma série de pequenas injeções (aproximadamente 50 mL cada) de lidocaína a 2% ao longo de uma diagonal do processo zyphoid para a parte inferior direita do abdômen. Em seguida, esfregue três vezes com betadine, começando no meio e se movendo para fora. Repita com etanol 70%. Cobrir o animal com uma cortina cirúrgica com uma janela de pré-fabricados circular; segura com pinças, se necessário.
- Usando um bisturi n º 10 faça uma incisão de 3-4 cm a partir do processo xifóide até o lado inferior do lado direito do abdômen. Localize apêndice xifóide e dissecar verticalmente para baixo através do músculo para a direita, tomando cuidado para evitar o grande navio à direita. Depois de ter dissecado através do músculo, use uma tesoura para cortar lateralmente através do músculo, expondo o diafragma. Ter cuidado para evitar o fígado.
- Usando um comprimento de 36 polegadas de sutura 3-0 Vicrile e um par de hemostats, agulha de uma unidade através do processo zyphoid e puxe o fio no meio. Fita adesiva nas extremidades da sutura em conjunto e corrigir isso para um ponto acima e atrás do animal, essencialmente, o levantamento do zyphoid cima e expondo o diafragma. Com outro comprimento de 36 polegadas de sutura 3-0 Vicrile, unidade de uma agulha através do músculo mais próximo ao apêndice xifóide e, novamente, puxe através de e fixar as extremidades para outro ponto à direita da mesa cirúrgica, totalmente expondo a cavidade cirúrgica.
- Neste ponto, você deve ser capaz de ver o coração através do diafragma. Usando um pequeno par de dente micropinças rato, pegue o centro do diafragma, puxe-o para você e fazer uma pequena incisão com uma tesoura sem corte. É extremamente importante o uso de tesoura muito contundente para evitar picar os pulmões. Uma vez que este buraco tenha sido feito, os pulmões será recolhido, permitindo que você faça uma incisão 2-3 cm verticalmente através do diafragma para visualizar o coração.
- Inserir um de 3 polegadas Q tip-à esquerda da cavidade para empurrar os pulmões para fora do caminho. Use uma pinça toalha para proteger a Q-ponta no lugar. Usar outro Q-ponta para mover o pulmão direito para fora do caminho, a fim de localizar o saco pericárdico. Usando um par de micropinças e um par de fórceps grande serrilhada, rasgam o saco pericárdico, expondo o ápice do coração. Se o animal já havia sido submetida a um procedimento de infarto, o pericárdio já estará ausente.
- Agarre o ápice do coração com o micropinças dente de rato e injetar o material da matriz líquido de um terço do caminho para cima a partir do ápice. Inserir a agulha, paralelamente à superfície epicárdica e injetar com a borda chanfrada da agulha para a esquerda. Certifique-se de evitar a grande veia cardíaca. Aguarde alguns segundos antes de remover a agulha. Você deverá ver um branqueamento do tecido no local da injeção.
- Limpar o sangue na cavidade e retire o grampo toalha e Q-ponta que estava segurando o pulmão direito. Use microhemostats curvas eo ratodente micropinças para fechar o diafragma. Faça um nó inicial e, em seguida, use a pinça serrilhada e microhemostats para fechar o diafragma com uma sutura contínua e uma agulha cónica. Antes de fechar totalmente, insira PE160 tubulação de sucção e usar uma seringa de 10 mL para evacuar a cavidade torácica como a sutura é apertada.
- Quando devidamente evacuado e fechado, o diafragma deve ser côncavo. Um diafragma convexa indica que ainda há ar na cavidade.
- Neste ponto, o isoflurano pode ser girado para baixo a 1%.
- Retire ambos os 3-0 suturas Vicrile segurando a cavidade aberta. Use água estéril para hidratar o músculo, enxugando o excesso de distância com um Q-ponta ou gaze estéril. Use um novo comprimento de 3-0 sutura para fechar a camada muscular com sutura intermitente.
- Neste ponto, o isoflurano pode ser desligado.
- Limpe a área com água estéril e grampos usar para fechar a pele. Se grampos vai interferir com o estudo, 5-0 sutura prolina também pode ser usado. Nesse caso, use um reverso corte agulha (RC) para fechar a pele com suturas intermitente. Em ambos os casos, spot cola cirúrgica sobre a incisão fechada.
- Usar um Q-ponta para ungir o local da incisão com uma pomada antibiótica tripla.
- Permitir que o animal se recuperar em oxigênio a 100%.
- Quando os animais começa a respirar em torno do ventilador, remova o tubo da traqueia.
- Uma vez que os animais são esternal, administrar uma injecção subcutânea de 0,05 mg / kg de cloridrato de buprenorfina e devolvê-los à sua gaiola em uma toalha estéril.
- Os animais devem receber pós-operatório de observação e cuidado.
- Nos pontos de tempo de interesse, os animais são sacrificados e os corações removidos para análise. Seções transversais curto eixo são tomadas e podem ser corados com hematoxilina e eosina (H & E) para análise de tecido grosseiro. Em pontos de curto espaço de tempo, a região injetada aparecerá como uma rede, rosa fibroso que se espalhou intersticialmente. Em momentos posteriores, observa-se um afluxo de células e uma degradação da matriz eventual injetado após 2-3 semanas. Se o ECM foi marcado com biotina antes de injetar, pode ser mais diretamente visualizados através da coloração da biotina com a HRP-conjugado estreptavidina. Coloração imuno-histoquímica pode ser usado para identificar células específicas ou estruturas na região da injeção, aqui os slides foram co-marcadas com um isolectin FITC-conjugada que se liga às células endoteliais e verde fluorescente e um anticorpo anti-actina de músculo liso com um secundário Alexafluor anticorpo que relata o SMCs em vermelho.
4. Resultados representante
Caracterização prévia de materiais de matriz preparada desta forma demonstrado a retenção de uma variedade de macromoléculas. Especificamente, as proteínas fibrosas e múltiplas glicoproteínas foram identificados através de espectrometria de massa (Tabela 1). Se os materiais de matriz processados de acordo com este protocolo são encontrados para já não contêm uma matriz complexa de macromoléculas, pode ser que o protocolo decelularização empregada é muito dura. Depois de completamente liofilizado, a seca pericárdico ECM parece muito dura, papel amassado. Outros tipos de tecido vai se assemelham a embalagem amendoins. Se bem moído, a ECM deve cair pela peneira e ser coletadas no frasco na parte inferior. Se houver umidade deixada na amostra, o MEC vai se aglutinarem e ficar preso na câmara de moagem. Após a digestão, a solução de ECM deve ser uma cor leitosa e completamente livre de partículas visíveis. Também será ligeiramente mais viscoso do que o HCl sozinho. Se o MEC não digerir bem, ainda haverá grandes partículas no frasco, alternativamente, a ECM pode falhar para fora da solução. Após ajuste de pH, não há nenhuma mudança visível na solução, ea ECM ainda é um líquido turvo homogênea. Se ele começa a gel, a viscosidade aumenta e vai ser difícil ou impossível extrair o material para uma seringa. Se isso acontecer, execute o passo de ajuste de pH no gelo, com pré-refrigerados soluções. Uma vez que as injeções foram preparadas, mantê-los no gelo até o uso. Se a injecção for bem sucedida, a região em torno da ponta da agulha whitens e um bolo pequeno é visível. Se isso não for observado, a injeção pode ter ido para a câmara, em vez de na parede. Quando o animal até a sutura após a injeção, fechando o cuidado do diafragma é o passo mais importante. Se feito corretamente, o diafragma será apertado contra os pulmões e aparecerá côncavo. Se houver alguma fica ar dentro dos pulmões, o diafragma permanecerá convexo, ou ter uma área onde os balões para fora. Ao examinar a histologia da região de injeção em um ponto de início do tempo (30 minutos a 4 horas após a injecção), deve-se ver uma área, rosa fibroso que é desprovido de células este é o material da matriz remontado pós-injeção (Figura 2) . A rede muitas vezes se espalha intersticialmente e pode estar presente durante todo muitas seções. Um possvel explicação para ver apenas uma área muito pequena da matriz de gel é que uma parte da injeção intramural errou o alvo e foi injetado na câmara de LV ou vazou do local da injeção. Além disso, dependendo do tempo de gelificação, a difusão intersticial pode variar.

Figura 1. Eletroforese em gel de poliacrilamida (PAGE) resultados. (A) padrão de peso molecular. (B) Rat colágeno tipo I de cauda (2,5 mg / mL) em comparação com o ser humano solubilizados (C) e (D) suína pericárdico ECM (7 mg / mL). Observe a presença de colágeno, assim como várias outras proteínas e peptídeos nas amostras da matriz de pericárdio.

Tabela 1. Componentes ECM identificado com espectroscopia de massa.
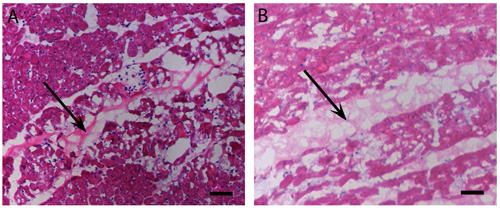
Figura 2 injeções do Miocárdio:. Gelificação em vivo. H & E mancha de humanos (A) e suínos (B) injeções matriz de pericárdio que têm gelled in vivo após 45 minutos. Setas indicam a localização da matriz, manchado leve rosa do que o miocárdio. Barra de escala é 500 mm.
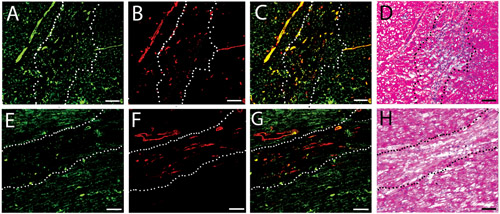
Figura 3. Infiltração de células Vascular. Manchas fluorescentes para os navios no ser humano injetado (AC) e géis suína (DF) matriz em duas semanas. Células endoteliais são marcadas de verde (A, D), enquanto as células do músculo liso são rotulados vermelha (B, E). Imagens fundidas são mostrados em C e F. bar escala é 100 mm. As linhas brancas pontilhadas indicam a área de injeção de matriz, como determinado pelo H & E a análise de uma seção próxima.
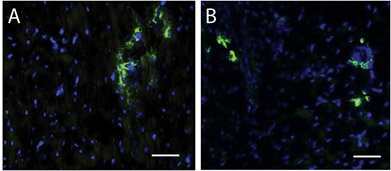
Figura 4. Células-tronco dentro da matriz região da injeção. A Hoescht mancha de núcleos (azul) e c-kit (verde) identifica células-tronco em humanos (A) e suínos (B) as regiões de injeção matriz. Barra de escala é 50 mm.
Discussão
Este método permite a geração de biologicamente derivada, andaimes injetável para a engenharia de tecidos do miocárdio. Embora estes métodos foram desenvolvidos inicialmente para a fabricação e testes in vivo de um gel matriz do miocárdio e apresentou aqui com um gel matriz de pericárdio, este protocolo pode ser adaptado para uso com qualquer tecido, desde que o tecido pode ser adequadamente descelularizados. Decelularização deve ser realizada e verificada antes da utilização destes métodos, como...
Divulgações
Agradecimentos
Esta pesquisa foi financiada em parte pelo Programa Novo Diretor do NIH Innovator Award, que faz parte do Roteiro NIH para Pesquisa Médica, através de concessão de número 1-DP2-OD004309-01. SBS-N. gostaria de agradecer a NSF para uma Bolsa de Investigação Pós-Graduação.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents: | |||
| Pepsin | Sigma-Aldrich | p6887-1G | Lyophilized |
| Biotin | Thermo Fisher Scientific, Inc. | 21217 | |
| Neutravidin-HRP | Thomas Scientific | 21130 | |
| Equipment: | |||
| Wiley Mini Mill | Thomas Scientific | 3383L10 | |
| Labconco Lyophilizer | Labconco Corp. | 7670520 | |
| Surgical supplies: | |||
| Betadine | Purdue Products L.P. | 67618-154-16 | |
| Lactated Ringers Solution | MWI Veterinary Supply | 003966 | |
| KY Jelly | MWI Veterinary Supply | 28658 | |
| Lidocaine, 2% | MWI Veterinary Supply | 17767 | |
| Buprenorphine hydrochloride | Reckitt Benckiser | 12496-0757-1 | |
| Artificial tear ointment | Fisher Scientific | NC9860843 | |
| Triple antibiotic ointment | Fisher Scientific | 19082795 | |
| Isoflurane | MWI Veterinary Supply | 60307-120-25 | |
| Otoscope | MWI Veterinary Supply | 008699 | |
| Stop cock | MWI Veterinary Supply | 006245 | |
| 3-0 Vicrile suture | MWI Veterinary Supply | J327H | |
| 5-0 Proline suture | MWI Veterinary Supply | s-1173 | |
| Reverse cutting (RC) needle | Ethicon Inc. | 8684G | |
| Microhemostats | Fine Science Tools | 13013-14 | |
| Rat tooth microforceps | Fine Science Tools | 11084-07 | |
| No. 10 scalpel | Fine Science Tools | 10110-01 | |
| Blunt scissors | Fine Science Tools | 14108-09 | |
| Sharp, curved scissors | Fine Science Tools | 14085-08 | |
| Large, serrated forceps | Fine Science Tools | 1106-12 | |
| PE160 suction tubing | BD Biosciences | 427430 | |
| Clippers | MWI Veterinary Supply | 21608 | |
| Skin staples/stapler | Ethicon Inc. | PRR35 | |
| General supplies: | |||
| Stir plates | |||
| 0.1 M HCl | |||
| 1 M NaOH | |||
| 10x PBS | |||
| 1x PBS | |||
| 70% Ethanol | |||
| 0.1 mL syringes | |||
| 10 mL syringe | |||
| Q-tips | |||
| Surgical glue | |||
| Surgical drape | |||
| Towel clamps | |||
| Small hand-held vacuum |
Referências
- Seif-Naraghi, S. B., Salvatore, M. A., Magoffin-Schup, P. J., Hu, D. P., Christman, K. L. Design and characterization of an injectable pericardial matrix gel: A potentially autologous scaffold for cardiac tissue engineering. Tissue Engineering. , (2009).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29, 1630-1630 (2008).
- Gilbert, T. W., Sellaro, T. L., Badylak, S. F. Decellularization of tissues and organs. Biomaterials. 27, 3675-3675 (2006).
- Liao, J., Joyce, E. M., Sacks, M. S. Effects of decellularization on the mechanical and structural properties of the porcine aortic valve leaflet. Biomaterials. 29, 1065-1065 (2008).
- Singelyn, J. M., DeQuach, J. A., Seif-Naraghi, S. B., Littlefield, R. B., Schup-Magoffin, P. J., Christman, K. L. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30, 5409-5409 (2009).
- Christman, K. L., Vardanian, A. J., Fang, Q., Sievers, R. E., Fok, H. H., Lee, R. J. Injectable fibrin scaffold improves cell transplant survival, reduces infarct expansion, and induces neovasculature formation in ischemic myocardium. J Am Coll Cardiol. 44, 654-654 (2004).
- Christman, K. L., Fok, H. H., Sievers, R. E., Fang, Q., Lee, R. J. Fibrin glue alone and skeletal myoblasts in a fibrin scaffold preserve cardiac function after myocardial infarction. Tissue Eng. 10, 403-410 (2004).
- Huang, N. F., Sievers, R. E., Park, J. S., Fang, Q., Li, S., Lee, R. J. A rodent model of myocardial infarction for testing the efficacy of cells and polymers for myocardial reconstruction. Nat Protoc. (1), 1596-1609 (2006).
- Ott, H. C., Matthiesen, T. S., Goh, S. K., Black, L. D., Kren, S. M., Netoff, T. I. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nat Med. 14, 213-221 (2008).
- Badylak, S. F. The extracellular matrix as a biologic scaffold material. Biomaterials. 28, 3587-3593 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados