Method Article
In vivo Laser axotomia em C. elegans
Neste Artigo
Resumo
Um protocolo para cortar neurônios C. elegans Com um Micropoint laser pulsado é apresentado. Descrevemos configurar o sistema, imobilizando worms, e cortando os neurônios marcados. As vantagens incluem um sistema de custo relativamente baixo ea possibilidade de romper processos neuronais ou células ablação In vivo.
Resumo
Os neurônios se comunicam com outras células através de axônios e dendritos, extensões de membrana delgada que contêm especializações pré ou pós-sináptica. Se um neurônio é danificado por lesão ou doença, ele pode se regenerar. Fatores de células-intrínsecos e extrínsecos influenciam a capacidade de um neurônio para regenerar e restaurar a função. Recentemente, o nemátodo C. elegans tem emergido como um organismo modelo excelente de identificar genes e vias de sinalização que influenciam a regeneração dos neurônios 1-6. A principal forma de iniciar a regeneração neuronal em C. elegans é mediada por laser de corte, ou axotomia. Durante a axotomia, um processo marcado fluorescente neuronal é cortado usando pulsos de alta energia. Inicialmente, regeneração neuronal em C. elegans foi examinado usando um laser de femtosegundos amplificada 5. No entanto, estudos de regeneração posteriores mostraram que um laser pulsado convencional pode ser usado para cortar com precisão os neurônios in vivo e provocar uma resposta semelhante regenerativa 1,3,7.
Nós apresentamos um protocolo para a realização in vivo de laser em axotomia o worm usando um Micropoint pulsada a laser, um sistema de turnkey que está prontamente disponível e que tem sido amplamente utilizada para a ablação de células-alvo. Descrevemos alinhando a laser, montagem dos vermes, o corte de neurônios específicos, e avaliar a regeneração subseqüente. O sistema fornece a capacidade de cortar um grande número de neurônios em worms múltiplos durante um experimento. Assim, laser axotomia como descrito aqui é um sistema eficiente para iniciar e analisar o processo de regeneração.
Protocolo
1. Montagem do sistema
Os componentes específicos do nosso sistema são descritos abaixo. Quando devidamente instalados, o usuário deve ser capaz de se concentrar no microscópio com uma mão, mover o palco com o outro (seja com o mouse ou o joystick), ativar o laser com o pedal, e tem uma visão clara do on- imagem na tela.
- Micropoint laser montado à porta de epi-fluorescência de um microscópio composto. Nós usamos uma Nikon 80i, mas qualquer escopo de pesquisa grau vertical ou invertida deve funcionar. O sistema irá incluir um Micropoint dichroic personalizado, que deve corresponder ao que os rótulos fluoróforo as células que você deseja cortar. Células marcadas com fluoróforos corte alternativa requer dichroics adicionais. Além disso, um gerador de pulso e pedal vêm com o sistema Micropoint.
- 100x, 1,4 objetivo de petróleo NA para realizar a cirurgia e avaliação de regeneração, além de objetivos adicionais, conforme necessário para colocar a amostra no slide. Usamos um Plano Nikon Apo VC para a cirurgia, e descobrir que um 4x é útil para focar grossa e encontrando a amostra.
- Motorizada palco com joystick. Um palco com uma precisão extremamente elevada e repetibilidade é desnecessária, uma vez que o palco é utilizado para segmentação. Nós usamos um Prior OptiScan II (ver discussão).
- Câmera. A câmera precisa oferecer uma taxa de quadros suficientes para se concentrar e direcionar a neurite rotulados com o objetivo de 100x, enquanto visualiza a imagem no monitor do computador. Nós preferimos atenuando a luz de iluminação durante o processo de axotomia para evitar potenciais efeitos de confusão de foto-branqueamento ou danos (ver 1.7, abaixo). Assim, a câmera precisa ser sensível o suficiente para acomodar este nível de luz reduzida. Nós usamos um Hamamatsu Orca 05G, e descobrir que imagem em 16,3 Hz é suficiente. Câmeras equivalentes poderiam ser substituídos.
- Computador, monitor, software e imagem que podem levar a câmera. Além disso, usamos o software de imagem para manipular o estágio motorizado com um mouse (ver discussão).
- Mesa de ar. Esta exigência pode variar dependendo da localização, mas desde que a cirurgia é realizada com um objetivo 100x, encontramos o isolamento de vibração a ser essencial.
- Fornecimento de iluminação com guia de luz e um mecanismo de disparo para iluminar o fluoróforo. A guia de luz vai anexar ao Micropoint. O mecanismo de obturador é útil para reduzir a intensidade de iluminação, independentemente do laser. Nós usamos uma Lumen Prior 200 ou uma Leica EL6000, e atenuar até 80% de intensidade de luz total para axotomia.
2. Configuração Laser
Um protocolo detalhado para inicialmente harmonizar e concentrar o laser é fornecido com o sistema de laser Micropoint. Nós assumimos que esse processo foi seguido com sucesso na configuração inicial. Isto inclui o alinhamento do laser com a mira na ocular. Aqui nós fornecemos um protocolo para manutenção regular do foco do laser e intensidade.
Como observado no manual Micropoint, o laser pulsado de nitrogênio é capaz de prejudicar gravemente o olho humano. Cuidados devem ser tomados para não olhar diretamente para o feixe de laser. Uma vez instalado, o filtro de barreira deve bloquear a radiação de forma segura através da ocular.
Corte de neurônios em um organismo do tamanho de um grão de areia pode ser um desafio. Como a área de danos causados pelo laser é muito pequena, é essencial saber a localização tridimensional de foco do laser a fim de orientar a amostra com precisão. O foco do laser é encontrado usando a lâmina espelhada. Primeiro, vamos verificar que o local z do foco do laser corresponde ao foco do caminho de imagem. Em seguida, a localização do foco xy danos são marcados com uma mira no software de imagem.
Centrando-se em plano z
- Empurre o filtro de densidade neutra ND16 (Figura 1a). Usamos filtros de densidade neutra no caminho de epi-iluminação para atenuar o laser enquanto se concentra. Até mesmo para melhor focalização, empurre tanto no ND16 e ND4 filtros fluorescentes.
- Definir o laser Micropoint a 1 pulso com o interruptor virou-se para 'Select' (Figura 1b), e depois mover a roda de filtros para o apropriado longa-pass barreira filtro (Figura 1c).
- Coloque o slide espelhado no palco e se concentrar em pinholes dentro dela, com o objetivo 4X usando luz transmitida.
- Adicionar uma gota de óleo de imersão para o slide espelhado e se focar no pinholes com o objetivo 100X. Abrir o obturador da câmera com a alavanca de comutação do caminho óptico (Figura 1d) eo obturador laser (Figura 1e). Se necessário, reduza a intensidade da luz transmitida para que as bordas dos furos são nítidas: isso vai ajudar a focar exatamente.
- Pressione o pedal. Isso deve produzir um pequeno buraco no espelho se o laser é focalizada de forma adequada.
- O foco do microscópio ligeiramente acima do plano da lâmina espelhada e disparar o laser de novo. Isto deve fazer uma ainda menorburaco do que o primeiro tiro, ou não deixam marcas em tudo. Repetir, concentrando-se abaixo da lâmina espelhada.
- Se um buraco não é produzido em 2.5, ou se um buraco maior é produzido quando o foco acima ou abaixo da superfície do espelho, recentrar a laser com o anel de foco na cabeça de ablação. Verifique se o buraco ainda está alinhado com a mira na ocular. Com uso consistente, o foco z-plano raramente precisa de ser ajustada.
Centrando-se no plano xy
- Siga os passos 2.1 a 2.3 acima e pressione o pedal para fazer um pequeno buraco no slide espelho.
- Iniciar 'Live' modo de captura de 'adquirir' Elementos menu. Na "medida" da barra de ferramentas selecione "ROI editor ', em seguida, selecione a ferramenta" cruz dupla "e arraste a mira para alinhá-los com o centro do buraco de novo. Clique em "Salvar ROI" e depois "Sair do editor" e retomar o modo de captura Live.
- Ativar a configuração 'mouse XY "em Elements para manipular o palco com o mouse.
- Puxe o filtro de densidade neutra (s) de volta à posição original (s), definir a pulsos de laser a 10, e remover o slide espelhado.
Ajustar a potência do laser
- A potência do laser deve ser ajustado para a potência mínima necessária para cortar o neurônio de sua escolha. Ajustar a potência movendo a placa atenuador (Figura 1f), enquanto o corte vermes vivos (descritas abaixo). Se a potência do laser é muito alta, ele irá causar danos periférica ou explosão de um buraco no worm. Se a potência do laser é muito baixo, não vai cortar o neurônio. Uma vez que o sistema foi criado, a posição do atenuador raramente precisa ser alterado. Se o laser torna-se fraca, ea placa atenuador precisa ser movido para continuar a corte, que poderia ser um sinal de que o corante na célula tintura precisa ser substituído (ver discussão).
3. Imobilizar os vermes
- Prepare uma solução de 3% agarose fundida em M9 (KH2PO4 22mm, 42mm Na2HPO4, NaCl 85mm, 1mM MgSO4). Dispense 5 mL de agarose fundida em um tubo falcon 15 mL. Preencha outro tubo com água. Colocar os tubos em um elemento de aquecimento modular definido para 55 ° C. Preencha o elemento de aquecimento com água para criar mini-banhos de água para cada tubo. Nota: agarose podem ser preparados em grandes quantidades com antecedência e re-derretido para experimentos subseqüentes.
- Coloque duas camadas de fita de rotulagem em cada uma das duas lâminas e uma lâmina limpa entre os slides. Dispensar uma gota de agarose utilizando uma pipeta lâmpada plástico para o meio da lâmina limpa e coloque outro perpendicular ao primeiro deslize para que o resultado agarose pad é a espessura de dois pedaços de fita adesiva (Figura 2). Remover uma das duas lâminas do bloco após 30 segundos. Lavar e guardar a pipeta no tubo falcon cheio de água para uso com slides subseqüentes.
- Lugar, próximos 3-5 mL de 0,10 m ou 0,05 mM esferas de poliestireno no centro da almofada. Adicionar worms 10/05 expressando a proteína fluorescente nos neurônios de interesse. Se os neurônios de interesse são assimetricamente distribuídos no lado direito ou esquerdo do worm, use uma pick platina para virar worms, para que o lado correto é voltada para cima. Worms devem ser colocadas em lâminas dentro de 10 minutos de preparar as pastilhas de agarose.
- Cuidadosamente coloque uma lamínula sobre os vermes. Depois de colocar a lamínula, não movê-lo em relação ao bloco de agarose como isso irá atrapalhar a cutícula e destruir os vermes. Coloque o slide preparado no palco microscópio.
4. Neurônios corte
- Luz direta para as oculares com a alavanca do percurso óptico de comutação. Focus on the worm para ser cortado com o objetivo de 4X, coloque uma gota de óleo sobre a lamínula, e mudar para o objetivo 100X. Retornar o caminho óptico para a câmera.
- Use o mouse para mover o neurônio de sua escolha sob o centro da mira. Pressione o pedal para disparar o laser e cortar o processo neuronal. Se necessário, dois conjuntos de impulsos pode ser usada para cortar o neurônio. Em primeiro lugar, é útil para monitorar precisamente o que os neurônios foram cortados em vermes individuais, a fim de avaliar a regeneração subseqüente. Quando realizada corretamente, laser axotomia produz uma pequena pausa no neurônio sem causar danos significativos ao tecido circunvizinho da pele ou outros neurônios (ver Figura 3). Em certos casos, uma pequena cicatriz pode formar em torno do local da lesão.
- Recuperação de vermes, removendo a lamínula em um movimento direto para cima, tomando cuidado para que os vermes continuam no bloco de agarose. Não faça deslizar a lamela off. Em seguida, corte a almofada em torno do worms com agulha nariz forceps e coloque na seção de agarose em um recém-placa NGM semeado contendo OP50 8. Lugar de 10 L de estéril M9 no teclado para libertar os worms de e remover os grânulos agarose.
5. Neurônios pontuação para a regeneração
- Prepare pad agarose, conforme descrito no passo 2.2.
- Worms lugar em 05/03 emu; L de esferas de poliestireno. Cobrir com uma lamela. Slides pode ser preparado em seqüência, ou, alternativamente, todos os vermes podem ser preparadas com antecedência e os slides mantidos em 10 pratos centímetros cultura, cada uma contendo uma Kimwipe úmido para manter a umidade do agarose.
- Use o objetivo 100X para visualizar os neurônios cortada. Em muitos neurônios, um toco neuronal distal ao local do corte permanecem. Usamos a presença deste remanescente como uma indicação de que o neurônio era realmente cortada (Figura 4). A presença deste coto torna possível distinguir um neurônio que foi cortado e regenerado de uma que não foi cortado. Nota: ambos os cotos distal e proximal inicialmente retrair após ser cortado.
- Avaliar a regeneração. Uma variedade de parâmetros podem ser determinados. Um ensaio simples é se o neurônio feridos formou um cone de crescimento (Figura 4a) e regenerado, ou não (Figura 4b). Alternativamente, o comprimento neurite pode ser rastreada e comparados.
6. Resultados representativos
Como exemplo, descrevemos a caracterização de regeneração do ácido γ-aminobutírico (GABA) neurônios motores. Esses neurônios, que residem no cordão nervoso ventral e estender os processos circunferencialmente ao cordão nervoso dorsal, são essenciais para a locomoção adequada 9. Neurônios GABA pode ser visualizado por expressar um fluoróforo geneticamente codificado, como a proteína verde fluorescente (GFP), sob o controle do -47 -25 unc unc ou promotores (cepas EG1285 e CZ1200, respectivamente, disponíveis a partir do C. elegans Centro de Genética ).
L4 montagem do palco worms como descrito, flip os vermes para os neurônios GABA em seus lados direito são voltadas para cima, e coloque a lamínula. Corte 03/01 das comissuras posterior em cada minhoca no meio do caminho, entre as cordas dorsal e ventral. Evitar o corte comissuras que cruzam ou fasciculadas com comissuras outros, como estes são difíceis de marcar mais tarde. Recuperar worms como descrito.
18 a 24 horas após uma axotomia bem sucedida, os vermes terá recuperado de uma cirurgia e exibem locomotora normal e egg-laying comportamentos. Descartar vermes que estão mortos ou doentes. Remontar o restante como descrito, e avaliar a regeneração. Nós geralmente visam avaliar pelo menos 30 neurônios corte por condição experimental. Em oxIs12 animais, normalmente 60-70% dos neurônios GABA cortada L4 terá iniciado uma estrutura de cone de crescimento, evidenciado por uma ampliação da membrana na ponta ea extensão de ramos diversos neurite, e migraram a partir do site de corte (Figura 4a). Em muitos casos, os cones de crescimento terão migrado para se reconectar com o cordão nervoso dorsal, uma comissura adjacentes neuronal, ou o coto distal. Os restantes 30% dos neurônios terá quer iniciado há crescimento, formando um coto proximal ao local da axotomia, ou terá prorrogado uma única filopodia pequena (Figura 4b).

Figura 1. O UV pulsada a laser do sistema axotomia. Componentes específicos são: (a) filtros ND (b) pulso seletor (c) da alavanca roda de filtros (d) caminho óptico de comutação alavanca (e) do obturador laser e (f) placa atenuador.
Figura 2. Preparação de um bloco de agarose. Para preparar uma almofada de agarose a espessura desejada, duas camadas de fita (verde) são colocados em duas lâminas. Um slide é colocado entre os dois primeiros, e uma gota de agarose é então adicionado ao slide limpo. Finalmente, um quarto slide é colocado perpendicularmente aos primeiros três, resultando em um bloco que é a espessura de dois pedaços de fita adesiva.
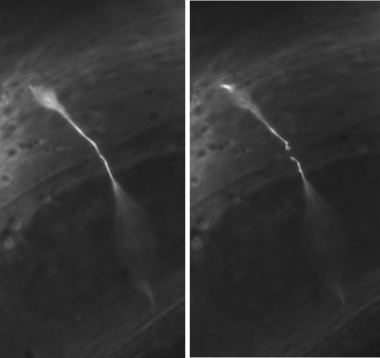
Figura 3. Representante GABA axotomies neurônio. Em um experimento típico, comissuras GABA neurônio são cortados ao meio da face lateral do worm. A comissura cortada é mostrado imediatamente antes (painel esquerdo) e depois (painel direito) axotomia. Todas as imagens foram tiradas com uma objectiva de petróleo 100X.
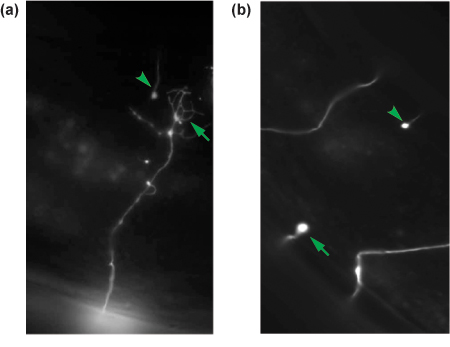
Figura 4. Resultados representativos de axotomies GABA neurônio. 24 horas pós-axotomia axônios cortados são marcados para regeneração. Um axônio em regeneração com um cone de crescimento (seta) é mostrado em (a), enquanto um não-regeneração do axônio é visto como um coto proximal (seta) em (b). O coto distal de cada axônio corte é mostrado em cada painel (seta) e é uma indicação de que o axônio tem sido cortada.
Discussão
Uma variedade de sistemas laser têm sido usados para cortar neurites em C. elegans, e vários estudos têm examinado o seu desempenho em detalhe 3,7,10,11. O laser Micropoint utilizada em nosso protocolo é um sistema de turnkey que é fácil de configurar e manter, e está disponível a um custo baixo para os pesquisadores compararam a um sistema de laser Ti-Safira. Comparado a um sistema Ti-Safira, no entanto, o laser Micropoint é esperado para causar danos a uma área maior, que pode ser desvantajoso para algumas aplicações. Se um sistema Ti-Safira é desejado, um protocolo excelente na construção de um sistema deste tipo está disponível 12.
O protocolo atual pode ser realizada em uma variedade de neurônios em C. elegans, no entanto, notamos que as diferenças na capacidade regenerativa entre tipos distintos de neurônios são esperados 13. Além disso, diferentes origens transgênicos podem afetar o sucesso regenerativo. Embora a percentagem de regeneração de neurônios GABA é bastante consistente entre diferentes linhagens transgênicas marcador, temos notado um aumento global leve em regeneração em juIs76 14 vs 15 oxIs12 worms. Diferenças entre os marcadores dos neurônios toque também foram descritos 2.
Nós preferimos a imobilizar o worms com microesferas, em vez de anestésicos como as contas resultam em mais rápido e mais consistente imobilização 16. Este também é vantajosa, somos capazes de observar a regeneração livre de quaisquer possíveis efeitos de confusão devido à anestesia 17. Um método anestésico sem alternativa para a imobilização é o uso de dispositivos microfluídicos. O uso de microfluídica para axotomia tem sido amplamente descrito 17-22.
Nós achamos que com o uso consistente, as funções de laser melhor quando a cumarina 440 na célula corante é alterada uma vez por semana seguindo o procedimento descrito no manual Micropoint. Se necessário, o controle deslizante de atenuação pode ser usado para aumentar a potência, mas isso pode ser uma indicação de tinta velha ou desalinhamento laser. Além disso, a célula de corante tem uma vida útil limitada e, eventualmente, precisam ser reconstruídos ou substituídos (Ver Troubleshooting).
Pode ser difícil de manobrar a neurite alvo sob a mira que marcam o foco do laser, principalmente se o animal não é completamente paralisado. Nós achamos que uma etapa manual não é ideal para este fim, embora seja certamente útil. Um palco joystick controlado motorizada é mais precisa, e nós achamos que usar o software que suporta a imagem arrastando com o mouse para mover o palco motorizado é o melhor. Elementos Nikon oferece esse recurso e é descrito neste protocolo, mas o pacote micromanager livre, assim como outros software de imagem, pode ter uma funcionalidade semelhante. Uma forma diferente de segmentação fina é para mover o foco do laser, em vez do animal. Um galvanômetro mecanismo de direção do feixe está disponível como um add-on para o laser Micropoint, se esta abordagem é preferido.
Além de sua aplicação ao estudo da regeneração neuronal, o laser pode ser utilizado para ablação outros tipos de células, tais como pele, músculo, ou células especializadas, ou interromper sinapses neuronais específicos 23-27. Além disso, as vias que regulam a degeneração de neurônios que acompanha a lesão ou doença poderia ser investigado com este sistema. Como tal, o uso de lasers pulsados continuará a lançar luz sobre ambos os fatores genéticos e as mudanças de células biológicas que facilitam a regeneração neuronal e outros processos relevantes.
Solução de problemas:
Aqui descritos são alguns problemas comuns e suas soluções associadas.
- O laser não é cortar corretamente. Isto é provável porque nem a laser está fora de foco (ver secção 2), ou a tinta corante na célula precisa ser substituído (ver Micropoint manual). Alternativamente, a célula de corante podem precisar ser substituídos ou reconstruídos.
- Os vermes estão se movendo em agarose pad. Este é geralmente um sinal de que o bloco de agarose é muito úmido. Nós achamos que as almofadas devem ser deixados por aproximadamente 30 segundos antes de worms são colocados sobre eles para contornar este problema. Você também pode tentar usar o menor tamanho (0,05 mm) microesferas.
- A recuperação de vermes é difícil e ineficiente. Isso pode ser causado pela remoção lamela incorreto ou por um bloco de agarose seca. Se o bloco é muito seco, você pode perceber que os axônios desenvolver uma aparência frisada. Em alguns casos, isso acontece porque os vermes não foram colocados no bloco logo depois que ele foi feito. Alternativamente, um estoque antigo de solução de agarose podem ter uma concentração superior a 3% após o derretimento repetido.
Divulgações
Agradecimentos
Trabalho no laboratório é financiado pelo Hammarlund: NIH concede NS066082 R01-01 e T32GM007223, a Fundação Beckman, eo Ellison Medical Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | Comentários |
|---|---|---|---|
| 0,05 mM esferas de poliestireno | Polysciences, Inc. | 08691 | |
| 0,10 mM esferas de poliestireno | Polysciences, Inc. | 00876 | |
| Agarose GPG / LE | Americana Bioanalytical | 00972 | Ultra pura |
| Falcon 14 ml Tubo de poliestireno de fundo redondo | BD Biosciences | 352057 | 17 x 100 mm estilo, nonpyrogenic |
| Thermo Scientific Plain lâminas de microscópio precleaned | Erie Empresa Scientific | 420-004T | 3 "x 1" x 1 mm |
| Lamínulas | VWR | 48366 205 | 18 mm x 18 mm N º 1 1 / 2 |
| Kimwipes KIMTECH Ciência | Kimberly-Clark | 34155 | |
| BD Falcon 100 x 15mm Estilo Petri Dish | BD Biosciences | 351029 | |
| Fita em branco 3/4W x 500L | TimeMed | T-512 | |
| Óleo de imersão | Nikon | Tipo A, nd = 1,515 | |
| EG1285 ou CZ1200 | C. elegans Centro de Genética | http://www.cbs.umn.edu/CGC/strains/ | |
| OptiScan II | ANTES Scientific | ||
| NIS Elements-Ar ou Br | Nikon | ||
| Micropoint Sistema Laser Ablation | Fotônicos Scientific | ||
| Microscópio composto | Nikon | Eclipse 80i | |
| Hamamatsu Camera | Hamamatsu Photonics | Modelo C8484-05G01 | |
| Dell Precision T3400 PC com Intel Core 2 Duo | Dell | ||
| Windows XP Professional | Microsoft | Versão de 2002, Série Pack 3 | |
| Dupla seca banho Incubadora | Fisher Scientific | Controles analógicos | |
| 4X Plano Fluor objetivo | Nikon | ||
| 100X Plano de Apo objetivo de petróleo VC | Nikon | ||
| Dumont # 5 / 45 forceps | Dumont | 11251-35 | Dicas Dumoxel padrão, também pode usar # 7 |
| Microscópio de dissecação | Nikon | SMZ800 | NI-150 com Iluminador de Alta Intensidade |
Referências
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Ghosh-Roy, A., Wu, Z., Goncharov, A., Jin, Y., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branchi ng. Proceedings of the National Academy of Sciences. 104, 15132-15137 (2007).
- Yan, D., Wu, Z., Chisholm, A. D., Jin, Y. The DLK-1 Kinase Promotes mRNA Stability and Local Translation in C. elegans Synapses and Axon Regeneration. Cell. 138, 1005-1018 (2009).
- Yanik, M. F. Neurosurgery: Functional regeneration after laser axotomy. Nature. 432, 822-822 (2004).
- Gabel, C. V., Antoine, F., Chuang, C., Samuel, A. D. T., Chang, C. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , (1988).
- McLntire, S. L., Jorgensen, E., Kaplan, J., Horvitz, H. R. The GABAergic nervous system of Caenorhabditis elegans. Nature. 364, 337-341 (1993).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in. C. elegans. Optics Express. 15, 8521-8531 (2007).
- Chung, S., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Applied Physics A: Materials Science & Processing. 96, 335-341 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature Protocols. 5, 395-407 (2010).
- Wang, Z., Jin, Y. Genetic dissection of axon regeneration. Current Opinion in Neurobiology. , (2010).
- Huang, X., Cheng, H. -. J., Tessier-Lavigne, M., Jin, Y. MAX-1, a Novel PH/MyTH4/FERM Domain Cytoplasmic Protein Implicated in Netrin-Mediated Axon Repulsion. Neuron. 34, 563-576 (2002).
- McIntire, S. L., Reimer, R. J., Schuske, K., Edwards, R. H., Jorgensen, E. M. Identification and characterization of the vesicular GABA transporter. Nature. 389, 870-876 (1997).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. . Laser microsurgery in C. elegans in Methods in Cell Biology: Caenorhabditis elegans: Modern Biological Analysis of an Organism. , .
- Guo, S. X. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5, 531-533 (2008).
- Zeng, F., Rohde, C. B., Yanik, M. F. Sub-cellular precision on-chip small-animal immobilization, multi-photon imaging and femtosecond-laser manipulation. Lab on a Chip. 8, 653-656 (2008).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F., F, M. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab on a Chip. 7, 1515-1523 (2007).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Current Opinion in Neurobiology. 19, 561-567 (2009).
- Samara, C. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proceedings of the National Academy of Sciences. , (2010).
- Nelson, F. K., Riddle, D. L. Functional study of the Caenorhabditis elegans secretory-excretory system using laser microsurgery. Journal of Experimental Zoology. 231, 45-56 (1984).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental Biology. 78, 577-597 (1980).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Developmental Biology. 87, 286-300 (1981).
- Allen, P. B. Single-synapse ablation and long-term imaging in live C. elegans. Journal of Neuroscience Methods. 173, 20-26 (2008).
- Pujol, N. Distinct Innate Immune Responses to Infection and Wounding in the C. elegans Epidermis. Current biology. CB 18, 481-489 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados