Method Article
In vivo Laser assotomia in C. elegans
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Un protocollo per ridurre i neuroni in C. elegans Con un laser pulsato MicroPoint è presentato. Ci descrivono la configurazione del sistema, immobilizzare worm e recidendo i neuroni etichettati. I vantaggi includono un sistema relativamente a basso costo e la possibilità di tagliare i processi neuronali o cellule ablazione In vivo.
Abstract
I neuroni di comunicare con altre cellule tramite assoni e dendriti, le estensioni della membrana sottile che contengono specializzazioni pre-o post-sinaptica. Se un neurone è danneggiato da lesioni o malattie, può rigenerare. Fattori Cell-intrinseci ed estrinseci influenzare la capacità di un neurone per rigenerare e ripristinare la funzione. Recentemente, il nematode C. elegans è emerso come un organismo modello eccellente per identificare i geni e le vie di segnalazione che influenzano la rigenerazione dei neuroni 1-6. Il modo principale per avviare la rigenerazione neuronale in C. elegans è mediata da taglio laser, o assotomia. Durante assotomia, un processo di fluorescenza marcata neuronale viene reciso con impulsi ad alta energia. Inizialmente, la rigenerazione neuronale in C. elegans è stata esaminata utilizzando un laser a femtosecondi amplificato 5. Tuttavia, gli studi rigenerazione successivi hanno dimostrato che un laser a impulsi convenzionale può essere usato per tagliare con precisione i neuroni in vivo e di suscitare una risposta simile rigenerativa 1,3,7.
Vi presentiamo un protocollo per l'esecuzione in vivo laser in assotomia il worm utilizzando un MicroPoint laser pulsato, un sistema chiavi in mano che è prontamente disponibile e che è stato ampiamente utilizzato per l'ablazione delle cellule bersaglio. Descriviamo allineando il laser, il montaggio del worm, il taglio neuroni specifici, e valutare la rigenerazione successive. Il sistema fornisce la possibilità di tagliare un gran numero di neuroni in più vermi durante un esperimento. Così, laser assotomia come descritto nel presente documento è un sistema efficiente per l'avvio e analisi del processo di rigenerazione.
Protocollo
1. Assemblaggio del sistema
I componenti specifiche del nostro sistema sono riportate qui di seguito. Se correttamente montato, l'utente dovrebbe essere in grado di concentrarsi al microscopio con una mano, spostare il palco con gli altri (sia con il mouse o il joystick), attivare il laser con il pedale, e avere una visione chiara di on- schermo delle immagini.
- MicroPoint laser montato sul epi-fluorescenza porta di un microscopio composto. Usiamo una Nikon 80i, ma ogni ricerca-grade portata in posizione verticale o invertita dovrebbe funzionare. Il sistema MicroPoint includerà un dicroico personalizzato, che dovrebbe corrispondere al fluoroforo che le etichette delle celle che si desidera tagliare. Cellule taglio etichettati con fluorofori alternativa richiede dicroici aggiuntivi. Inoltre, un generatore di impulsi e pedale fornite con il sistema MicroPoint.
- 100x, 1,4 NA obiettivo di petrolio per l'esecuzione di interventi chirurgici e valutare la rigenerazione, oltre a obiettivi supplementari, se necessario per localizzare il campione sul vetrino. Usiamo un piano Nikon Apo VC per la chirurgia, e scoprire che un 4x è utile per la messa a fuoco grossolana e trovare il campione.
- Motorizzato palco con joystick. Un palco con estrema precisione e ripetibilità elevate non è necessaria, dal momento che lo stadio viene utilizzato solo per il targeting. Noi utilizziamo un Priore OptiScan II (vedi la discussione).
- Fotocamera. La fotocamera ha bisogno di fornire un frame rate sufficiente mettere a fuoco il bersaglio e neurite etichettati con l'obiettivo 100x, mentre visualizzando l'immagine sul monitor del computer. Noi preferiamo attenuare la luce dell'illuminazione durante la procedura assotomia per evitare possibili effetti confondenti da fotometabolismo o danni (vedi 1.7, di seguito). Così, la fotocamera ha bisogno di essere abbastanza sensibile per ospitare questo livello ridotto di luce. Usiamo un Hamamatsu Orca 05G, e scoprire che l'imaging a 16,3 Hz è sufficiente. Telecamere equivalente potrebbe essere sostituito.
- Computer, monitor, e software di imaging che può guidare la macchina fotografica. Inoltre, si usa il software di imaging per manipolare la scena motorizzata con il mouse (vedi discussione).
- Air tavolo. Questo requisito può variare a seconda della posizione, ma poiché la chirurgia è eseguita con un obiettivo 100x, troviamo isolamento dalle vibrazioni essenziali.
- Fornitura di luce con guida di luce e il meccanismo di scatto per illuminare il fluoroforo. La guida di luce si collega alla MicroPoint. Il meccanismo dell'otturatore è utile per ridurre l'intensità dell'illuminazione indipendentemente dal laser. Noi utilizziamo un Priore Lumen 200 o una Leica EL6000, e attenuare fino al 80% del totale per l'intensità della luce assotomia.
2. Laser di setup
Un protocollo dettagliato per allineare inizialmente e mettere a fuoco il laser viene fornito con il sistema laser MicroPoint. Non ci assumiamo tale procedura sia stata seguita con successo al momento della configurazione iniziale. Ciò include l'allineamento del laser con il reticolo nell'oculare. Qui forniamo un protocollo per la manutenzione ordinaria di messa a fuoco del laser e l'intensità.
Come notato nel manuale MicroPoint, il laser pulsato di azoto è in grado di danneggiare seriamente l'occhio umano. Si deve prestare attenzione a guardare mai direttamente il raggio laser. Una volta installato, il filtro di sbarramento dovrebbe bloccare la radiazione in modo sicuro attraverso gli oculari.
Taglio neuroni in un organismo delle dimensioni di un granello di sabbia può essere impegnativo. Poiché l'area del danno fatto dal laser è molto piccolo, è essenziale conoscere la posizione tridimensionale di messa a fuoco del laser al fine di indirizzare il proprio campione. La messa a fuoco laser è trovato usando la diapositiva mirroring. In primo luogo, verifichiamo che la posizione z del fuoco del laser corrisponde al centro del percorso di imaging. Quindi, la posizione xy del fuoco danno è contrassegnato con croce nel software di imaging.
Messa a fuoco nel piano z
- Spingere il filtro a densità neutra ND16 (Figura 1a). Noi usiamo i filtri a densità neutra nella epi-illuminazione percorso per attenuare il laser mentre ci si concentra. Per ancora più fini di messa a fuoco, spingere in entrambe le ND16 e ND4 filtri fluorescenti.
- Impostare il laser MicroPoint a 1 impulso con l'interruttore girato a 'Select' (figura 1b), e quindi spostare la ruota portafiltri alla barriera filtro appropriato lungo-pass (Figura 1c).
- Posizionare la diapositiva speculare sul palco e mettere a fuoco fori all'interno di esso con l'obiettivo 4X a luce trasmessa.
- Aggiungere una goccia di olio di immersione alla diapositiva specchio e concentrarsi sui fori con l'obiettivo 100X. Aperto l'otturatore della fotocamera con il percorso ottico di commutazione leva (Figura 1d) e l'otturatore laser (figura 1e). Se necessario, ridurre l'intensità della luce trasmessa modo che i bordi dei fori per perno sono nitidi: questo sarà di aiuto nella messa a fuoco esattamente.
- Premere il pedale. Questo dovrebbe produrre un piccolo foro nello specchio se il laser è focalizzato in modo corretto.
- Messa a fuoco il microscopio leggermente sopra il piano della diapositiva specchio e sparare con il laser di nuovo. Questo dovrebbe fare un ancora più piccolobuco che il primo colpo, o non lasciano segno. Ripetere concentrandosi sotto la diapositiva mirroring.
- Se il buco non è prodotto in 2,5, o se un buco più grande è prodotto quando concentrando sopra o sotto la superficie dello specchio, rimettere a fuoco il laser con l'anello di messa a fuoco sulla testa ablazione. Verificare che il buco è ancora correttamente allineato con il reticolo nell'oculare. Con l'uso costante, il piano z necessario concentrarsi raramente da regolare.
Messa a fuoco nel piano xy
- Seguire i passaggi da 2.1 a 2.3 e premere il pedale per fare un piccolo foro nella diapositiva specchio.
- Iniziato 'Live' modalità di cattura dal menu 'acquisire' Elementi. Nella barra degli strumenti 'misura' selezionare 'ROI editore', quindi selezionare lo strumento 'doppia croce' e trascinare il mirino per allinearle con il centro del foro nuova. Fare clic su 'Salva ROI' e poi 'Exit Editor' e riprendere la modalità Live cattura.
- Attivare il 'mouse XY' impostazione in Elementi di manipolare il palco con il mouse.
- Tirare il filtro a densità neutra (s) nella posizione originale (s), impostare gli impulsi laser a 10, e rimuovere il vetrino mirroring.
Regolazione della potenza del laser
- La potenza del laser deve essere aggiustato per la potenza minima necessaria per tagliare il neurone di vostra scelta. Regolare la potenza spostando il piatto attenuatore (Figura 1f) mentre il taglio vermi che vivono (descritta sotto). Se la potenza del laser è troppo alta, può causare danni periferici o blastica un buco nel verme. Se la potenza del laser è troppo bassa, non rompere il neurone. Una volta che il sistema è stato istituito, la posizione attenuatore raramente necessita di essere cambiato. Se il laser diventa debole, e il piatto attenuatore deve essere spostato di continuare a tagliare, potrebbe essere un segno che il colorante nella cellula colorante deve essere sostituita (vedi discussione).
3. Immobilizzare i vermi
- Preparare una soluzione del 3% agarosio fuso in M9 (KH2PO4 22mm, Na2HPO4 42mm, 85mm NaCl, 1 mM MgSO4). Dispensare 5 ml di agarosio fuso in un tubo da 15 ml falco. Riempire un altro tubo con l'acqua. Tubi posto in un elemento modulare di riscaldamento impostato a 55 ° C. Riempire la resistenza con l'acqua per creare bagni di acqua mini per ogni tubo. Nota: agarosio può essere preparato in grandi quantità in anticipo e rifuso per esperimenti successivi.
- Inserire due strati di nastro etichetta su ciascuna delle due diapositive e un vetrino pulito tra queste diapositive. Dispensare una goccia di agarosio utilizzando una pipetta di plastica lampadina al centro del vetrino pulito e un altro luogo perpendicular scivolare al primo in modo che le agarosio pad è lo spessore di due pezzi di nastro (Figura 2). Togliere uno dei due diapositive dal cuscinetto dopo 30 secondi. Sciacquare e memorizzare la pipetta in plastica pieno d'acqua tubo falcon per l'uso con diapositive successive.
- Quindi, posto 3-5 l di 0,10 micron o 0,05 micron perle di polistirene al centro del pad. Aggiungi worm 5-10 esprimono proteine fluorescenti nei neuroni di interesse. Se i neuroni di interesse sono asimmetricamente distribuiti sul lato destro o sinistro del worm, usare un plettro di platino per capovolgere i vermi in modo che il lato corretto è rivolto verso l'alto. Worms devono essere collocati su vetrini entro 10 minuti di preparare il pad agarosio.
- Attentamente luogo uno slittamento copertura sul worm. Dopo aver posizionato la polizza di copertura, non spostarlo rispetto al pad di agarosio come in questo ostacolerà la cuticola e distruggere il worm. Posizionare il vetrino preparato sul palco microscopio.
4. Tagliare i neuroni
- Luce diretta negli oculari con la leva di commutazione ottica percorso. Focus sulla vite senza fine da tagliare con l'obiettivo 4X, una goccia di olio sul vetrino, e passare l'obiettivo 100X. Restituire il percorso ottico alla fotocamera.
- Usa il mouse per spostare il neurone di vostra scelta sotto il centro del mirino. Premere il pedale per il fuoco del laser e tagliare il processo neuronale. Se necessario, due serie di impulsi possono essere usati per tagliare il neurone. In un primo momento, è utile per tenere traccia con precisione quali neuroni sono state tagliate in vermi individuali al fine di valutare la rigenerazione successive. Quando eseguito correttamente, il laser assotomia produce una piccola pausa nel neurone senza causare danni significativi al tessuto cutaneo circostante o altri neuroni (Figura 3). In alcuni casi, una piccola cicatrice può formarsi intorno al luogo della ferita.
- Recuperare i vermi rimuovendo il vetrino in un movimento diretto verso l'alto, facendo attenzione che i vermi rimangono sulla rampa di agarosio. NON scorrere il copri off. Quindi, tagliare il pad in tutto il worm con punta a spillo pinze e posto la sezione di agarosio su un piatto appena seminato NGM contenente OP50 8. Introdurre 10 ml di sterili M9 sul pad per liberare i vermi dalle perline e rimuovere agarosio.
5. Punteggio per la rigenerazione dei neuroni
- Preparare agarosio pad come descritto al punto 2.2.
- Worm posto in 3-5 &mu, L di perle di polistirene. Applicare un vetrino coprioggetti. Le diapositive possono essere preparati in sequenza, o in alternativa tutti i vermi possono essere preparati in anticipo e le diapositive tenuti in piatti di cm 10 la cultura, ciascuno contenente un Kimwipe umido per mantenere umido il agarosio.
- Utilizzare l'obiettivo 100X di visualizzare i neuroni reciso. In molti neuroni, un ceppo neuronale distale al sito di taglio rimarrà. Noi usiamo la presenza di questo residuo come un'indicazione che il neurone era effettivamente rotto (Figura 4). La presenza di questo ceppo permette di distinguere un neurone che è stato tagliato e rigenerato da uno che non è stata tagliata. Nota: entrambi i ceppi distali e prossimali inizialmente ritrattare dopo essere stato tagliato.
- Valutare la rigenerazione. Una varietà di parametri possono essere determinati. Un test semplice è se il neurone infortunato ha formato un cono di crescita (Figura 4a) e rigenerati, o no (Figura 4b). In alternativa, la lunghezza dei neuriti possono essere rintracciati e confrontati.
6. Rappresentante risultati
Come esempio, si descrive la caratterizzazione di rigenerazione del γ-aminobutirrico (GABA) motoneuroni. Questi neuroni, che risiedono nel cordone nervoso ventrale ed estendere i processi la circonferenza del cordone nervoso dorsale, sono essenziali per la locomozione proprio 9. Neuroni GABA può essere visualizzata esprimendo un fluoroforo geneticamente codificato, come la proteina fluorescente verde (GFP), sotto il controllo del -47 unc unc o -25 promotori (ceppi EG1285 e CZ1200, rispettivamente, disponibile presso il C. elegans Centro Genetico ).
Monte L4-stadio worm come descritto, capovolgere i vermi così i neuroni GABA su un fianco destro sono rivolti verso l'alto, e posto il vetrino. Tagliate 1-3 di commessure posteriore in ogni metà strada senza fine, tra le corde dorsale e ventrale. Evitare di tagliare commissure che si incrociano o fasciculate commissure con altri, in quanto questi sono difficili da punteggio più tardi. Recupera worm come descritto.
18 a 24 ore dopo un assotomia successo, i vermi avranno recuperato da un intervento chirurgico ed esporre locomotore normale e la deposizione delle uova comportamenti. Eliminare i vermi che sono morti o malati. Rimontare il resto come descritto, e valutare la rigenerazione. Di solito scopo di valutare almeno 30 neuroni per tagliare condizione sperimentale. In oxIs12 animali, di solito 60-70% dei neuroni GABA mozzata L4 avrà inizio una struttura cono di crescita, evidenziato da un ampliamento della membrana in punta e l'estensione dei neuriti rami diversi, e migrati dal sito di taglio (Figura 4a). In molti casi, i coni di crescita si sono migrati a riconnettersi con il cordone nervoso dorsale, una commessura adiacente neuronale, o il moncone distale. Il restante 30% dei neuroni avranno sia iniziata alcuna crescita, formando un moncone prossimale al sito di assotomia, o che hanno esteso solo piccole filopodia (Fig. 4b).

Figura 1. L'UV laser pulsato sistema assotomia. Componenti specifici sono: (a) I filtri ND (b) impulso selettore (c) la leva ruota portafiltri (d) di cammino ottico di commutazione leva (e) otturatore laser e (f) piatto attenuatore.
Figura 2. Preparazione di un pad agarosio. Per preparare un pad agarosio dello spessore desiderato, due strati di nastro (verde) sono disposti su due colonne. Una diapositiva è posta tra le prime due, e una goccia di agarosio viene quindi aggiunto il vetrino pulito. Infine, una diapositiva quarto è posizionato perpendicolarmente alle prime tre, risultando in un pad che è lo spessore di due pezzi di nastro.
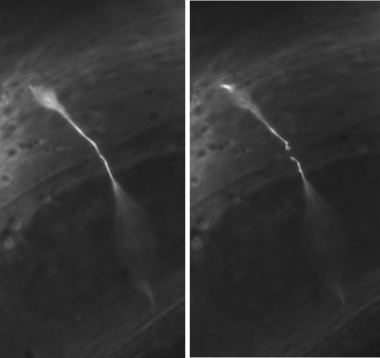
Figura 3. Rappresentante dei neuroni GABA axotomies. In un tipico esperimento, GABA commissure neurone sono tagliato al centro della faccia laterale del worm. Una commessura mozzata è mostrata immediatamente prima (pannello di sinistra) e dopo (pannello di destra) assotomia. Tutte le immagini sono state scattate con un obiettivo 100X olio.
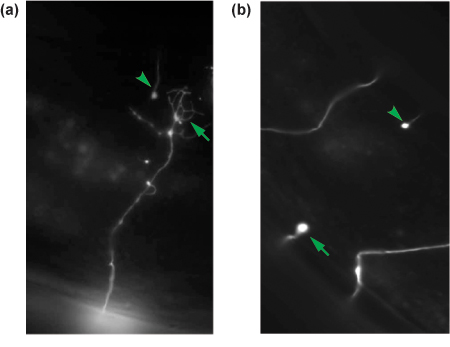
Figura 4. Risultati rappresentativi di GABA axotomies neurone. 24 ore post-assotomia assoni reciso sono segnati per la rigenerazione. Un assone rigenerante con un cono di crescita (freccia) è mostrato in (a), mentre un non-rigenerazione dell'assone è visto come un moncone prossimale (freccia) a (b). Il moncone distale di ciascun assone taglio viene mostrato in ogni pannello (punta di freccia) ed è un'indicazione che l'assone è stata interrotta.
Discussione
Una varietà di sistemi laser sono stati utilizzati per tagliare neuriti in C. elegans, e diversi studi hanno esaminato le loro prestazioni in dettaglio 3,7,10,11. Il laser MicroPoint utilizzati nel nostro protocollo è un sistema chiavi in mano che è facile da installare e mantenere, ed è disponibile a basso costo per i ricercatori rispetto a un Ti-zaffiro sistema laser. Rispetto ad un sistema Ti-zaffiro, comunque, il laser MicroPoint si prevede di causare danni ad un'area più ampia, che può essere svantaggioso per alcune applicazioni. Se un Ti-zaffiro sistema si desidera, un protocollo eccellente sulla costruzione di tale sistema è disponibile 12.
L'attuale protocollo può essere eseguito su una varietà di neuroni in C. elegans, tuttavia, si nota che le differenze di capacità rigenerative tra diversi tipi di neuroni sono attesi 13. Inoltre, diversi background transgenici possono influenzare il successo rigenerativa. Anche se la percentuale di rigenerare i neuroni GABA è abbastanza coerente tra diversi ceppi marcatore transgenici, abbiamo notato un aumento complessivo lieve recupero in juIs76 14 vs 15 oxIs12 vermi. Le differenze tra i marker dei neuroni contatto sono stati anche descritti 2.
Noi preferiamo immobilizzare il worm con microsfere piuttosto che anestetici come le perline risultato più veloce e immobilizzazione più coerente 16. Questo è anche vantaggioso come siamo in grado di osservare la rigenerazione privi di possibili effetti di confusione a causa di anestesia 17. Un'alternativa anestetico senza metodo di immobilizzazione è l'uso di dispositivi microfluidici. L'uso di microfluidica per assotomia è stato ampiamente descritto 17-22.
Troviamo che con l'uso costante, le funzioni laser meglio quando la cumarina 440 nella cella colorante viene cambiata una volta ogni settimana seguendo la procedura descritta nel manuale MicroPoint. Se necessario, il dispositivo di scorrimento attenuazione può essere utilizzato per aumentare la potenza, ma questo può essere un'indicazione di colorante vecchi o disallineamento laser. Inoltre, la cellula colorante ha una durata limitata e alla fine devono essere ricostruiti o sostituiti (Vedere Risoluzione dei problemi).
Può essere difficile da manovrare i neuriti bersaglio sotto il mirino che segnano il fuoco del laser, in particolare se l'animale è completamente paralizzato. Troviamo che una fase manuale non è ottimale per questo scopo, anche se è certamente utilizzabile. Un joystick controllato stadio motorizzato è più precisa, e troviamo che l'uso di software che supporta l'immagine trascinando con il mouse per spostare lo stadio motorizzato è il migliore. Elementi Nikon offre questa caratteristica ed è descritto in questo protocollo, ma il pacchetto Micromanager libero, così come altri software di imaging, può avere funzionalità simili. Un modo diverso di targeting multa è di spostare il fuoco del laser, piuttosto che l'animale. Un fascio-direzione meccanismo galvanometro è disponibile come add-on per il laser MicroPoint, se questo approccio è preferito.
Oltre alla sua applicazione allo studio della rigenerazione neuronale, il laser può essere usata per l'ablazione altri tipi di cellule, come la pelle, muscolo, o di cellule specializzate, o di distruggere specifiche sinapsi neuronali 23-27. Inoltre, i percorsi che regolano la degenerazione dei neuroni che accompagna infortunio o malattia potrebbe essere indagata con questo sistema. Come tale, l'uso di laser pulsati continuerà a far luce su entrambi i fattori genetici ed i cambiamenti delle cellule biologiche che favoriscono la rigenerazione neuronale e altri processi pertinenti.
Risoluzione dei problemi:
Qui descritte sono alcuni problemi comuni e le loro soluzioni associate.
- Il laser non è il taglio in modo corretto. Ciò è probabilmente perché o il laser è fuori fuoco (vedi sezione 2), o il colorante nella cellula colorante deve essere sostituita (vedi MicroPoint manuale). In alternativa, la cellula colorante può essere necessario sostituire o ricostruire.
- I vermi si muovono su agarosio pad. Questo è generalmente un segno che il pad agarosio è troppo umida. Troviamo che pattini devono essere lasciati per circa 30 secondi prima che i vermi sono posti su di loro per aggirare questo problema. Potete anche provare a utilizzare più piccole dimensioni (0,05 micron) microsfere.
- Il recupero di worm è difficile e inefficiente. Ciò può essere causato dalla rimozione coprioggetto non corretto o da un tampone a secco agarosio. Se il pad è troppo secca, si può notare che gli assoni sviluppare un aspetto in rilievo. In alcuni casi, questo avviene perché i vermi non sono stati immessi sul pad abbastanza presto dopo che è stato fatto. In alternativa, un vecchio magazzino della soluzione di agarosio possono presentare una concentrazione superiore al 3% dopo la fusione ripetuti.
Divulgazioni
Riconoscimenti
Lavoro in laboratorio Hammarlund è finanziato da: NS066082 NIH R01-01 e T32GM007223, la Fondazione Beckman, e il Ellison Medical Foundation.
Materiali
| Name | Company | Catalog Number | Comments |
| Nome del reagente | Azienda | Numero di catalogo | Commenti |
|---|---|---|---|
| Perle di polistirene 0,05 micron | Polysciences, Inc. | 08691 | |
| Perle di polistirene 0,10 micron | Polysciences, Inc. | 00876 | |
| Agarosio GPG / LE | Americano Bioanalytical | 00972 | Ultra pura |
| Falcon 14 polistirolo ml a fondo rotondo Tubo | BD Biosciences | 352057 | 17 x 100 stile mm, apirogeno |
| Thermo Scientific Pianura vetrini da microscopio predepurata | Erie Scientifica Azienda | 420-004T | 3 "x 1" x 1 mm |
| Copertura Slips | VWR | 48366 205 | 18 millimetri x 18 mm n ° 1 1 / 2 |
| KIMTECH Scienza Kimwipes | Kimberly-Clark | 34155 | |
| BD Falcon 100 x 15mm Piatto Stile Petri | BD Biosciences | 351029 | |
| Nastro vuoto 3/4w x 500L | TimeMed | T-512 | |
| Olio di immersione | Nikon | Tipo A, nd = 1,515 | |
| EG1285 o CZ1200 | C. elegans Centro Genetico | http://www.cbs.umn.edu/CGC/strains/ | |
| OptiScan II | PRIMA scientifico | ||
| NIS-Elements Ar o Br | Nikon | ||
| MicroPoint Ablazione Laser System | Fotonici scientifico | ||
| Microscopio composto | Nikon | Eclipse 80i | |
| Hamamatsu Camera | Hamamatsu Photonics | Modello C8484-05G01 | |
| Dell Precision T3400 PC con processore Intel Core 2 Duo | Conca | ||
| Windows XP Professional | Microsoft | Versione 2002, Serie Pack 3 | |
| Doppio bagno secco Incubator | Fisher Scientific | Controlli analogici | |
| 4X Plan Fluor obiettivo | Nikon | ||
| 100X Apo Piano obiettivo olio VC | Nikon | ||
| Dumont # 5 / 45 forcipe | Dumont | 11251-35 | Dumoxel punte standard, può anche usare # 7 |
| Microscopio da dissezione | Nikon | SMZ800 | Con NI-150 Illuminatore ad alta intensità |
Riferimenti
- Hammarlund, M., Nix, P., Hauth, L., Jorgensen, E. M., Bastiani, M. Axon regeneration requires a conserved MAP kinase pathway. Science. 323, 802-806 (2009).
- Ghosh-Roy, A., Wu, Z., Goncharov, A., Jin, Y., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Wu, Z. Caenorhabditis elegans neuronal regeneration is influenced by life stage, ephrin signaling, and synaptic branchi ng. Proceedings of the National Academy of Sciences. 104, 15132-15137 (2007).
- Yan, D., Wu, Z., Chisholm, A. D., Jin, Y. The DLK-1 Kinase Promotes mRNA Stability and Local Translation in C. elegans Synapses and Axon Regeneration. Cell. 138, 1005-1018 (2009).
- Yanik, M. F. Neurosurgery: Functional regeneration after laser axotomy. Nature. 432, 822-822 (2004).
- Gabel, C. V., Antoine, F., Chuang, C., Samuel, A. D. T., Chang, C. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Rao, G. N., Kulkarni, S. S., Koushika, S. P., Rau, K. R. In vivo nanosecond laser axotomy: cavitation dynamics and vesicle transport. Optics Express. 16, 9884-9894 (2008).
- Wood, W. B. The Nematode Caenorhabditis Elegans. , (1988).
- McLntire, S. L., Jorgensen, E., Kaplan, J., Horvitz, H. R. The GABAergic nervous system of Caenorhabditis elegans. Nature. 364, 337-341 (1993).
- Bourgeois, F., Ben-Yakar, A. Femtosecond laser nanoaxotomy properties and their effect on axonal recovery in. C. elegans. Optics Express. 15, 8521-8531 (2007).
- Chung, S., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Applied Physics A: Materials Science & Processing. 96, 335-341 (2009).
- Steinmeyer, J. D. Construction of a femtosecond laser microsurgery system. Nature Protocols. 5, 395-407 (2010).
- Wang, Z., Jin, Y. Genetic dissection of axon regeneration. Current Opinion in Neurobiology. , (2010).
- Huang, X., Cheng, H. -. J., Tessier-Lavigne, M., Jin, Y. MAX-1, a Novel PH/MyTH4/FERM Domain Cytoplasmic Protein Implicated in Netrin-Mediated Axon Repulsion. Neuron. 34, 563-576 (2002).
- McIntire, S. L., Reimer, R. J., Schuske, K., Edwards, R. H., Jorgensen, E. M. Identification and characterization of the vesicular GABA transporter. Nature. 389, 870-876 (1997).
- Fang-Yen, C., Gabel, C. V., Samuel, A. D. T., Bargmann, C. I., Avery, L. . Laser microsurgery in C. elegans in Methods in Cell Biology: Caenorhabditis elegans: Modern Biological Analysis of an Organism. , .
- Guo, S. X. Femtosecond laser nanoaxotomy lab-on-a-chip for in vivo nerve regeneration studies. Nature Methods. 5, 531-533 (2008).
- Zeng, F., Rohde, C. B., Yanik, M. F. Sub-cellular precision on-chip small-animal immobilization, multi-photon imaging and femtosecond-laser manipulation. Lab on a Chip. 8, 653-656 (2008).
- Rohde, C. B., Zeng, F., Gonzalez-Rubio, R., Angel, M., Yanik, M. F., F, M. Microfluidic system for on-chip high-throughput whole-animal sorting and screening at subcellular resolution. Proceedings of the National Academy of Sciences. 104, 13891-13895 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab on a Chip. 7, 1515-1523 (2007).
- Ben-Yakar, A., Chronis, N., Lu, H. Microfluidics for the analysis of behavior, nerve regeneration, and neural cell biology in C. elegans. Current Opinion in Neurobiology. 19, 561-567 (2009).
- Samara, C. Large-scale in vivo femtosecond laser neurosurgery screen reveals small-molecule enhancer of regeneration. Proceedings of the National Academy of Sciences. , (2010).
- Nelson, F. K., Riddle, D. L. Functional study of the Caenorhabditis elegans secretory-excretory system using laser microsurgery. Journal of Experimental Zoology. 231, 45-56 (1984).
- Sulston, J. E., White, J. G. Regulation and cell autonomy during postembryonic development of Caenorhabditis elegans. Developmental Biology. 78, 577-597 (1980).
- Kimble, J. Alterations in cell lineage following laser ablation of cells in the somatic gonad of Caenorhabditis elegans. Developmental Biology. 87, 286-300 (1981).
- Allen, P. B. Single-synapse ablation and long-term imaging in live C. elegans. Journal of Neuroscience Methods. 173, 20-26 (2008).
- Pujol, N. Distinct Innate Immune Responses to Infection and Wounding in the C. elegans Epidermis. Current biology. CB 18, 481-489 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon