Method Article
Imagem Lifetime fluorescência de rotores moleculares em células vivas
Neste Artigo
Resumo
Imagens Lifetime fluorescência (FLIM) emergiu como uma técnica de imagem chave para o meio ambiente e interacção de proteínas específicas e corantes em células vivas. FLIM de rotores moleculares fluorescentes permite o mapeamento de viscosidade em células vivas.
Resumo
A difusão é muitas vezes um passo de taxa de determinação importante nas reacções químicas ou processos biológicos e desempenha um papel em uma grande variedade de eventos intracelulares. A viscosidade é um dos parâmetros importantes que afectam a difusão de moléculas e proteínas, e as alterações na viscosidade têm sido associados a doença e mau funcionamento, ao nível celular. 1-3 Embora os métodos para medir a viscosidade a granel são bem desenvolvida, microviscosidade imagiologia permanece um desafio . Mapas de viscosidade de objectos microscópicos, tais como as células individuais, têm até recentemente sido difícil de obter. Viscosidade mapeamento com técnicas de fluorescência é vantajoso porque, semelhante a outras técnicas ópticas, é minimamente invasiva, não destrutivo e pode ser aplicado a células vivas e tecidos.
Fluorescentes rotores moleculares exibem tempos de vida de fluorescência e os rendimentos quânticos que são uma função da viscosidade do seu microambiente. Torção intramolecular 4,5 ourotação leva a não-radiativa de decaimento da parte de trás estado animado para o estado fundamental. Um ambiente viscoso diminui essa rotação ou torção, restringindo o acesso a esta via decomposição não-radiativa. Isto leva a um aumento do rendimento quântico de fluorescência eo tempo de vida de fluorescência. Imagens Lifetime fluorescência (FLIM) de modificados corantes BODIPY hidrofóbicos que actuam como fluorescentes rotores moleculares mostram que o tempo de vida de fluorescência destas sondas é uma função do microviscosidade do seu ambiente. 6-8 Um gráfico logarítmico do tempo de vida de fluorescência versus os rendimentos viscosidade do solvente uma linha recta que obedece à equação Förster Hoffman. 9 Este lote também serve como uma curva de calibração para converter tempo de vida de fluorescência em viscosidade.
Após a incubação de células vivas com o modificado BODIPY rotor fluorescente molecular, uma distribuição de corante ponteada é observada nas imagens de fluorescência. O valor da viscosidade obtida em poe puncta em células vivas é de cerca de 100 vezes maior do que a da água e do citoplasma celular. 6,7 tempo resolvido medições de anisotropia de fluorescência produzir tempos de correlação rotacional de acordo com estes valores microviscosidade grandes. Mapeamento o tempo de vida de fluorescência é independente da intensidade de fluorescência, e, assim, permite a separação de concentração da sonda e efeitos de viscosidade.
Em resumo, temos desenvolvido uma abordagem prática e versátil para mapear o microviscosidade em células baseado em FLIM de fluorescentes rotores moleculares.
Protocolo
Os protocolos para a preparação da amostra FLIM não diferem daquelas para as confocal ou de grande intensidade microscopia de campo baseado em fluorescência. A aquisição de dados é seguido pela tarefa principal da análise de dados, isto é, extraindo os tempos de vida de fluorescência a partir dos dados em bruto. Uma vez que estes tenham sido obtidos, a interpretação dos dados ajuda a verificar ou falsificar as hipóteses.
1. Células marcadas com rotores moleculares
- Preparar uma solução-mãe (10 ml) por dissolução de aproximadamente 1 mg / ml do corante num solvente apropriado (por exemplo metanol para BODIPY-C 12) 6,7 usando uma balança com uma precisão e uma pipeta.
- As células (um modelo da linha de células cancerosas, HeLa, no nosso caso) de serem coradas são cultivados em em uma placa de poços múltiplos com um lado de baixo coverslide para microscopia, numa incubadora a 37 ° C com uma atmosfera de 5% de CO 2 até ~ 80% confluente .
- Adicionar 10-20 ul da solução de estoque para as células vivas que crescem em um multi-well placa (50 SmartSlide sistema de incubação de micro-, Wafergen) em 4 ml de meio Opti-MEM (GIBCO) por poço para uma placa de 6 poços. Isso produz uma concentração de corante micro-molar no poço.
- Retornar a placa multi-poço para uma incubadora a 37 ° C com uma atmosfera de 5% de CO2 durante 10-45 minutos, para a coloração.
- Remova a placa de poços múltiplos da incubadora e lavar as células de 3-4 vezes com 4 ml meio de cultura de células opticamente transparente (por exemplo, Opti-MEM) para remover o excesso de corante.
- Transferir a placa de poços múltiplos para a platina do microscópio e ligar a um controlador de temperatura / 5% de CO de entrada de gás 2, conforme necessário, em preparação para a imagem latente.
2. FLIM de fluorescentes rotores moleculares em células
- Colocar a amostra sobre a platina do microscópio e obter uma transmissão e uma imagem de fluorescência para identificar as células fluorescentes. Um diagrama esquemático do conjunto experimental acima é mostrada na fig. 1.Verify que emana de fluorescência a partir da expe localizaçõesCTED (por exemplo, da membrana celular, citoplasma). Obter um espectro de emissão de fluorescência, e verificar que é a do corante ou da proteína esperado, neste caso, o espectro do rotor molecular. Como um controlo negativo de imagem, uma amostra não-coradas e verificar que não fluorescente. Embora este passo não é essencial especificamente para FLIM, é uma boa prática, em geral, e não ajuda a verificar que a amostra é o que você pensa que é.
- Mude para o modo FLIM - isto é facilmente conseguido através de um espelho se movendo para fora do caminho de fluorescência de detecção de feixe ("detector externo" botão "caminho configuração de feixe" painel sobre o SP2 TCS Leica software de controle de aquisição). Um filtro de emissão de fluorescência apropriado para bloquear qualquer luz de excitação de alcançar o detector deve estar no beampath detecção de fluorescência.
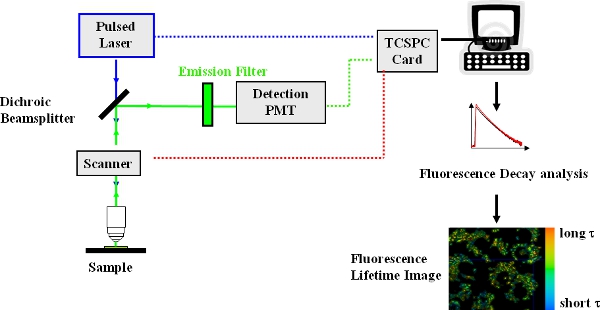
Figura 1. Arranjo experimental para domínio do tempo FLIM usando acdo laser onfocal microscópio de varredura.
- Digitalizar a amostra e verificar, no computador que controla a aquisição FLIM, que a taxa de contagem de detector (barra preta rotulado CFD em software de aquisição de controlo do Becker e Hickl SPC 830 da placa) não é mais do que cerca de 1% da taxa de repetição do laser ( barra verde marcado SYNC software de controle de aquisição). Se for, reduzir a intensidade de excitação laser, por exemplo, pela colocação de um filtro de densidade neutro no caminho do feixe de laser, para evitar a recolha de pilha-up distorcidas curvas de decaimento da fluorescência.
- Adquirir uma imagem FLIM, geralmente durante 3-5 minutos, parar a busca e salvar os dados em bruto (um 3D de dados "cubo", que consiste de coordenadas espaciais x e y, e tempo).
- Abra os dados brutos na fluorescência pacote de software decadência análise, por exemplo TRI-2 14 ou software comercial, para exibir a imagem de intensidade de fluorescência. Isto é simplesmente o decaimento integrado de fluorescência, isto é, a área sob a curva de decaimento da fluorescência, em cadapixel.
- Selecione um pixel típico, colocando o cursor sobre ele, e inspecionar o decaimento de fluorescência em que pixel. Se a contagem de pico é abaixo de 100, utilizar binning espacial de pixels. As contagens de pixels adjacentes (por exemplo, 3x3 ou 5x5) são adicionados ao pixel central, de modo que um maior número de pico é obtido lá. Isto proporciona uma maior precisão estatística para o passo seguinte. Alternativamente, a medição pode ser repetido para um tempo de aquisição (passo 5). Para 30-50min, uma contagem de cerca de 10 vezes maior pico (e contagens totais) é obtido, mas esta é muito tempo um tempo de aquisição para a maioria das amostras biológicas por causa do perigo de introdução de artefactos devidos ao movimento da amostra, deriva microscópio, fototoxicidade e fotodegradação.
- Seleccionar um valor de limiar global pixel (acima do qual o decaimento num pixel está equipado) e aplicar um ajuste de decaimento exponencial simples para a imagem. O resultado produz um tempo de vida de fluorescência para cada pixel acima do limiar, o qual é então codificado emcor. Cada pixel é colorida com o resultado do ajuste, e um mapa FLIM é obtido. Verifique os reduzidos valores de qui-quadrado de pixels diferentes - cerca de 1 (e até 1,3) indica um bom ajuste. Inspecione os resíduos correspondentes, que devem ser distribuídos aleatoriamente em torno de zero.
- As parcelas da vida de fluorescência do histograma como muitas vezes vidas de fluorescência certas ocorrem contra a vida de fluorescência em si. Ajuste o intervalo de cor tal que a distribuição tempo de vida de fluorescência se encaixa na gama de cores.
- Se um ajuste monoexponencial não produzir um valor de qui-quadrado de cerca de 1 (e até 1,3), e há um desvio sistemática dos resíduos a partir de zero, um modelo mais sofisticado é necessária. Por exemplo, tente ajustamento de um modelo exponencial dupla para os decai de fluorescência, a conta de dois ambientes diferentes a sonda pode ser polegadas O ajuste também irá produzir os factores pré-exponencial ou amplitudes que dão uma indicação da quantidade relativa de corante em um ambientemento ou o outro. Alternativamente, uma função exponencial estirado pode ser apropriado para explicar uma distribuição de tempos de vida de fluorescência.
- Os resultados para os tempos de vida de fluorescência, pré-exponencial factores, ea relação de tempo de vida ea razão factor de pré-exponencial para cada pixel pode então ser codificado em cor. Cada pixel é colorido de acordo com o seu valor, eo contraste devido ao tempo de vida de fluorescência, pré-exponencial factores e as suas proporções é obtido. Mais uma vez, verificar as reduzidas de qui-quadrado valores (que também pode ser codificado em cor e exibidos como uma imagem) - cerca de 1 (e até 1,3) indica um bom ajuste. Inspecione os resíduos, que devem ser distribuídos aleatoriamente em torno de zero.
- Histogramas vida de fluorescência deve acompanhar todas as imagens para uma fácil visualização de valores médios de vida de fluorescência, ea distribuição da vida de fluorescência.
3. Os resultados representativos
Decai fluorescência medida parao rotor fluorescente molecular a aumentar a viscosidade em metanol / glicerol misturas são mostrados na fig. 2. Os decai de fluorescência são monoexponencial, eo tempo de vida de fluorescência varia marcadamente como uma função da viscosidade. Ela aumenta de cerca de 300 ps em metanol (viscosidade 0,6 cP) a 3,4 ns em glicerol 95% (cP viscosidade 950).

Figura 2. Fluorescência perfis de decaimento para BODIPY-C em metanol 12 / glicerol misturas de viscosidade variando. 6
A curva de calibração logarítmica do tempo de vida de fluorescência τ contra viscosidade η para o rotor fluorescente molecular é mostrado na fig. 3. É uma linha reta como exigido pela equação de Hoffman Förster 9
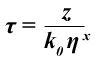
onde k é a 0 radiativtaxa constante e e z e x são constantes, com 0
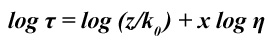
onde x é o gradiente da linha recta.

Figura 3. Um lote de viscosidade log log fluorescência vida vs para BODIPY C-12 produz uma linha reta de acordo com a equação Förster-Hoffmann. 6
Após a incubação de células vivas com o rotor fluorescente molecular uma distribuição corante ponteada é observada nas imagens de fluorescência. Imagens Flim de células HeLa incubadas com um corante BODIPY meso-substituída são mostrados na fig. 4. Os decai de fluorescência em cada pixel da imagem pode ser adequadamente ajustada utilizando um modelo de decaimento exponencial simples.
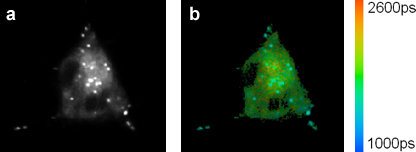
Figura 4. (A) A intensidade da fluorescência e as imagens (b) Flim de células HeLa coradas com BODIPY-C 12. As regiões brilhantes e pontuam exibem uma vida mais curta do que outras regiões. Esta menor liftime corresponde a uma viscosidade mais baixa no puncta, gotículas provavelmente lipídicos, de acordo com a equação Förster-Hoffmann.
Traçando os tempos de vida extraídos de cada pixel, obtém-se um histograma tempo de vida de fluorescência de toda a imagem, como mostrado na fig. 5.
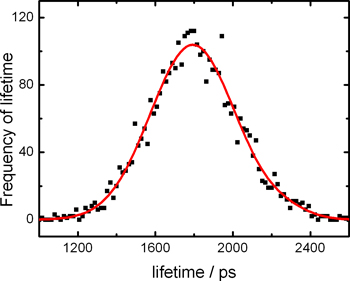
Figura 5. Histogramas de vidas de fluorescência a partir de imagens Flim de células HeLa coradas com meso-substituida rotores BODIPY moleculares.
Discussão
FLIM oferece algumas vantagens sobre a intensidade baseada em imagens de fluorescência. Pode informar sobre acontecimentos fotofísicas que são difíceis ou impossíveis de observar por imagem intensidade de fluorescência, porque pode separá-los contra os efeitos de concentração fluoróforo. Isto é particularmente útil para o mapeamento de viscosidade intracelular por imagem fluorescente rotores moleculares. O tempo de vida de fluorescência pode ser prontamente convertido em uma viscosidade usando um gráfico de calibração, como mostrado na fig. 3, independente da concentração de fluorescentes rotores moleculares.
Em FLIM pode haver artefactos que possam complicar a interpretação dos dados. 10 artefactos incluem Instrumental luz dispersa que vai aparecer como um pico no topo do início do decaimento da fluorescência e pode ser confundida com um tempo de decaimento curto, ou um pequeno pico após o IRF que pode ser causada por reflexões no interior do microscópio. Estes artefactos de luz dispersos podem ser identificados como talporque eles podem ser distinguidos com a discriminação espectral - eles estão sempre no mesmo comprimento de onda da luz excitante. Lembrando que no ar, a luz viaja 30 cm em 1 nanossegundo ajuda a identificar a origem de reflexões.
Filtro de vidro ou de fluorescência pode também causar um artefacto, especialmente a fluorescência da amostra baixa, mas isto pode ser facilmente identificado por tendo uma medição sem a amostra: se um decaimento é obtido sob estas circunstâncias, é devido ao instrumento e não tem nada a ver com a amostra! Por outro lado, note que autofluorescência amostra pode também contribuir para um decaimento da fluorescência.
Em tempo de contagem correlacionada fotão único (TCSPC), tempo-para-amplitude conversor (TAC) não-linearidades podem causar ataques pobres, mas podem ser identificadas através do bloqueio da excitação e brilhante de luz ambiente, por exemplo, a partir da fonte de luz transmitida sobre a amostra e medindo o tempo. Um fundo deve ser constanteobtido em cada pixel da imagem. Regiões onde desvios a partir de um fundo constante ocorrer, nunca irá produzir um bom ajuste e deve ser evitado para a medição se eles não podem ser eliminados por ajustar os parâmetros para a placa de TCSPC.
Um artefato é infame em TCSPC fóton pile-up que é causada por demasiado elevada taxa de detecção de um fóton. 11,12 Isto leva a apenas fóton o primeiro a ser cronometrado, ignorando os fótons subseqüentes porque os componentes eletrônicos são tempo ocupado e processar o primeiro fóton. Amontoado conduz a um encurtamento do tempo de vida de fluorescência, ea melhor maneira de evitar esta é a de manter a taxa de contagem de fotão em cerca de 1% da taxa de repetição do laser.
Perspectiva
Existem várias implementações de FLIM, e, dependendo da aplicação, cada um tem as suas vantagens e desvantagens. 13 microscópio de fluorescência O ideal seria adquirir a totalidade multidimensional fluorescência emission contorno de intensidade, posição, comprimento de onda da vida, e polarização em uma única medição, com sensibilidade de fóton único, resolução espacial máximo e mínimo tempo de aquisição. Não há atualmente tecnologia com esta combinação única de características, e para construir um continua sendo um desafio para os desenvolvedores de instrumentação. A aplicação de novas técnicas físicas para problemas importantes em biologia celular é muitas vezes o caminho para descobertas inesperadas, e há um longo caminho a percorrer antes de estarmos perto de saturar as capacidades de imagens de fluorescência para a biologia celular. Com efeito, os parâmetros de imagens de fluorescência, tais como tempo de vida, espectro e polarização, bem como uma imagem mais rapidamente em 3D com maior resolução espacial, são determinados para revelar novos aspectos da biologia celular.
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
MKK graças Engenharia do Reino Unido e Ciências Físicas Research Council (EPSRC) programa Life Sciences interface para uma bolsa pessoal. Gostaríamos também de agradecer pelo financiamento de Biotecnologia do Reino Unido e Ciências Biológicas Research Council (BBSRC).
Materiais
Amostra com rotores moleculares fluorescentes
Hardware:
invertido Leica TCS SP2 microscópio confocal
Coerente Mira 900 Ti: Sapphire laser de femtossegundos com um V6 Verdi bomba laser ou Hamamatsu PLP-10 470 picossegundos pulsados diodo fontes de excitação laser
Becker & Hickl SPC 830 placa em 3GHz, Pentium IV, 1GB RAM do computador com o Windows XP
cabeça Becker & Hickl refrigerado PMC100-01 detector baseado em Hamamatsu H5773P-01 fotomultiplicadores, montado na porta microscópio X1, ou detectores de híbridos
DCC 100 módulo de controle do detector
Software:
TRI-2 14 ou SPCImage 2,8 por Becker & Hickl
Referências
- Luby-Phelps, K. Cytoarchitecture and physical properties of cytoplasm: Volume, viscosity. diffusion, intracellular surface area. International Review of Cytology - a Survey of Cell Biology. , 192-1189 (2000).
- Stutts, M. J., Canessa, C. M., Olsen, J. C., Hamrick, M., Cohn, J. A., Rossier, B. C., Boucher, R. C. CFTR as a CAMP-dependent regulator of sodium channels. Science. 269, 847-850 (1995).
- Dondorp, A. M., Angus, B. J., Hardeman, M. R., Chotivanich, K. T., Silamut, K., Ruangveerayuth, R., Kager, P. A., White, N. J., Vreeken, J. Prognostic significance of reduced red blood cell deformability in severe falciparum malaria. Am. J. Trop. Med. Hyg. 57, 507-511 (1997).
- Haidekker, M. A., Nipper, M., Mustafic, A., Lichlyter, D., Dakanali, M., Theodorakis, E. A., Demchenko, A. P. . Advanced Fluorescence Reporters in Chemistry and Biology I. Fundamentals and Molecular Design. 8, 267-308 (2010).
- Haidekker, M. A., Theodorakis, E. A. Environment-sensitive behavior of fluorescent molecular rotors. J. Biol. Eng. 4, (2010).
- Kuimova, M. K., Yahioglu, G., Levitt, J. A., Suhling, K. Molecular Rotor Measures Viscosity of Live Cells via Fluorescence Lifetime Imaging. Journal of the American Chemical Society. 130, 6672-6673 (2008).
- Levitt, J. A., Kuimova, M. K., Yahioglu, G., Chung, P. H., Suhling, K., Phillips, D. Membrane-Bound Molecular Rotors Measure Viscosity in Live Cells via Fluorescence Lifetime Imaging. Journal of Physical Chemistry C. 113, 11634-11642 (2009).
- Hungerford, G., Allison, A., McLoskey, D., Kuimova, M. K., Yahioglu, G., Suhling, K. Monitoring Sol-to-Gel Transitions via Fluorescence Lifetime Determination Using Viscosity Sensitive Fluorescent Probes. J. Phys. Chem. B. 113, 12067-12074 (2009).
- Förster, T., Hoffmann, G. Die Viskositätsabhängigkeit der Fluoreszenzquantenausbeuten einiger Farbstoffsysteme. Zeitschrift für Physikalische Chemie Neue Folge. 75, 63-76 (1971).
- vandeVen, M., Ameloot, M., Valeur, B., Boens, N. L. Pitfalls and Their Remedies in Time-Resolved Fluorescence Spectroscopy and Microscopy. J. Fluores. 15, 377-413 (2005).
- Becker, W. . Advanced Time-Correlated Single Photon Counting Techniques. , (2005).
- O'Connor, D. V., Phillips, D. . Time-correlated single-photon counting. , (1984).
- Suhling, K., French, P. M. W., Phillips, D. Time-resolved fluorescence microscopy. Photochem. Photobiol. Sci. 4, 13-22 (2005).
- Barber, P. R., Ameer-Beg, S. M., Gilbey, J., Carlin, L. M., Keppler, M. D., Ng, T. C., Vojnovic, B. Multiphoton time-domain fluorescence lifetime imaging microscopy: practical application to protein-protein interactions using global analysis. Journal of the Royal Society - Interface. 6, S93-S105 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados