É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Continuamente agitada digestor anaeróbico para converter resíduos orgânicos em biogás: Configuração do Sistema e Operação Básica
Neste Artigo
Resumo
Laboratório escala biodigestores permitem aos cientistas para pesquisar novas formas de otimização de aplicações existentes de biotecnologia anaeróbia e avaliar o potencial de produção de metano de vários resíduos orgânicos. Este artigo apresenta um modelo generalizado para a construção, a inoculação, operação e monitoramento de uma escala laboratorial continuamente agitada digestor anaeróbico.
Resumo
A digestão anaeróbia (DA) é um bioprocesso que é comumente usado para converter resíduos orgânicos complexos em um biogás úteis com o metano como o portador de energia 1-3. Cada vez mais, AD está sendo usado em resíduos industriais, agrícolas e urbanos (água) aplicações de tratamento de 4,5. O uso da tecnologia AD permite que os operadores para reduzir os custos de eliminação de resíduos e compensar as despesas de utilidade de energia. Além disso para o tratamento de resíduos orgânicos, as culturas de energia estão a ser convertida em energia a transportadora metano 6,7. Como a aplicação de tecnologia AD amplia para o tratamento de substratos novos e co-substrato misturas 8, o mesmo acontece com a demanda por uma metodologia de teste de confiança ao piloto e à escala laboratorial.
Sistemas de digestão anaeróbia ter uma variedade de configurações, incluindo o reactor de tanque continuamente agitado (CSTR), o fluxo de ficha (PF), eo reactor anaeróbio lote sequenciação (ASBR) configurações 9 Este artigo apresenta uma metodologia geral para a construção, inoculando, operação e monitoramento de um sistema CSAD com a finalidade de testar a adequação de um determinado substrato orgânico a longo prazo de digestão anaeróbia. A seção de construção deste artigo abrange a construção do sistema de reator de escala de laboratório. A seção de inoculação irá explicar como criar um ambiente anaeróbico adequado para semear com um inóculo ativo metanogênica. A seção operacional irá cobrir a operação, manutenção e solução de problemas. A seção de monitoramento irá introduzir protocolos de ensaio por meio de análises padrão. O uso dessas medidas é necessário para avaliações confiáveis experimentais de adequação do substrato para a AD. Este protocolo deve proporcionar uma maior protecção contra um erro comum feito em estudos AD, que é de concluir que a falha do reator foi causado pelo substrato in uso, quando na realidade foi a operação do usuário impróprio 10.
Introdução
A digestão anaeróbia (DA) é uma tecnologia madura, envolvendo a conversão biológica mediada por complexos substratos de resíduos orgânicos em biogás úteis com o metano como transportador de energia. Há muitos benefícios de tratamento anaeróbio, incluindo um mínimo de energia e nutrientes e produção de biossólidos reduzido em comparação ao tratamento aeróbio 10. Além disso, a versatilidade da comunidade microbiana misto inerente a estes sistemas torna uma grande variedade de substratos orgânicos adequados como matérias-primas 11,12. De fato, é devido a esses benefícios que um número crescente de pedidos de AD estão sendo adotadas fora do tratamento de esgoto convencional municipal, particularmente nos sectores industrial, municipais (por exemplo, resíduos de alimentos) e agrícola 4,7,13. AD experimentou seu primeiro grande proliferação início na década de 1980 em resposta à crise nacional de energia da década anterior. Enquanto o mundo enfrenta uma crise energética global crescente,juntamente com a degradação ambiental, maior foco agora está sendo colocado em tecnologias de biocombustíveis eo conceito de lixo em energia, em particular. Por exemplo, em os EUA, a digestão anaeróbia pode gerar 5,5% da potência eléctrica total necessita de 8.
Isso aumentou a demanda para o bem-controlado de pesquisa experimental para o piloto e em escala de laboratório para avaliar a adequação de novos materiais de resíduos orgânicos e misturas de resíduos de digestão anaeróbia 14. Nós pretendemos fornecer um modelo genérico para a construção, a inoculação, operação e monitoramento de um digestor anaeróbio à escala laboratorial, que será adequado para avaliações robustos. Digestores anaeróbicos existir em várias configurações diferentes. Algumas configurações comuns incluem:-continuamente reator tanque agitado (CSTR), com alimentação contínua influente; continuamente agitada digestor anaeróbico (CSAD) com alimentação influente periódico; fluxo plug (PF), de fluxo ascendente com manta de lodo anaeróbio (UASB); reator anaeróbio de manta de migrar (AMBR); reator compartimentado anaeróbio (ABR) e reator anaeróbio de batelada seqüencial (ASBR) configurações 9,15. A configuração do CSTR e CSAD têm sido amplamente adotado para laboratório de experimentos em escala, devido à sua facilidade de configuração e condições operacionais favoráveis. Devido a mistura contínua, o tempo de retenção hidráulica (TRH) é igual ao tempo de retenção de lamas (TSA). A SRT é o parâmetro de projeto importante para anúncios. A configuração é também favorável à experiências controladas por causa de uma maior uniformidade espacial dos parâmetros, tais como concentrações químicas espécies, temperatura, e as taxas de difusão. Deve-se notar, no entanto, que a configuração em grande escala óptima para um digestor anaeróbico depende das qualidades particulares físicas e químicas do substrato orgânico entre outros aspectos não técnicos, tais como a qualidade do efluente alvo. Por exemplo, diluir fluxos de resíduos com relativamente alto teor orgânico solúvel e littlpartículas electrónicos, tais como cerveja de águas residuais, tipicamente experiência de conversão de energia maior numa configuração bioreactor de alta taxa de fluxo ascendente (por exemplo, UASB) em vez de uma configuração CSAD. Independentemente disso, há parâmetros operacionais fundamentais que são essenciais à digestão bem-sucedida e relevantes para todas as configurações, o que justifica uma explicação genérica de usar essa configuração.
Na verdade, todo sistema de AD contendo uma comunidade diversa, aberto de microorganismos anaeróbicos irá série metabolizar o substrato em metano (a final do produto final com a menor energia disponível gratuitamente por elétron). As vias metabólicas envolvidas neste processo constituem uma intricada teia alimentar vagamente classificados em quatro estágios tróficos: hidrólise, acidogênese; acetogénese e metanogênese. Em hidrólise, complexos de polímeros orgânicos (por exemplo, hidratos de carbono, lípidos e proteínas) são desagregadas aos seus respectivos monómeros (por exemplo, açúcares, ácidos gordos de cadeia longa, e aminoácidos) por HYDrolyzing, as bactérias fermentativas. Em acidogênese, estes monómeros são fermentadas por bactérias acidogênicas para ácidos gordos voláteis (AGV) e álcoois, que, em acetogénese, são oxidado para acetato e hidrogénio por homoacetogenic e obrigatório hidrogénio produtoras de bactérias, respeitosamente 5. No passo final de metanogênese, acetato e hidrogénio são metabolizados em metano por metanógenos acetoclástica e hydrogenotrophic. É importante reconhecer que o processo geral do anúncio, baseando-se uma série interligada de metabolismos por diferentes grupos de micróbios, vai depender da função bem sucedida de cada membro antes que o sistema como um todo será um desempenho óptimo. O projeto ea construção de um sistema biorreator AD deve sempre levar em consideração a exigência para fechar completamente o biorreator. Vazamentos pequenos no topo do bioreactor (que separa o espaço superior) ou no sistema de tratamento de gás pode ser difícil de detectar, e, por conseguinte, o sistema deve ser prescerteza testado antes da utilização. Depois de garantir uma instalação livre de vazamentos, falhas com estudos digestor anaeróbico muitas vezes resultam de erros durante a inoculação, cultura e dia-a-dia operação. Como resultado, digestores têm uma reputação como sendo intrinsecamente instável e propensa ao fracasso inesperado. Por que é então que em escala biodigestores foram operados sob condições estáveis por décadas de 13? O fracasso é provável que resultam de manuseio impróprio por parte do operador, especialmente durante o período de inicialização durante o qual a comunidade microbiana deve lentamente aclimatar para a composição de resíduos orgânicos e força. Portanto, nosso objetivo não é apenas para fornecer uma metodologia para a construção de um sistema de AD, mas também para elucidar os processos de inoculação, operação e monitoramento desses sistemas.
A primeira seção do artigo irá explicar como construir o CSTR ou sistema CSAD, enquanto a segunda seção irá fornecer um procedimento para digestor inoculação com ativo methanogbiomassa enic. É mais prático e menos demorado para inocular digestores com biomassa metanogênica activo a partir da. Misto licor ou efluente de um digestor de funcionamento que é o tratamento de um substrato semelhante a tentar desenvolver um biomassa suficiente a partir de uma cultura incipiente A terceira seção do artigo abrange considerações operacionais, como substrato de alimentação, decantação de efluentes, e solucionar problemas de reatores diferentes. Alimentando substrato e decantação do efluente para este sistema será conduzida numa base semi-contínua (isto é, alimentando periódica e decantação, enquanto a maioria da biomassa e licor misto permanece no bioreactor). A freqüência em que o digestor é alimentado / decantado é prerrogativa do operador. Em geral, alimentando / decantação mais frequentemente e com intervalos regulares vai promover uma maior estabilidade do digestor e consistência de desempenho entre ciclos de alimentação. A quarta secção irá introduzir um protocolo de controlo básico a ser utilizado durante o experimental período. Várias análises padrão, que são descritas no Standard Methods para o Exame de Água e de Águas Residuais 16 (Tabela 1, 2), serão necessários para a caracterização do substrato e sistema de monitoramento adequado. Além dos parâmetros medidos, um aspecto importante da monitorização é verificar que os componentes do sistema digestor estão a funcionar correctamente. A manutenção regular para o sistema digestor vai antecipar os problemas principais do sistema que poderiam comprometer o desempenho a longo prazo e estabilidade do digestor. Por exemplo, uma falha do elemento de aquecimento, levando a uma queda na temperatura, pode causar a acumulação de ácidos gordos voláteis através da redução da taxa metabólica de metanogenos. Este problema seria composto se o sistema não tinha a alcalinidade suficiente para manter o pH acima dos níveis de inibição para metanogenos. É também importante para detectar e fechar possíveis vazamentos depois de quedas inesperadas na produção de biogás ratoes. Portanto, a duplicação dentro do projeto experimental, por exemplo, executar dois biorreatores lado a lado nas condições de funcionamento exatas, é importante para detectar perdas inesperados de desempenho causadas por mau funcionamento do sistema, tais como pequenos vazamentos.
Protocolo
1. Construção digestor
- Selecione um vaso digestor que contém todas as características mostradas na fig. 1 (um cone não é necessária), eo seu volume de trabalho desejado (tipicamente entre 1-10 L). Se o seu vaso do digestor não está equipado com uma camisa aquecida-água, coloque o digestor em algum ambiente de temperatura controlada outro, tal como um banho de água aquecida ou câmara de incubação.
- Fixar o vaso numa posição vertical em uma área com espaço suficiente bancada horizontal para colocação de componentes restantes (Tabela 2).
- Construir a tampa do recipiente de acordo com a fig. 2. As portas dos tubos afluentes e efluentes deve ser grande o suficiente para evitar o entupimento. Os tubos no interior do bioreactor deve ser de comprimento suficiente para ficar submersa no meio do digestor durante a decantação, enquanto se estende para fora a partir do topo da tampa para permitir a ligação da tubagem. O impulsor de bainha deve estender-se na medida do posvel para o meio digestor (a tubulação submersa e revestimento impedir a fuga de biogás headspace do biorreator).
- Aplicar à base de silicone graxa vácuo para a superfície de contacto da tampa e fixá-lo na tampa do reservatório digestor.
- Fixe o misturador de velocidade variável paralela ao eixo vertical do digestor, usando um anel de suporte e braçadeiras, então eixo impulsor apor. Devido a vibrações do misturador a motor e de circulação, é importante utilizar um suporte independente e livre de se mover.
- Conectar uma secção de tubagem flexível para ambos os tubos de afluentes e efluentes e depois ligar uma outra secção da tubagem para a porta de gás a ser utilizado como a linha de gás.
- Ligue a linha de biogás a cada um dos vários componentes, que pode ser colocado por cima do digestor em prateleiras. Os componentes devem ser ligados por esta ordem: porta de amostragem, armadilha de espuma, H 2 S purificador, reservatório de gás, borbulhador, contador de gás, e uma linha de ventilação (Fig. 3). Para facilitar o isolamento ou reMoval de componentes individuais para solucionar problemas ou limpeza, considerar a adição de válvulas e acessórios conector entre os componentes. Certifique-se que a saída de gás é bem ventilado para o exterior ou um capuz químico porque o biogás é explosivo.
- A porta de amostragem de gás deve ser posicionada perto da câmara de expansão do reactor.
- A armadilha de espuma pode ser construído usando um balão de simples ou garrafa, e deve ser de pelo menos 25% do volume do reactor. Deve conter duas portas, uma para a linha de entrada de biogás e outro para a linha de saída de biogás. Estas portas podem ser feitas através da perfuração de dois furos em uma rolha de borracha através da qual tubagem rígida está inserido. O tubo de entrada de biogás deve estender-se para uma profundidade maior do que o tubo de saída de biogás (Fig. 4). Aprisionamento de espuma é necessária para proteger o sistema de manipulação de gás a partir de espuma de digestor possível.
- O H 2 S purificador é constituído por um tubo de vidro de comprimento, com um diâmetro interno maior do que 2 cm, cheia com steel lã com uma entrada de biogás e porta de saída em cada extremidade. A lã de aço deve ser embalado também para proporcionar uma área de superfície suficiente para descascar, mas não com tanta força que o fluxo de biogás é bloqueado. Esfregar é necessária para proteger os componentes metálicos no contador de gás a partir de produtos químicos corrosivos.
- O reservatório de gás pode ser feita de qualquer colapsável, material estanque ao ar, tal como um saco de gás, ou mesmo uma bola infantil, com um volume superior a duas vezes o volume de alimentação de destino. Isto é necessário para evitar uma queda de pressão durante a decantação de sucção de ar efluente e possível, para a câmara de expansão.
- Se o sistema será temperatura controlada por um aquecedor de água de circulação, ligar o aquecedor para o revestimento de aquecimento usando tubagem flexível. Coloque a unidade acima do nível do líquido do revestimento de aquecimento. Ajuste o aquecedor para a temperatura apropriada para a digestão mesofílica ou termofílica (Tabela 1).
- Realizar um teste de vazamento do sistema de detecção de vazamentos com soapy água. Comece por enchimento do tanque digestor com água, depois ligeiramente pressurizar a linha de influente com um gás a uma pressão inferior a 5 psi. Primeiro, prenda a linha de biogás e as linhas de efluentes para verificar vazamentos ao redor da tampa do reator, e, em seguida, remova a braçadeira linha de biogás para testar se há vazamentos para todo o sistema de gás manuseio. Note-se que mais de pressurização da linha de afluente irá forçar a água para fora através do tubo de impulsor de bainha.
- Ligue o impulsor eo elemento de aquecimento e deixar rodar durante a noite para assegurar que o misturador e aquecedor pode sustentar o funcionamento contínuo. A velocidade de rotação do impulsor deve ser suficientemente rápido para assegurar a mistura completa dos meios de comunicação do reactor. Problemas comuns incluem misturadores de atrito, o desalinhamento excessivo do eixo, e inadequada fixação do motor para o anel de suporte.
2. Digestor Inoculação e condicionado usando uma biomassa ativa metanogênicas
- Guarde a biomassa ativa metanogênica (inóculo) em uma closed recipiente no frigorífico a 4 ° C, enquanto a preparação dos digestores. Idealmente, o inoculo deve ser armazenado durante tão pouco tempo como possível e não deve ser suficiente para encher completamente todo o volume do digestor. No entanto, a biomassa anaeróbio determinado (por exemplo, biomassa granular) pode ser armazenado por períodos muito longos. Diluir o inoculo com a água que foi purgado com um gás anaeróbico para o volume apropriado, se necessário.
- Lavar o sistema digestor anaeróbico vazio com gás durante vários minutos, ligando-o para o tubo de alimentação, de prender a linha de efluente, e gravando o espaço entre o eixo do misturador e bainha para evitar a perda excessiva de gás anaeróbico.
- Durante o período de lavagem, certifique-se de lavar-out do reservatório de gás.
- Após lavagem está completa, ligar um funil para o tubo de alimentação e adicionar o inoculo certificando-se a misturar o inoculo periodicamente para assegurar a uniformidade.
- Volte a ligar o gás anaeróbios para o tubo de alimentação, por sua vez, no mixer, e lave o licor do digestor durante pelo menos 15 min. Em seguida, desligue o gás, fixar o tubo de alimentação e unclamp o reservatório de gás. Este digestor está agora em operação.
- Permitir que o digestor a operar por um par de dias antes de iniciar a alimentação e monitorar a produção de biogás. Durante este tempo, realizar sólidos totais e de análise de concentração de sólidos voláteis para o inóculo (Tabela 1). Se a concentração de sólidos é consideravelmente maior do que a da concentração de licor misto alvo, remover e diluir conteúdo do digestor de acordo antes de iniciar a alimentação. Isto é feito para prevenir a lavagem excessiva de biomassa durante o período de funcionamento, que pode aumentar a comida a Microorganismo proporção (F / M) também acentuadamente durante todo o período de arranque.
- Determinar a fracção orgânica biodegradável do substrato, quer através da medição do total e volátil concentração de sólidos, a procura de oxigénio biológico ou químico, ou de carbono orgânico total do substrato. Use this valor para calcular uma taxa de carregamento conservadora inicial orgânica (OLR).
- O operador deve aumentar gradualmente a ROL até um valor-alvo é atingido (start-up período). Uma abordagem durante o período de start-up é para corrigir a força orgânica da alimentação, e, em seguida, reduzir o tempo de retenção hidráulica (TRH) de forma incremental até que o ROL alvo é alcançado (um processo que pode demorar vários meses a um ano, dependendo da qualidade do inoculo eo substrato utilizado). Aumentando a ROL demasiado rapidamente as concentrações excessivas de ácidos gordos voláteis (> 2.000 mg / L de acetato) como mostrado na fig. 5. O operador deverá reduzir o ROL se voláteis concentrações de ácidos gordos aumentar a níveis suboptimum (Tabela 1). Se as concentrações de ácidos gordos voláteis são demasiado elevada, o conteúdo do biorreactor podem precisar de ser diluída com água.
- Permitir que o digestor um período de três Hrts no ROL alvo antes da experimentação para estabelecer uma stacondição de linha de base ble.
3. Operação digestor
- Efluente decantação sempre precede a adição do substrato para o digestor, assim imediatamente antes decantação, preparar a mistura de alimentação e armazenar a 4 ° C até ao momento para alimentar.
- Decantar efluente do digestor através da ligação do tubo efluente de uma bomba (lado-braço balão sob vácuo é uma possibilidade de decantação) e remover um volume igual em comparação com o volume de alimentos para animais. Armazenar o efluente a 4 ° C para posterior análise. Note-se que muitas das análises são sensíveis tempo. Por exemplo, o pH deve ser medido imediatamente porque CO 2 escapa da solução, o aumento do pH.
- Remover a mistura de alimentação do frigorífico. Ligue um funil para o tubo de alimentação e derrame na alimentação (substrato) certificando-se a misturar periodicamente para assegurar que os sólidos são transportadas em grandes quantidades com o fluido.
- Execute as etapas de solução de problemas descritas na Tabela 3, se nedesnecessária.
4. Monitoramento do Sistema
- Verificar o sistema digestor e os seus componentes frequentemente durante a operação. Especial atenção deve ser dada aos sistemas de mistura e aquecimento. Manifesto falta de vontade de mistura em uma diminuição abrupta na concentração de sólidos de efluente (Fig. 6). Periodicamente verificar que o óleo ou a água nos contadores de gás é, ao nível adequado e substituir a lã de aço em armadilha de H2S, conforme necessário. Note-se que a lã de aço irá tornar-se negro e brilhante como ele reage com H2S para formar sulfureto de ferro.
- Execute estas análises em digestor de efluentes para o diagnóstico do desempenho do sistema e estabilidade. Os valores devem consistentemente cair dentro do intervalo especificado óptima indicado na Tabela 1.
- Medir a taxa de produção de biogás e pH em cada ciclo de alimentação.
- Medir a concentração de ácidos graxos voláteis, alcalinidade e biogás conteúdo várias vezes por semana.Nota: O teor de biogás deve ser medido ao mesmo tempo em relação ao ciclo de alimentação desde a sua composição irá mudar ao longo do ciclo. Idealmente, o biogás deve ser amostrado no final de um ciclo de alimentação, imediatamente antes da alimentação.
- Medir a necessidade de oxigénio biológico ou químico e sólidos totais e volátil, uma vez por semana ou mais vezes para obter pelo menos três pontos de dados para cada condição experimental em condições de pseudo-estado estacionário.
5. Os resultados representativos
Inoculação sucesso do digestor é marcado pela produção de biogás dentro de alguns dias. O metano a proporção de dióxido de carbono do biogás irá aumentar durante o período de aclimatação de biomassa metanogênica mais é recrutado. O lento crescimento dos microrganismos metanogênicos em comparação com períodos de aclimatização acidogens faz longas e graduais mudanças operacionais necessárias. Na fig. 5, que demonstram a responsabilidade dinâmicasi de um digestor quando uma taxa de carregamento orgânico de alta (ROL) é introduzido cedo demais na fase de start-up. Neste exemplo, não havia biomassa metanogênica insuficiente para remover (isto é, utilizam) os ácidos gordos voláteis (AGV) evoluíram a partir do passo de degradação de substrato, acidogênese. Isto conduziu a uma acumulação de AGVs, e subsequentemente, a redução do pH. Para resolver esta situação, o ROL foi reduzido para limitar a produção de AGVs por acidogens e para permitir que o recrutamento maior methanogen antes de retornar para a maior ROL. Os digestores, em seguida, exibiu a digestão estável por três períodos de retenção hidráulica.
Digestão estável ou pseudo-condições de estado estacionário pode ser assumida quando os parâmetros medidos, tais como as taxas de produção de biogás, As concentrações totais de AGV, as concentrações voláteis sólidos, e níveis de pH, são consistentemente mantida dentro de 10% dos seus valores médios, para um mínimo período de tempo de um HRT. O significado desta colocação é revelado in fig. 6, que mostra a resposta prolongada do sistema CSTR a uma perturbação provocada por mistura insuficiente. A falta de correta mistura permitiu que os sólidos sejam no reator, o que significava menos sólidos foram removidas durante efluente decantado. A sua acumulação resultou em concentrações mais elevadas de sólidos de efluentes após a mistura suficiente foi restaurada. Levou aproximadamente HRT um (isto é, 25 dias) para retornar o digestor para uma concentração de sólidos normais efluente.
Um digestor anaeróbico é um sistema biológico; assim será exibem alguma variabilidade interna no desempenho. Esta variabilidade deve ser quantificada antes do experimentador pode discernir os efeitos específicos causados por perturbações experimentais impostas ao sistema (o uso adequado das estatísticas é necessário). Três períodos de TRH são necessárias antes de uma mudança experimental é feita para o sistema do reactor, porque esta é geralmente considerada um período adequado de tempo para assumir concentrat estáveliões de espécies químicas no licor misto (Fig. 7). Para o fim deste intervalo, o experimentador deve ser capaz de construir uma linha de base de confiança para cada parâmetro medido. Esta base serve como base de comparação para a experimentação futuro.
O rendimento geral do digestor pode ser avaliada, seguindo o protocolo de monitorização, que requer que várias análises padrão ser executado de forma rotineira. Este calendário prevê a resolução temporal adequada para identificar os precursores para a maioria dos problemas do sistema eo tempo lee para impedi-los. Além disso, os resultados destes testes de diagnóstico são destinadas a ser utilizado em conjunto com a Tabela 1 para identificar o desempenho suboptimum. Tabela 3 fornece soluções para muitos dos problemas tipicamente encontrados quando definindo-se um digestor. No caso em que um problema não pode ser rectificada, seguindo as instruções descritas no mesmo, o operador deve consultar recur outroCES, tal como um texto de referência pertencente a biotecnologia anaeróbia.
| Parâmetros de Operação | Índice de Standard Methods | Faixa típica | Faixa de extrema | ||
| Mesófilos | Termofílica | Mesófilos | Termofílica | ||
| Temperatura | 2550 (A) | 32-37 17 ° C | 50-60 17 ° C | 20-42 17 ° C | 45-65 17 ° C |
| Taxa de carga orgânica | NL | 0,8-2,0 17 g VS-L -1-d -1 | 1,5-5,0 17 g VS-L -1-d -1 | 0,4-6,4 17 g VS-L -1-d -1 | 1,0-7,5 17 g VS-L -1-d -1 |
| Tempo de Retenção Hidráulica | NL | 15 - 35 Dias | <15,> 35 dias | ||
| Carbono: Nitrogênio Relação | NL | 25:1 17 | > 25:1 | ||
| Parâmetros de Monitoramento | Índice de Standard Methods | Faixa de Optimum | Faixa Suboptimum | ||
| pH | 4500-H + (B) | 6,5-8,2 10 | <6,5;> 8,2 | ||
| Alcalinidade | 2320 (B) | 1300 - 3000 17 mg CaCO 3-L -1 | <1300 mg CaCO 3 - L-1 | ||
| Ácidos voláteis | 5560 (C) | <200 10 mg Ac-L -1 | > 200 10 mg Ac-L -1 | ||
| Eficiência de Remoção de sólidos | 2540 (B, E) | > 50% | <50% | ||
| Conteúdo biogás | 2720 (C) | 55-70 CH 4; 30-45 CO 2% | <55 CH 4;> 45 CO 2% | ||
Tabela 1. Guia de seleção Geral operação e os parâmetros de monitoramento para os sistemas CSTR.
| Componente | Especificações (Considerações sobre o design) | Comentários |
| Temperatura controlada aquecedor de água circulante | Faixa de Temperatura: 25-65 ° C (Capacidade de aquecimento, Max Head. Pressão, vazão volumétrica) | Água aquecida, devem ser fornecidos a uma taxa de fluxo suficientemente elevado e com uma pressão suficiente para completamente circular. |
| Porta de amostragem | NA | Localizado perto de headspace é o ideal. |
| Armadilha espuma | Volume: 25% do volume do reactor | Balão de tubuladura lateral simples ou frascos de vidro podem ser usados. A unidade deve ser acessível para limpeza. |
| Scrubber sulfeto de hidrogênio | (Tempo de Contato Gás) | Vidro ou tubos de plástico devem ser usados (não metal). Dimensionamento de comprimento deve fornecer tempo de contato adequado de gás. |
| Reservatório de gás | Volume:> Volume 2x de Efluentes; Material: Semi-elástica (não rígida) | O volume deve ser superior a que foi tomada durante de efluenteshipócrita. O material deve permitir a retracção e de expansão. |
| Bubbler | NA | A pressão de cabeça fornecido pelo nível de água deve ser minimizada para limitar a acumulação de pressão no sistema de entrega de gás. |
| Contador de gás | (Gás Faixa de detecção de fluxo) | Os medidores de gás de plástico são preferíveis em relação metal. A faixa de detecção de gás de fluxo deve ser preciso em taxas de produção de biogás esperadas. |
Tabela 2. Auxiliares componentes de reatores com especificações e comentários.
r>| SINTOMA ERRO | POSSÍVEIS SOLUÇÕES |
| Entupimento freqüente de alimentação ou tubos de efluentes | • Use tubulação de maior diâmetro e / ou acessórios. • Reduzir o tamanho de partícula de substrato (por exemplo, usando um misturador ou peneira). • Mix alimentar com mais freqüência, enquanto a alimentação. • Certifique-se que o conteúdo do digestor são completamente misturados. |
| Excessiva formação de espuma | • Reduzir o ROL • Reduza a intensidade de mistura no digestor. • Aumentar o espaço superior no digestor através da redução do volume do digestor activo. |
| Rendimento de biogás inconsistente entre digestor replica | • Verificar se há fugas estão presentes no sistema de manuseamento do gás de qualquer digestor. • Verifique se o medidor de gás e elemento de aquecimento estão a funcionar correctamente e são calibrados. • Verifique se as misturas de alimentos são preparados de forma equivalente. |
| Inconsistente ou altamente variável concentração de sólidos em tele efluente entre digestor repetições (Fig. 6) | • Verifique se o conteúdo do digestor são bem misturado. • Certifique-se que o reator de linha efluente decantado é equivalente entre os reatores. |
| Conteúdo de metano reduzida em biogás | • Verificar se o pH está dentro da gama óptima para metanogênese (isto é, 6,5-8,2). Se não, completar com acidez ou alcalinidade, conforme apropriado. • Se for detectada significativa de nitrogênio no biogás (ou seja,> 10%), verificar se há vazamentos perto do porto de amostragem. • Regularizar a periodicidade de amostragem de biogás. • Verifique a que a concentração de AGV está dentro da gama óptima. Se não, siga os passos de resolução de problemas listados para cronicamente elevadas concentrações de ácidos graxos voláteis. |
| Cronicamente elevada concentração de ácido gordo volátil (Fig. 5) | • Reduzir a ROL. • Superar as deficiências de nutrientes ou metais traço por suplementação. • Verifique se o conteúdo do reator são selados contra a intrusão de oxigênio. • Aumente a freqüência de ciclo de alimentação. • Eliminar um curto-circuito hidráulico. • Superar a deficiência de alcalinidade pela suplementação. |
Tabela 3. Solução de problemas de protocolo para a operação do digestor.

Figura 1. Exemplo básico de projeto do reator: Corpo material de vidro; tubos de aço material inoxidável / alumínio; Tampa material PVC / acrílico.

Figura 2. Exemplo básico de projeto do reator tampa: Tampa material PVC / acrílico, peças-material de aço inoxidável / plástico; Tubulação material Aço Inoxidável / Alumínio.

Figura 3. Diagrama do sistema mostrando disposição dos componentes.
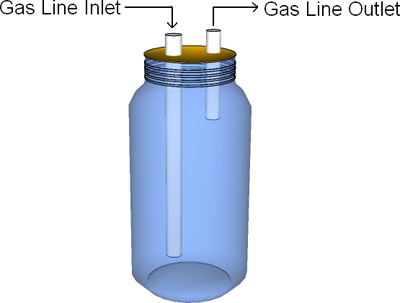
Figura 4. Exemplo básico de projeto de espuma armadilha: Jar-material plástico / vidro, tubo de material plástico-/ Vidro.

Figura 5. Resposta típica do sistema a uma taxa elevada carga orgânica (ROL) durante reator start-up. Começando com uma COV de 1,35 GVS-L -1 causou o acúmulo de ácidos graxos voláteis totais (TVFA). A acumulação de ácido cau sed uma diminuição do pH seguido por uma redução na produção de biogás. Com a diminuição do ROL para 1,15 g VS-dia -1, ambos os sistemas foram capazes de recuperar e estabelecer uma concentração de biomassa metanogênica suficiente para tolerar uma 1,35 GVS-L -1 ROL. A diferença de pH e acúmulo TVFA entre reatores apresenta as dinâmicas específicas de comunidades mistas.

A Figura 6 resposta típica do sistema para insuficiente de mistura (Reactor A) em comparação com um sistema suficientemente misto (Reactor B) Durante a mistura pobre, os sólidos assentam no fundo do reactor e não são removidos durante a decantação (dia 280 - 290)... Quando a mistura é retornado para a intensidade suficiente (dia 300), os sólidos acumulados são gradualmente removidos (dia 305 - 330), eo sistema volta para concentrações estáveis sólidos.
ig7.jpg "/>
Figura 7. Relação teórica entre a concentração de uma espécie química conservadoras e do período de retenção hidráulica (TRH) em um sistema CSTR ideal. Menos três Hrts a concentração real de uma espécie química [C] no digestor é de 95% da do inicial concentração presentes na alimentação [C 0].
Discussão
O sistema de digestão anaeróbia apresentada neste artigo fornece uma introdução geral e algumas orientações básicas para o tratamento da maioria dos substratos em um contexto experimental. A grande variedade de tipos de substrato, configurações do digestor, parâmetros de funcionamento, e também a ecologia única da comunidade misto-microbiana subjacente a estes sistemas se opõe delineando rígidos métricas quantitativas, que podem ser aplicados universalmente. Apesar de toda a variabilidade isso, todos os s...
Divulgações
Não há conflitos de interesse declarados.
Agradecimentos
Esta pesquisa é apoiada é suportado pelo USDA através do Instituto Nacional de Alimentação e Agricultura (Nifa), conceda número 2007-35504-05381; por concessão não. 58872 de NYSERDA e NYC-123444 através de fundos da Cornell University Estação Experimental Agrícola da fórmula federais do Nifa USDA.
Materiais
| Name | Company | Catalog Number | Comments |
| Equipamentos Reactor | Companhia | Número de catálogo | Comentários |
| Recirculador aquecida | VWR Scientific | 13271-063 VWR | Para utilização com um sistema de reactor de aquecimento revestimento |
| Elétricos de velocidade variável Lab Agitador | Cleveland Mixer Co. | (Modelo 5VB) | Este modelo de misturador facilita a montagem de um estande anel |
| Wet-Type Medidor de Gás de precisão | Ritter Gasmeters | (Modelo TG-01) | Este modelo necessita de um fluxo mínimo de (0,1 L / h) e pode lidar com um fluxo máximo de 30 L / h |
| Gás Bubbler | Chemglass | (Modelo AF-0513-20) | |
| Tubo de amostragem de gás | Chemglass | (Modelo CG-1808) | |
| impulsor axial | Lightnin ' | R04560-25 Cole-Parmer | Palhetas da turbina com 7,9375 milímetros diâmetro do furo |
| Eixo do impulsor | Grainger | 2EXC9 Grainger | 1,83 m em aço inoxidável com 7,9375 milímetros OD (precisa ser cortado para o tamanho apropriado) |
| Suporte Ferro Fundido Stands | Produtos americanos Educacionais | (Modelo 7-G16) | Para o misturador de montagem |
| Três pinos Pinça Extensão | Garra | 21572-803 VWR | Para o misturador de montagem |
| Titular Grampo regular | Garra | 21572-501 VWR | Para o misturador de montagem |
| Bomba peristáltica | Masterflex | WU-07523-80 Cole-Parmer | Para efluente decantado |
| L / S Cabeça bomba padrão | Masterflex | EW-07018-21 Cole-Parmer | Para decantar efluentesing acessório para bomba peristáltica |
| L / S de tubulação da bomba de precisão | Masterflex | EW-06508-18 Cole-Parmer | Por decantação de efluentes - acessório para bomba peristáltica |
| Equipamento de análise / Reagentes | Companhia | Número de catálogo | Comentários |
| Análise de pH | |||
| medidor de pH | Thermo Fisher Scientific - Orion | 1212000 | |
| Total e volátil Análise de Sólidos (Standard Methods: 2540-B, E) | |||
| Exsicador vácuo de vidro | Kimax | WU-06536-30 Cole-Parmer | |
| Porcelana evaporação Pratos | VWR | 89038-082 VWR | |
| Forno Lab | Thermo Fisher Scientific | (Modelo 13-246-516GAQ) | |
| Mufla Médio Câmara | Barnstead / Thermolyne | F6010 Thermo Scientific | |
| Análise de ácidos graxos voláteis (Standard Methods: 5560-C) | |||
| Grande Capacidade Centrífuga de Velocidade Variável | Sigma | WU-17451-00 Cole-Parmer | |
| Laboratório Hot Plate | Thermo Scientific | (Modelo HP53013A) | |
| Condensador Grande | Kemtech América | (Modelo C150190) | |
| Reagente ácido acético [CAS: 64-19-7] | Alfa Aesar | AA33252-AK | |
| Demanda Química de Oxigênio (Standard Methods: 5520-C) | |||
| Aquecedor Bloco COD | HACH | (Modelo DRB-200) | |
| Borosilicato tubos de cultura | Pyrex | (Modelo 9825-13) | |
| Reagente dicromato de potássio [CAS: 7778-50-9] | Performance Materials Avantor | 3090-01 | |
| Mercury Reagente Sulfato II [CAS: 7783-35-9] | Performance Materials Avantor | 2640-04 | |
| Indicador Ferroína Solution [CAS: 14634-91-4] | Ricca Química | R3140000-120C | |
| Amónio e de ferro (II) hexa-sulfato de [CAS: 7783-85-9] | Alfa Aesar | 13448-36 | |
| Composição de gás por cromatografia gasosa | |||
| Cromatógrafo de Gás | SRI Instruments | Modelo 8610C | Deve estar equipado com um detector de condutibilidade térmica (TCD), utilizando coluna abaixo mencionado e gás transportador operado a uma temperatura isotérmica de 105 ° C |
| Hélio Gás | Airgas | Ele HP300 | Para ser usado como gás de transporte |
| Packed Column- | Restek | 80484-800 | Para ser usado para N 2, CH 4, e CO 2 separação |
Referências
- Dague, R. R., McKinney, R. E., Pfeffer, J. T. Solids retention in anaerobic waste treatment systems. J. Water Pollut. Control Fed. 42, R29-R46 (1970).
- McCarty, P. L., Smith, D. P. Anaerobic wastewater treatment. Environ. Sci. Technol. 20, 1200-1206 (1986).
- Lettinga, G. Anaerobic digestion and wastewater treatment systems. Antonie Van Leeuwenhoek. 67, 3-28 (1995).
- De Baere, L. Anaerobic digestion of solid waste: state-of-the-art. Water Sci. Technol. 41, 283-290 (2000).
- Angenent, L. T., Karim, K., Al-Dahhan, M. H., Wrenn, B. A., Domínguez-Espinosa, R. Production of bioenergy and biochemicals from industrial and agricultural wastewater. Trends Biotechnol. 22, 477-485 (2004).
- Jewell, W. J., Cummings, R. J., Richards, B. K. Methane fermentation of energy crops - maximum conversion kinetics and in-situ biogas purification. Biomass & Bioenergy. 5, 261-278 (1993).
- Weiland, P. Biomass digestion in agriculture: A successful pathway for the energy production and waste treatment in Germany. Eng. Life Sci. 6, 302-309 (2006).
- Zaks, D. P. M. Contribution of anaerobic digesters to emissions mitigation and electricity generation under U.S. climate policy. Environ. Sci. Technol. 45, 6735-6742 (2011).
- Tchobanoglous, G., Burton, F. L., Stensel, H. D. . Wastewater Engineering, Treatment and Reuse: Metcalf & Eddy. , (2003).
- Speece, R. E. . Anaerobic Biotechnology for Industrial Wastewaters. , (1996).
- Kleerebezem, R., van Loosdrecht, M. C. M. Mixed culture biotechnology for bioenergy production. Curr. Opin. Biotechnol. 18, 207-212 (2007).
- Angenent, L. T., Wrenn, B. A., Wall, J., Harwood, C. S., Demain, A. L. Chp. 15. Bioenergy. , (2008).
- Werner, J. J. Bacterial community structures are unique and resilient in full-scale bioenergy systems. Proc. Natl. Acad. Sci. U.S.A. 108, 4158-4163 (2011).
- Holm-Nielsen, J. B., Al Seadi, T., Oleskowicz-Popiel, P. The future of anaerobic digestion and biogas utilization. Bioresour. Technol. 100, 5478-5484 (2009).
- Hoffmann, R. Effect of shear on performance and microbial ecology of completely-stirred anaerobic digesters treating animal manure. Biotechnol. Bioeng. 100, 38-48 (2008).
- Clesceri, L. S., Greenberg, A. E., Eaton, A. D. . Standard Methods for the Examination of Water and Wastewater. , (1998).
- Amani, T., Nosrati, M., Sreekrishnan, T. R. Anaerobic digestion from the viewpoint of microbiological, chemical, and operational aspects: a review. Environmental Reviews. 18, 255-278 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados