Method Article
Isolamento de precursor de células B subconjuntos de Sangue do Cordão Umbilical
Neste Artigo
Resumo
Aqui descrevemos um protocolo para o isolamento de subconjuntos de precursor células B do sangue do cordão umbilical. A quantidade e qualidade suficientes de ácidos nucleicos podem ser extraídos a partir das células e usadas em ensaios subsequentes utilizando DNA ou RNA.
Resumo
O sangue do cordão umbilical é altamente enriquecida para células progenitoras hematopoiéticas em estágios diferentes de autorização de linhagem. Nós desenvolvemos um protocolo para o isolamento de células B precursor em quatro diferentes fases de diferenciação. Porque os genes são expressos e modificações epigenéticas ocorrer de uma forma específica de tecido, que é vital para discriminar entre tecidos e tipos de células, a fim de ser capaz de identificar alterações no genoma e o epigenoma que podem levar ao desenvolvimento de doença. Este método pode ser adaptado a qualquer tipo de célula presente no sangue do cordão umbilical, em qualquer fase da diferenciação.
Este método compreende 4 passos principais. Primeiro, as células mononucleares foram separadas por centrifugação de densidade. Em segundo lugar, as células B são enriquecidas utilizando anticorpos conjugados com biotina que não reconhecem e remover as células B a partir de células mononucleares. Terceiros as células B são marcado por fluorescência, com anticorpos específicos de proteínas da superfície celular para as fases individuaisde desenvolvimento de células-B. Finalmente, as células marcadas por fluorescência são classificados e populações individuais são recuperados. As células são recuperadas da quantidade e qualidade suficiente para ser utilizado em ensaios de ácidos nucleicos a jusante.
Introdução
De modo a identificar aberrações que estão presentes em doenças, é de vital importância que usamos tecidos saudáveis ou células que correspondem ao tipo de tecido ou célula afectada pela doença. Uma razão para isso é que a variação epigenética entre tipos de tecidos é responsável por regular a expressão do gene e é crítica para a diferenciação celular durante 1,2 desenvolvimento humano normal. Uma segunda razão é que a regulação aberrante do tecido gene específico pode ter consequências para o desenvolvimento normal e é conhecida por contribuir para uma multiplicidade de estados de doença, incluindo o cancro. Assim, uma melhor compreensão de uma doença que envolve as células hematopoiéticas requer o conhecimento das células hematopoiéticas saudáveis.
O desenvolvimento de células hematopoiéticas em medula óssea o produto através de uma ordem sistemática dos acontecimentos caracterizadas por alterações na expressão de marcadores de superfície celular 3. Estudos envolvendo participantes adultos têmmostrado que a medula óssea contém normalmente um número baixo de células B precursor de 4,5, ao passo que estudos envolvendo participantes pediátricos demonstraram que a percentagem de células B precursor é relativamente elevada em indivíduos com menos de 5 anos de idade 6. O sangue do cordão umbilical é usado como uma fonte de células-tronco hematopoiéticas no tratamento de distúrbios relacionados com o sangue e as doenças malignas, está prontamente disponível através dos bancos de sangue de cordão e é enriquecido para B imaturas e células T 7, que são as células alvo de várias doenças, incluindo a leucemia e linfomas.
Precursor de células B na medula óssea têm sido extensivamente fenotipado 8,9 e pode ser definida pela presença de marcadores de células de superfície específicos que podem ser usados para classificar essas células em subconjuntos distintos. Normais de células B procede de diferenciação através de uma série de fases da medula óssea que começam com as primeiras células pró-B e culminando em imaturas ou células B naïve. Segundoa van ZELM e colegas 10, células pró-B são caracterizados pela presença de CD34 e na transição para a fase 2 (Pre-BI) CD19 é adquirido. Células Fase 3 (Pré-BII) já não expressam o CD34 e começam a expressar IgM citoplasmática. Por último, uma característica essencial da fase 4 (imaturo células B) é a expressão de IgM de superfície. A estratégia de triagem descrito no presente protocolo foi descrito pela primeira vez por Caldwell e colegas 6 e inclui a utilização de apenas três marcadores de superfície das células o que reduz significativamente a complexidade e o custo de realizar as experiências de triagem de células. No seu trabalho, uma relação entre o CD45 e os estágios de diferenciação de células B foi estabelecida. Eles observaram que as células B na medula óssea, exibem níveis variáveis de expressão de CD45. Especificamente, as células que expressavam níveis elevados de CD45 correspondendo a células que expressam IgM de superfície (células B imaturas), aqueles que expressaram um nível intermédio de CD45 correspondendo a células que expressavam cytoplasmic IgM (pré-BII células), e aqueles que expressaram baixos níveis de CD45 correspondendo a células que não expressaram IgM citoplasmática (pré-BI células). Este protocolo utiliza a estratégia desenvolvida por Caldwell e colegas 6 para isolar subconjuntos de precursor de células B a partir do sangue do cordão umbilical (Figura 1), que podem ser utilizados em ensaios a jusante que requerem ácidos nucleicos de elevada qualidade, tais como o ensaio de recuperação metilado CpG-island (MIRA ) 11 e quantitativos Os ensaios de PCR em tempo real. O método emprega uma separação inicial utilizando contas magnéticas para esgotar todas as células não-B do sangue do cordão umbilical e requer coloração com apenas 3 (anticorpos CD34, CD19 e CD45). As células que são recuperadas representam quatro estágios de diferenciação de células-B: 1) CD34 +; CD19 + (tarde) pro-B e no início pré-BI, 2) CD34 -, CD19 +; CD45 baixo (final pré-BI); 3) CD34 -, CD19 +; CD45 med (pré-BII) e 4) CD34 -; CD19 +; CD45 elevado (células B imaturas).
Protocolo
1. Isolamento de células mononucleares do sangue do cordão umbilical
- Preparar o tampão PBS-EDTA-se 5 ml de soro bovina solução de albumina (BSA) a 95 ml de tampão de lavagem (diluição de 1:20). Degas tampão e a manter o tampão no gelo IMPORTANTE:. Falha para desgaseificar o tampão pode resultar em menos do que os melhores resultados quando se isola CD19 + células-B, porque as bolhas podem bloquear a coluna de isolamento.
- Preparar 50 ml por tubos cónicos de centrifugação de gradiente de densidade. Determinar o número de tubos necessários para processar o sangue do cordão umbilical (um tubo pode processar 8 ml de sangue) e adicionar 15 ml de Ficoll-Paque PLUS para cada tubo.
- Diluir 8 ml de sangue de cordão, com 24 ml de DPBS (1X) e cuidadosamente a mistura da camada de sangue diluído cabo no topo do Ficoll-Paque PLUS em cada um dos tubos de 50 ml. Não misture o sangue e Ficoll-Paque PLUS IMPORTANTE:. Para evitar a mistura do sangue do cordão umbilical e Ficoll-Paque PLUS, manter o tubo em um ângulo de 45 graus emistura da camada do sangue lentamente.
- Centrifugar a 400 xg durante 40 min a 20 ° C. As células mononucleares (MNC) permanecerá no plasma-Ficoll-Paque PLUS de interface enquanto granulócitos e eritrócitos de sedimentos, devido à densidade mais elevada a uma pressão osmótica de Ficoll-Paque PLUS. Etiqueta sete de 5 ml de fundo redondo de tubos a serem utilizados na parte 3, com a data de amostragem ID, e o seguinte:
| Tubo | Etiqueta | Propósito |
| 1 | Imaculado | As células não coradas para citometria de fluxo durante a normalização |
| 2 | 7AAD | Para determinar a viabilidade de citometria de fluxo durante |
| 3 | + + + | Contém as células que serão classificados |
| 4 | 34 + | Para a coleta de células CD34 + / CD19 +(Tarde pró-B - início de pré-BI), as células |
| 5 | 45 baixo | Para a coleta de CD34 - / CD19 + / CD45 baixo (pré-BI), as células |
| 6 | 45 med | Para a coleta de CD34 - / CD19 + / CD45 med (pré-BII), as células |
| 7 | 45 de alta | Para a coleta de CD34 - / CD19 + / CD45 alta (B) células imaturas |
Casaco tubos 4, 5, 6, e 7 com 2% de FBS e colocar todos os tubos em gelo.
- Aspirar a camada de plasma superior com cuidado e evitar o contato com a camada de células mononucleares. Utilizando uma pipeta de vidro de 10 ml, transferir cuidadosamente a camada de células mononucleares de um novo tubo de 50 ml. Reúne-se as células mononucleares a partir de três tubos em conjunto dentro de um tubo simples 50 ml.
- Encher o tubo com PBS, mistura suavemente e centrifugar a 300 xg durante 10 min a20 ° C. Aspirar cuidadosamente o sobrenadante sem perturbar o sedimento celular. Repita 1x. Após a primeira lavagem, ressuspender as pastilhas e transferir para um tubo de 50 ml único cónico.
- Gentilmente ressuspender o sedimento de células em 200 ul de PBS. Remover 1 ml de suspensão de células, adicione-a 1 ml de PBS, num tubo de microcentrífuga de 1,5 ml e retiradas para contagem (contagem de células após a colocação da suspensão de células de 50 ml na centrífuga). Encher o tubo com PBS e centrifugar a 200 xg durante 15 min para remover as plaquetas. Remover o sobrenadante completamente sem perturbar o sedimento celular.
2. Modificado isolamento de células B a partir de células mononucleares utilizando a separação MACS
- Ressuspender o sedimento do passo 1.7 com 160 ul de frio (4 ° C) de tampão de EDTA-PBS.
- Adicionar 40 ul de B-CLL cocktail anticorpo biotina. Pipetar para misturar bem e incubar durante 10 min a 4 ° C.
- Lave as células - adicionar 1 ml frio (4 ° C) de tampão de EDTA-PBS por 10 milhões de células (células number determinado no passo 1.7) e centrifugar a 300 xg durante 10 min. Aspirar o sobrenadante completamente e, em seguida, voltar a suspender o sedimento de células em 320 ul de frio (4 ° C) de tampão de EDTA-PBS.
- Adicionar 80 ul de anti-biotina micropérolas, misturar bem e incubar durante 15 min a 4 ° C.
- Lave as células - adicionar 1 ml frio (4 ° C) de tampão de EDTA-PBS por 10 milhões de células e centrifugar a 300 xg durante 10 min. Ressuspender até 100 milhões de células em 500 uL de frio (4 ° C) de tampão de EDTA-PBS. Volume de tampão de acordo com a escala do número de células.
- Prepare MACS Colunas e Separadores de MACS durante a centrifugação (Passo 2.5). Colocar uma coluna LS no campo magnético do separador MACS, adicionar 3 ml de frio (4 ° C) de tampão PBS-EDTA sobre a coluna e permitir que o tampão para gotejar através da coluna. Use um recipiente para pegar o fluxo através. Descartar o fluxo através.
- Coloque um tubo cónico de 50 ml, abaixo da coluna e pipetar a suspensão de células na coluna. Permitir que as células não marcadas para gotejar through a coluna e para dentro do tubo cónico de 50 ml. IMPORTANTE: Estas são as células que irão ser utilizados para a rotulagem de anticorpos e separação de células. Não descarte o fluxo através. Para recuperar todas as células a partir do passo 2.5, adicionar 1 ml de uma adicional de frio (4 ° C) de tampão PBS-EDTA para as paredes do tubo cónico. Misturar suavemente e pipetar a suspensão de células remanescente na coluna. Repita 1x. Avance para o passo 2,8 utilizando as células não marcadas recolhidos no tubo cónico, depois de passar através da coluna.
- Encher o tubo cónico contendo células não marcadas com PBS e centrifugar a 300 xg durante 10 min. Cuidadosamente remover o sobrenadante sem perturbar o sedimento celular. Adicionar 200 ul de tampão PBS-EDTA e gentilmente ressuspender as células.
3. Rotulagem de anticorpos e Preparação para separação de células
- Aspirar 1 ul de suspensão de células e colocar num tubo rotulado "sem mancha" (Passo 1.4). Adicionar 500 de tampão de EDTA-PBS e armazenar o tubo em gelo.
- Adicionar 20ul de cada anticorpo (CD19, CD34 e CD45) por milhão de células em suspensão de células remanescente. Misturar bem e colocar o tubo no escuro durante 30 min à TA. Anticorpos CD são sensíveis à luz, execute as etapas 2-4 com as luzes apagadas.
- Após 30 min de incubação com os anticorpos, aspirar 40 ul da suspensão de células e colocá-lo no tubo rotulado "7AAD". Adicionar 1 ml de PBS para dentro do tubo e centrifugar a 500 xg durante 2 min. Remover o sobrenadante e ressuspender as células em 100 uL de tampão de ligação. Adicionar 7 uL de 7AAD (7-Aminoactinomycin D) e incubar no escuro durante 10 min à TA. Durante o passo de incubação de 10 min completa 3.4.
- Adicionar PBS para a parte superior do tubo contendo as células restantes marcadas com anticorpos de CD. Centrifuga-se o tubo a 500 xg durante 3 min. Remover o sobrenadante, adicionar 500 ul de tampão PBS-EDTA e ressuspender o sedimento celular. Transfira a totalidade do volume de suspensão de células no tubo rotulado "+ + +". A recuperação da totalidade da suspensão de células de umdd mais 1 ml de tampão de EDTA-PBS ao tubo cónico de 50 ml e de transferência para o tubo rotulado "+ + +".
- Após incubação (passo 3.3), adicionam-se 300 ul de tampão de ligação para dentro do tubo 7AAD. O "imaculada", "7AAD" e "+ + +" e as amostras de "34 +", "45 baixo", "45 med" e "altos" tubos 45 estão prontos para a citometria de fluxo.
4. A classificação de células usando o citómetro de fluxo MoFlo XDP
- Set-up MoFlo para classificação: Alinhar lasers; estabilizar fluxo de gotículas; determinar atraso gota.
- Prepare os controles de cor única compensação usando Invitrogen ABC Rato talão kit (ou similar) de acordo com as instruções do fabricante. Executar os controlos de cor individuais, ajustando as tensões dos canais de fluorescência para uma separação óptima das populações positivas e negativas. Definir coeficientes de compensação e aplicar parâmetro compensada para protocolo de coleta. Restabelece-se coeficientes de compensação de cada vez que um novo lote de anticorpo é obtido.
- Criar protocolo incluindo lotes como se mostra na Figura 2.
- Executar amostra sem manchas, definir tensão e ganho para dispersão de frente e de lado, e identificar negativos populações de fluorescência. Porque a recuperação do ADN é o objetivo do tipo, o limite deve ser definido baixa (≤ 1%), de forma que o DNA contendo detritos não contaminar as amostras recuperadas. * Certifique-se de que o sistema de evacuação Aerosol está funcionando em todos os momentos que vivem as células humanas estão sendo executados no MoFlo.
- Executar uma pequena alíquota de + + + de amostra (~ 50.000 eventos) para definir a estratégia gating (Figura 2). Porque os progenitores de células B não dispersam de forma idêntica para amadurecer as células B, o CD19 backgate ungated + / CD34 + na população do FSC vs SSC a assegurar a delimitação de linfócitos inclui potenciais células pró-B. A partir dessa amostra também definir a população negativo de fluorescência para 7AAD.
- Execute o exemplo 7AAD para determinar a viabilidade da amostra. Apenas as células de classificação a partir de uma amostra com alta viabilidade noinício (≥ 95%) como as células mortas vai manchar de forma indiscriminada e pode contaminar as populações de classificação.
- Configure decisões de classificação para coletar quatro populações: CD19 + / CD34 +; CD19 + / CD34 - / CD45 baixa; CD19 + / CD34 - / med CD45 e CD19 + / CD34 - / CD45 alta. Incluir o linfócito e portões discriminação doublet nas decisões de classificação de todas as populações.
- Para evitar obstruções na ponta de classificação, filtro + + + amostra através de um filtro de 40 um de células imediatamente antes da triagem e re-se qualquer filtro agregação ocorre na amostra durante a classificação.
- Classificar as células para dentro de tubos de recolha (Passo 1.4) revestidas com FBS a 2% em PBS, em um suporte do tubo arrefecido com gelo ou embalado.
- Imediatamente após a classificação é completada, extrair DNA.
Resultados
Entre a amostra variação desempenha um papel importante no sucesso do tipo de célula (Tabela 1). As amostras com boas taxas de sucesso têm baixos níveis de contaminação de detritos (Figura 3A) e as amostras com índices de sucesso pobres têm níveis elevados de resíduos contaminantes (Figura 3B). Entre a amostra de variação pode ser um pouco controlado, se a amostra de sangue do cordão foram recolhidos em 24 hr de embarque (O / N prioritário).
As células de fluxo classificados de cada precursor subconjunto de células B são da quantidade e qualidade suficientes para realizar isolamentos de ácido nucleico. O DNA isolado é de alta qualidade e podem ser usados em análises de jusante. Rotineiramente, utilizam este DNA em MIRA 11 para enriquecer para o ADN metilado (Figura 4).
| Cabo de Dados dos serviços de sangue | Ordenar pobres | Classificar Boa |
| Volume de sangue trabalhando com anticoagulante (ml) | 110 | 104 |
| White Blood Cells [10 3 / ul] | 8,68 | 11,19 |
| Linfócitos [10 3 / ul] | 3,88 | 3,76 |
| Linfócitos (%) | 44,70 | 33,6 |
| Os glóbulos vermelhos [10 6 / ul] | 3,65 | 3,05 |
| In-house Dados | ||
| Número de células depois de Ficoll-Paque | 206 M | 309 M |
| Número de células após separação MACS | 22 M | 16,5 M |
| Conde Eventos Total (MoFlo XDP) | 30,57 M | 19,97 M |
| Viabilidade (%) | 98,00 | 98,00 |
| As células em Portão de linfócitos (%) | 17,00 | 50,00 |
| CD19 + / CD34 + | ||
| Número total de células | 10959 | 48316 |
| % Do total de eventos | 0,04 | 0,24 |
| Eficiência | 88% | 88% |
| CD19 + / CD34 - / CD45 baixo | ||
| Número total de células | 16619 | 26941 |
| % Do total de eventos | 0,05 | 0,13 |
| Eficiência | 89% | 87% |
| CD19 + / CD34 - / CD45 med | ||
| Número total de células | 469745 | 507540 |
| % Do total de eventos | 1,54 | 2,54 |
| Eficiência | 89% | 89% |
| CD19 + / CD34 - / CD45 alto | ||
| Número total de células | 1896062 | 2047142 |
| % Do total de eventos | 6,2 | 10,25 |
| Eficiência | 91% | 90% |
Tabela 1. Estatísticas celulares representativas de classificação. Linhas 1-5 são contagens fornecidos pela facilidade de sangue do cordão umbilical. As linhas restantes são dados coletados em nosso laboratório. O tipo pobre continha altos níveis de detritos e uma baixa percentagem de células no portão de linfócitos.
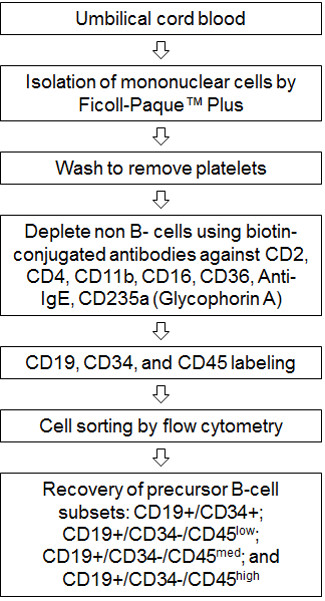
Figure 1. Fluxograma de processo. Sangue do cordão umbilical é processada e células mononucleares são isoladas usando Ficoll-Paque PLUS. Um passo de lavagem adicional é incluído para remover as plaquetas contaminantes. As células B são isolados a partir de células mononucleares utilizando o kit de isolamento de MACS da célula B humana (B-CLL). Este passo utiliza biotina-conjugados de anticorpos monoclonais (CD2, CD4, CD11b, CD36, anti-IgE e CD235a) para remover todas as células não-B. Os recuperadas células B são marcadas com CD19-APC, CD34-PE e CD45-FITC de anticorpos então classificados usando o citómetro de fluxo MoFlo XDP para recuperar precursores de células-B subconjuntos: CD19 + / CD34 +, CD19 + / CD34 - / CD45 baixa ; CD19 + / CD34 - / CD45 med, e CD19 + / CD34 - / CD45 alto.
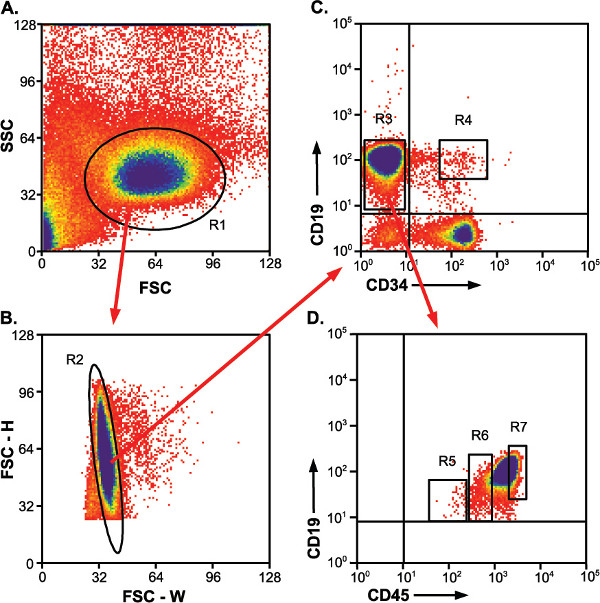
Figura 2. Estratégia de propagação para a identificação e classificação de populations. setas vermelhas indicam o portão que é aplicada a trama subseqüente. Portões R4, R5, R6 e R7 indicam populações classificados. A) Encaminhar vs enredo lado dispersão mostrando enriquecido população de linfócitos. Portão, R1 linfócitos. B) Altura vs largura de dispersão para a frente para a identificação de células individuais contra doublets. R2, de porta única célula. C) CD19-APC células positivas cair em populações de células CD34-PE positivo e negativo. R3, CD19 + / CD34 - portão; R4, CD19 + / CD34 + portão população indicando tipo desejado d) CD19 + / CD34 - as células se dividem em três um pouco distintas CD45-FITC populações.. R5 e R6, CD19 + / CD34 - / CD45 baixo e CD19 + / CD34 - / CD45 populações med, respectivamente. R7, por causa do número de células altas na CD19 + / CD34 - / CD45 população elevada, esta porta tipo engloba somenteuma parte da população. Todas as células dessa população não precisa ser coletadas para análises a jusante.
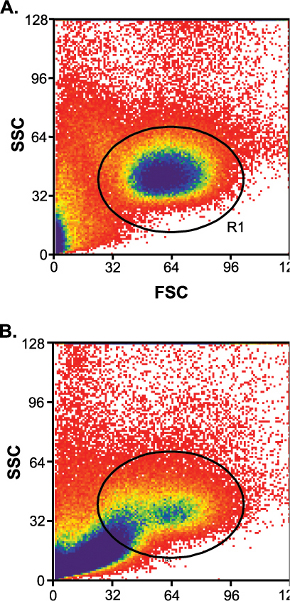
Figura 3 a.) Níveis baixos de contaminação detritos após o enriquecimento da coluna. R1, barreira linfocitária. B) níveis elevados de contaminantes detritos após o enriquecimento da coluna.
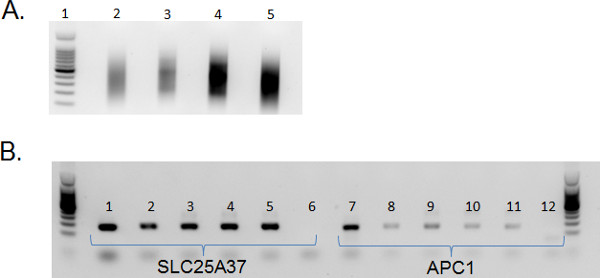
Figura 4. Enriquecimento de DNA metilado em subconjuntos de células-B precursor. Uma DNA) sonicado isolado a partir de precursores de células-B subconjuntos é de alta qualidade. Para a construção da biblioteca de ADN é sonicada a uma média de 200-600 bp. Pista 1: Promega 100 bp ladder (catálogo # G2101), Pista 2: O ADN total isolado a partir de células CD19 + / CD34 +, Pista 3: O ADN total isolado a partir de células CD19 + / CD34 - / CD45 células baixos; Pista 4: 100 ng de DNA isolado a partir de células CD19 + / CD34 - / CD45 células med; Pista 5: 100 ng de DNA isolado a partir de células CD19 + / CD34 - CD45 / células elevados. O DNA foi sonicado utilizando o Bioruptor Diagenode em alta durante um total de 9 min (30 seg ON; 30 seg OFF). O DNA foi purificado em coluna e visualizadas sobre um gel de agarose a 1% com SYBR green gel de ácido nucleico mancha. B) Após MIRA utilizando o Ultra ActivMotif MethylCollector kit, PCR com SLC25A37 (1-6) e APC1 (7-12) é realizada para confirmar enriquecimento de DNA metilado. 1 & 7: ADN genómico foi sonicada (não MIRA), 2 & 8: MIRA-CD19 + / CD34 DNA +, 3 & 9: MIRA-CD19 + / CD34 - / CD45 DNA baixo, 4 & 10: MIRA-CD19 + / CD34 - / CD45 med DNA; 5 & 11: MIRA -CD19 + / CD34 - / CD45 DNA alta; 6 e 12: controle de água. Maior amplificação de SLC25A37 confirma o enriquecimento do ADN metiladoem subconjuntos de células-B precursor.
Discussão
O factor de maior impacto sobre o sucesso do protocolo é a presença de contaminação de detritos. Se solicitando sangue a partir de um banco de sangue do cordão umbilical, é importante para que o sangue fornecido como logo após a colheita quanto possível. Além disso, as amostras classificadas como linfocitose conter um maior número de linfócitos, no entanto, estes exemplos não têm um número suficiente de células B precursor e não devem ser usados. Para aumentar a probabilidade de se obter um número suficiente de células para cada um dos subconjuntos precursores É aconselhável começar com, pelo menos, 85 ml de sangue de cordão umbilical.
É importante notar que, ao contrário dos adultos separações de sangue periférico, quando do fraccionamento de sangue de cordão umbilical a camada mononuclear é frequentemente contaminado com células vermelhas do sangue 12. Este protocolo inclui uma etapa de lavagem adicional para remover as plaquetas contaminantes. Protocolos descrevem separações mononucleares do sangue do cordão sugerem incluindo um passo de lise to Remover indesejadas células vermelhas. Não é recomendável este passo porque produz detritos contaminantes e tem um impacto negativo sobre o sucesso do tipo de célula.
A fim de reduzir o número de células que têm de ser distinguidos através de citometria de fluxo que é necessário realizar um enriquecimento de células B antes da separação de células. O protocolo fornecido pela Miltenyi Biotec, que acompanha o kit de isolamento de célula B (B-CLL), foi optimizado para o sangue periférico, e recomenda o uso de 10 ul de B-CLL cocktail de anticorpos de biotina por cada 10 milhões de células. Este passo utiliza anticorpos contra CD2 (células T, células NK), CD4 (células T), CD11b (granulócitos, monócitos, macrófagos), CD16 (células NK; macrófagos; mastócitos), CD36 (plaquetas), CD235a (células eritróides) para esgotar as células não-B a partir do sangue do cordão umbilical. É importante a utilização do kit descrito e não o isolamento de células B kit II porque o kit primeiro contém um anticorpo contra CD43, que está presente em células pró-B. Durante a nossa optimization deste protocolo, verificou-se que um total de 40 ul de B-CLL cocktail anticorpo biotina é suficiente para produzir um resultado positivo tipo de célula. Além disso verificou-se que usando tão pouco como 5 pi mais do cocktail de anticorpos B-CLL biotina tinha efeitos adversos sobre o tipo de célula. Portanto, é altamente recomendável usar 40 ul de B-CLL cocktail de anticorpos biotina para o total de número de células mononucleares entre 175-250000000. Se começar com números mais baixos ou mais altos de células pode ser necessário para escalar os reagentes em conformidade.
Há inúmeras publicações que descrevem conflitantes os marcadores que podem ser utilizados para distinguir sub-populações de células-B. A maior parte da discrepância pode ser explicada pelo facto de que a diferenciação é um processo contínuo e que a presença ou ausência de marcadores de superfície celular ocorre de forma gradual, em vez de numa maneira de tudo ou nada. Neste protocolo CD34 - / CD19 + e o nível de intensidade de CD45 + (expressão baixa, média e alta) foi utilizada para distinguir pré-BI, BII e pré-células B imaturas com um aumento no nível de expressão de CD45 correspondendo a progressão da diferenciação 6. Células pró-B, foram descritas por alguns como sendo CD19 + / CD34 + 13, enquanto outros têm mostrado que a pró-células B são CD19 - / CD34 + e células pré-BI são CD19 + / CD34 + 9,10. Com base nestas diferenças nós designamos os CD19 + / CD34 + como tardios células pró-B / BI iniciais pré-células. É importante notar que esta estratégia foi desenvolvida para isolar subconjuntos de precursor de células B que correspondem às células afectadas pela doença de leucemia linfoblástica aguda. No entanto, existem várias estratégias de triagem que podem ser empregues dependendo do subtipo de células de interesse.
Anticorpo-fluorocromo combinações devem ser selecionados com base nas capacidades do seleccionador de células disponíveis. Como génerosl regra, a mais brilhante fluorocromo no seu painel deve ser usado para rotular o antígeno menos populoso e vice-versa. Na detecção de dupla manchadas de populações, especialmente eventos raros, como estes, gibão discriminação (Figura 2B) é uma parte vital da estratégia de aquisição electrónica. Isto assegura que os eventos de duplo-positivas são as células coradas verdadeiramente único com ambos os anticorpos e não meramente duas single-coradas células aderidas umas às outras.
Alta velocidade, 4 vias de separação de células necessariamente cria um ambiente de aerossol controlada. Portanto, a classificação de células vivas humana deve ser feita com cautela. Diretrizes publicadas segurança e descontaminação estão disponíveis e devem ser revistos e aplicados antes de o tipo 14. Aprovação de Comitês Institucionais de Biossegurança ou seus equivalentes pode ser necessária antes da classificação. Para a descontaminação adequada após separação, lixívia deve ser adicionado ao recipiente de lixo para uma concentração final de 10%. Similarly, todos os tubos de amostras, bem como todas as superfícies na área imediata deve ser completamente descontaminado com uma solução de lixívia a 10%, recentemente feita.
Em resumo, este protocolo proporciona uma estratégia para a obtenção de populações raras de precursor de células B e pode ser modificada para isolar uma população rara presente no sangue de cordão, incluindo as células estaminais hematopoiéticas e as células T imaturas. Recentemente, células B imaturas foram identificados no sangue periférico de indivíduos com VIH avançada 15. Por conseguinte, a utilidade deste método ultrapassa o estudo dos cancros do sangue. Finalmente, não foram ainda realizados isolamentos de RNA nas células de fluxo classificados, no entanto, este método deve ser adaptável com a ressalva de que, durante a separação de células das células deve ser seleccionada directamente em Trizol ou uma solução equivalente de ARN compatível, tal como o kit de RLT RNeasy disponível através da Qiagen.
Divulgações
Autores têm nada a revelar.
Agradecimentos
Este trabalho foi financiado pelos Institutos Nacionais de Saúde (NCI R00 CA132784) para KT
Materiais
| Name | Company | Catalog Number | Comments |
| DPBS (1X) | Gibco by Life Technologies | 14190-144 | |
| Ficoll-Paque PLUS | GE Healthcare Bio-Sciences AB | 17-1440-03 | |
| LS Column | MACS Miltenyi Biotec | 130-042-401 | |
| MACS Multi Stand | MACS Miltenyi Biotec | 130-042-303 | |
| MidiMACS Separator | MACS Miltenyi Biotec | 130-042-302 | |
| B-Cell Isolation Kit (B CLL) | MACS Miltenyi Biotec | 130-093-660 | |
| Fetal Bovine Serum | ATLANTA Biologicals | S11195 | |
| Microcentrifuge tube (1.5 ml) | MIDSCI | SS1500 | |
| BD Pharmingen 7-AAD (7-Aminoactinomycin D) | BD Biosciences | 559763 | |
| DB Pharmingen APC Mouse Anti-Human CD19 | BD Biosciences | 555415 | |
| DB Pharmingen PE Mouse Anti-Human CD34 | BD Biosciences | 560941 | |
| CD45 FITC | BD Biosciences | 347463 | |
| autoMACS Rinsing Solution | MACS Miltenyi Biotec | 130-091-222 | |
| MACS BSA Stock Solution | MACS Miltenyi Biotec | 130-091-376 | |
| BD Falcon 5 ml Polystyrene Round-Bottom Tube | BD Biosciences | 352058 | |
| BD Falcon 50 ml Tube | BD Biosciences | 352098 | |
| PuraFlow Sheath Fluid, 8X | Beckman Coulter | CY30230 | |
| FlowCheck Alignment beads | Beckman Coulter | 6605359 | |
| Ultra Rainbow Alignment beads | Spherotech | URFP-30-2 | |
| ViroSafe Aerosol Evacuation Filter | Beckman Coulter | ML01330 | |
| ABC Mouse bead kit | Invitrogen | A-10344 | |
| 40 μm cell strainer | Fisher Scientific | 22363547 | |
| Fisher Scientific Hemocytometer | Fisher Scientific | 267110 | |
| Microscope | |||
| accuSpin Model 3R Benchtop Centrifuge | Fisher Scientific | 13-100-516 | |
| MoFlo XDP flow Cytometer | Beckman Coulter | ML99030 | |
| Aerosol Evacuation Unit | Beckman Coulter |
Referências
- Song, F., et al. Association of tissue-specific differentially methylated regions (TDMs) with differential gene expression. PNAS. 102 (9), 3336-3341 (2005).
- Ohgane, J., Yagi, S., Shiota, K. Epigenetics: The DNA methylation profile of tissue-dependent and differentially methylated regions in cells. Placenta. 29 (S), 29-35 (2008).
- Brown, G., et al. The sequential determination model of hematopoiesis. Trends Immunol. 28 (10), 442-448 (2007).
- Clark, P., et al. Lymphocyte subsets in normal bone marrow. Blood. 67 (6), 1600-1606 (1986).
- Loken, M. R., et al. Flow cytometric analysis of human bone marrow. II. Normal B lymphocyte development. Blood. 70 (5), 1316-1324 (1987).
- Caldwell, C. W., Poje, E., Helikson, M. A. B-cell precursors in normal pediatric bone marrow. American Journal of Clinical Pathology. 95 (6), 816-823 (1991).
- Tucci, A., et al. Are cord blood B cells functionally mature? Clin. Exp. Immunol. 84 (3), 389-394 (1991).
- Ghia, P., et al. Ordering of human bone marrow B lymphocyte precursors by single-cell polymerase chain reaction analyses of the rearrangement status of the immunoglobulin H and L chain gene loci. J. Exp. Med. 184, 2217-2219 (1996).
- Noordzij, J. G., et al. Composition of precursor B-cell compartment in bone marrow from patients with X-linked agammaglobulinemia compared with healthy children. Pediatric Research. 51 (2), 159-168 (2002).
- van Zelm, M. C., et al. Ig gene rearrangement steps are initiated in early human precursor B cell subsets and correlate with specific transcription factor expression. J. Immunol. 175 (9), 5912-5922 (2005).
- Rauch, T. A., Pfeifer, G. P. The MIRA method for DNA methylation analysis. Methods Mol. Biol. 507, 65-75 (2009).
- Kanof, E. M., et al. Isolation of whole mononuclear cells from peripheral blood and cord blood. Current Protocols in Immunology. , Suppl 19. 7.1.1-7.1.7 (1996).
- LeBien, T. W. Fates of human B-cell precursors. Blood. 96 (1), 9-23 (2000).
- Schmid, I., et al. International society for analytical cytology biosafety standard for sorting of unfixed cells. Cytometry A. 71 (6), 414-437 (2007).
- Malaspina, A., et al. Appearance of immature/transitional B cells in HIV-infected individuals with advanced disease: correlation with increased IL-7. PNAS. 103 (7), 2262-2267 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados