Method Article
Mielina Oligodendrocyte glicoproteína (MOG
Neste Artigo
Resumo
Encefalomielite autoimune experimental (EAE) é um modelo animal estabelecido de esclerose múltipla. C57BL / 6 são imunizados com mielina de oligodendrócitos glicoproteína (MOG) peptídeo 35-55 (MOG 35-55), o que resulta em uma paralisia flácida ascendente causada por células imunes autorreactivas no sistema nervoso central. Protocolos para indução e monitoramento de doenças serão discutidos.
Resumo
A esclerose múltipla é um distúrbio neuroinflamatória desmielinizante crónica do sistema nervoso central com uma componente neurodegenerativa forte. Embora a etiologia exacta da doença é ainda incerto, linfócitos T auto-reactivas são pensados para desempenhar um papel central na patofisiologia. Terapia MS é apenas parcialmente eficaz até o momento e os esforços de pesquisa continuam a expandir o nosso conhecimento sobre a fisiopatologia da doença e para desenvolver novas estratégias de tratamento. Encefalomielite autoimune experimental (EAE) é o modelo animal mais comum para MS partilha muitas características clínicas e fisiopatológicas. Há uma grande diversidade de modelos de EAE que refletem diferentes aspectos clínicos, imunológicos e histológicos de MS humanos. EAE induzida por ativamente em ratos é o modelo mais fácil induzida com resultados robustos e replicáveis. É especialmente indicado para investigar os efeitos de drogas ou de genes específicos, utilizando camundongos transgênicos desafiados por Neuroi auto-imunenflammation. Portanto, os ratinhos são imunizados com homogenatos do SNC ou péptidos de proteínas da mielina. Devido ao baixo potencial imunogénico destes péptidos, adjuvantes fortes são utilizados. EAE susceptibilidade e fenótipo depende do antigénio escolhido e roedor estirpe. C57BL / 6 são a tensão comumente usado para a construção de camundongo transgênico e responder entre outros, para mielina oligodendrócitos glicoproteína (MOG). O epitopo imunogénico MOG 35-55 é suspensa em adjuvante de Freund completo (CFA), antes da imunização e toxina da tosse convulsa é aplicado no dia da imunização e dois dias mais tarde. Ratos desenvolver um "clássico" EAE monofásica auto-limitada com ascendente paralisia flácida dentro de 9-14 dias após a imunização. Ratos são avaliados diariamente utilizando-se um sistema de pontuação clínica para 25-50 dias. São discutidas as considerações especiais para cuidar de animais com EAE, bem como aplicações potenciais e limitações deste modelo.
Introdução
A esclerose múltipla (EM) é uma doença desmielinizante inflamatória crónica do sistema nervoso central, em que a destruição de oligodendrócitos e neurónios resulta em sintomas clínicos heterogéneos e que se acumulam. MS é considerada como uma doença auto-imune protótipo do sistema nervoso central (SNC) e modelos animais têm sido desenvolvidos para lançar luz sobre a sua patogénese complexo. Além disso, as terapias actuais são apenas parcialmente eficazes e principalmente alvo a fase inflamatória da doença, enquanto a componente neurodegenerativa é, provavelmente, o maior desafio para futuras abordagens terapêuticas 1,2.
Embora a etiologia exacta da doença é ainda pouco claro, uma reacção auto-imune contra epitopos sobre a bainha de mielina dos axónios no SNC é assumido para provocar o aparecimento da doença. A desregulação do sistema imunológico, vulnerabilidade genética e fatores ambientais (por exemplo, infecções, vitamina D) Acredita-se queinfluenciar os aspectos centrais dos mecanismos fisiopatológicos da MS.
Três tipos diferentes de modelos animais atualmente estabelecido para a exploração de padrões patológicos de MS: modelos virais como o vírus da encefalomielite murina de Theiler (TMEV), os modelos induzidos por agentes tóxicos como cuprizone e, finalmente, diferentes variantes de encefalomielite autoimune experimental (EAE) 3, 4. Embora todos eles imitam características do MS, eles diferem enormemente em características patológicas subjacentes, como o envolvimento do sistema imunológico adaptativo. EAE é o modelo animal mais comum, uma vez que é especialmente útil para investigar as vias neuroinflamatórias e muitas vezes serve como um modelo de "prova de princípio" para a eficácia de novas estratégias de tratamento 5,6. A EAE pode ser induzida em muitos animais diferentes (por exemplo, ratos, ratazanas, miniswine, cobaias, frangos, ou primatas). No entanto, os ratos se tornaram mais amplamente utilizar espécies que é, pelo menos em parte devidopara a expansão repertório de transgênicos sofisticado ou camundongos knockout 7.
A patofisiologia da EAE é baseado na reacção do sistema imunitário contra antigénios específicos do cérebro. Esta reação provoca inflamação e destruição das estruturas contábeis antígeno, resultando em características neurológicas e patológicas que comparáveis aos observados em pacientes com EM. Três abordagens diferentes podem ser distinguidos: EAE induzida por ativamente (aEAE; imunização activa), passivamente transferida EAE (peae; transferência de células de um animal encefalitogénicas imunizados), e os modelos mais recentemente espontâneas EAE rato (SEAE), que permitem o estudo da auto-imune mecanismos sem manipulação exógena. O modelo mais simples é induzida em ratos aEAE rendendo em resultados rápidos e robustos. Este modelo é considerado como o "padrão ouro" de modelos animais neuroimunológicas por muitos pesquisadores da área 8.
Para a indução aEAE, o animalé imunizado com uma injecção subcutânea de uma emulsão que consiste no antigénio escolhido e completar adjuvantes de Freund (CFA), acompanhados por uma injecção intraperitoneal de toxina pertussis no dia da imunização e dois dias mais tarde. Por conseguinte, linfócitos T específicos da mielina T são activadas na periferia e migrar para o SNC através do-barreira hematoencefálica. Após a entrada no CNS, as células T são reactivadas por células apresentadoras de antigénios e do local em que se infiltram resultantes subsequente cascatas inflamatórias, o envolvimento de outras células, como monócitos ou macrófagos e, eventualmente, na desmielinização e morte celular axonal 9. Dependendo do protocolo de imunização e combinação da estirpe de ratinhos (por exemplo, ratinhos C57BL / 6, ratinhos SJL / J, Biozzi) e antigénio (por exemplo, glicoproteína oligodendrocítica de mielina (MOG), proteína básica de mielina (MBP), proteína proteolipidica de mielina (PLP)), a doença curso pode ter um curso progressivo ou recidivante aguda, crônica doença remitente.
C57BL / 6 tornaram-se a estirpe mais comumente usado para camundongos transgênicos construção e uma multidão crescente de nocaute ou camundongos transgênicos está disponível. Nós aqui descrever um protocolo para a imunização de camundongos C57BL / 6 com MOG 35-55 peptídeo 10, que resulta em uma EAE monofásico com os primeiros sintomas após 9-14 dias, a máxima da doença cerca de 3-5 dias após o início da doença e recuperação sintoma lenta e parcial ao longo dos próximos 10-20 dias. À medida que o potencial imunogénico de MOG 35-55 péptido por si só não é suficiente para induzir a doença, os adjuvantes, tais como CFA são necessárias. Supõe-se que os componentes do CFA activar fagócitos mononucleares induzindo a fagocitose destas moléculas e a secreção de citocinas. Isto resulta no prolongamento da presença de antigénios e um transporte mais eficiente destes para o sistema linfático. Indução de EAE é facilitada pela aplicação de toxina pertussis (PT) que tem entre outros sido sugerido para modulara barreira sangue-cérebro e o próprio 11 a resposta imunitária. Após a indução da doença, cuidados especiais devem ser tomados para a avaliação diária de ratos para os sintomas da doença.
Protocolo
1. Comentários Gerais para o Rato Experimentos
- Todos os experimentos com ratos devem ser realizados de acordo com as diretrizes da respectiva comissão cuidados com os animais institucional e uso.
- Mantenha os ratos em condições livres de patógenos e permitir-lhes ter acesso a comida e água ad libitum. Nota: É importante o uso de camundongos pareados por idade e sexo, em grupos experimentais porque a susceptibilidade à doença pode variar de acordo com idade e sexo.
- Dependendo das condições experimentais escolhidas, um grupo de controlo imunizado simulada pode ser considerada onde MOG 35-55 péptido é substituído por PBS sem antigénio ou um péptido nonencephalitogenic.
- Por favor, considere aspectos metodológicos antes experimentos iniciais (ver também abaixo). Recomendamos envolver um ou dois observadores cegos para EAE pontuação.
2. Preparação de MOG 35-55 Emulsão
- 200 ul de uma proporção de 1:1 de MOG 35-55 solução de peptídeo e CFA deve ser injetado a cada mouse. Há alguma perda da emulsão viscosa durante a preparação e injeção. Portanto, prepare-se 1,5-2x da quantidade necessária. Calcular o volume total da emulsão e divide-se por dois para as quantidades necessárias de solução de péptido tanto MOG 35-55 e CFA.
- Diluir MOG 35-55 liofilizado em ddH2O para uma concentração final de 2 mg / ml. Nós usamos geralmente 200 mg MOG 35-55 peptídeo por mouse. Esta quantidade está contida em 100 ul de solução-mãe. A solução de péptido deve ser armazenado a -20 ° C.
- Colocar o conteúdo de 1 frasco de Mycobacterium tuberculosis H37RA desidratado (100 mg) para um almofariz.
- Chão com almofariz e pilão para se obter um pó fino.
- Adicionar 10 ml de adjuvantes de Freund incompleto para se obter uma solução de estoque de 10 mg / ml de CFA, que pode ser armazenado a 4 ° C.
- Antes da imunização, diluir CFA solução estoque sagacidadeh IFA para uma concentração final de 2 mg / ml. Misturar bem antes de cada utilização para ressuspender o material particulado e considerar alguma perda de volume da solução viscosa durante as preparações experimentais.
- Mistura a 1:1 com MOG 35-55 solução de péptido até à concentração final de 1 mg / ml é atingida.
CUIDADO: morta pelo calor Mycobacterium tuberculosis estimula a resposta imune inata. Evitar a inalação, ingestão e contato com a pele e os olhos.
- Precool soluções no gelo.
- Desenha-se 1 ml de 2 mg / ml de CFA e 1 ml de 2 mg / ml de solução de MOG 35-55 em duas seringas de 2 ml. Calcular o número de seringas necessárias de acordo com o número de animais imunizados.
CUIDADO: Estritamente evitar costura durante a preparação de adjuvante, pois pode causar granulomas ou induzir reações auto-imunes. - Use uma cânula G 27 para o 35-55 solução MOG e uma cânula G 20 para CFA. Evite bolhas de ar e conectar ambas as seringas com pelorês-way-válvula.
- Enviar a emulsão a partir de uma seringa para a outra e misturar completamente durante pelo menos 10 minutos como uma boa emulsificação é um passo crítico. Near-fechar a três vias válvulas para apoiar emulsificação. A solução deve ser de cor branca, dura e viscosa, sem separação de fases.
- Emulsão pode ser armazenada durante vários dias antes da imunização. Espere pelo menos 30 minutos após a preparação das emulsões para observar se eles são estáveis. Antes da imunização, desenhar a solução para uma das duas seringas e conectar um G cânula 27.
- Desenha-se 1 ml de 2 mg / ml de CFA e 1 ml de 2 mg / ml de solução de MOG 35-55 em duas seringas de 2 ml. Calcular o número de seringas necessárias de acordo com o número de animais imunizados.
3. Preparação de toxina pertussis
- Diferentes quantidades de toxina da tosse convulsa pode ser encontrada na literatura, que depende também da via de administração (por exemplo, por via intravenosa ou intraperitoneal). O nosso laboratório utiliza 400 ng de toxina da tosse convulsa, em 200 ul de PBS por via intraperitoneal no dia da imunização e dois dias mais tarde. ATENÇÃO: A toxina pertussis tem muitos efeitos biológicos. Evitar a inalação, ingestão e contato com a pele e os olhos.
- Reconstituir 50 mg de toxina da tosse convulsa, em 500 ul de ddH2O para uma solução de estoque de 100 ug / ml. Armazenar a 4 ° C.
- Diluir 1:50 com PBS. 200 uL agora contêm 400 ng de PBS. Preparar a quantidade necessária de seringas e considerar um volume em excesso adicional de ~ 100 ul de cada cubo de agulha.
4. Animal Imunização
- Por favor, consulte a comissão de cuidados com os animais e uso institucional para a critérios específicos para a eutanásia necessário a curto prazo. Nosso laboratório utiliza breve narcotização com isoflurano, enquanto outros protocolos como injeção de cetamina / xilazina ou halothan também pode ser possível. Espere para anestesia e usar uma frente pitada pé dedo do pé para avaliar o nível de anestesia.
- Certifique-se de que a imunização é feita por uma pessoa experiente para minimizar a tensão para os animais e para assegurar a imunização óptima.
- Injectar 100 ul de antigen / CFA emulsão por via subcutânea em dois locais diferentes em cada flanco posterior. Certifique-se de que se forme um massa bulbosas sob a pele, que deve persistir durante todo o experimento.
- Injetar 200 mL de toxina pertussis intraperitonelly.
- Certifique-se de que os ratos individuais podem ser facilmente identificados por avaliação diária, por exemplo, marcações de cores sobre a base da cauda.
- Administrar uma segunda dose de toxina da tosse convulsa em dois dias após a imunização.
5. Monitoramento EAE
- Peso e escore clínico deve ser avaliado diariamente. O aparecimento de EAE geralmente correlaciona-se com a perda de peso, que pode ser utilizada como um indicador da actividade da doença. Consulte o cuidado com os animais institucional e usar comitê para predefinir critérios quando os ratos individuais têm de ser retirados dos experimentos. Isto deve ser considerado quando a perda de peso superior a 20% do peso corporal inicial, ou quando os sinais clínicos graves (EAE marcar 7 ou pior) ocorrer. Por favor, consulte o rediretrizes dentemente do respectivo comitê de cuidados com os animais e uso institucional para pontuação máxima permitida.
- Quando os ratos têm sintomas clínicos da EAE, é importante para garantir que a garrafa de água pode ainda ser atingido e que o alimento é colocado no chão da gaiola.
- Sintomas de pontuação diferentes pode ser usado. No nosso laboratório, numa escala de 0-10 é estabelecido.
| Grau | Sinal clínico | Comentário |
| 0 | Sem sinais clínicos | Marcha normal, os movimentos da cauda e pode ser levantado, cauda envolve em torno de um objeto redondo se do mouse é mantida na base da cauda |
| 1 | Cauda parcialmente mole | Marcha normal, ponta da cauda droops |
| 2 | Cauda Paralisado | Marcha normal, cauda droops |
| 3 | Paresia dos membros posteriores, movimentos descoordenados | Andar cambaleante, cauda manca, membros posteriores responder a beliscar |
| 4 | Um dos membros posteriores paralisados | Andar cambaleante, com uma traseira membro arrastando, cauda manca, um dos membros posteriores não responder a beliscar |
| 5 | Ambos os membros posteriores paralisados | Marcha descoordenada com as duas patas traseiras arrastando, cauda manca, ambos os membros posteriores não respondem a beliscar |
| 6 | Membros posteriores paralisados, fraqueza nos membros anteriores | Andar cambaleante com membros anteriores lutar para puxar o corpo, membros anteriores reflexo após beliscar, cauda manca |
| 7 | Membros posteriores paralisados, um membro anterior paralisado | Mouse não pode se mover, um membro anterior responde aos pés pitada, cauda manca |
| 8 | Membros posteriores paralisados, ambos os membros paralisados | Mouse não pode se mover, ambos os membros não respondem aos pés pitada, cauda manca |
| 9 | Moribundo | Nenhum movimento, respiração alterada |
| 10 | Morte |
Tabela 1. Sistema de pontuação clínica.
Resultados
Após a imunização, os murganhos têm de ser avaliados diariamente quanto a mudanças de peso e os sintomas clínicos. O início da doença é geralmente correlacionada com uma redução de peso, que pode começar 1-2 dias antes dos sintomas de EAE são visíveis. Os sinais clínicos da EAE geralmente começam entre os dias 9 e 14 de pós-imunização. Como as lesões são predominantemente localizadas na medula espinhal em MOG-EAE em camundongos C57BL / 6, eles geralmente desenvolvem sintomas predominantemente motoras em um caudal de padrão rostral. Uma imagem exemplificativa de um ratinho imunizado com sintomas de EAE (pontuação 6) é apresentada na Figura 1A. Alguns sintomas atípicos EAE também pode ocorrer como rolar de forma axial-rotativo, aparência corcunda ou hipersensibilidade que não são refletidas dentro da EAE clássico pontuação representado na Tabela 1. Como sintomas motores são a principal característica deste modelo, esta pontuação nos dá uma boa indicação da gravidade da doença. Sistemas de monitoramento diferentes (por exemplo, 0 -5 ou 0-6) e mais escores compostos complexos que avaliam diferentes déficits também foram publicados. Por favor note que os ratos com sintomas graves têm de ser retirados da experiência de acordo com o respectivo comité institucional de cuidados animais e uso. Ratos mostram recuperação parcial dos sintomas, geralmente ao longo dos próximos 10-20 dias. Um curso da doença representativa está representada na Figura 1B. Existem diferentes pontos de tempo durante EAE que são de interesse para avaliar parâmetros de resultados. Alguns ensaios típicos que podem ser encontrados estão descritos de forma muito breve. No máximo doença, os ratos podem ser avaliadas para a produção ou a proliferação de citocinas após restimulação de células imunes isoladas com MOG 35-55 peptídeo in vitro (teste de recordação MOG). As células imunes pode também ser isolado a partir do cérebro e espinal-medula de ratos com sintomas de EAE e tratados, por exemplo, por citometria de fluxo. A análise histológica de secções da espinal medula pode ser realizada a doença maximum para carga lesão e desmielinização, ao momento posterior aponta marcadores para neurodegeneração e morte celular neuronal pode ser do seu interesse.
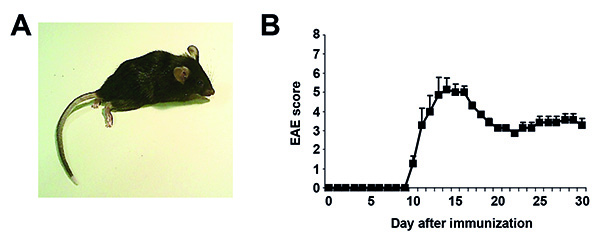
Figura 1. Resultados Representante EAE. A. imagem representativa de um imunizados C57BL / 6 rato com sintomas de EAE (EAE marcar 6) o curso da doença. B. Representante após a imunização de mais de 30 dias. Os dados são apresentados como média e erro padrão da média (n = 5). Clique aqui para ver a imagem ampliada .
Discussão
Uma multidão de diferentes modelos de EAE com protocolos de imunização activa foi descrito ao longo das últimas décadas. Enquanto os modelos de ratos têm sido amplamente utilizados até recentemente, os ratos são agora o organismo modelo mais popular para a pesquisa EAE. Este desenvolvimento é, entre outros, devido ao repertório amplo e cada vez maior de camundongos transgênicos disponíveis. A imunização de ratinhos C57BL / 6 com MOG 35-55 péptido é um dos modelos mais amplamente distribuído EAE e pode ser considerado como um modelo animal bem para uso confiável, replicável e. Em muitos laboratórios neuroimunológicas, MOG 35-55 EAE induzida é estabelecido como o modelo de escolha enquanto outros modelos EAE são usados para questões experimentais mais específicas.
Um ponto crítico a ser considerado é o planejamento das condições experimentais para assegurar que os experimentos são realizados EAE metodologicamente correta. Para a validade interna, marcando cego dos sintomas da doença é altamente recomendado. Expergrupos imental deve ser a idade, o peso, e os ratos-acompanhado sexo e devem ser distribuídos aleatoriamente em grupos de tratamento. Experimentos sempre deve ser realizado em conformidade com as normas de bem-estar animal. EAE estudos são muitas vezes de fraca potência e não levam em conta os erros estatísticos do tipo II. Por conseguinte, antes das experiências, os cálculos do tamanho da amostra deve ser realizada. Tamanhos de grupo necessárias dependem do tamanho esperado efeito. Consulta de um especialista para análise estatística pode ser considerado antes de iniciar experimentos EAE.
Algumas limitações do protocolo devem ser mantidos em mente. Mais importante ainda, a interpretação de dados aEAE é comprometida pelo modo de imunização com o uso de adjuvante e toxina da tosse convulsa que têm ambos influência adicional sobre a reacção imunológica. Também deve ser considerado que o modelo de EAE MOG 35-55 mostra, principalmente, uma célula CD4 + T dirigida resposta imunológica. As células T CD8 + e células B desempenhamum papel menos proeminente e protocolos alternativos devem ser considerados ao abordar esses tipos de células. O curso da doença é esperado aguda, monofásicos e auto-limitada. Alternativamente, um curso recorrente-remitente da doença também pode ser conseguida em modelos de EAE alternativos. Uma importante limitação adicional de que o protocolo é um certa tendência para o componente imunológico da fisiopatologia MS. Durante os últimos anos, tornou-se cada vez mais claro que a MS tem um componente forte neurodegenerativa. A morte de oligodendrócitos e neurônios resulta em um acúmulo progressivo de déficits neurológicos. Deve ser levado em conta que o modelo de EAE não pode ser totalmente adequados para abordar questões experimentais relativos aos mecanismos de inflamação neurodegenerativas autoimune. Modelos animais alternativos com foco na patologia do SNC pode ser considerado - por exemplo, o modelo cuprizone que compromete desmielinização tóxica, sem envolvimento do sistema imunológico periférico.
O protocolo descrito ser considerado como um modelo experimental neuroimunológicos básica e poderá ser modificada para outras aplicações. O procedimento experimental descrito acima pode ser facilmente aplicada a outros protocolos de EAE por estirpes de ratos ou variando o tipo e quantidade de proteína (por exemplo, usar PLP 139-151 péptido e SJL de EAE curso recorrente-remitente da doença, que é especialmente adequado para a avaliação da terapêutica efeitos sobre recidivas). O protocolo descrito pode também ser usado para as experiências de transferência adoptiva de EAE (passiva). Neste modelo, ratinhos C57BL / 6 são imunizados com MOG 35-55 péptido e CFA como descrito acima. Em contraste, a toxina da tosse convulsa não é necessária. Após 7-15 dias, baço ou nódulos linfáticos são isoladas e células do sistema imune são estimuladas de novo in vitro com MOG 35-55 péptido e várias citocinas antes de serem transferidos para um novo grupo de ratinhos C57BL/6se. Estes ratos receptores desenvolver EAE alguns dias mais cedo do que em cima de clasimunização Sical. condições in vitro podem ser variadas para questões imunológicas específicas (por exemplo, a polarização em T H 1 ou T H 17 células).
Às vezes, a incidência da doença baixa ou sintomas fracos pode ser um desafio experimental. Algumas recomendações para solução de problemas são:
- A severidade da doença pode variar com diferentes quantidades de péptido / rato.
- Concentração óptima CFA pode variar de 1-5 mg / ml. Considere-se uma titulação do CFA ao estabelecer os experimentos. Por favor, consulte as respectivas diretrizes da respectiva comissão cuidados com os animais institucional e uso para as concentrações de CFA permitidos como muitos regulamentos proíbem concentrações CFA superiores a 2 mg / ml.
- Diferentes métodos são descritos para a preparação da emulsão. Métodos alternativos, tais como a centrifugação durante 1 hora ou de ultra-sons pode ser considerada se pobre emulsificação é considerado como possibilifonte de erro le.
- Idade, sexo, estação do ano e das condições ambientais dentro das instalações dos animais são factores importantes que influenciam a susceptibilidade EAE. Deve assegurar-se que as condições são comparáveis entre experimentos independentes.
Como descrito acima, o protocolo mencionado pode ser utilizado como ponto de partida para as experiências de EAE adoptivos. Este modelo é especialmente adequado para a separação de efeitos periféricos e do sistema nervoso central de um fenótipo genético (por exemplo, por transferência de células encefalitogénicas knockout em ratinhos receptores de tipo selvagem) e por questões imunológicas específicas como o fenótipo das células transferidas podem ser completamente caracterizado. O mais recente desenvolvimento na pesquisa EAE durante os últimos anos são receptores de células T camundongos transgênicos. Esses camundongos desenvolvem sintomas EAE espontaneamente, sem influência externa contornando o problema da inoculação adjuvante. No entanto, este modelo requer grandes quantidades de animais para breeding a assegurar o tamanho dos grupos suficientes. Avaliação de ratinhos knockout requer cruzamento antes das experiências de EAE em contraste com aEAE. À medida que cada rato desenvolve sintomas da doença em um dia diferente, a avaliação de novas substâncias pode ser bastante complicado. Portanto, o valor do clássico aEAE para neuroimunológicos permanece incontestado.
Divulgações
Os autores declaram não haver interesses financeiros concorrentes.
Agradecimentos
Este trabalho foi apoiado pelo Centro Interdisciplinar de Pesquisa Clínica (IZKF) Münster (SEED 12/03, SB).
Materiais
| Name | Company | Catalog Number | Comments |
| Female C57BL/6 mice, age 10-12 weeks, ~20 g weight | e.g. Jackson Laboratory, Charles River | ||
| MOG35-55 (MEVGWYRSPFSRVVHLYRNGK) | e.g. Pepceuticals Ltd | Store at -20 °C | |
| Incomplete Freund’s adjuvant (IFA) | e.g. Sigma-Aldrich Co. | F5506 | Store at 4 °C |
| Syringes, 1 ml with 26 G 3/8 in needle | e.g. Becton Dickinson & Co. | 309625 | |
| Syringes, 2 ml | e.g. B. Braun | 7389 | |
| Needles, 25 G 5/8 in and 30 G 1/2 in | e.g. Becton Dickinson & Co., | 305122, 305106 | |
| Three way valve | e.g. B. Braun | 16494 C | |
| Pertussis toxin, lyophilized in buffer | Enzo Life Sciences Inc. | BML-G100 | Store at 4 °C |
| M. tuberculosis H37 RA | BD Difco | 231141 | Store at 4 °C |
Referências
- McFarland, H. F., Martin, R. Multiple sclerosis: a complicated picture of autoimmunity. Nat. Immunol. 8, 913-919 (2007).
- Wiendl, H. Neuroinflammation: the world is not enough. Curr. Opin. Neurol. 25, 302-305 (2012).
- vander Star, B. J., et al. In vitro and in vivo models of multiple sclerosis. CNS Neurol. Disord. Drug Targets. 11, 570-588 (2012).
- Pachner, A. R. Experimental models of multiple sclerosis. Curr. Opin. Neurol. 24, 291-299 (2011).
- Bittner, S., et al. The TASK1 channel inhibitor A293 shows efficacy in a mouse model of multiple sclerosis. Exp. Neurol. 238, 149-155 (2012).
- Handel, A. E., Lincoln, M. R., Ramagopalan, S. V. Of mice and men: experimental autoimmune encephalitis and multiple sclerosis. Eur. J. Clin. Invest. 41, 1254-1258 (2011).
- Krishnamoorthy, G., Wekerle, H. EAE: an immunologist's magic eye. Eur. J. Immunol. 39, 2031-2035 (2009).
- Stromnes, I. M., Goverman, J. M. Active induction of experimental allergic encephalomyelitis. Nat. Protoc. 1, 1810-1819 (2006).
- Fletcher, J. M., Lalor, S. J., Sweeney, C. M., Tubridy, N., Mills, K. H. T cells in multiple sclerosis and experimental autoimmune encephalomyelitis. Clin. Exp. Immunol. 162, 1-11 (2010).
- Mendel, I., Kerlero de Rosbo, N., Ben-Nun, A. A myelin oligodendrocyte glycoprotein peptide induces typical chronic experimental autoimmune encephalomyelitis in H-2b mice: fine specificity and T cell receptor V beta expression of encephalitogenic T cells. Eur. J. Immunol. 25, 1951-1959 (1995).
- Hofstetter, H. H., Shive, C. L., Forsthuber, T. G. Pertussis toxin modulates the immune response to neuroantigens injected in incomplete Freund's adjuvant: induction of Th1 cells and experimental autoimmune encephalomyelitis in the presence of high frequencies of Th2 cells. J. Immunol. 169, 117-125 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados