Method Article
Rato rombencéfalo
Neste Artigo
Resumo
Embrionárias neurônios nascem na zona ventricular do tubo neural, mas migrar para atingir metas adequadas. Branchiomotor Facial (FBM) neurônios são um modelo útil para estudar a migração neuronal. Este protocolo descreve o ex vivo cultura wholemount de hindbrains embrião de rato para investigar os mecanismos que regulam a migração FBM.
Resumo
Embrionárias neurônios nascem na zona ventricular do cérebro, mas, posteriormente, migrar para novos destinos para alcançar metas adequadas. Decifrando os sinais moleculares que cooperativamente guia de migração neuronal no cérebro embrionário, é importante entender como as redes neurais complexas formar que mais tarde suportar a vida pós-natal. Branchiomotor Facial (FBM) neurônios no cérebro posterior rato embrião migrar de rhombomere (r) 4 caudalmente para formar os núcleos faciais emparelhados na região R6-derivado do cérebro posterior. Aqui nós fornecemos um protocolo detalhado para wholemount ex vivo cultura de hindbrains embrião de rato adequados para investigar as vias de sinalização que regulam a migração FBM. Neste método, hindbrains de embriões de rato E11.5 são dissecados e cultivados em uma preparação de livro aberto em inserções de cultura de células durante 24 horas. Durante este tempo, os neurónios FBM migrar em direcção caudal r6 e podem ser expostas a anticorpos bloqueadores de função e pequena molecules nos meios de cultura ou grânulos carregados de heparina com as proteínas recombinantes para examinar funções para as vias de sinalização envolvidos em guiar a migração neuronal.
Introdução
Embrionárias neurônios nascem na zona ventricular do cérebro, mas, posteriormente, migrar para novos destinos para alcançar regiões-alvo apropriadas que estão localizados em uma grande distância. O posicionamento correto de corpos celulares neuronais em lugares apropriados ao longo dos eixos dorso-ventral e ântero-posterior do cérebro em desenvolvimento é essencial para a fiação correta, sobrevivência e função desses neurônios após a fase migratória 1-4. Similar aos mecanismos moleculares que controlam a orientação do axônio 5-7, conjuntos combinatória de sugestões atrativas e repulsivas são pensados para orientar os neurônios migram 1,8. No entanto, devido às interações de vários tipos de células, os sinais que controlam a migração neuronal têm sido menos estudada do que aqueles que estão envolvidos na orientação do axônio, que pode ser estudado célula autônoma. A parte posterior do cérebro em desenvolvimento de vertebrados tem sido utilizado em vários estudos recentes para compreender os mecanismos moleculares e celularesda migração neuronal, por exemplo, na garota, mouse e zebrafish 1-4,9. Este órgão contém vários tipos diferentes de neurônios, incluindo vários subtipos de precerebellar e neurônios motores 5,7,10,11.
Motorneuron hindbrain nascem na zona ventricular perto do floorplate, e se diferenciam em subconjuntos específicos de acordo com sua rhombomere de origem 1,12. O branchiomotor facial (FBM) neurônios são gerados no rhombomere (r) 4, na parte posterior do cérebro e estender seus axônios dorsal através de um ponto de saída r4 para o segundo arco branquial que inervam os músculos faciais 2,9,13. Neurónios MRF de peixe-zebra e ratinhos proporcionam excelentes modelos para o estudo dos mecanismos moleculares e celulares de migração neuronal num processo que é facilmente visualizada, porque estes neurónios reprodutivelmente translocam o seu somata num processo espaçotemporalmente bem definida. Em camundongos, os neurônios FBM primeiro migrar caudally através de R5 e, em seguida, tanto caudal e ventralmente para chegar a sua posição final sobre o lado pial do cérebro posterior, no território de r6, onde formam os núcleos emparelhados do nervo craniano VII (VIIn) 10,11,14. No peixe-zebra, os neurónios FBM inicialmente migrar ventral e depois mudar de direcção no limite r4-r5 para continuar a migrar para a superfície pial em uma maneira dependente da laminina 4,12,15,16. Esta migração continua ao longo de um período de vários dias em desenvolvimento e pode ser dividido em fases de migração tangencial e radial, permitindo a identificação de moléculas que medeiam estes dois processos distintos. Em contraste, os neurônios FBM da garota hindbrain embrionárias permanecem em r4 3,13,17-19.
Durante a migração, os neurônios FBM podem ser identificados, como outros tipos ou neurônios motores, através de sua expressão do fator de transcrição homoeodomain ilhota 1 (ISL1) 14. Assim, wholimunofluorescência emount ou hibridação in situ para este marcador, em diferentes estágios de desenvolvimento revela o fluxo migratório distinto de FBM somata que se estende desde a r4 r6 no peixe-zebra ou rato 4,15,16. Além disso, repórteres fluorescentes, tais como transgénicos ISL1-GFP foram usados como ferramentas adequadas para visualizar a migração neurónios de MRF no peixe-zebra 3,17-19. Além de sua adequação para a imagem latente, muitos pesquisadores têm estudado a migração dos neurônios FBM no desenvolvimento do peixe-zebra, porque seus embriões de vida livre pode ser manipulado facilmente com as técnicas de transplante de células e compostos farmacológicos aplicados diretamente na água do aquário. Em contraste, o embrião de rato desenvolve fechado no útero, impedindo a implantação de grânulos que transportam sinais de orientação ou a administração de anticorpos bloqueadores de função que não atravessam a barreira placentária. Além disso, compostos farmacológicos administrados à mãe grávida pode ter unefeitos colaterais desejados que podem indiretamente prejudicar a embriogênese. Contornar essa limitação, desenvolvemos um método de cultura ex vivo para mouse hindbrain todo que é compatível com a migração FBM neurônio e sobrevivência de 24 horas após o explante 7,16. Este método permite uma manipulação fácil farmacológico, o implante de grânulos que transportam sinais de orientação ou a administração de anticorpos bloqueadores de função e também pode ser adaptado para estudar a migração de outros subtipos neuronais no cérebro posterior, em diferentes estádios de desenvolvimento.
Protocolo
1. Opcional: Prepare Affi-gel heparina Beads (gel de Contas) para FBM Ensaio atração
Nota: Preparar grânulos de gel pelo menos 1 dia antes de iniciar o procedimento de explante.
- Lavar 100 ul da suspensão de esferas de gel de heparina com PBS esterilizado durante 20 min num rolo à temperatura ambiente (RT).
- Grânulos de pellets em uma centrífuga de topo de mesa durante 5 min a 13.000 x g. Adicionar PBS estéril e repita o procedimento de lavagem de 4x.
- Após a lavagem final, retirar PBS e embeber os grânulos em um pequeno volume de uma solução estéril contendo a proteína recombinante de escolha, tendo o cuidado de cobrir as pérolas com a solução. Este protocolo utiliza 100 VEGF165 humano recombinante ng / mL em PBS, para reproduzir uma experiência publicada anteriormente 16.
- Incubar as pérolas de gel de heparina, com a solução de proteína recombinante para um mínimo de 12 horas e um período máximo de 1 semana, de um rolo, a 4 ° C.
2. Revestimento de Cultura Inserts
Explantes rombencéfalo são cultivadas em cultura Corning insere com um tamanho de poro de 8 mM, ou inserções equivalentes. Inserções de cultura pode ser reutilizada depois de completado o protocolo, desde que sejam lavados com água destilada, esterilizada com etanol, e armazenada em etanol a 70% até ser necessário.
NOTA: As etapas a seguir devem ser realizadas numa câmara de fluxo em condições de esterilidade.
- Preparar meios de cultura de explante que consiste em meio Neurobasal suplementado com B27 (20 ul / ml), glicose (6 mg / ml) e penicilina / estreptomicina (5 mg / mL).
- Cultura de lavagem insere com PBS estéril durante 5 minutos e seco durante 5-10 minutos, sob a câmara de fluxo.
- Coloque uma inserção de cultura em cada poço individual de uma placa 12well. Nota: inserções pode precisar de um pequeno empurrão para se encaixar bem no poço.
- Cobrir as inserções de cultura com 10-20 ug / ml de laminina rato em meio Neurobasal e colocá-los numa incubadora de cultura de tecidos (37 ° C, 5% de CO 2) durante 1 hora. Nota: revestimento deve ser realizado no dia de explante.
3. Dissecção da Hindbrains de E11.5 embriões de camundongos
- Cull cronometrado rato fêmea grávida de um procedimento eticamente aprovado no dia embrionário (E) 11,5 e colocar o útero contendo os embriões em um prato de plástico 100 milímetros com meio L15 gelada.
NOTA: Todas as etapas de dissecção deve ser realizada em L15 gelada. - Usando um microscópio de dissecação e Dumont relojoeiro fórceps número 5, rasgar a parede do músculo uterino para expor os embriões, libertar cada embrião, cortar o cordão umbilical, e cuidadosamente remover o saco vitelino.
- Utilizando uma pipeta de Pasteur de plástico, com uma abertura grande calibre, transferir cada embrião para um prato de plástico limpo com L15 gelado.
- Utilizando uma pinça Dumont, decapitar o embrião logo acima dos membros anteriores. Se a experiência requer genotipagem dos embriões, recolher amostras de tecido para isolamento de ADN genómico (por exemplo, uma pequena piece do saco vitelino ou ponta da cauda 16,20).
- Vire o lado dorsal da cabeça para cima e identificar o 4 º ventrículo, que é coberto por uma camada de tecido fino (Figura 2B). Perfurar cuidadosamente o roofplate e começam a descascar afastado caudalmente ao longo da linha média sobre o cérebro posterior posterior e da medula espinhal, e rostralmente sobre o mesencéfalo. A parte posterior do cérebro deve agora ser exposto (Figura 2C).
- Importunar com cuidado todo mesenchyme cabeça restante e qualquer meninges, que são ligados ao lado pial do cérebro posterior (Figura 2D).
- Remover tecido da medula espinhal e do mesencéfalo para que o cérebro posterior se desenrola e pode ficar na posição horizontal em uma preparação de livro aberto (Figura 2E).
- Usando uma vasta de Pasteur de plástico pipeta, transferir cada rombencéfalo dissecados para uma placa de 12 poços contendo gelada L15 e armazená-los em gelo até que todos os hindbrains foram dissecados.
- Usando uma grande calibre Pasteur de plástico pipeta, transferir um pecadogle hindbrain a um prato vazio, mantendo-se uma preparação livro aberto, o lado ventricular-se, em uma gota de aproximadamente 100 l L15.
- Transferir alguns microlitros de pérolas de gel de heparina incubadas à mesma gota. Nota: Como os tamanhos de contas são variáveis, é aconselhável transferir cerca de 10 contas e, em seguida, escolher um tamanho ideal para o transplante na parte posterior do cérebro.
- Fazer uma pequena lágrima no tecido do cérebro posterior e inseri cuidadosamente 1-3 contas de gel para o tecido rombencéfalo no nível de R5 / 6, a cerca de meio caminho entre a linha central e a borda lateral da parte posterior do cérebro, reduzindo-os para dentro do tecido de modo que o talão está posicionado logo abaixo da superfície hindbrain.
NOTA: O procedimento de dissecção pode levar entre 5-20 min / hindbrain, dependendo da experiência, e pode se estender por um longo período se ninhadas são grandes, em qualquer caso, hindbrains deve estar em cultura não mais do que 3 horas post-mortem para o bem resultados.
4. HindbrainExplante Cultura
- Remova a placa contendo as inserções de cultura do incubador, aspirar a solução de revestimento de laminina.
- Coloque uma lâmina de cultura em um prato de cultura separada cheio de gelada L15 e, usando uma grande calibre plástico Pasteur pipeta, transferir cada lado ventral hindbrain cima sobre a inserção da cultura (Figura 2G). O cérebro posterior deve ficar completamente plana na membrana de inserção.
- Levante cuidadosamente a inserção da cultura do prato e dab-lo várias vezes em um papel absorvente limpo para remover o excesso de líquido. Este processo assegura que a parte posterior do cérebro adere à inserção de cultura em, uma preparação plana livro aberto. Se o cérebro posterior enrola, seu tecido pode irreversivelmente crescer juntos.
- Preencha o original 12 poços placa com 500 mL meio de cultura pré-aquecido e coloque a pastilha de volta a este bem. Ajustar cuidadosamente o volume com outro 400-600 ul de meios para cobrir apenas a parte posterior do cérebro, assegurando que a parte posterior do cérebro não flutuarfora da membrana. Se ele flutua, volte ao passo 4.4 e repetir até que a parte posterior do cérebro permanece ligado à membrana.
- Nesta fase, é possível adicionar inibidores biológicos de interesse para a mídia para estudar seu efeito sobre a migração dos neurônios FBM.
NOTA: Se a implantação de contas ou administrar outros tratamentos, recomenda-se manter pelo menos dois explantes de controle em condições normais de crescimento por experimento para garantir que o experimento foi criado com sucesso. - Incubar explantes de 24-30 horas numa incubadora de cultura de tecidos (37 ° C, 5% CO 2).
5. Wholemount Immunofluorescent Coloração de rombencéfalo explantes
- Aspirar o meio de cada poço, enxaguar em PBS e fixar durante 2 horas a 4 ° C com agitação suave em gelo frio 4% de formaldeído (paraformaldeído a 4% dissolvido em PBS preparado de fresco ou recentemente descongelado). Nota: Não tente remover hindbrain a partir da inserção da cultura antes da fixaçãoestá completo.
- Lavar 3x com PBS. Retire cuidadosamente as hindbrains das inserções de cultura, utilizando fórceps Dumont. Alguns explantes são difíceis de descascar, mas geralmente pode ser levantado através da aplicação de uma leve pressão através expulsando repetidamente PBS a partir de uma pipeta.
- Transfira os hindbrains para 2,0 ml tubos de fundo redondo para a rotulagem de imunofluorescência. Permeabilizar hindbrains durante 30 minutos à temperatura ambiente (TA) em PBS contendo 0,1% Triton X-100 (PBT) com rolamento suave.
- Incubar durante 1 hora à temperatura ambiente em PBT contendo 10% inactivado por calor soro normal de cabra com rolamento suave.
- Incubar explantes com rolamento suave a 4 ° C durante 5 dias, com o anticorpo primário específico para ISL1, diluído a 1:100 em PBT contendo 1% de soro normal de cabra inactivado pelo calor.
- Lave os explantes em RT 4x com PBT durante 15 min cada.
- Incubar explantes com rolamento suave à temperatura ambiente durante 3 horas com cabra fluoróforo conjugado anticorpo anti-rato (por exemplo, Alexa Fluor 488 cabra antirato, diluída a 1:200) em PBT contendo 1% de soro normal de cabra inactivado pelo calor.
- Lave os explantes 4x no RT com PBT de 15 min cada um com rolamento suave.
- Pós-fixarem os explantes em formaldeído a 4% durante 30 min à temperatura ambiente.
- Cubra uma lâmina de vidro com 3 camadas de fita isolante preta e impostos especiais de consumo com um bisturi um pequeno quadrado da fita em camadas para criar um bolso para os explantes, alternativamente, use uma lâmina de vidro da depressão.
- Monte cada hindbrain em reagente SlowFade em um bolso e cobrir com uma lamela de vidro, evitando cuidadosamente a bolhas de ar armadilha e imagem usando um microscópio de varredura a laser confocal.
NOTA: Como uma alternativa para a imunocoloração, hibridação in situ com ribossondas que reconhecem FBMS (isto é, ISL1 ou PHOX2B) pode ser usado para visualizar os neurónios FBM 16,21.
Resumo dos passos e temporização
Cronometrado acasalamento obter gravidezes E11.25: ~ 14 dias
Opcional: Bead preparação (Protocol 1): ~ 2 horas, no dia antes do isolamento do embrião
Prepare inserções de cultura e mídia (Protocolo 2): ~ 30 min, antes do isolamento do embrião
Isolamento de embriões e dissecção hindbrain (passos 3,1-3,4): ~ 10 min / embrião
Dissecção rombencéfalo (passos 3,5-3,7): ~ 5-10 min / hindbrain
Procedimento explante (passos 3,8-3,9): ~ 5-10 min / hindbrain
Opcional: implantação talão (passos 3,10-3,11): ~ 5-10 min / hindbrain
Cultura explante (passo 4.7): 24 horas
Fixação para coloração de anticorpos (passo 5.1): 2 horas
Processo de coloração e de imagem (Protocolo 5): 5 dias
Resultados
Esta seção ilustra exemplos de resultados que podem ser obtidos através do estudo de migração neuronal FBM na parte posterior do cérebro do rato através ex vivo da cultura. Mostramos que os neurônios FBM em hindbrains explante a partir de dia 11 embriões de camundongos primeiro passar por uma migração tangencial (Figura 3A) e, em seguida, começar a montar o núcleo motor do facial (Figura 3B), similar ao seu comportamento no útero (veja a Figura 1). Demonstramos ainda que a implantação de um talão embebido-VEGF165 atrai neurónios FBM (Figuras 3C e 3D), como anteriormente mostrado 16. Importante, este protocolo permite estudar a migração FBM na ausência de vasos sanguíneos ou factores derivados de vasos que podem influenciar a migração FBM no útero, pois a vasculatura nonperfused degenera em cultura 16. Assim, a rotulagem de glóbulos inespecíficas observadas quando se utiliza o anticorpo ISL1 mouse no recém-isolados de rato hindbrains (Figura 1) não está mais presente no tecido hindbrain após 24 horas em cultura (Figuras 3A-F). Finalmente, vamos mostrar dois exemplos de hindbrains que não foram explantados corretamente e, portanto, contêm neurônios FBM em uma distribuição anormal, seja porque a parte posterior do cérebro não foi retirada logo após o isolamento do embrião (Figura 3E), ou porque o tecido hindbrain dobrado no transwell ( Figura 3F).
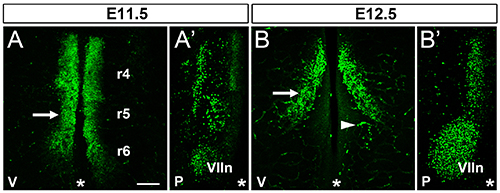
Figura 1. FBM migração neuronal confocal z-stack de hindbrains wildtype mouse depois ISL1 imunomarcação wholemount e flatmounting;.. Linha média hindbrain é indicado com um asterisco em todos os painéis (A) superfície ventricular de um hindbrain E11.5 no área de neurónios contendo FBM ISL1-positiva (setas), demonstrando assim a sua migração tangencial de R4 a R6;. da posição de R4, R5 e R6 é indicada (A ') Pial superfície de uma metade da mesma parte posterior do cérebro na área que contém o primórdio de um dos núcleos de MRF emparelhados (indicados com VIIn), bem como de outras populações de neurónios ISL1-positivo (B) da superfície de uma parte posterior do cérebro ventricular E12.5 FBM contendo neurónios que estão de migrar tangencialmente (seta);. da ponta de seta indicam um exemplo de um vaso sanguíneo que contém células circulantes que são não especificamente marcadas pela reacção cruzada do anticorpo secundário anti-rato para detectar o anticorpo IgG de ratinho ISL1. (B ') Pial superfície de uma metade do mesmo rombencéfalo E12.5, que contém um dos núcleos de MRF emparelhados. A linha média é indicado com um asterisco em cada painel. Barra de escala (todos os painéis): 200 m. V, ventral; P, pial./ 51397fig1highres.jpg "target =" _blank "> Clique aqui para ver imagem ampliada.
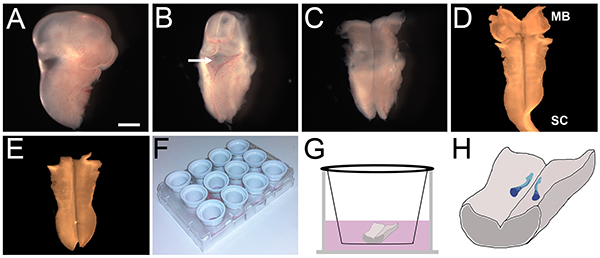
Figura 2. E11.5 rato hindbrain dissecção e ex vivo da cultura. (A) Cabeça de 1 mm da embrião depois que ele foi cortado do restante do embrião ao nível dos membros anteriores (B) A parte rostral do: barra de escala, (AE) As principais etapas no protocolo de dissecção E11.5 hindbrain.. cabeça foi removida e o resto do tecido cabeça posicionada de modo que a 4 º ventrículo (seta) foi orientada para cima. (C) A cobertura do 4 º ventrículo foi descascada, e a parte posterior do cérebro foi exposta por descamação do tecido sob o rombencéfalo distância rostral e caudal. (D) A membrana pial foi removido (note que neste examplo, alguns medula espinhal cervical (SC) de tecido permaneceu ligada à parte posterior do cérebro). de (E) O excesso de mesencéfalo (MB) e espinal medula (SC) do tecido foi removida para reter apenas a parte posterior do cérebro. (inserções F) de cultura foram revestidas com laminina e colocado em uma placa de cultura de tecido de 12 também. (G) Cada hindbrain foi colocado sobre uma pastilha e coberto com a mídia. (H) Representação esquemática do caminho percorrido pela migração de neurônios FBM (azuis), durante 24 horas de cultura. Clique aqui para ver a imagem maior.

Figura 3. Rato hindbrain ex vivo da cultura. (A, B) Uma rombencéfalo E11.5 foi cultivada durante 24 horas e immunofluoresc temente marcado para ISL1 para ilustrar a migração neurónio FBM num explante; tanto ventricular (A) e (B) pial os lados da parte posterior do cérebro são mostrados (C, D) da mesma ninhada hindbrains E11.5 foram cultivadas na presença de heparina implantado talão encharcado. em PBS (C) ou VEGF165 (D); notar que os neurónios FBM migraram em direcção e para o talão de VEGF165, e, portanto, o fluxo de migração mais alargado caudal comparado com o lado não tratado do mesmo rombencéfalo ou a parte posterior do cérebro contendo o talão de controlo (E. , F) Exemplos de explantes insatisfatórios E11.5 rombencéfalo, em que FBMS não emigraram a partir de r4 (E), ou em que o tecido hindbrain dobrado durante a cultura (F). A linha média é indicado com um asterisco em cada painel. Barra de escala (para todos os painéis): 200 um. V, ventral; P, pial."> Clique aqui para ver imagem ampliada.
Discussão
Este protocolo descreve a cultura de wholemount hindbrains E11.5 de rato em um transwell sistema para estudar a migração de neurónios FBM. Este protocolo permite neurónios motores rato rombencéfalo para ser mantido vivo e migrando para um período de 24 horas, permitindo a manipulação ex vivo. Este método tem inúmeras vantagens experimentais para os investigadores procuram identificar os mecanismos moleculares e celulares da migração neuronal. Considerando que os ensaios de migração tradicionais explante pequenos pedaços de tecido neural em matriz em placas de cultura e permite a observação de neurónios individuais, que respondem a estímulos exógenos, uma grande vantagem do ensaio transwell é a sua aptidão para manipular neurónios migram dentro do ambiente órgão hospedeiro e, portanto, uma maior contexto fisiológico. Importante, as substâncias podem ser facilmente aplicados aos ex vivo romboencéfalo explantes para testar o seu efeito na migração neuronal, evitando possíveis efeitos colaterais associados com administetocar essas substâncias a um rato grávida. Finalmente, o modelo ex vivo também permite que o ensaio de substâncias que não atravessam a barreira placentária, tais como anticorpos bloqueadores de função. Devido a estas vantagens, o rombencéfalo cultura ex vivo proporciona um método alternativo e complementar a utilização de embriões de peixes-zebra, os quais podem ser tratados com água pequenas moléculas solúveis na água do aquário, ou no útero electroporação de cérebros embrionários, que requer o uso de especializada equipamento e é mais difícil de dominar que a técnica de cultura aqui descrito. Uma outra vantagem do protocolo descrito aqui é a sua receptividade para implantar os grânulos embebidos em proteína recombinante ou de outros reagentes, por isso permitindo que a aplicação de um método padrão embrionário desenvolvidos para manipular embriões de galinha para um modelo de rato de migração neuronal. Em particular, o modelo ex vivo de cultura pode ser aplicada a hindbrains de ratos geneticamente modificados defectiva em moléculas específicas implicadas na migração neuronal, tais como receptores de crescimento ou factor de orientação, e combinado com os implantes do grânulo para testar se a capacidade de resposta a ligandos é perdida. Em adição à manipulação farmacológica, o protocolo ex vivo de cultura pode também ser adaptado para electroporar vectores de expressão que podem manipular a expressão de genes de interesse; métodos adequados para eletroporação foram previamente descrito 22,23. Este protocolo também pode ser adaptado para visualizar a migração neuronal por microscopia de lapso de tempo em explantes rombencéfalo de camundongos transgênicos contendo neurônios fluorescente etiquetado FBM, por exemplo ISL1-Cre; Rosa26Yfp 21. Finalmente, o protocolo pode também ser usado para estudar outros tipos de neurónios que migraram para a parte posterior do cérebro, tais como aqueles que constituem a oliva inferior, embora isso exigiria a utilização de hindbrains em estágios embrionários idosos e pode exigir a cultura durante até 48 horas, dependendo da viabilidade neuronal Ex vivo.
As etapas críticas e solução de problemas
Para o sucesso deste protocolo, é crucial que os embriões são coletados no início E11.5 dia, mais perto de E11.25, quando a migração neuronal FBM está apenas começando. No entanto, isso nem sempre é possível recuperar embriões neste estágio de desenvolvimento, devido a variabilidade de acasalamento natural de ratinhos, e, consequentemente, pode haver alguma variação na extensão da FBM migração entre diferentes experimentos. Variabilidade na migração FBM também pode ser observada se a experiência não for concluída dentro do prazo designado, cerca de 3 horas, como pode ser visto na Figura 3E. Hindbrain tecido a partir de embriões de rato E11.25 é delicada. Ao dissecar e durante todo o processo de explante, é importante para não rasgar o tecido rombencéfalo nas áreas de r4-R6, onde os neurónios de MRF estão localizados. Devido à natureza delicada da Dissprocesso exão, e por causa da velocidade com que hindbrains são colocados em cultura influencia resultado, o procedimento pode levar um par de prática funciona de dominar, em especial, antes de serem utilizadas amostras preciosas ou reagentes. Finalmente, é importante que o tecido rombencéfalo é colocada numa configuração livro aberto sobre a inserção de cultura, porque a dobragem do tecido do cérebro posterior durante a cultura vai impedir a migração normais FBM (ver Figura 3F).
Divulgações
Nenhum dos autores competindo interesses ou interesses conflitantes.
Agradecimentos
MT é apoiado por uma bolsa de estudo de doutorado [ref. 092839/Z/10/Z] e CR por um New Investigator Award [ref. 095623/Z/11/Z] a partir do Wellcome Trust.
Materiais
| Name | Company | Catalog Number | Comments |
| Eppendorf round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | |
| Cell culture plates, 12-well | Thermo Scientific | 150628 | |
| Plastic cell culture dish, 100 mm | Thermo Scientific | 150288 | |
| 15 mm Netwell insert with Mesh Polyester Membrane | Corning | 3477 | |
| Watchmaker forceps, no. 5 | Dumont | 91150-20 | |
| Phosphate buffered saline | Sigma | P4417 | |
| Laminin mouse protein | Life Technologies | 23017-015 | |
| Primary antibody, Isl1 | Developmental Hybridoma Bank | 39.4D5 | Dilution 1/100 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Life Technologies | A11029 | Dilution 1/200 |
| Neurobasal medium | Life Technologies | 21103 | |
| B27 supplement (50x) | Life Technologies | 17504-044 | |
| Leibovitz’s L-15 | Life Technologies | 21083-027 | |
| Penicillin/ streptomycin | Life Technologies | 15070 | |
| Glucose | VWR | 101174Y | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Triton X-100 | Sigma | T8787 | |
| Paraformaldehyde | Sigma | P6148 | |
| Slowfade Antifade Kit | Life Technologies | S-2828 | Alternative mounting solutions may be used |
| Microscope slides | VWR | 631-0912 | |
| Cover glass | VWR | 631-0137 | |
| Affi-Gel Heparin Beads | Biorad | 153-6173 | Glass, latex, or coloured beads may be used alternatively |
| Recombinant human VEGF165 | R&D Systems | 293-VE | Resuspend in PBS, store aliquots at -80 °C |
| Stereo Microscope, Leica MZ16 | Leica | ||
| Confocal laser scanning microscope LSM710 | Zeiss |
Referências
- Lumsden, A., Keynes, R. Segmental patterns of neuronal development in the chick hindbrain. Nature. 337 (6206), 424-428 (1989).
- Chandrasekhar, A. Turning heads: development of vertebrate branchiomotor neurons. Dev. Dyn. 229 (1), 143-161 (2004).
- Mapp, O. M., Wanner, S. J., Rohrschneider, M. R., Prince, V. E. Prickle1b mediates interpretation of migratory cues during zebrafish facial branchiomotor neuron migration. Dev. Dyn. 239 (6), 1596-1608 (2010).
- Glasco, D. M., Sittaramane, V., Biol, D. e. v. .., et al. . The mouse Wnt/PCP protein Vangl2 is necessary for migration of facial branchiomotor neurons, and functions independently of Dishevelled. 369 (2), 211-222 (2012).
- Marillat, V., Sabatier, C., et al. The Slit Receptor Rig-1/Robo3 Controls Midline Crossing by Hindbrain Precerebellar Neurons and Axons. Neuron. 43 (1), 69-79 (2004).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298 (5600), 1959-1964 (2002).
- Vivancos, V., Chen, P., et al. Wnt activity guides facial branchiomotor neuron migration and involves the PCP pathway and JNK and ROCK kinases. Neural Dev. 4, 7 (2009).
- Guan, K. -. L., Rao, Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat. Rev. Neurosci. 4 (12), 941-956 (2003).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat. Rev. 8 (11), 859-871 (2007).
- Garel, S., Garcia-Dominguez, M., Charnay, P. Control of the migratory pathway of facial branchiomotor neurones. Development. 127 (24), 5297-5307 (2000).
- Gavalas, A., Ruhrberg, C., Livet, J., Henderson, C. E., Krumlauf, R. Neuronal defects in the hindbrain of Hoxa1, Hoxb1 and Hoxb2 mutants reflect regulatory interactions among these Hox genes. Development. 130 (23), 5663-5679 (2003).
- Grant, P. K., Moens, C. B. The neuroepithelial basement membrane serves as a boundary and a substrate for neuron migration in the zebrafish hindbrain. Neural Dev. 5, 9 (2010).
- Lumsden, A. Segmentation and compartition in the early avian hindbrain. Mech. Dev. 121 (9), 1081-1088 (2004).
- Tsuchida, T., Ensini, M., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Qu, Y., Glasco, D. M., et al. Atypical cadherins Celsr1-3 differentially regulate migration of facial branchiomotor neurons in mice. J. Neurosci. 30 (28), 9392-9401 (2010).
- Schwarz, Q., Gu, C., et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve. Genes Dev. 18 (22), 2822-2834 (2004).
- Stockinger, P., Maître, J. -. L., Heisenberg, C. -. P. Defective neuroepithelial cell cohesion affects tangential branchiomotor neuron migration in the zebrafish neural tube. Development. 138 (21), 4673-4683 (2011).
- Wanner, S. J., Prince, V. E. Axon tracts guide zebrafish facial branchiomotor neuron migration through the hindbrain. Development. , (2013).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. Neurosci. 20 (1), 206-218 (2000).
- Laird, P. W., Zijderveld, A., Linders, K., Rudnicki, M. A., Jaenisch, R., Berns, A. Simplified mammalian DNA isolation procedure. Nucleic Acids Res. 19 (15), 4293 (1991).
- Srinivas, S., Watanabe, T., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1 (1), 4 (2001).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J. Vis. Exp. (74), (2013).
- Holland, P. J., George, A. M., Worrell, L. T. C., Landsberg, R. L. In vitro electroporation of the lower rhombic lip of midgestation mouse embryos. J. Vis. Exp. (66), (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados