Method Article
마우스 후뇌
요약
배아 신경 세포는 신경 튜브의 심실 영역에서 태어 났지만, 적절한 목표에 도달하기 위해 마이그레이션됩니다. 얼굴 branchiomotor (FBM) 신경 세포는 신경 세포의 이동을 연구하기위한 유용한 모델이다. 이 프로토콜은 FBM 이동을 조절하는 메커니즘을 조사하기 위해 마우스 배아 hindbrains의 wholemount 생체 문화를 설명합니다.
초록
배아 신경 세포는 두뇌의 심실 영역에서 태어 났지만, 이후 적절한 목표에 도달하기 위해 새로운 목적지로 마이그레이션됩니다. 협력 배아 뇌의 신경 세포의 이동을 안내하는 분자 신호를 해독하는 것은 복잡한 신경 네트워크 나중에 출생 후의 생활을 지원하는 구성 방법을 이해하는 것이 중요하다. 마우스 배아 후뇌의 얼굴 branchiomotor (FBM) 신경 후뇌의 6 - 파생 영역에서의 쌍 얼굴 핵을 형성하는 rhombomere (R) 4 꼬리 쪽부터 이동한다. 여기에서 우리는 FBM 이동을 조절하는 신호 전달 경로를 조사하기에 적합한 마우스 배아 hindbrains의 wholemount 체외 문화에 대한 상세한 프로토콜을 제공합니다. 이 방법에서는, E11.5 마우스 배아의 hindbrains 24 시간 동안 세포 배양 삽입에 책 준비에 해부 배양된다. 이 시간 동안, FBM 뉴런 R6 향해 꼬리 쪽 마이그레이션 기능 차단 항체 및 작은 molecul에 노출 될 수있다신경 세포의 이주를 안내에 연루 신호 전달 경로의 역할을 검토하는 재조합 단백질과 함께로드 문화 미디어 또는 헤파린 구슬 에스.
서문
배아 신경 세포는 두뇌의 심실 영역에서 태어 났지만, 이후 큰 거리에있는 해당 대상 지역에 도달하기 위해 새로운 목적지로 마이그레이션됩니다. 두뇌 개발의 dorso - 복부 및 전후방 축을 따라 적절한 위치에있는 신경 세포 기관의 정확한 위치는 철새 단계 1-4 후 올바른 배선, 생존, 이러한 신경 세포의 기능에 필수적입니다. 축삭지도 5-7을 제어하는 분자 메커니즘과 유사하게, 매력적이고 불쾌 신호의 조합 세트가 이주 뉴런 1.8을 안내하는 것으로 생각된다. 그러나, 여러 세포 유형의 상호 작용, 신경 세포의 이동을 제어하는 신호가 덜 광범위하게 자율적으로 세포를 연구 할 수있는 축삭지도에 참여하는 것보다 연구되고있다. 척추 동물의 후뇌 현상은 다양한 기전을 이해하는 것이 최근의 여러 연구에 사용되었다신경 세포의 이주, 병아리, 마우스, 제브라 피쉬 1-4,9 예를 들면. 이 기관은 여러 precerebellar의 하위 유형과 운동 뉴런 5,7,10,11 등의 신경의 여러 가지 종류가 포함되어 있습니다.
후뇌 motorneuron는 floorplate에 가까운 심실 영역에서 태어 났으며, 그들은 원래 1,12 그들의 rhombomere에 따라 특정 하위 집합으로 구분됩니다. 얼굴 branchiomotor (FBM) 뉴런은 후뇌에 rhombomere (R) 4 생성 및 얼굴 근육 2,9,13을 신경을 분포시키다 두 번째 아가미 아치에 등쪽 R4 출구 지점을 통해 자신의 축삭을 확장하고 있습니다. 제브라 피쉬와 마우스의 FBM 뉴런이 신경이 재현 시공간으로 잘 정의 된 프로세스에 자신 인 somata를 이동시키다 때문에, 쉽게 시각화하는 과정에서 연결을 마이 그 레이션의 분자 및 세포 메커니즘을 연구하는 훌륭한 모델을 제공합니다. 마우스에서는, FBM 신경 먼저 CAU를 마이그레이션서두르는 R5을 통해 다음 두 꼬리 쪽과 배쪽으로가 VIIth 뇌신경 (VIIn) 10,11,14의 쌍 핵을 형성 R6, 영토의 후뇌의 pial 측의 최종 위치에 도달 할 수 있습니다. 제브라 피쉬에서 FBM의 뉴런은 처음에 배쪽으로 이주하고 라미닌 의존적으로 4,12,15,16에 pial 표면으로 마이그레이션 계속 R4-R5의 경계에서 방향을 변경합니다. 이 마이그레이션 현상에 몇 일에 걸쳐 진행하고있는 두 가지 과정을 매개하는 분자의 식별을 허용 접선 방향 및 반경 방향 이동의 단계로 나눌 수있다. 대조적으로, 닭 배아 후뇌의 FBM 뉴런 R4 3,13,17-19 남아.
그들의 마이그레이션하는 동안, FBM 뉴런 homoeodomain 전사 인자의 섬 1 (ISL1) 14의 발현을 통해, 다른 유형의 모터 뉴런과 같은 식별 할 수 있습니다. 따라서,도 ë다른 발달 단계에서이 마커 emount의 면역 형광 염색 또는 현장 하이브리드 화에는 제브라 피쉬 마우스 4,15,16에서 R6에 R4에서 연장 FBM의 인 somata의 별개의 철새 스트림을 보여준다. 또한, 이러한 ISL1-GFP와 같은 형광 유전자 변형 기자 제브라 피쉬 3,17-19에 FBM 신경을 마이그레이션 시각화하는 적절한 도구로 사용되어왔다. 자신의 독립 생활 배아 세포 이식 기술과 수족관 물에 직접 적용 약물 화합물로 쉽게 조작 할 수 있기 때문에 영상에 대한 적합성뿐만 아니라, 많은 연구자들은, 제브라 피쉬를 개발 FBM 신경 세포의 이동을 연구했다. 반면에, 마우스 배아 안내 단서 또는 태반 장벽을 통과하지 않는 기능을 차단 항체의 투여를 들고 구슬의 주입을 배제, 자궁에 동봉 개발하고 있습니다. 또한, 임신 어머니에게 투여 약물 화합물은 유엔이있을 수 있습니다간접적으로 배 발생에 악영향을 줄 수 원하는 부작용. 이 제한을 우회, 우리는 7,16를 explanting 후 24 시간 동안 FBM의 신경 세포의 이동과 생존과 호환되는 모든 마우스 후뇌에 대한 체외 배양 방법을 개발했습니다. 이 방법은 쉽게 약리 조작, 안내 단서 또는 함수 차단 항체의 투여를 들고 구슬의 주입을 허용하고 또한 다른 발달 단계에 후뇌에서 다른 신경 세포 아형의 이동을 연구하기에 적합 할 수있다.
프로토콜
1. 선택 사항 : FBM 장르 분석을 위해 아피 - 겔 헤파린 구슬 (젤 구슬)를 준비
참고 : 이식편의 절차를 시작하기 전에 적어도 일일 젤 구슬을 준비합니다.
- 실온 (RT)에서 롤러에 20 분 동안 멸균 PBS 100 μL 젤 헤파린 구슬 서스펜션을 씻으십시오.
- 13,000 X g에서 5 분을위한 테이블 탑 원심 분리기의 펠렛의 구슬. 멸균 PBS를 추가하고 세척 절차 배를 반복합니다.
- 최종 세척 후 PBS를 제거하고 솔루션과 비즈를 충당하기 위해주의하면서 선택의 재조합 단백질을 포함하는 살균 용액의 작은 양의 구슬을 적신다. 이 프로토콜은 이전에 출판 된 실험 (16)을 재현하기 위해 PBS 100 μL / NG 재조합 인간 VEGF165를 사용합니다.
- 4 ℃에서 롤러에 12 시간의 최소 재조합 단백질 용액 1 주 최대 젤 헤파린 구슬을 품어
2. 문화 삽입의 코팅의
후뇌 외식 코닝의 문화를 배양 8 μm의 기공 크기, 또는 이에 상응하는 인서트로 삽입합니다. 농경 인서트들이, 증류수로 세척하고, 에탄올로 소독하고, 필요할 때까지 70 % 에탄올 중에 저장되어 제공되는, 프로토콜의 완료 후에 재사용 될 수있다.
NOTE : 다음 단계는 무균 조건 하에서 흐름 후드에서 수행되어야한다.
- B27 (20 μL / ml)로 보충 Neurobasal 배지 이루어진 이식편 배양 배지를 준비, 글루코스 (10 ㎎ / ㎖), 페니실린 / 스트렙토 마이신 (5 ㎍ / μL).
- 세척 문화는 5 분, 흐름 후드 아래에 5 ~ 10 분 동안 건조 멸균 PBS로 삽입합니다.
- 12well 플레이트의 각 우물에 하나의 문화 삽입물을 놓습니다. 참고 : 삽입 우물에 꽉 맞게 작은 푸시를해야 할 수도 있습니다.
- Neurobasal 배지에서 10 ~ 20 ㎍ / ㎖의 마우스 라미닌과 문화의 삽입을 커버하고 37 ° C, 5 % CO (조직 문화 인큐베이터에 배치 2) 1 시간 동안. 참고 : 코팅 explanting의 날에 실시한다.
3. E11.5 마우스 배아에서 Hindbrains의 해부
- 배아 일에 윤리적 승인 절차 (E) 11.5 초과 임신 여성 마우스를 추려과 얼음처럼 차가운 L15 매체와 100mm 플라스틱 접시에 배아가 들어있는 자궁을 배치합니다.
참고 : 모든 해부 단계는 얼음처럼 차가운 L15에서 수행해야합니다. - 해부 현미경을 사용하여 뒤몽 시계 제조는, 배아를 노출하는 자궁의 근육 벽을 찢어 각각의 배아를 분리 한 탯줄을 절단하고,주의 깊게 난황을 제거, 숫자 5를 핀셋.
- 넓은 구멍 구멍을 가진 플라스틱 파스퇴르 피펫을 사용하여 얼음처럼 차가운 L15 깨끗한 플라스틱 접시에 각각의 배아를 전송합니다.
- 뒤몽의 집게를 사용하여, 단지 앞다리 위의 배아 목을 벨. 실험은 배아의 유전자형을 필요로하는 경우, 게놈 DNA의 분리를위한 조직 샘플을 수집 (예 : 작은 조각 복장난황 또는 꼬리 끝 16, 20)의 전자.
- 최대 헤드 등의 측면을 켜고 얇은 조직 층 (그림 2B)이 적용됩니다 제 4 뇌실을 확인합니다. 조심스럽게 roofplate을 뚫고 후방 후뇌와 척수에 중간 선을 따라 꼬리 쪽을 벗겨하기 시작 rostrally 중뇌에. 후뇌는 지금 (그림 2C)를 노출해야합니다.
- 조심스럽게 남아있는 머리 중간 엽와 후뇌 (그림 2D)의 pial 측면에 부착 된 모든 수막을 멀리 애타게.
- 후뇌가 펼쳐진 있도록 중뇌와 척수 조직을 제거하고 책의 준비 (그림 2E)에 평평하게 거짓말을 할 수 있습니다.
- 넓은 구멍 플라스틱 파스퇴르 피펫을 사용하여 얼음처럼 차가운 L15를 포함하는 12 - 웰 플레이트에 각 해부 후뇌를 전송하고 모든 hindbrains 해부 될 때까지 얼음에 저장합니다.
- 넓은 구멍 플라스틱 파스퇴르 피펫을 사용하여 죄를 전송그것을 대략 100 μL의 L15의 물방울 최대 책 준비, 심실 측면을 유지 빈 접시에 GLE의 후뇌.
- 같은 물방울을 배양 젤 헤파린 구슬 몇 마이크로 리터를 전송합니다. 참고 : 구슬의 크기가 변수이므로,이 약 10 구슬을 전송 한 후 후뇌에 이식을위한 최적의 크기를 선택하는 것이 좋습니다.
- 후뇌 조직에있는 작은 눈물을 조심스럽게 조직으로 그들을 낮추고, 중간 선 및 후뇌의 측면 가장자리 사이의 약 절반, [5 / 6의 수준에 후뇌 조직에 1-3 젤 구슬을 삽입되도록 구슬은 그냥 후뇌 표면 아래에 위치한다.
참고 : 해부 절차는 경험에 따라 5 ~ 20 분 / 후뇌 사이에 걸릴 수도, 그리고 새끼가 큰 경우 연장 된 기간 동안 늘릴 수 있으며, 어떤 경우에, hindbrains 좋은 3 시간의 사후보다 더 이상 문화에 있어야합니다 결과.
4. 후뇌이식편 문화
- 인큐베이터에서 배양 삽입을 포함하는 플레이트를 제거, 라미닌 코팅 솔루션을 대기음.
- 문화 삽입합니다 (그림 2G)에 각각 최대 후뇌 복부 측면을 전송, 넓은 구멍 플라스틱 파스퇴르 피펫을 사용하여, 얼음처럼 차가운 L15와 가득 별도의 배양 접시에 하나의 문화 삽입물을 놓습니다. 후뇌는 삽입 막에 완전히 평평해야합니다.
- 조심스럽게 접시에서 배양 삽입을 들어 올려 물기를 제거하는 깨끗한 조직 종이에 여러 번 줘봐. 이 프로세스는 후뇌 플랫, 책의 준비에 문화 삽입 규칙을 준수한다는 것을 보장한다. 후뇌가 곱슬 경우, 그 조직은 비가 역적으로 함께 성장 할 수 있습니다.
- 500 ㎕의 예비 가온 문화 매체를 원래의 12 - 웰 플레이트를 입력하고 잘에 다시 삽입을 배치합니다. 조심스럽게 후뇌가 뜨지 않는 것을 보장, 단지 후뇌를 커버하는 미디어의 또 다른 400 ~ 600 ㎕를 사용하여 볼륨을 조정막 끕니다. 이 수레 경우, 4.4 단계와 후뇌가 막에 붙어 남을 때까지 반복 돌아갑니다.
- 이 단계에서, 그것은 FBM 신경 세포의 이동에 미치는 영향을 연구하기 위해 미디어에 관심 생물학적 억제제를 추가 할 수 있습니다.
참고 : 구슬을 주입하거나 다른 치료를 관리하는 경우,이 실험이 성공적으로 설정되었는지 확인하기 위해 실험 당 정상적인 성장 조건에서 최소 2 제어 외식을 유지하는 것이 좋습니다. - 조직 문화 인큐베이터 (37 ° C에서 5 % CO 2)에 24 ~ 30 시간 동안 외식을 품어.
5. 후뇌 외식 Wholemount 면역 형광 염색법
- 각 우물에서 미디어를 대기음, PBS로 세척하고 얼음처럼 차가운 4 %의 포름 알데히드 (PBS에 녹인 4 % 파라 포름 알데히드를 새로 제조 또는 갓 해동)에서 교반과 함께 4 ° C에서 2 시간 동안 고정합니다. 참고 : 고정하기 전에 문화 삽입에서 후뇌를 제거하려고하지 마십시오완료됩니다.
- PBS로 3 회 씻어. 조심스럽게 뒤몽의 집게를 사용하여 문화 삽입에서 hindbrains 껍질. 일부 외식이 벗겨하기 어려운,하지만, 일반적으로 반복 피펫에서 PBS 추방을 통해 부드러운 압력을 적용하여 해제 할 수 있습니다.
- 면역 형광 라벨 2.0 ㎖의 둥근 바닥 튜브에 hindbrains을 전송합니다. 온화한 회전으로 0.1 % 트리톤-100 (PBT)을 함유하는 PBS에서, 실온 (RT)에서 30 분 동안 hindbrains을 투과.
- 부드러운 롤링과 10 %의 열 불 활성화 정상 염소 혈청을 포함하는 PBT에서 실온에서 1 시간 동안 배양한다.
- ISL1 특정 차 항체와 함께 5 일 동안 4 ° C에서 부드러운 롤링과 함께 외식을 품어, 1 % 열 불 활성화 정상 염소 혈청을 포함하는 PBT에서 1:100으로 희석.
- 15 분마다 PBT와 RT 배에서 외식을 씻으십시오.
- 형광 - 복합 염소 항 - 마우스 항체 (예 : 알렉사 플 루어 488 염소 항과 3 시간 동안 실온에서 부드러운 롤링과 외식을 품어마우스는 1 % 열 불 활성화 정상 염소 혈청을 포함하는 PBT에서) 1:200 희석.
- 외식 부드러운 회전과 15 분마다 PBT와 실온에서 4 배 씻으십시오.
- RT에서 30 분 동안 4 % 포름 알데히드에 이식편을 후위.
- 외식 용 포켓을 만들 검은 색 전기 테이프의 레이어와 메스 층 테이프의 작은 사각형 소비세와 유리 슬라이드 커버, 대안, 우울증 유리 슬라이드를 사용합니다.
- 포켓에 SlowFade 시약 각 후뇌를 탑재 조심스럽게 레이저 스캐닝 공 초점 현미경을 사용하여 트랩 기포와 이미지에 방지, 유리 커버 슬립 커버.
NOTE : 면역 염색에 대한 대안으로서, FBMS (즉 ISL1 또는 Phox2b)를 인식 리보 프로브와 함께 제자리 혼성화에 FBM 뉴런 16,21를 시각화하는데 이용 될 수있다.
단계와 타이밍의 개요
14 ~ 날짜 : E11.25 임신을 얻기 위해 짝짓기를 초과
선택 사항 : 비드 준비 (ProtocoL 1) : 배아 분리하기 전에 하루에 1 ~ 2 시간,
문화 삽입 및 미디어 (프로토콜 2)를 준비 ~ 30 분 전에 배아 분리
배아 격리와 후뇌 해부 (3.1-3.4 단계) : ~ 10 분 / 배
후뇌 해부 (3.5-3.7 단계) : ~ ~ 10 분 / 후뇌
이식편 절차 (3.8-3.9 단계) : ~ ~ 10 분 / 후뇌
선택 사항 : 구슬 주입 (3.10-3.11 단계) : ~ ~ 10 분 / 후뇌
이식편 문화 (단계 4.7) : 24 시간
항체 염색에 대한 고정 (단계 5.1) : 2 시간
염색 절차 및 영상 (프로토콜 5) : 5 일
결과
이 섹션에서는 체외 배양을 통해 마우스 후뇌에서 FBM의 신경 세포의 이동을 연구하여 얻을 수 있습니다 결과의 예를 보여줍니다. 우리는 하루 11 마우스 배아에서 외식 hindbrains에서 FBM 신경 먼저 접선 마이그레이션 (그림 3A)를 받아야하고 자궁 내에서의 동작과 비슷 얼굴 모터 핵 (그림 3B)을, (그림 1 참조) 조립하기 시작 것을 보여줍니다. 우리는 더 이상 이전 16 같이 VEGF165 적신 구슬의 주입은, FBM 뉴런 (그림 3C 및 3D)를 받고 있음을 보여줍니다. 망막 비관 혈관 문화 16 퇴화하기 때문에 중요한 것은,이 프로토콜은 혈관이나 자궁에 FBM 마이그레이션에 영향을 미칠 수있는 용기 파생 요소의 부재에서 FBM 마이그레이션을 공부하실 수 있습니다. 갓에 ISL1 마우스 항체를 사용하는 경우 이에 비특이적 혈구 라벨링 관찰고립 된 마우스 hindbrains (그림 1) 문화 (그림 3A-F)에서 24 시간 후에 더 이상 후뇌 조직에 존재하지 않습니다. 후뇌는 배아 분리 (그림 3E) 후 또는 곧 외식되지 않았기 때문에 마지막으로, 우리는 하나, 제대로 외식 따라서 비정상적인 유통 FBM의 뉴런을 포함하지 않은 hindbrains의 두 가지 예를 보여줍니다 때문에 (트랜스 웰에 접어 후뇌 조직 그림 3 층).
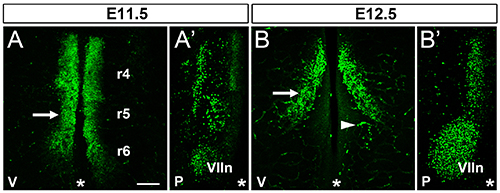
그림 1. FBM 신경 세포의 이주 ISL1 wholemount immunolabeling 및 flatmounting 후 야생형 마우스 hindbrains의 공 촛점 Z-스택;..에 E11.5의 후뇌의 후뇌 중간 선은 모든 패널에 별표로 표시됩니다 (A) 심실 표면 R6에 R4에서 그들의 접선 옮기는 보여주는 ISL1 양성 FBM 뉴런 (화살표)를 포함하는 영역]. anlage 함유 영역에서 동일한 후뇌의 절반의 R4, R5 및 R6의 위치가 표시된다 (A ') Pial 표면 . 접선 방향 (화살표)를 마이그레이션하는 FBM 뉴런을 포함 E12.5의 후뇌의 (VIIn로 표시된) 한 쌍의 FBM 핵의 하나뿐만 아니라 다른 ISL1 양성 신경 세포 개체군 (B) 심실 표면; 화살촉은 일례를 나타내 비특이적 ISL1 마우스 IgG 항체를 검출하는 데 사용되는 항 - 마우스 이차 항체 교차 반응에 의해 표시되어 순환하는 세포를 포함하는 혈관. (B ')가 포함 된 동일한 E12.5의 후뇌의 절반의 Pial 표면 쌍 FBM 핵의 하나. 중간 선은 각 패널에 별표로 표시됩니다. 스케일 바 (모든 패널) : 200 ㎛. V, 복부, P, pial./ 51397fig1highres.jpg "대상 ="_blank "> 큰 이미지를 보려면 여기를 클릭하십시오.
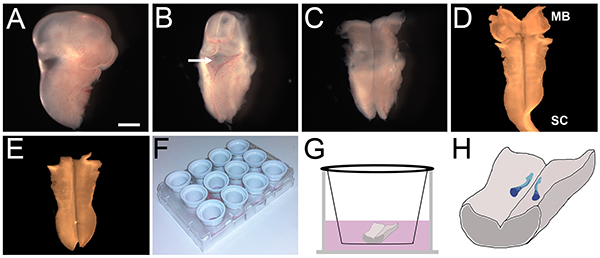
그림 2. E11.5 마우스 후뇌의 해부 및 생체 문화. (AE) E11.5의 후뇌 해부 프로토콜에있는 중요한 단계, 스케일 바 :.이 떨어져 앞다리 수준에서 배아의 나머지 부분에서 절단 된 후 배아의 1mm (A) 헤드 (B)의 주동이의 부분. 헤드는 제거되고 제 4 뇌실 (화살표)가 위쪽으로 지향 된되도록 헤드 조직의 나머지 부분에 위치. (C) 제 4 뇌실의 지붕이 박리하고, 후뇌 멀리 후뇌 아래 조직을 박리에 의해 노출시켰다 rostrally와 꼬리 쪽. (D) pial 막 (이 예에있는 점에 유의 제거충분한, 일부 자궁 경부 척수 (SC) 조직) 후뇌에 부착 남아있다. (E) 초과 중뇌 (MB)와 척수 (SC) 조직이 바로 후뇌을 유지하기 위해 제거되었습니다. (F) 문화의 삽입이 코팅 된 라미닌 및 12 잘 조직 배양 플레이트에 배치. (G) 각 후뇌는 하나의 삽입에 배치 미디어로 덮여 있었다. (H) 문화의 24 시간 동안 FBM 뉴런 (파란색)을 마이그레이션하여 촬영 경로의 도식 표현. 여기를 클릭하십시오 더 큰 이미지를 볼 수 있습니다.

그림 3. 마우스 후뇌 생체 문화. (A, B) E11.5의 후뇌는 24 시간 및 immunofluoresc에 대한 배양 이라 고한다면, 이식편의 FBM 신경 세포의 이동을 설명하기 ISL1 표지, 심실 (A) 및 pial 후뇌의 (B) 양쪽이 표시됩니다 (C, D) E11.5의 littermate의 hindbrains 젖었 이식 헤파린 비드의 존재에 배양 하였다. PBS (C) 또는 VEGF165 (D)에, FBM 뉴런으로하고 VEGF165 구슬로 이주하고 이주 스트림 따라서 같은 후뇌 컨트롤 구슬이 들어있는 후뇌의 치료면에 비해 더 꼬리 쪽 확장주의 (E. 불만족 E11.5의 후뇌의 FBMS은 R4에서 이주하지 않은하는 외식, (E), 또는 F) 예하는 문화 (F) 중에 접혀 후뇌 조직. 중간 선은 각 패널에 별표로 표시됩니다. (모든 패널) 스케일 바 : 200 μm의. V, 복부, P, pial."> 큰 이미지를 보려면 여기를 클릭하십시오.
토론
이 프로토콜은 FBM 신경 세포의 이동을 연구하는 트랜스 웰 시스템에서 E11.5 마우스 hindbrains의 wholemount 문화를 설명합니다. 이 프로토콜은 마우스 후뇌의 motorneurons는 생체 조작이 가능, 24 시간 동안 살아 마이그레이션 유지 될 수 있습니다. 이 방법은 연결을 마이 그 레이션의 분자 및 세포 메커니즘을 파악하고자하는 연구자에 대한 여러 실험적인 장점이 있습니다. 기존의 마이그레이션 분석은 배양 접시에 매트릭스에 작은 신경 조직의 조각을 이식편 그들이 외인성 자극에 반응 개별 신경 세포의 관찰을 가능하게하는 반면, 트랜스 웰의 분석의 주요 장점은 호스트 기관 환경에서 마이그레이션하는 뉴런을 조작 할 수있는 적합성 때문에 더 생리적 인 상황. 중요한 사실은, 물질은 쉽게 administe와 관련된 부작용을 회피, 신경원 이주에 미치는 영향을 시험하기 위하여 생체 외 이식편 후뇌에 적용될 수있다임신 한 쥐에이 물질을 반지. 마지막으로, 생체 모델은 이러한 기능을 차단 항체로 태반 장벽을 통과하지 않는 물질의 테스트를 할 수 있습니다. 때문에 이러한 장점으로, 생체 후뇌 문화는 수족관 물, 또는 전문의 사용을 필요로 배아 두뇌의 자궁 일렉트로,의에 수용성 작은 분자로 취급 될 수 제브라 피쉬 배아를 사용하는 대신 보완 방법을 제공 장비는 여기서 설명 배양 기법보다 마스터에 더욱 곤란하다. 여기에 설명 된 프로토콜의 또 다른 장점은, 따라서 신경 마이그레이션의 마우스 모델에 병아리 배아를 조작하기 위해 개발 된 표준 학적 방법의 적용을 허용하는, 재조합 단백질 또는 다른 시약 담그어 구슬을 주입 자사 복종 할 의무이다. 특히, 생체 외 배양 모델은 유전자 변형 마우스의 hindbrains에 적용될 수있다으로 결함이러한 성장이나 지침 인자 수용체로의 연결을 마이 그 레이션에 연루 특정 분자에 심하게 배, 및 리간드에 응답이 분실되는 경우 테스트하는 비드 임플란트와 결합. 약리 조작 이외에도 체외 배양 프로토콜은 또한 유전자의 발현을 조작 할 수있는 발현 벡터를 electroporate하도록 적응 될 수있는, 전기 천공을위한 적절한 방법은 이전에 (22, 23)를 설명 하였다. Rosa26Yfp (21)이 프로토콜은 찬란 FBM 신경 세포, 예를 들어 ISL1 - 크레을 포함하는 형질 전환 마우스에서 후뇌 외식에 시간 경과 현미경으로 신경 세포의 이동을 시각화하는 데에 적합 할 수있다. 이것은 이전 배아 단계에서 hindbrains의 사용을 필요로하고, 최대 48 시간 동안 배양을 요구할 수 있지만, 최종적으로,이 프로토콜은 또한, 그러한 열등 올리브를 형성하는 것과 같은 후뇌에서 이주 뉴런의 다른 유형을 연구하기 위해 사용될 수있다, 신경 세포의 생존 능력에 따라 생체.
중요한 단계 및 문제 해결
이 프로토콜의 성공을 위해, 그것은 배아 FBM 신경 세포의 이주 단지 시작했다 E11.25에 가까운 일 E11.5, 조기에 수집하는 것이 중요합니다. 그러나 의한 생쥐의 자연 교배 변동성이 발달 단계에서 배아를 잡으려고하고, 그에 따라, 다른 실험 사이 FBM 이동의 확장에 약간의 변동이있을 수 있습니다 항상 가능한 것은 아니다. 실험은도 3e에서 볼 수있는 바와 같이, 할당 된 시간 프레임 내에서 약 3 시간이 완료되지 않은 경우 FBM 이주 가변성 또한 관찰 될 수있다. E11.25 마우스 배아에서 후뇌 조직이 섬세합니다. 해부 및 이식편 절차 내내 때 FBM 뉴런이 위치한 R4-R6에서 구역 후뇌 조직을 찢어지지하는 것이 중요하다. 때문에 디스의 섬세한 성격hindbrains는 문화에 배치되는 속도가 결과에 영향을 미치는, 사출 공정하고 있기 때문에, 절차는 귀중한 샘플이나 시약이 사용되는 특히 전에 몇번 연습 마스터에 실행이 걸릴 수 있습니다. 마지막으로, 문화 동안 후뇌 조직의 폴딩 (그림 3 층 참조) 일반 FBM의 이동을 방지하기 때문에 후뇌 조직이, 문화 삽입에 책의 구성에 배치하는 것이 중요합니다.
공개
저자의 아무도는 이익 또는 이해 충돌을 경쟁 없습니다.
감사의 말
MT는 박사 과정 재학 [참조에 의해 지원됩니다. 새로운 탐정 수상 [참조하여 092839/Z/10/Z] 및 CR. 095623/Z/11/Z] 웰컴 트러스트 (Wellcome Trust)에서.
자료
| Name | Company | Catalog Number | Comments |
| Eppendorf round-bottomed reagent tube, 2.0 ml (Safe-Lock) | VWR | 211-2120 | |
| Cell culture plates, 12-well | Thermo Scientific | 150628 | |
| Plastic cell culture dish, 100 mm | Thermo Scientific | 150288 | |
| 15 mm Netwell insert with Mesh Polyester Membrane | Corning | 3477 | |
| Watchmaker forceps, no. 5 | Dumont | 91150-20 | |
| Phosphate buffered saline | Sigma | P4417 | |
| Laminin mouse protein | Life Technologies | 23017-015 | |
| Primary antibody, Isl1 | Developmental Hybridoma Bank | 39.4D5 | Dilution 1/100 |
| Alexa Fluor 488-conjugated goat anti mouse secondary antibody | Life Technologies | A11029 | Dilution 1/200 |
| Neurobasal medium | Life Technologies | 21103 | |
| B27 supplement (50x) | Life Technologies | 17504-044 | |
| Leibovitz’s L-15 | Life Technologies | 21083-027 | |
| Penicillin/ streptomycin | Life Technologies | 15070 | |
| Glucose | VWR | 101174Y | |
| Heat-inactivated goat serum | Sigma | G9023 | |
| Triton X-100 | Sigma | T8787 | |
| Paraformaldehyde | Sigma | P6148 | |
| Slowfade Antifade Kit | Life Technologies | S-2828 | Alternative mounting solutions may be used |
| Microscope slides | VWR | 631-0912 | |
| Cover glass | VWR | 631-0137 | |
| Affi-Gel Heparin Beads | Biorad | 153-6173 | Glass, latex, or coloured beads may be used alternatively |
| Recombinant human VEGF165 | R&D Systems | 293-VE | Resuspend in PBS, store aliquots at -80 °C |
| Stereo Microscope, Leica MZ16 | Leica | ||
| Confocal laser scanning microscope LSM710 | Zeiss |
참고문헌
- Lumsden, A., Keynes, R. Segmental patterns of neuronal development in the chick hindbrain. Nature. 337 (6206), 424-428 (1989).
- Chandrasekhar, A. Turning heads: development of vertebrate branchiomotor neurons. Dev. Dyn. 229 (1), 143-161 (2004).
- Mapp, O. M., Wanner, S. J., Rohrschneider, M. R., Prince, V. E. Prickle1b mediates interpretation of migratory cues during zebrafish facial branchiomotor neuron migration. Dev. Dyn. 239 (6), 1596-1608 (2010).
- Glasco, D. M., Sittaramane, V., Biol, D. e. v. .., et al. . The mouse Wnt/PCP protein Vangl2 is necessary for migration of facial branchiomotor neurons, and functions independently of Dishevelled. 369 (2), 211-222 (2012).
- Marillat, V., Sabatier, C., et al. The Slit Receptor Rig-1/Robo3 Controls Midline Crossing by Hindbrain Precerebellar Neurons and Axons. Neuron. 43 (1), 69-79 (2004).
- Dickson, B. J. Molecular mechanisms of axon guidance. Science. 298 (5600), 1959-1964 (2002).
- Vivancos, V., Chen, P., et al. Wnt activity guides facial branchiomotor neuron migration and involves the PCP pathway and JNK and ROCK kinases. Neural Dev. 4, 7 (2009).
- Guan, K. -. L., Rao, Y. Signalling mechanisms mediating neuronal responses to guidance cues. Nat. Rev. Neurosci. 4 (12), 941-956 (2003).
- Guthrie, S. Patterning and axon guidance of cranial motor neurons. Nat. Rev. 8 (11), 859-871 (2007).
- Garel, S., Garcia-Dominguez, M., Charnay, P. Control of the migratory pathway of facial branchiomotor neurones. Development. 127 (24), 5297-5307 (2000).
- Gavalas, A., Ruhrberg, C., Livet, J., Henderson, C. E., Krumlauf, R. Neuronal defects in the hindbrain of Hoxa1, Hoxb1 and Hoxb2 mutants reflect regulatory interactions among these Hox genes. Development. 130 (23), 5663-5679 (2003).
- Grant, P. K., Moens, C. B. The neuroepithelial basement membrane serves as a boundary and a substrate for neuron migration in the zebrafish hindbrain. Neural Dev. 5, 9 (2010).
- Lumsden, A. Segmentation and compartition in the early avian hindbrain. Mech. Dev. 121 (9), 1081-1088 (2004).
- Tsuchida, T., Ensini, M., et al. Topographic organization of embryonic motor neurons defined by expression of LIM homeobox genes. Cell. 79 (6), 957-970 (1994).
- Qu, Y., Glasco, D. M., et al. Atypical cadherins Celsr1-3 differentially regulate migration of facial branchiomotor neurons in mice. J. Neurosci. 30 (28), 9392-9401 (2010).
- Schwarz, Q., Gu, C., et al. Vascular endothelial growth factor controls neuronal migration and cooperates with Sema3A to pattern distinct compartments of the facial nerve. Genes Dev. 18 (22), 2822-2834 (2004).
- Stockinger, P., Maître, J. -. L., Heisenberg, C. -. P. Defective neuroepithelial cell cohesion affects tangential branchiomotor neuron migration in the zebrafish neural tube. Development. 138 (21), 4673-4683 (2011).
- Wanner, S. J., Prince, V. E. Axon tracts guide zebrafish facial branchiomotor neuron migration through the hindbrain. Development. , (2013).
- Higashijima, S., Hotta, Y., Okamoto, H. Visualization of cranial motor neurons in live transgenic zebrafish expressing green fluorescent protein under the control of the islet-1 promoter/enhancer. Neurosci. 20 (1), 206-218 (2000).
- Laird, P. W., Zijderveld, A., Linders, K., Rudnicki, M. A., Jaenisch, R., Berns, A. Simplified mammalian DNA isolation procedure. Nucleic Acids Res. 19 (15), 4293 (1991).
- Srinivas, S., Watanabe, T., et al. Cre reporter strains produced by targeted insertion of EYFP and ECFP into the ROSA26 locus. BMC Dev. Biol. 1 (1), 4 (2001).
- Nichols, A. J., O'Dell, R. S., Powrozek, T. A., Olson, E. C. Ex utero electroporation and whole hemisphere explants: a simple experimental method for studies of early cortical development. J. Vis. Exp. (74), (2013).
- Holland, P. J., George, A. M., Worrell, L. T. C., Landsberg, R. L. In vitro electroporation of the lower rhombic lip of midgestation mouse embryos. J. Vis. Exp. (66), (2012).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유