Method Article
Utilização de
Neste Artigo
Resumo
Para combater a disseminação da bactéria, as células hospedeiras reorganizar seu citoesqueleto de compartimentar as bactérias e induzir a autofagia. Usando Shigella infecção de células de cultura de tecidos, hospedeiro e determinantes de agentes patogénicos subjacentes a este processo são identificados e caracterizados. Utilizando modelos de peixe-zebra de infecção Shigella, o papel de moléculas e de mecanismos descobertos são investigados in vivo.
Resumo
Shigella flexneri é um patógeno intracelular que pode escapar de phagosomes para chegar ao citosol, e polimerizar o anfitrião do citoesqueleto de actina para promover a sua mobilidade e divulgação. Novo trabalho mostrou que as proteínas envolvidas na motilidade de actina também estão ligados a autofagia, um processo de degradação intracelular crucial para a imunidade autônoma celular. Surpreendentemente, as células hospedeiras podem impedir a motilidade à base de actina de S. flexneri por compartimentar bactérias dentro 'gaiolas Septin' e orientando-as para a autofagia. Estas observações indicam que uma compreensão mais completa de septinas, uma família de proteínas de ligação a GTP filamentosos, irá fornecer novos insights sobre o processo de autofagia. Este relatório descreve os protocolos para monitorar as interações autofagia-citoesqueleto causadas por S. flexneri in vitro utilizando células de cultura de tecidos e em vivo, utilizando larvas de peixes-zebra. Estes protocolos permitem a investigação de mechanis intracelularesms que controlam a disseminação de bactérias no organismo nível molecular, celular e inteiro.
Introdução
Shigella flexneri, uma bactéria invasiva enteropatogénica Gram-negativas, podem escapar de fagossomas para o citosol, e polimerizar o citoesqueleto de actina hospedeiro para evadir respostas imunes citosólicas e promover intra e intercelular movimento 1,2. Apesar do conhecimento da motilidade à base de actina 3,4 in vitro, os mecanismos que limitam a disseminação de bactérias in vivo não foram completamente definidos. Isto é crítico para uma compreensão mais completa da imunidade inata e a defesa do hospedeiro.
Septinas, uma família de proteínas altamente conservadas entre metazoários, são trifosfato de guanosina (GTP) liga�o ao proteínas que se reúnem em complexos hetero-oligoméricos e formam filamentos não polares que se associam com as membranas celulares e o citoesqueleto de 5,6. Trabalhos recentes descobriram que as células do hospedeiro infectado pode impedir a mobilidade baseada Shigella actina por bactérias compartimentar direcionados para autophagy dentro 'gaiolas' Septin, revelando o primeiro mecanismo celular que neutraliza motilidade baseado actina 7,8. Um vasto campo aberto de investigação encontra-se agora em 'biologia septina e infecção. Montagem Septin, induzida por uma variedade de agentes patogênicos (por exemplo, Listeria monocytogenes 7,9,10, Mycobacterium marinum 7,8, Candida albicans 11), pode emergir como uma questão-chave na defesa do hospedeiro 5,12.
A autofagia, um processo de degradação intracelular altamente conservada, é visto como um componente-chave da imunidade celular-autônoma devido à sua capacidade de fornecer bactérias citossólicas ao lisossoma 13,14. No entanto, o papel de autofagia bacteriana in vivo para restringir ou promover a replicação bacteriana permanece pouco compreendido 15,16. O peixe-zebra (Danio rerio) tem emergido como um modelo para o estudo de vertebrados de infecções por ser opticamente acessíveisnas fases larvares quando o sistema imune inato já é funcional 17,18. Trabalhos recentes têm caracterizado a susceptibilidade de larvas do peixe para S. flexneri, um paradigma para autofagia bacteriano 15, e foi utilizado o modelo de infecção -zebrafish Shigella para estudar a manipulação de autofagia para a terapia anti-bacteriana in vivo 19.
Este relatório fornece novas ferramentas e ensaios para estudar S. flexneri interacções com autofagia e o citoesqueleto. Em um primeiro passo, os protocolos para monitorar interacções autofagia-citoesqueleto são descritas usando Shigella infecção da linha de células epiteliais humanas HeLa. Para avaliar o papel das interacções autofagia-citoesqueleto no processo de infecção Shigella in vitro, os métodos para manipular autofagia e componentes do citoesqueleto (utilizando siRNA ou reagentes farmacológicos) são fornecidos. Novo trabalho mostrou que, usando Shigella infecção of larvas de peixe-zebra, ensaios semelhantes pode ser aplicado para estudar a biologia celular de infecção in vivo. Protocolos para preparar e infectar larvas do peixe são detalhados, e para avaliar a resposta do hospedeiro à infecção Shigella in vivo, os protocolos para determinar a sobrevivência do hospedeiro e carga bacteriana de larvas infectadas são fornecidos. Métodos para monitorizar o recrutamento de marcadores Septin e autofagia a Shigella (utilizando larvas de peixe-zebra vivos ou fixo) e métodos para testar o papel de tais processos in vivo [usando oligonucleótidos morfolino (injectados em embriões de fase de células 1-4) ou reagentes farmacológicos ( adicionado directamente à água do banho de peixe-zebra)] também são discutidos. Este programa de trabalho é esperado para fornecer insights sobre os mecanismos necessários para o controlo da infecção por respostas do hospedeiro citosólicas.
Protocolo
1. Monitoramento autofagia eo citoesqueleto in vitro utilizando células de cultivo
- Prepare S. flexneri
- Placa S. flexneri M90T (tipo selvagem) de -80 ° C estoque de glicerol em um Red Congo trípticos caseína de soja (TCS) placa de ágar. Incubar durante a noite a 37 ° C. A mesma placa podem ser usados para várias experiências.
- Escolher uma colónia individual e crescem em 8 ml de meio TCS num agitador durante a noite a 37 ° C.
NOTA: Congo-vermelho de ligação indica que o plasmídeo de virulência foi retido. - Para subcultura bactérias de crescimento exponencial, inocular TCS fresco com a cultura bacteriana durante a noite a 1/80 de diluição e crescer em um shaker a 37 ° C para OD600 = 0,3-0,6.
- Gire a subcultura bacteriana a 1.000 xg por 5 min. Lava-se a pelete com MEM e centrifugar a 1000 g durante 5 min. Reconstituir o sedimento em MEM para OD600 = 0,3-0,6.
- Prepare HeLa Cells para a infecção
- Cultivar células HeLa em "meio completo", ou seja. MEM mais L-alanil-L-glutamina, suplementado com 1 mM de piruvato de sódio, solução de aminoácidos não essenciais 0,1 mM, e 10% de soro fetal de vitelo.
- Placa de 1-1,5 x 10 5 células em placas de 6 poços de 24 ou 48 horas antes da experiência se inicia. Placa em lamínulas em placas de 6 poços para microscopia, ou placa de 35 mm de vidro pratos de fundo para se preparar para imagens ao vivo.
NOTA: (. Eg, caudas de actina, gaiolas Septin) Para acompanhar a autofagia (por exemplo, Atg8 / LC3 + ve autofagossomas) e citoesqueleto dinâmica em tempo real durante a infecção Shigella usando imagens ao vivo, as células de cultura de tecidos pode ser transitoriamente transfectadas com GFP, RFP- ou construções CFP-marcados (ver discussão).
- Infecção
- Infectar as células com 100: 1 multiplicidade de infecção (MOI) de Shigella (DO600 = 0,3 - 0,6), diluiu-se em meio MEM; adicionar diretamente a células HeLa, semeadas em 6-well placas 24-48 horas antes da infecção (tal como descrito na secção 1.2) em 2 ml de MEM (carência de soro).
- Para maximizar a adesão bacteriana às células hospedeiras de bactérias, de centrífuga e as células a 700 xg durante 10 min à temperatura ambiente. Após centrifugação, incubar durante 30 minutos a 37 ° C, 5% de CO 2 e permitir a infecção de proceder.
- Lave as células infectadas duas vezes com MEM fresco e incuba-se com meio completo contendo gentamicina (50 ug / ml, para eliminar as bactérias extracelulares) durante 1-4 h, dependendo da experiência.
- Fixação e Rotulagem células HeLa infectadas para Microscopia
- Lave as células infectadas duas vezes com PBS 1x e fixar durante 15 min em 4% de paraformaldeído em PBS 1x à temperatura ambiente. Para remover o paraformaldeído, células da lavagem 2x com PBS 1x.
- Incubar as células fixas em cloreto de amónio a 50 mM durante 10 min à temperatura ambiente. Lavar uma vez com PBS 1x e permeabilizar as células durante 4 min, com 0,1% de condensado de óxido de etileno octilfenol no quarto temperature.
NOTA: Alternativas para octilfenol condensado de óxido de etileno para permeabilização, tal como a saponina ou o metanol, pode ser aplicado para diferentes preservação de estruturas celulares 20. - Lavar células em 1x PBS e incubar em câmara húmida com anticorpos primários contra os componentes críticos autofagia (por exemplo, p62 / SQSTM1) ou o citoesqueleto septina (SEPT2, SEPT6, SEPT7, SEPT9, e SEPT11 são expressos em células HeLa) durante 30 min (a temperatura ambiente) durante a noite (a 4 ° C).
- Lave as células duas vezes com PBS 1x e incubar em câmara húmida com anticorpos secundários, e rotular actina filamentosa (F-actina) com faloidina, durante 30 minutos (à temperatura ambiente) durante a noite (cerca de 4 ° C). Para a coloração de núcleos de células de acolhimento adicionar 4 ", 6-diamidino-2-fenilindole (DAPI).
- Lave as células em PBS 1x e montar as lamelas de vidro em lâminas com meio de montagem.
- Imagem microscópica de células HeLa infectadas
- Para a imagem da infcélulas ected usar um epifluorescência ou microscópio confocal e uma objectiva 63X 100X ou para identificar DAPI marcado Shigella.
NOTA: Como mostrado nas Figuras 1A - 1C, gaiolas Septin pode ser visualizado como anel de estruturas semelhantes, ~ 0,6 m de diâmetro, cerca de bactérias citosólicas polimerização de actina e recrutamento (por exemplo, marcadores de autofagia, p62 e LC3) 7,8. Em contraste, as bactérias polimerizadores caudas de actina não será compartimentada por gaiolas Septin e não serão direcionados para a autofagia 7,8. - Usando um microscópio de epifluorescência ou confocal e uma objectiva 63X ou 100X, quantificar o número de bactérias intracelulares, por campo microscópico. Também quantificar o número de bactérias aprisionadas em gaiolas Septin e específicas para a autofagia, ou polimerização caudas de actina e escapando autofagia.
- Para determinar a percentagem de bactérias aprisionadas em gaiolas Septin ou polimerização de actina caudas, tomar uma série de imagens Z-stack de INFEcted células, processar as imagens e contar pelo menos 500-1.000 bactérias por ensaio de, pelo menos, três experiências independentes.
- Para a imagem da infcélulas ected usar um epifluorescência ou microscópio confocal e uma objectiva 63X 100X ou para identificar DAPI marcado Shigella.
2 Análise Funcional de autofagia e do citoesqueleto In Vitro
NOTA: Ambos genética e abordagens farmacológicas podem ser utilizados para perturbar autofagia em células de cultura de tecidos infectadas, bem como o impacto destes tratamentos sobre o decurso da infecção pode ser controlada.
- O silenciamento mediado por siRNA
- Placa de 0,8 x 10 5 células HeLa sobre lamelas de vidro em placas de 6 poços em meio completo.
- Transfectar o dia seguinte usando um reagente de transfecção à base de lípidos com ARNsi contra autofagia e / ou marcadores do citoesqueleto.
- Após o período de incubação desejado, infectar as células com a Shigella, como descrito na secção 1.3.
- Corrigir e rotular as células como descrito na seção 1.4.
- Manipulação farmacológica
NOTA: O citoesqueleto podem ser manipulados farmacologicamente, por exemplo, para o uso despolimerizar citoesqueleto de actina citocalasina D ou latrunculin B, para despolimerizar microtúbulos usar nocodazole, para bloquear a actividade actomiosina uso blebbistatin, ou para interromper septina utilização montagem forchlorfeneuron. Autophagy pode ser estimulada através da utilização de rapamicina ou bloqueados usando bafilomicina.- Para manipular o citoesqueleto durante a infecção Shigella, primeiro infectar as células com Shigella, tal como descrito no ponto 1.3 e dar tempo suficiente para que as bactérias entram nas células e escapar do fagossoma para o citosol (eg.,> 1,5 infecção hr post).
- Dilui-se as drogas a partir da solução-mãe de solução de estoque [suspensas em dimetil-sulfóxido (DMSO)] em MEM para uma concentração final de 5 M (citocalasina D, latrunculina B, nocodazol), 20 H (forchlorfeneuron) ou 50 M (blebbistatin), e tratamento de células de 30 min a 37 ° C. A quantidade total de droga (volume de DMSO / dmistura tapete) adicionado por placa / frasco de células é de 1-5 l (dependendo da solução estoque) por 2 ml de mídia. Tratar as células com uma dose semelhante de DMSO diluído em MEM como um controlo negativo.
- Corrigir e rotular as células como descrito na seção 1.4.
NOTA: Para a manipulação do fluxo autofágica (em células infectadas ou não infectadas), estender o tratamento medicamentoso com rapamicina (20 nM) ou bafilomicina (160 Nm) de 4 a 12 horas.
- Western Blot
NOTA: autophagic actividade pode ser quantificada através da medição do nível de proteína de marcadores autofagia tais como p62 e LC3.- Após o período de incubação desejado, recolha e lise das células para imunoblotting. Extratos protéicos executado em 8, 10, ou 14% de gel de acrilamida.
- Fluxo autofágica, ie. a taxa de autofagia, pode ser analisado como descrito no 21,22.
- Imagem microscópica e quantificação
- Usando um microscópio de epifluorescência ou confocal e um objeto 100X 63X ouive, o efeito de ARNsi ou tratamento de infecção por Shigella droga pode ser avaliada por microscopia quantitativa (isto é, a contagem de autofagossomas, gaiolas Septin e caudas de actina), tal como descrito na secção 1.5 e mostrados nas Figuras 2A e 2B.
3. imagem in vivo de S. flexneri Interações com autofagia e do citoesqueleto
NOTA: O modelo de infecção por Shigella peixe-zebra pode ser usado para investigar encarceramento septina autofagia e in vivo 19.
- Prepare S. flexneri
- Cultura S. flexneri como descrito na seção 1.1.
- No OD 600 = 0,3-0,6, rotação 8 ml subcultura bacteriana a 1.000 xg durante 10 min. Lava-se a pelete com 1x PBS e centrifugação a 1000 xg durante 10 min.
- Ressuspender o sedimento em 80 mL de 0,1% de vermelho de fenol 1x PBS para se obter ~ 2.000 bactérias / nl. Mantenha a bactériapreparação erial em gelo para retardar o crescimento.
Nota: A adição de fenol vermelho vai ajudar a visualizar o inóculo ao injetar em larvas.
- Prepare peixe zebra Larvas para Injeção
NOTA: Peixe-zebra são definidos como ovos e são identificados como embriões até 72 horas após a fertilização, quando são chamados larvas.- Breed peixe-zebra adultos tal como descrito no Westerfield 23 colocando quatro machos e 8 fêmeas (geralmente uma proporção de 2: 1) para um tanque de peixe separada com o fundo coberto com berlindes (que vai impedir adultos de comer os ovos gerados). Alternativamente, coloque cestos de coleta de ovos no interior dos tanques de criação na noite anterior.
NOTA: Os ovos são fertilizados ~ 30 min após as luzes se acendem na instalação zebrafish 23, e deve ser coletado o mais rápido possível para evitar o crescimento de fungos. Cestas de coleta de ovos servem para recolher os ovos para que eles possam ser facilmente colhidas e também proteger os ovos dos adultos. - Recolhe-se o embriãos e limpá-los por lavagem em media embrião (E2) com 0,003% de alvejante para 10 min. Remover E2 com lixívia, lavar os embriões em meio 5x E2, e os embriões crescem em placa de Petri de 10 centímetros (100 embriões / 50 ml de meio de E2) a 28 ° C.
- Se vão ser utilizados embriões ou larvas para estudos de microscopia, às 24 horas após a fertilização adicionar 0,003% de N-feniltioureia E2 ao meio para evitar a melanização. Mantenha os embriões a 28 ° C para o desenvolvimento normal.
NOTA: larvas do peixe está pronto para a infecção em 72 horas após a fertilização. - Para procedimentos de infecção e de microscopia, anestesiar larvas do peixe em 200 g / ml tricaina em E2.
- Breed peixe-zebra adultos tal como descrito no Westerfield 23 colocando quatro machos e 8 fêmeas (geralmente uma proporção de 2: 1) para um tanque de peixe separada com o fundo coberto com berlindes (que vai impedir adultos de comer os ovos gerados). Alternativamente, coloque cestos de coleta de ovos no interior dos tanques de criação na noite anterior.
- Preparação de peixe zebra Larvas para intravenosa e infecção local
NOTA: Para avaliar a sobrevivência do peixe-zebra durante a infecção Shigella, realizar injeções intravenosas caudais. Para visualizar o recrutamento de marcadores Septin e autofagia a Shigella, execute infecção em sites localizados, tais como o músculo da cauda.- Para uma injecção intravenosa caudal, posicionar as larvas anestesiados lateralmente com o lado dorsal voltada para a agulha. Como mostrado na Figura 3A, colocar a ponta de agulha perto (posterior) da abertura urogenital, apontando para a veia da cauda, e perfurar a pele e proporcionar a dose desejada de bactérias (volume de injecção de 1-5 nl).
NOTA: A infecção por via intravenosa é um desafio para executar e levará várias semanas de treinamento para se sentir confortável com este procedimento. A injeção de fenol vermelho (sem bactérias) para formação vai ajudar a avaliar o local da injeção corretamente.
NOTA: No caso de Shigella, doses experimentos dependentes têm demonstrado que uma infecção de baixa dosagem (<1.000 CFU) é apagada dentro de 48 horas, e uma infecção de alta dose (> 4.000 CFU) leva para sediar a mortalidade em 48 h 19. - Para uma infecção do músculo da cauda, posicione as larvas anestesiados como descrito no ponto 3.3.1. Como mostrado na Figura 3A, colocar o cuidado agulhay sobre somitos musculares (isto é, segmentos de músculo esquelético) e injectar um pequeno volume (isto é., 1 nl) da preparação bacteriana.
- Para uma injecção intravenosa caudal, posicionar as larvas anestesiados lateralmente com o lado dorsal voltada para a agulha. Como mostrado na Figura 3A, colocar a ponta de agulha perto (posterior) da abertura urogenital, apontando para a veia da cauda, e perfurar a pele e proporcionar a dose desejada de bactérias (volume de injecção de 1-5 nl).
- Injeção intravenosa de bactérias em larvas
- Puxe microcapilares vidro de borosilicato, conforme descrito em 24.
- Conecte agulha para o titular do manipulador manual de grosso tridimensional e quebrar a ponta da agulha com uma pinça fina.
- Para colocar a agulha, coloque uma gota de cultura bacteriana em uma lamela. Ligar o cilindro de gás e microinjetor, ligeiramente submergir a ponta da agulha dentro da gota, e encher-se a agulha com a quantidade desejada de preparação bacteriana.
- Para calibrar o volume de injeção, coloque uma gota de óleo mineral em uma lamela e injetar a preparação bacteriana. Medir o diâmetro da gota utilizando um micrómetro e calcula o volume injectado [V = (4/3) πr 3].
NOTA: Usando configurações de injeção de 40 psi e 50 ms com uma bacteripreparação al como descrito na seção 3.1 vai dar ~ 2.000 UFC / nl. - Preparar a placa de injecção, utilizando um molde de plástico, tal como descrito em Westerfield 23.
- Transferir as larvas para a placa de injeção e alinhá-los usando um pincel fino. Orient e injetar as larvas, como descrito no ponto 3.3.1.
- Para a avaliação da sobrevivência de peixe-zebra, a transferência das larvas infectadas individualmente em placas de 24 poços em 1 ml de E2 / poço e incubar a 28 ° C. Monitorizar as larvas infectadas por dia durante os próximos 2-5 dias e a sobrevivência trama ao longo do tempo (Figura 3B).
- Chapeamento de peixe zebra Larvas de Quantificação bacteriana
NOTA: Trabalhar sob um capuz estéril para evitar contaminação.- Para avaliar o número de bactérias injetadas no peixe (no tempo 0 horas após a infecção) e para a quantificação de bactérias em momentos desejados, sacrificar larvas do peixe com uma overdose de tricaina (200-500 mg / L). Coloque larvas individuais em 1,5 ml de poltubo de microcentrífuga ypropylene com 200 ul de 0,1% de óxido de etileno condensado de octilfenol 1x PBS e homogeneizar mecanicamente utilizando um pilão.
NOTA: Para confirmar a carga bacteriana no volume de injeção, bomba de uma dose igual a uma estéril queda 1x PBS e placa-lo. - Fazer uma diluição em série dos homogenatos de larvas de peixes-zebra em água estéril e prato em caldo lisogenia (LB) agar. As larvas podem ser banhado alternativamente em placas Congo Red TCS para discriminar entre Shigella ter mantido o plasmídeo virulento ou não.
NOTA: Placa 3 ou mais peixes não infectadas como controlo para verificar o estado do larvas do peixe utilizado para a infecção. - Após incubação durante a noite das placas a 37 ° C, a contagem de colónias bacterianas. Como mostrado na Figura 3C, representam usando uma escala logarítmica.
NOTA: carga bacteriana durante a infecção de larvas do peixe também pode ser visualizado utilizando fluorescente etiquetado Shigella e eu microscópicamaging como descrito na seção 3.7 ou 3.8 (Figura 3D).
- Para avaliar o número de bactérias injetadas no peixe (no tempo 0 horas após a infecção) e para a quantificação de bactérias em momentos desejados, sacrificar larvas do peixe com uma overdose de tricaina (200-500 mg / L). Coloque larvas individuais em 1,5 ml de poltubo de microcentrífuga ypropylene com 200 ul de 0,1% de óxido de etileno condensado de octilfenol 1x PBS e homogeneizar mecanicamente utilizando um pilão.
- Peixe-zebra Larvas Imunocoloração
- Em intervalos de tempo desejados, sacrificar as larvas com uma overdose de tricaina. Recolhe-se o peixe em tubos de 1,5 ml de microcentrífuga de polipropileno (10 a 20 larvas / tubo).
- Fixar as larvas usando 4% de paraformaldeído com 0,4% de óxido de etileno condensado de octilfenol em 1x PBS e incubar num agitador orbital (a fim de evitar aglomeração das larvas) durante 2 horas (à temperatura ambiente) ou durante a noite (cerca de 4 ° C).
NOTA: Electron microscopia pode ser usado para análises ultra-estruturais de larvas do peixe infectado. Neste caso, os embriões anestesiados devem ser fixadas e processadas de acordo com Mostowy et al 19. - Lavar 3x em 1x PBS, 0,4% de óxido de etileno condensado de octilfenol, durante 5 min, depois bloquear na solução de bloqueio (10% de soro fetal de vitelo, 1% de DMSO, 0,1% de monolaurato de polioxietilenossorbitano em 1x PBS) durante 1 hora à temperatura ambiente.
- Dilute o anticorpo primário em solução de bloqueio. Adicionar larvas de anticorpo primário diluído e incuba-se durante a noite a 4 ° C num agitador orbital. Use anticorpos primários, tal como descrito acima na secção 1.4.3.
- Lavam-se as larvas 4x durante 15 min em 0,1% de monolaurato de polioxietilenossorbitano 1x PBS, à temperatura ambiente.
- Dilui-se o anticorpo secundário em solução de bloqueio. Adicionar larvas de anticorpo secundário diluído e incuba-se durante a noite a 4 ° C num agitador orbital. Utilize os mesmos anticorpos secundários e phalloidin como descrito na seção 1.4.4.
- Lavar 4x durante 15 min em 0,1% de monolaurato de polioxietilenossorbitano 1x PBS, à temperatura ambiente. Para a coloração de núcleos de células hospedeiras adicionar DAPI (150 nM de concentração final), durante a primeira destas lavagens de 15 min.
- Para a preservação de larvas marcado com fluorescência, incubá-las progressivamente num gradiente de glicerol de 15, 30, 60, e 80% diluído em PBS 1x e 0,1% de monolaurato de polioxietilenossorbitano, durante 2 horas (a têmpera quartoature) durante a noite (cerca de 4 ° C).
NOTA: manchado larvas podem ser armazenadas por longos períodos de tempo em glicerol a 80%, a 4 ° C (por exemplo, 4 meses.).
- Imagem microscópica do fixo Zebrafish Larvas
- Transferir glicerol fixo larvas incorporado a uma pequena gota de 80% de glicerol em uma placa de Petri de 35 mm (por estereomicroscopia) ou prato de fundo de vidro cheio (para miscopy confocal).
- Tome Z-stack série de imagens de larvas infectadas e processar as imagens conforme necessário.
- Use uma epifluorescência ou um microscópio confocal e objectiva 10X ou 20X para imagiologia organismo inteiro. Em seguida, use um microscópio confocal e objetiva de 40X, 63X, 100X ou para visualizar as células individuais eo recrutamento de autofagia e do citoesqueleto marcadores para bactérias individuais in vivo 19 (Figuras 4A e 4B).
NOTA: Infect peixe no músculo da cauda e montar em glicerol plana ao longo da parte inferior do prato de vidro de fundo para permitir eAfoco sy.
- Viver microscópica imagem de infectados Zebrafish Larvas
NOTA: As larvas são opticamente acessíveis, assim, em autofagossomas in vivo pode ser visualizada usando a linha transgénico de peixe-zebra de GFP-Lc3 25. Infectar larvas do peixe como descrito na seção 3.3 e montagem, conforme descrito nesta seção.- Prepare a baixo ponto de fusão a 1% de agarose (LMA) em E2 e deixa-se arrefecer para 35-37 ° C para evitar danos larvas / assassínio. Distribuir gotas de LMA em uma placa de Petri de 35 mm (para lupa estereoscópica) ou prato fundo de vidro completo (por microscopia confocal).
- Transferência anestesiados larvas do peixe individualmente (com o mínimo de água possível) para a LMA cai. Larvas Orient para a posição desejada usando um pincel e aguarde a agarose para solidificar.
- Cobrir a superfície inteira prato com LMA e sobreposição com E2 contendo 200 ug / ml tricaina para evitar a preparação de secar e para permitir que os peixes para a troca de oxigénio da água.
- Use um epifluorescência ou microscópio confocal e uma objetiva de 10X ou 20X para geração de imagens de toda a larvas do peixe. Usar um microscópio confocal e uma objectiva de 40x, 63X, ou 100X para visualizar authopagosomes bacterianas (por exemplo, GFP-Lc3 + ve vacúolos circundantes Shigella) in vivo.
- Dê uma pilha Z de larvas infectadas ao longo do tempo (por exemplo., A cada 2 minutos ao longo de várias horas) para visualizar autofagossomas, e sua dinâmica, em tempo real.
4 Análise Funcional de autofagia e do citoesqueleto In Vivo
Nota: O impacto das perturbações farmacológicas e genéticas de autofagia no curso da infecção pode ser controlada ao nível inteiro animal, e ao nível da célula individual.
- A autofagia Manipulação por Morfolino Injeção
- Reconstituir morfolino oligonucleótidos em água estéril a uma solução de reserva de 1 mM, por aquecimento a 65 ° C durante 10 min. Lojaà temperatura ambiente.
NOTA: morfolínicos injeções de oligonucleotídeos deve ser realizada em 1-4 de embriões em estágio de célula. - Preparar a solução de trabalho morfolino oligonucleótido com estéril 0,1% de vermelho de fenol em solução salina tamponada com fosfato de Dulbecco. Coloque a agulha como descrito no ponto 3.4.2., Morfolino volume de injeção oligonucleotídeo pode ser calibrado conforme descrito no ponto 3.4.3.
NOTA: O fenol vermelho vai ajudar a visualizar o volume injetado. - Preparar uma câmara de posicionamento do embrião (ie., Uma lâmina de microscópio colado com cianoacrilato em um Petri tampa prato de 10 cm com bordas que enfrentam a agulha parcialmente removido). Transferir 1-4 embriões em estágio de célula para a câmara com uma pequena quantidade de água e alinhá-los com um pincel fino.
- Penetrar o córion ea gema sem problemas. Uma vez dentro, pressiona o pedal para injectar o volume desejado de solução de morfolino oligonucleótido.
NOTA: minimizar o volume de injeção de 0,5-2 nl; volumes maiores than 5 nl pode causar danos ao desenvolvimento e aumentar a mortalidade de ovos. - Após a microinjeção, os embriões limpas (por branqueamento, como descrito na seção 3.2) e incubar-los em uma placa de Petri com E2 a 28 ° C.
- Infectar 72 horas controle após a fertilização (ou seja, larvas do peixe injetados com controle morfolino oligonucleotídeo) ou morphants p62 (ie., Larvas do peixe injetados com p62 morfolino oligonucleotídeo) com Shigella como descrito na seção 3.4. Avaliar a sobrevida e carga bacteriana para os próximos 2-5 dias, conforme descrito na seção 3.5. Imagem fixa larvas do peixe como descrito na seção 3.7 e em destaque na Figura 4C, ou imagem viva larvas do peixe como descrito na seção 3.8.
NOTA: A dose eficaz de oligonucleótido morfolino pode ser avaliada com base na sua eficácia para inibir o splicing transcrição ou tradução da proteína (ver discussão).
- Reconstituir morfolino oligonucleótidos em água estéril a uma solução de reserva de 1 mM, por aquecimento a 65 ° C durante 10 min. Lojaà temperatura ambiente.
Resultados
Após a infecção de células de cultura de tecidos in vitro, S. flexneri pode escapar do fagossoma e invadem o citosol. No citosol, as células hospedeiras podem impedir a motilidade à base de actina de Shigella por compartimentar bactérias dentro das gaiolas Septin (Figura 1A). As bactérias aprisionadas por gaiolas Septin também podem ser marcadas por marcadores autofagia p62 (Figura 1B) e LC3 (Figura 1C). Estas observações destacar um novo mecanismo de defesa do hospedeiro que restringe a disseminação de patógenos invasores, e também revelam novas ligações entre autofagia e do citoesqueleto. Surpreendentemente, a depleção de marcadores autofagia reduz significativamente septina encarceramento de bactérias (Figura 2A), e também o trabalho mostrou que a depleção de septina encarceramento reduz significativamente o recrutamento de marcadores autofagia 8. Deste modo, pelo menos no caso de Shigella, Septin conjunto de gaiola e Formações autofagossomon pode ser vista como processos interdependentes. Outros requisitos para celulares compartimentalização de Shigella por gaiolas Septin incluem a polimerização de actina e atividade actomiosina (Figura 2B).
Não existe um modelo natural, rato de shigelose, e investigação de Shigella patogênese, biologia septina e autofagia bacteriana in vivo pode se beneficiar de um novo modelo animal de infecção, as larvas de peixe-zebra 19. É possível infectar larvas do peixe por bactérias de diversos sítios anatômicos, como injetar injeções intravenosas caudais para experiências de sobrevivência, e injeções musculares da cauda para a microscopia in vivo (Figura 3A). Dependendo da dose, S. flexneri injetado em larvas do peixe ou podem ser apagados dentro de 48 horas após a infecção, ou pode resultar em uma infecção progressiva e fatal, em última análise (Figuras 3B - 3D). Shigella virulência factors são expressos a 28 ° C, a temperatura óptima de crescimento do peixe-zebra, e infecção por Shigella peixe-zebra é estritamente dependente do seu sistema de secreção de tipo III (T3SS) 19, um elemento determinante de virulência em doença humana. Tomados em conjunto, estas observações indicam que a larva do peixe-zebra representa um novo hospedeiro valioso para a análise in vivo da infecção por Shigella.
A acessibilidade óptico de larvas do peixe permite a visualização de enjaulamento septina in vivo (Figura 4A), um feito que nunca foi realizado usando modelos hospedeiras de mamíferos. Para complementar a evidência que as gaiolas Septin reter bactérias visadas para autofagia in vivo, pode-se infectar larvas de peixes-zebra transgénicos que expressam a GFP-Lc3 e observar recrutamento marcador autofagia a Shigella (Figura 4B). Para a análise ultraestruturais de autofagossomas Shigella in vivo, elmicroscopia ectron pode ser utilizado para mostrar claramente o sequestro citosólica de bactérias por vacúolos de dupla membrana 19. A autofagia é visto como um componente-chave da imunidade celular-autônomo e um mecanismo crucial de defesa contra bactérias intracytosolic 14-16. Para caracterizar a função autofagia in vivo, p62-morfolino tratadas larvas de peixe-zebra pode ser utilizado. Ao contrário das máquinas núcleo autofagia [ex., As proteínas 36 autofagia relacionado (ATG) 26], p62 não é essencial para o desenvolvimento dos vertebrados 27 e larvas de peixe-zebra, assim, pode desenvolver-se normalmente antes da infecção. Surpreendentemente, larvas empobrecido-p62 inoculadas com S. flexneri resultado num aumento significativo da mortalidade e uma maior carga bacteriana 19. De acordo com o trabalho in vitro mostrando que conjunto de gaiola septina é interdependente com formação autofagossomo 7,8, recrutamento septina a Shigella é claramente reduzido em larvas depleção de p62 ( Figura 4C). Estes dados demonstram que a sobrevivência de peixe-zebra depende autofagia mediada por p62 para controlar a infecção bacteriana intracelular.
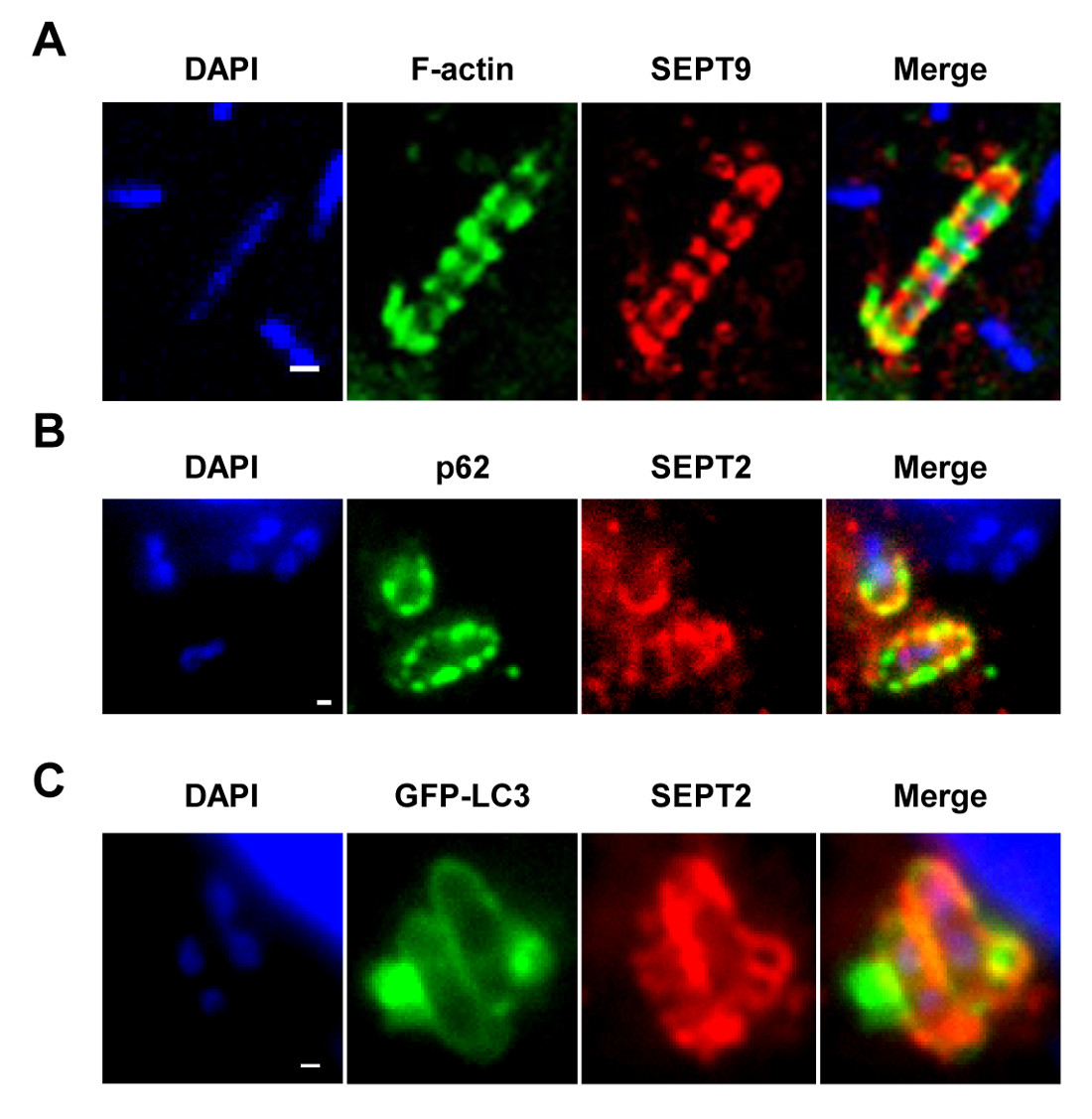
Figura 1 A gaiola septina in vitro. (A) células HeLa foram infectadas com S. flexneri, durante 4 h 40 min, fixa, marcadas com anticorpos para SEPT9 e faloidina, e visualizados por microscopia confocal. A barra de escala, 1 um. (B) As células HeLa foram infectadas com S. flexneri, durante 4 h 40 min, fixa, marcadas com anticorpos para p62 e SEPT2, e visualizados por microscopia de luz fluorescente. A barra de escala, 1 um. Células (C) HeLa foram transfectadas com GFP-Atg8 / LC3, infectado com S. flexneri, durante 4 h 40 min, fixa, marcadas com anticorpos para SEPT2, e visualizados por mi fluorescentescroscopy. A barra de escala, 1 um. Estes números foram modificados a partir Mostowy et al 7.
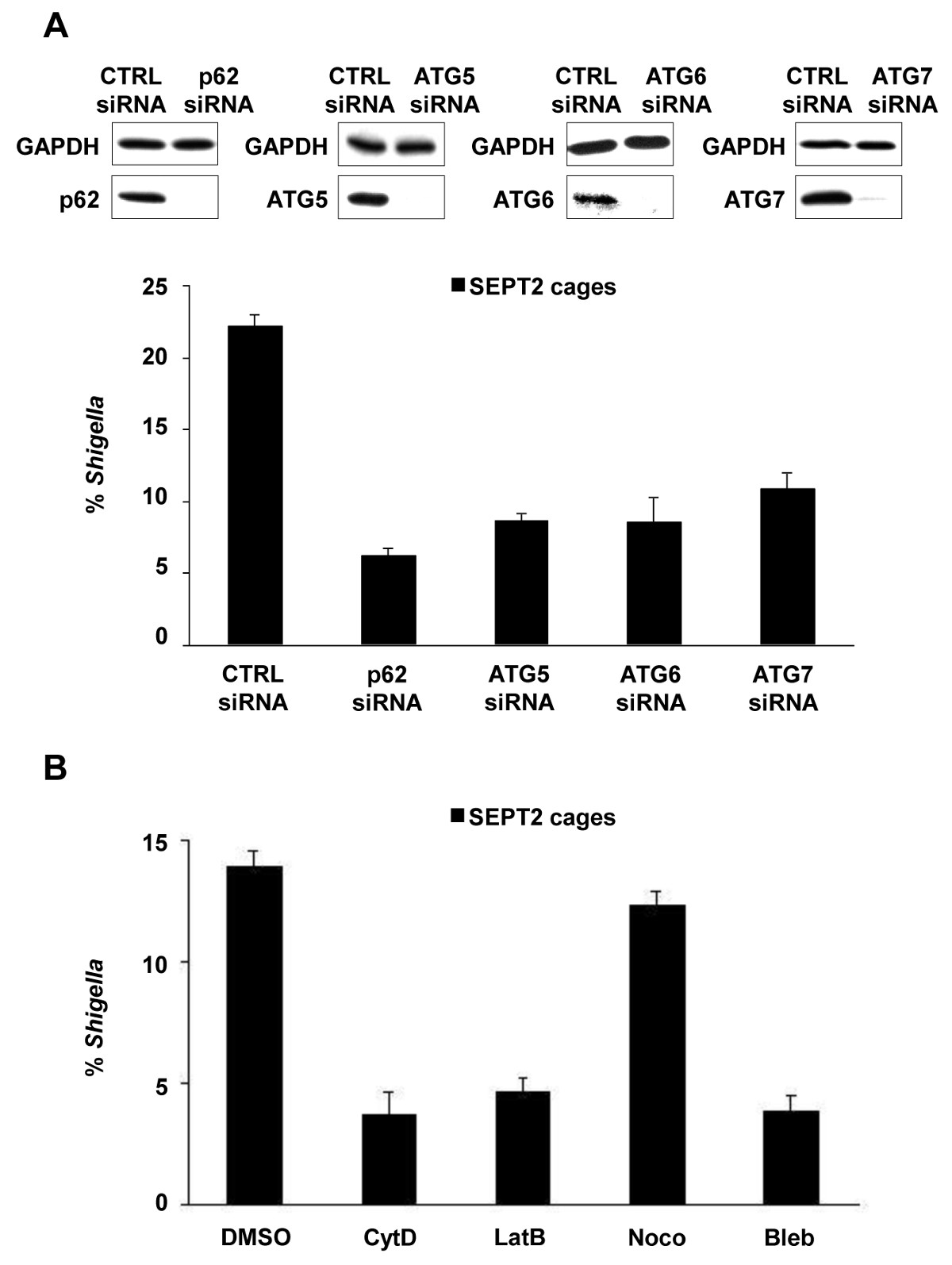
Figura 2. requisitos celulares para Shigella formação gaiola -septin. (A) células HeLa foram tratadas com controle (CTRL), p62, ATG5, ATG6 ou ATG7 siRNA. Lisados de células inteiras das células tratadas com siRNA foram imunotrans para GAPDH, p62, ATG5, ATG6, ou ATG7 para mostrar a eficiência do esgotamento siRNA (superior). células tratadas com siRNA foram infectados com S. flexneri, durante 4 h 40 min, fixa, e rotuladas para microscopia quantitativa. Gráficos (em baixo) representam a média ± SEM% de Shigella em gaiolas SEPT2 de n ≥3 experiências por tratamento. (B) células HeLa foram infectadas com S. flexneri, tratado com DMSO, citocalasina D (CYTD), latrunculin B (LATB), nocodazole (Noco), ou blebbistatin (Bleb) e após 4 h 40 min foram fixados e rotulado para microscopia quantitativa. Os gráficos representam a média ± SEM% de Shigella em gaiolas SEPT2 de dois experimentos independentes por tratamento. Estes números foram modificados a partir Mostowy et al 7.
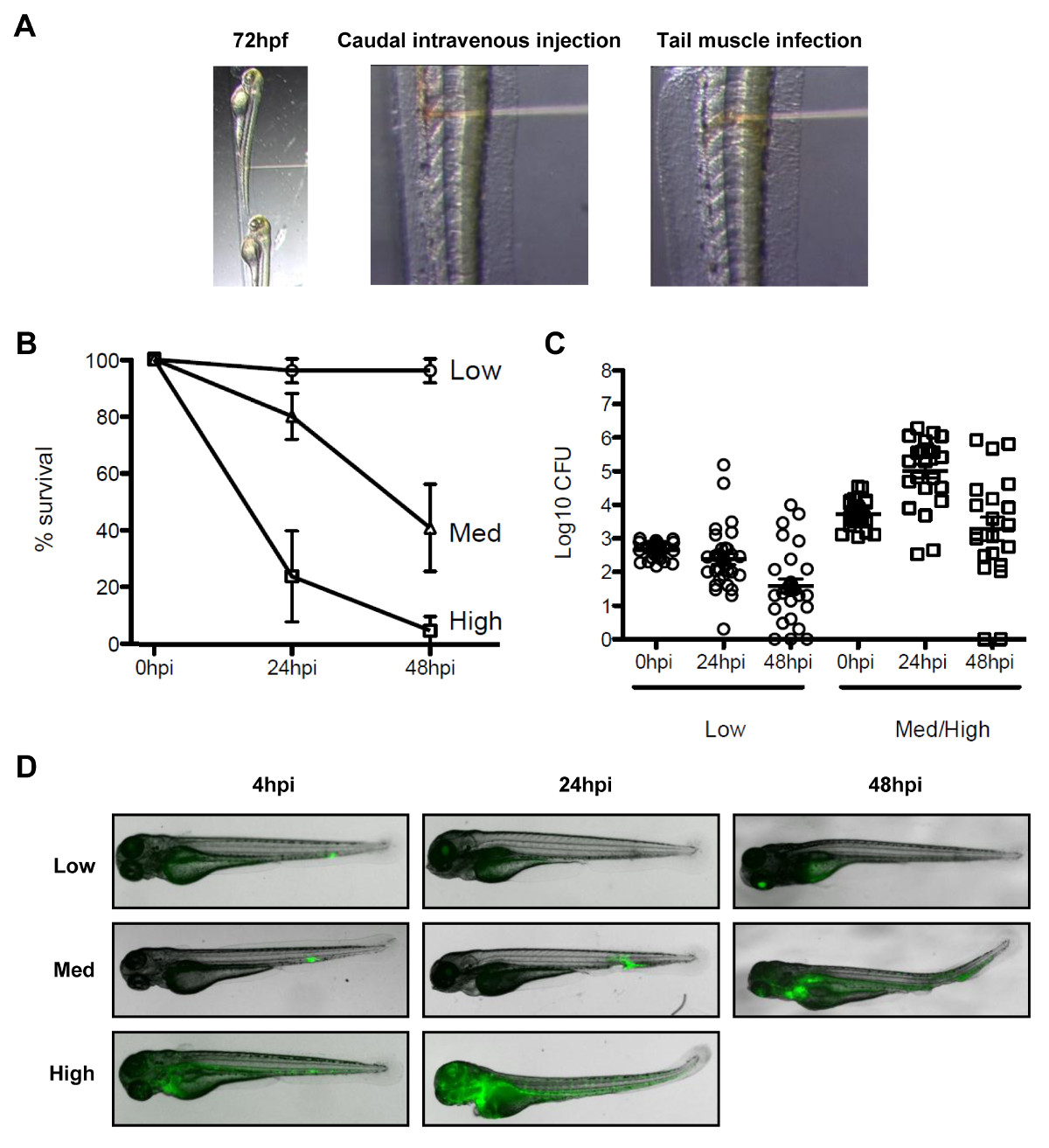
Figura 3 O modelo de infecção por Shigella peixe-zebra. (A) Imagens para ilustrar orientação da larva do peixe-zebra, ao microscópio estereoscópico. (Painel esquerdo) Zebrafish larvas 72 horas pós fertilização foram posicionados lateralmente na placa de injeção com seu lado dorsal voltada para a agulha de injeção. Infecção (painel do meio) foi realizada por meio da corrente sanguínea injecting as bactérias (solução vermelho) na veia caudal, posterior à abertura urogenital. (Painel direito) Infecção no músculo da cauda foi realizada através da injeção de bactérias (solução vermelha) ao longo de um somito. (B) As curvas de sobrevida de 72 horas após a fertilização larvas injetadas com várias doses de S. flexneri e incubados a 28 ° C durante 48 horas após a infecção. O inoculo foi classificada como eficaz baixo (<10 3 CFU, círculos abertos), médio (~ 4 x 10 3 CFU, triângulos abertos) ou alta (~ 10 4 UFC, quadrados abertos). A média de% ± SEM (barras horizontais) de n ≥3 experimentos por turma inóculo. (C) enumeração de bactérias vivas em homogeneizados de larvas indivíduo em vários momentos após a infecção medido por plaqueamento em LB. Note, apenas larvas depois de ter sobrevivido a infecção estão incluídos na análise enumeração. A média ± SEM (barras horizontais) também mostrado. (D) Distribuição de GFP Shigella determinada pelaimagens ao vivo usando um microscópio estereoscópico fluorescente em vários momentos após a infecção usando um, média ou inóculo alta dose baixa (caudais injeções intravenosas). Sobreposição de imagem de transmissão (cinza) e fluorescência da GFP (verde) (B) de -. (D) Estes valores foram modificados a partir Mostowy et al 19.
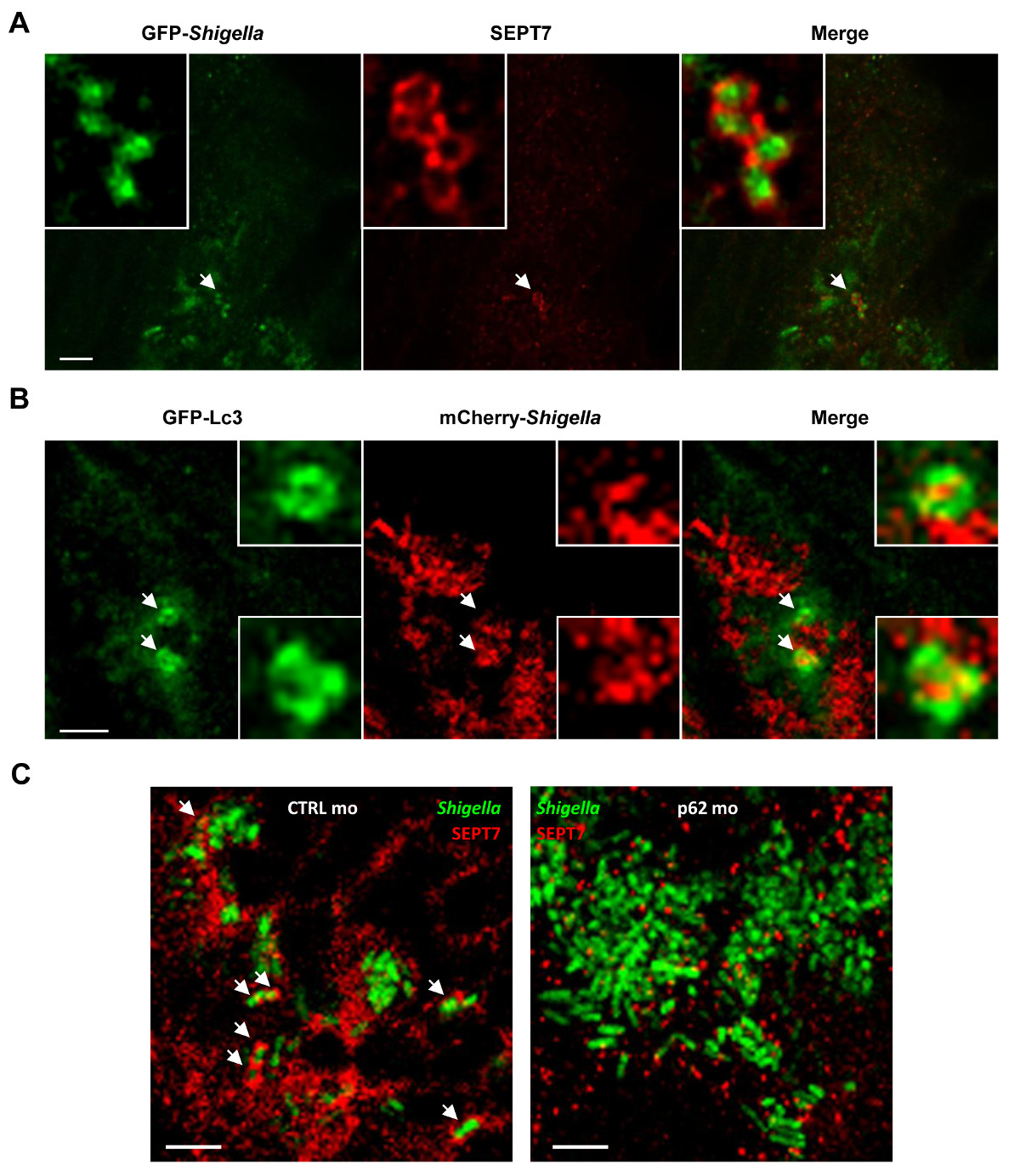
Figura 4.-se a biologia celular de Shigella infecção in vivo. (A) de larvas de peixe-zebra foram infectados no músculo da cauda com GFP Shigella (dose baixa), durante 24 h, fixadas, marcadas com anticorpos contra SEPT7 (vermelho) e a GFP (green ), e fotografada por microscopia confocal. Barra de escala, 5 um. (B) GFP-Lc3 larvas de peixe-zebra foram infectadas com mCherry- Shigella (dose média) para4 horas, fixado, marcadas com anticorpos contra mCherry (vermelho) e a GFP (verde), e visualizada por microscopia confocal. . Barra de escala, de 1,5 um (C) larvas do peixe tratado com controle (CTRL; imagem à esquerda) ou p62 (imagem à direita) morpholinos foram infectados com GFP Shigella, durante 4 horas (dose média), fixo, marcadas com anticorpos contra SEPT7 ( vermelho) e a GFP (verde), e visualizada por microscopia confocal. Setas destacar alguns exemplos de Shigella aprisionados em gaiolas Septin (Ctrl) ou não (p62 empobrecido) uma infecção 4 horas post. Barra de escala, 5 um. Estes números foram modificados a partir Mostowy et al 19.
Discussão
Ao monitorizar autofagia e o citoesqueleto in vitro utilizando células de cultura de tecidos, os protocolos descritos nas secções 1 e 2 pode ser aplicada a uma grande variedade de tipos de células de cultura de tecidos. Além disso, a seguir autofagia (por exemplo, Atg8 / LC3 + ve autofagossomas) e do citoesqueleto (por exemplo. Caudas, actina, gaiolas septina) dinâmica em tempo real durante a infecção por Shigella usando imagens ao vivo, as células de cultura de tecidos podem ser transitoriamente transfectadas com GFP, construções RFP- ou CFP-marcado como descrito anteriormente 7,8. Para aumentar a percentagem de células infectadas por Shigella (isto é, em geral, desejável, para análise em tempo real, uma vez que a Shigella pode invadir 5-30% de células HeLa a 100: 1. MOI), adicionar directamente 400 uL de Shigella (DO600 = 0,3 -0.6) para as células em 2 ml MEM (sedentos de soro) e aguarde pelo menos 1,5 horas após a infecção para a entrada de bactérias suficiente, escapar do fagossoma, replicação, aureconhecimento tophagy e septina enjaulamento. Alternativamente, pode-se usar a estirpe de Shigella M90T AAII que expressa a adesina AfaE e foram muito mais elevadas capacidades de invasão das células epiteliais em comparação com a estirpe 28 M90T. De notar que a tensão M90T AFAI ainda não foi testado in vivo usando zebrafish. As placas de colónias de Shigella podem ser mantidas a 4 ° C durante 2-3 dias e utilizados para várias experiências. No entanto, ao longo do tempo, as colónias de Shigella que perderam o plasmídeo de virulência pode também absorver o Vermelho do Congo e parecem ter retido a sua plasmídeo de virulência. Por este motivo, recomendamos usar stocks bacterianas frescos sempre que possível.
Ao monitorar a biologia celular da infecção in vivo, os protocolos descritos nas secções 3 e 4 usam wildtype AB linha de peixe-zebra. Para monitorar Shigella interações -leukocyte, linhas de peixes-zebra transgénicos pode ser usado, por exemplo, a MPX: GFP ou lyz: DsRed para visuaisize neutrófilos 19,29,30 ou mpeg1: mCherry visualizar macrófagos 19,31. Para visualizar autofagia in vivo, a linha transgénico de peixe-zebra de GFP-Lc3 19,24 pode ser utilizado tal como descrito na secção 3.8.
Para perturbar a autofagia in vivo, a dose efetiva morfolino oligonucleotídeo tem de ser avaliada experimentalmente com base na sua eficiência para inibir splicing transcrição e tradução de proteínas. É aconselhável realizar uma experiência de titulação e para confirmar o esgotamento por meio de RT-PCR (por splicing oligonucleótido morfolino) ou por SDS-PAGE (por translação oligonucleótido morfolino) 32. Isolamento de RNA a partir de embriões de peixes-zebra ou larvas podem ser realizadas utilizando extracção tiocianato de guanidina-fenol-clorofórmio. Para extrair a proteína a partir de larvas de peixe-zebra (8 a 15 larvas / tubo), homogeneizar mecanicamente utilizando um pilão em 200 ul de tampão de lise (Tris 1 M, 5 M de NaCl, 0,5 M de EDTA, 0,01% de óxido de etileno octilfenol condensate, e inibidores da protease). Tubos de centrifugação a 19.000 xg, a 4 ° C durante 15 minutos e transferir o sobrenadante para um novo tubo. Adicionar tampão Laemmli e a amostra é aquecida a 95 ° C durante 15 min. Os lisados podem ser armazenados a -80 ° C até ser necessário, e pode ser avaliada por transferência de Western tal como descrito na secção 2.3.
O peixe-zebra é um excelente modelo in vivo para a aplicação do fármaco. Análise usando oligonucleótidos morfolino pode ser complementada com medicamentos estabelecidos para manipular autofagia (por exemplo, a rapamicina e bafilomicina). Larvas não infectadas e / ou infectadas podem ser tratadas com rapamicina (1,5 uM) ou bafilomicina (80 nM) diluído em E2 e fluxo autophagic pode ser avaliada por transferência de Western como descrito em 25,33. A consequência da manipulação autofagia na evolução da infecção e a sobrevivência das larvas infectadas pode ser avaliada, tal como descrito na secção 3.5.
Em adição ao estudo da célula hospedeiradeterminantes, in vitro e in vivo em protocolos podem ser aplicados para avaliar os determinantes bacterianos necessários para o reconhecimento autofagia, utilizando estirpes mutantes bacterianas que são reconhecidos por autofagia diferencialmente, por exemplo., Shigella ΔicsA (a proteína Shigella IcsA recruta N-WASP e depois Arp2 / 3 para a cauda de actina e formação de gaiola septina; na sua ausência não pode haver caudas de actina, sem gaiolas Septin) e ShigellaΔicsB (Shigella evita a resposta autofágica através da proteína efetora bacteriana ICSB, o que impede o recrutamento de autofagia máquinas para IcsA; na sua ausência Pode haver mais gaiolas Septin, mais a autofagia) 7,8.
Shigella não é um agente patogénico natural de peixe-zebra e cresce de forma óptima a 37 ° C. No entanto, o trabalho tem mostrado que os factores de virulência necessários para a invasão de Shigella, escapar do vacúolo fagocítica e replicação em cyTosol podem ser expressos e são funcionais em larvas de peixe-zebra, a 28 ° C 19. 28 ° C é a temperatura mais comumente utilizada para a criação de peixe-zebra e temperatura padrão para assegurar o desenvolvimento do peixe-zebra normais 23. Surpreendentemente, os principais eventos patogénicos que conduzem a shigelose em seres humanos (isto é, a morte de células de macrófagos, invasão e multiplicação dentro das células epiteliais, disseminação célula-a-célula, a destruição inflamatória do epitélio do hospedeiro) são fielmente reproduzidas no modelo de infecção por Shigella zebrafish 19.
Genes Autophagy e citoesqueleto são ubiquamente expressos e têm uma ampla gama de funções biológicas. Estudos com ratos mostraram que nocaute de autofagia essencial ou 26 genes Septin 5 são letal embrionário, e é provável que alguns destes genes, é também essencial para o desenvolvimento do peixe-zebra (embora este problema pode ser reduzido pelo facto de peixes-zebra possuem múltiplosgenes parálogas 33). Se assim for, há várias alternativas para superar este problema, incluindo (i) o uso de reagentes farmacológicos para regular a autofagia e do citoesqueleto, (ii) morpholinos pode ser ajustada para baixo, (iii) nocaute de genes pode ser concebido apenas para célula específica tipos, e / ou (iv) os genes envolvidos no reconhecimento autophagic que não são essenciais para o desenvolvimento do animal (por exemplo,., p62) pode ser alvejado.
Enquanto o peixe-zebra é um sistema modelo ideal para investigar a autofagia e do citoesqueleto durante a infecção Shigella, ferramentas moleculares não existem actualmente. O campo necessário para gerar novas ferramentas e expressão específica de célula de unidade de as proteínas de interesse. Para derrubar expressão de genes autofagia / citoesqueleto, são necessárias novas sequências de morfolino, e novos métodos para a engenharia de genoma (por exemplo, TALEN, CRISPR / Cas9) pode também ser usado. No entanto, várias ferramentas anteriormente gerados para estudos em seres humanos ou de ratinhopode igualmente trabalhar para peixe-zebra.
As bactérias intracelulares S. flexneri surgiu como um organismo modelo excepcional para abordar questões-chave na biologia, incluindo a capacidade das bactérias para ser reconhecido pelo sistema imunológico 1,2. A célula hospedeira emprega septinas para restringir a mobilidade de S. flexneri e orientá-las para a autofagia, um componente crítico da imunidade celular autônomo 7,8. Estas observações sugerem uma nova estrutura molecular para estudar autofagia e a sua capacidade para degradar as bactérias citosólicas. A grande questão agora é decifrar totalmente os eventos moleculares e celulares subjacentes, e para validar esses eventos analisados in vitro durante a infecção bacteriana in vivo utilizando modelos animais relevantes. Para este fim, o peixe-zebra foi estabelecida como um novo hospedeiro valioso para a análise de S. infecção flexneri 19. As interacções entre as bactérias e as células hospedeiras podem ser visualizados em alta resolução, eo modelo peixe-zebra deve ser útil para a compreensão da biologia celular da infecção por Shigella in vivo. Larvas de peixe-zebra pode ser utilizado para investigar o papel da autofagia bacteriana na defesa do hospedeiro, e trabalho mostrou que a perturbação de que autofagia pode afectar adversamente a sobrevivência do hospedeiro em resposta à infecção por Shigella 19.
As observações geradas a partir de estudo de Shigella, Septin enjaulamento e autofagia in vitro utilizando células de cultura de tecidos e in vivo com larvas do peixe-zebra pode proporcionar avanços fundamentais na compreensão de defesa do hospedeiro. Eles também poderiam sugerir o desenvolvimento de novas estratégias destinadas a combater doenças infecciosas.
Um objetivo fundamental deste relatório é fazer sentido dos eventos moleculares e celulares analisadas in vitro (isto é, a autofagia, caudas de actina, Septin enjaulamento) durante a infecção bacteriana in vivo, no contexto de uma entorganismo ira, utilizando larvas do peixe. Se não está familiarizado com a biologia do peixe-zebra e manuseio, pode referir-se a nos protocolos de profundidade para criação de peixes-zebra adequado 23 e na análise in vivo de infecção zebrafish 19,35.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Trabalho no laboratório SM é apoiado por um Wellcome Trust Research Career Development Fellowship [WT097411MA].
Materiais
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Sigma-Aldrich | B1793 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Borosilicate glass microcapillars | Harvard Apparatus | 30038 | |
| Coarse manual manipulator | Narishige | M-152 | |
| Cytochalasin D | Sigma-Aldrich | C6762 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes | D1306 | |
| Dumont #5 fine tweezers | Fine Science Tools | 11254-20 | |
| Forchlorfeneuron | Sigma-Aldrich | 32974 | |
| Goat anti-mouse IgG (H+L) antibody | Molecular Probes | N/A | |
| Goat ant-rabbit IgG (H+L) antibody | Molecular Probes | N/A | |
| JetPEI transfection reagent | Polyplus transfection | 101-01N | |
| Latrunculin B | Sigma-Aldrich | L5288 | |
| LC3 antibody | Novus Biologicals | NB100-2220 | |
| Low melting agarose | Promega | V2111 | |
| MatTek glass bottom dish | MatTek corporation | P35G-1.0-14 | |
| MEM plus L-alanyl-L-glutamine | GIBCO | 41090028 | |
| MEM non-essential amino acids solution | GIBCO | 11140-035 | |
| Microinjector | Narishige | IM-300 | |
| Micropipette puller device | Sutter Instrument Co., Novato, | P-87 | |
| Mineral oil | Sigma-Aldrich | P35G-1.0-14 | |
| Monoclonal anti-tubulin, acetylated antibody | Sigma-Aldrich | T6793 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| N-phenylthiourea | Sigma-Aldrich | P7629 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Phalloidin | Molecular Probes | A12379 | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Protease inhibitor cocktail | Roche | 4693116001 | |
| p62/SQSTM1 antibody | Cliniscience | PM045 | |
| Rapamycin | Sigma-Aldrich | R8781 | |
| Sodium pyruvate | GIBCO | 11360039 | |
| Transfection reagent | Life Technologies | 12252-011 | |
| Vectashield hard set mounting medium containing DAPI | Vector Laboratories | H-1500 |
Referências
- Ashida, H., et al. Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr Opin Immunol. 23, 448-455 (2011).
- Phalipon, A., Sansonetti, P. J. Shigella's ways of manipulating the host intestinal innate and adaptive immune system: a tool box for survival. Immunol Cell Biol. 85, 119-129 (2007).
- Welch, M. D., Way, M. Arp2/3-mediated actin-based motility: A tail of pathogen abuse. Cell Host Microbe. 14, 242-255 (2013).
- Haglund, C. M., Welch, M. D. Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton. J Cell Biol. 195, 7-17 (2011).
- Mostowy, S., Cossart, P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 13, 183-194 (2012).
- Saarikangas, J., Barral, Y. The emerging functions of septins in metazoans. EMBO Rep. 12, 1118-1126 (2011).
- Mostowy, S., et al. Entrapment of intracytosolic bacteria by septin cage-like structures. Cell Host Microbe. 8, 433-444 (2010).
- Mostowy, S., et al. p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways. J Biol Chem. 286, 26987-26995 (2011).
- Mostowy, S., et al. Septins regulate bacterial entry into host cells. PLoS One. 4 (15), (2009).
- Mostowy, S., et al. Septin 11 restricts InlB-mediated invasion by Listeria. J Biol Chem. 284, 11613-11621 (2009).
- Phan, Q. T., et al. Role of endothelial cell Septin 7 in the endocytosis of Candida albicans. mBio. 4 (e00542-13), (2013).
- Mostowy, S., Cossart, P. Septins as key regulators of actin based processes in bacterial infection. Biol Chem. 392, 831-835 (2011).
- Levine, B., Mizushima, N., Virgin, H. W. Autophagy in immunity and inflammation. Nature. 469, 323-335 (2011).
- Randow, F., MacMicking, J. D., James, L. C. Cellular self-defense: how cell-autonomous immunity protects against pathogens. Science. 340, 701-706 (2013).
- Mostowy, S. Autophagy and bacterial clearance: a not so clear picture. Cell Microbiol. 2 (12063), (2012).
- Mostowy, S., Cossart, P. Bacterial autophagy: restriction or promotion of bacterial replication. Trends Cell Biol. 22, 283-291 (2012).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr Opin Immunol. 22, 10-19 (2010).
- Renshaw, S. A., Trede, N. S. A model 450 million years in the making: zebrafish and vertebrate immunity. Dis Model Mech. 5, 38-47 (2012).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. Plos Path. 9, e1003588 (2013).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Fixation and permeabilization of cells and tissues. Cold Spring Harb Protoc. , (2008).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 8, 445-544 (2012).
- Mizushima, N., Yoshimori, T., Levine, B. Methods in mammalian autophagy research. Cell. 140, 313-326 (2010).
- Westerfield, M. A guide for the laboratory use of zebrafish (Danio rerio). The Zebrafish Book. , (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. 61 (e3781), (2012).
- He, C., Bartholomew, C. R., Zhou, W., Klionsky, D. J. Assaying autophagic activity in transgenic GFP-Lc3 and GFP-Gabarap zebrafish embryos. Autophagy. 5 (4), 520-526 (2009).
- Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell. 147, 728-741 (2011).
- Komatsu, M., et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell. 131, 1149-1163 (2007).
- Nowicki, B., Coyne, K. E., Lublin, D. M., Nowicki, S., Hart, A. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. J Exp Med. 178, 2115-2121 (1993).
- Hall, C., Flores, M., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7 (42), (2007).
- Renshaw, S. A., et al. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, 2010-2010 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (9), (2009).
- He, C., Klionsky, D. J. Analyzing autophagy in zebrafish. Autophagy. 6, 642-644 (2010).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 25 (496 (7446)), 498-503 (2013).
- Levraud, J. P., Colucci-Guyon, E., Redd, M. J., Lutfalla, G., Herbomel, P. In vivo analysis of zebrafish innate immunity. Methods Mol Biol. 415, 337-363 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados