Method Article
사용
요약
병원균의 확산을 대응하기 위해 숙주 세포는 박테리아를 구획하고 자식 작용을 유도하는 자신의 세포 골격을 재구성. 조직 배양 세포, 호스트와이 프로세스를 기본 병원체 결정의 사용 이질균 감염 식별 특징으로한다. 시겔 감염 제브라 피쉬 모델을 사용하여, 분자 발견 및 메커니즘의 역할은 생체에 조사된다.
초록
시겔 flexneri는 세포질에 도달 phagosomes에서 탈출, 그 운동성 및 보급을 촉진하기 위해 세포 골격을하는 걸 호스트를 중합 할 수있는 세포 내 병원균이다. 새로운 작품은 액틴 기반의 운동에 관여하는 단백질이 또한 자식 작용, 세포 자율 면역에 중요한 세포 내 분해 과정에 연결되어 있음을 보여 주었다. 놀랍게도, 숙주 세포의 S. 액틴 기반 운동성 못할 수도 박테리아 내부의 'septin 케이지'를 구획화와 자식 작용에를 대상으로 flexneri. 이러한 관찰은 septins의보다 완전한 이해, 사상 GTP 결합 단백질의 가족, 자식 작용의 과정에 새로운 통찰력을 제공 할 것입니다 나타냅니다. 이 보고서는 S.에 의한 자식 작용 - 세포 골격의 상호 작용을 모니터링하는 프로토콜을 설명합니다 flexneri 시험 관내 조직 배양 세포를 사용하여 생체 내에서 지브라 피쉬의 유충을 사용. 이러한 프로토콜은 세포 내 메커니즘 정보의 조사를 가능하게분자 세포 및 전체 유기체 수준에서 세균의 확산을 제어 MS.
서문
시겔 flexneri, 그람 음성 침략 장내 유해 세균은 세포질에 phagosomes에서 탈출하고, 세포질 면역 반응을 회피하고 세포 내 및 세포 간 이동 1, 2를 홍보하기 위해 호스트 액틴 세포 골격을 중합 할 수 있습니다. 체외 3,4에서 액틴 기반 운동의 이해에도 불구하고, 생체 내에서 세균의 확산을 제한하는 메커니즘은 완전히 정의되지 않았습니다. 이 선천성 면역 (innate immunity) 및 호스트 방어의보다 완전한 이해에 매우 중요합니다.
Septins, 후생 동물 중 단백질의 높은 보존 가족, 헤테로 올리고머 단지에 조립하고 세포막과 세포 골격 5,6와 연관 비극성 필라멘트를 형성하는 단백질을 -binding 구아노 신 삼인산 (GTP)입니다. 최근 연구는 감염된 숙주 세포가 autoph를 목표로 구획화 박테리아에 의해 시겔 액틴을 기반으로 운동을 방지 할 수 있음을 발견했다액틴 기반 운동 7,8 중화 첫번째 세포 메커니즘을 공개 AGY 내부 'septin 케이지'. 조사 활짝 열려 필드는 이제 'septin 생물학 및 감염'에있다. 병원균의 다양한 의해 유도 Septin 조립, (예를 들어, 리스테리아 7,9,10, 마이 코박 테 리움 marinum 7, 8, 칸디다 알비 칸스 11), 호스트 방어 5,12의 핵심 이슈로 등장 할 수있다.
자식 작용, 고도로 보존 된 세포 내 분해 과정 때문에 리소좀 13,14 박테리아 세포질에 전달하는 능력의 자율 면역 세포의 핵심 요소로 간주된다. 그러나, 생체 내에서 세균 자식 작용의 역할은 제한하거나 저조한 15, 16를 이해 남아 세균의 복제를 촉진. 이 광학적으로 액세스 할 수 있기 때문에 제브라 피쉬 (다니오 rerio)는 감염의 연구를위한 척추 동물 모델로 등장했다애벌레 단계에서 선천성 면역 시스템은 이미 17, 18 작동 할 때. 최근 연구는 S.에 제브라 피쉬 유충의 감수성을 특징으로하고있다 flexneri, 세균 자식 작용 (15)에 대한 패러다임은, 생체 (19)에 항균 치료를위한 자식 작용 (autophagy)의 조작을 연구하는 시겔 -zebrafish 감염 모델을 사용하고있다.
이 보고서는 새로운 도구와 S.을 연구 분석을 제공합니다 자식 작용과 세포 골격과 flexneri의 상호 작용. 제 1 단계에서, 프로토콜은 자식 작용-세포 골격 상호 작용은 인간 상피 세포주 HeLa 세포의 감염 시겔를 사용하여 설명된다 모니터링한다. 체외 이질균 감염 과정에 자식 작용 - 골격 상호 작용의 역할을 평가하기 위해, 방법이 제공된다를 자식 작용 및 (또는 약리학 적 siRNA를 이용하여 시약) 세포 골격 성분을 조작한다. 새로운 작품은 이질균 감염 O를 사용하여 해당을 보여 주었다F 지브라 피쉬 유충은 유사한 분석이 생체 내에서 감염 세포 생물학 연구에 적용될 수있다. 프로토콜 준비하고 제브라 피쉬의 유충이 자세히 설명되어 감염 및 생체 내에서 이질 감염에 대한 호스트 응답을 평가하기 위해, 프로토콜은 호스트의 생존과 감염된 유충의 세균 부담이 제공됩니다 결정합니다. (방법 (고정 또는 생활 제브라 피쉬의 유충을 사용하여) 시겔에 septin와 자식 작용 (autophagy) 마커의 채용을 모니터링 및 방법은 [모르 폴리 노의 (1-4 세포 단계의 배아에 주입) 올리고 뉴클레오티드 또는 약물 시약을 사용하여 생체 내에서 이러한 프로세스의 역할을 테스트 제브라 피쉬 목욕 물에 직접 추가)]에 대해서도 설명합니다. 작업이 프로그램은 세포질 숙주 반응에 의한 감염의 제어에 필요한 메커니즘에 대한 통찰력을 제공 할 것으로 기대된다.
프로토콜
1 모니터링 자식 작용과 체외에서 세포 골격 조직 배양 세포를 사용하여
- S. 준비 flexneri
- 플레이트 S. 콩고 레드 상 -80 ° C 글리세롤 재고 flexneri M90T (야생형)는 카제인 대두 (TCS) 한천 플레이트를 트립신. 37 ° C에서 밤새 품어. 동일 플레이트는 여러 실험을 위해 사용될 수있다.
- 개별 식민지를 선택하고 37 ° C에서 밤새 진탕에 8 ㎖의 TCS 미디어에서 성장합니다.
참고 : 바인딩 콩고 - 빨강 독성 플라스미드이 유지되었음을 나타냅니다. - 기하 급수적 인 성장을위한 박테리아를 배양하기 위해 80분의 1 희석 하룻밤 박테리아 문화에 신선한 TCS를 접종하고 = 0.3-0.6 600 과다 복용 37 ° C에서 진탕에서 성장합니다.
- 5 분 동안 1,000 XG에서 세균 배양을 스핀. 5 분 동안 1,000 XG에서 MEM 원심 분리기와 펠렛을 씻으십시오. = 0.3-0.6 600 과다 복용 MEM에서 펠렛을 복원합니다.
- 헬라 세륨 준비감염에 대한 재편
- "완전 배지", 즉 HeLa 세포에서 성장., MEM 플러스 L-알라 닐-L-글루타민 1 mM의 피루브산 나트륨, 0.1 mM의 비 필수 아미노산 용액, 및 10 % 소 태아 혈청으로 보충.
- 실험이 시작되기 전에 6 - 웰 플레이트 (24)에 1.5 × 10 5 세포 또는 48 시간 플레이트. 유리 현미경 6 - 웰 플레이트에서 커버 슬립, 또는 35mm의 유리 바닥 접시에 접시에 접시 라이브 영상을 준비합니다.
참고 : (. 예를 들어, 굴지의 꼬리, septin 케이지) 자식 작용을 따르 라이브 영상을 사용하여 이질 감염시 실시간 및 세포 골격 역학 (예, ATG8 / LC3가 autophagosomes을했습니다 +), 조직 배양 세포는 일시적으로, GFP-를 사용하여 형질 전환 될 수있다 RFP- 또는 CFP 태그가 지정된 구조 (토론 참조).
- 감염
- 100 세포 감염 : 감염 한 다수 (MOI)를 시겔의 (OD 600 = 0.3-0.6) MEM에 희석; 직접 6 w 도금 HeLa 세포 담기(혈청 결핍) MEM 2 ㎖에 (1.2 절에 설명 된대로) 감염 48 시간 전에 - 24 ELL 판.
- 실온에서 10 분 동안 700 XG에서 세포, 박테리아 및 원심 분리 세포를 호스팅 박테리아 부착을 최대화한다. 원심 분리 후, 37 ° C, 5 % CO 2에서 30 분 동안 배양하고 감염이 계속 진행 할 수 있습니다.
- 신선한 MEM로 두 번 감염된 세포를 세척하고 1-4 시간은 실험에 따라 대한 (세포 외 박테리아를 제거하기 위해 50 μg / ㎖) 겐타 마이신 포함하는 완전 배지와 배양한다.
- 현미경에 대한 감염된 HeLa 세포를 고정 및 라벨
- 1X PBS로 두 번 감염된 세포를 세척하고, 실온에서 1X PBS에서 4 % 파라 포름 알데히드의 15 분에 대한 수정. 파라 포름 알데히드를 제거하기 위해 세척 세포는 1X PBS로 2 배.
- 실온에서 10 분 동안 50 mM의 염화 암모늄에 고정 된 세포를 배양한다. 방 t에서 0.1 % 옥틸 페놀 에틸렌 옥 시드 축합 물 4 분 동안 세포를 1X PBS로 한번 씻어 Permeabilize 하시려면온도.
NOTE : 대안 같은 사포닌 또는 메탄올, permeabilization 위해 에틸렌 옥사이드 축합 물을 옥틸하는 셀룰러 구조 (20)의 다른 보존 적용될 수있다. - 에서 (1X PBS에 세포를 세척하고 30 분 동안 (예를 들어, P62 / SQSTM1) 또는 septin 세포 골격 (SEPT2, SEPT6, SEPT7, SEPT9 및 SEPT11은 헬라 세포에서 발현하는) 자식 작용 중요한 구성 요소에 대한 기본 항체 젖은 챔버에서 부화 하룻밤 실온) (4 ºC에서).
- (4 ° C에서) 하룻밤 (실온에서) 30 분, phalloidin와 사상 액틴 (F-액틴)를 1X PBS로 두 번 세포를 세척하고 이차 항체에 젖은 실에서 배양하고, 레이블을 붙입니다. 호스트의 염색은 세포의 핵은 4 ", 6-diamidino-2 - 페닐 인돌 (DAPI)를 추가합니다.
- 1X PBS에 세포를 씻으과 설치 매체를 사용하여 슬라이드에 유리 커버 슬립을 탑재합니다.
- 감염된 HeLa 세포의 현미경 이미징
- 이미지 INF에반사 된 세포 표면 형광 또는 공 초점 현미경 및 DAPI 표지 시겔을 식별 할 수있는 63X 또는 100X 목적을 사용합니다.
참고 :도 1a에 도시 된 바와 같이 - 1C, septin 케이지, 구조와 같은 링으로 시각화 할 수 있습니다 ~ 액틴의 중합와 자식 작용 (autophagy) 마커 (예를 들어, P62 및 LC3) 7,8 모집 세포질 박테리아를 둘러싼 직경 0.6 μm의. 대조적으로, 굴지의 꼬리를 중합 박테리아 septin 케이지에 의해 구획화되지 않고 7,8 자식 작용을 타겟으로하지 않습니다. - 또는 표면 형광 공 초점 현미경 및 63X 또는 100X 대물를 사용하여, 미세한 필드 당 세포 내 박테리아의 수를 정량화. 또한 박테리아 septin 새장에 갇힌과 자식 작용 (autophagy)을 대상으로, 또는 굴지의 꼬리를 중합와 자식 작용 탈출의 수를 정량화.
- infe의 Z-스택 이미지 시리즈를 타고 septin 케이지 또는 중합 액틴 꼬리에 갇힌 박테리아의 비율을 확인하려면세포, 프로세스 이미지 cted 적어도 세 독립적 인 실험에서 실험 당 최소 500 ~ 1,000 박테리아를 계산합니다.
- 이미지 INF에반사 된 세포 표면 형광 또는 공 초점 현미경 및 DAPI 표지 시겔을 식별 할 수있는 63X 또는 100X 목적을 사용합니다.
자식 작용과 세포 골격 시험 관내의 2 기능 분석
NOTE : 유전 적 및 약리학 적 접근 방법은 감염된 조직 배양 세포에서 자식 작용을 교란하는 데 사용될 수 있으며, 모니터링 할 수 감염 과정에서 이러한 치료의 효과 둘 다.
- siRNA를 매개 음소거
- 완전 배지에서 6 - 웰 플레이트에서 유리 커버 슬립에 0.8 × 105 HeLa 세포를 접시.
- 자식 작용 및 / 또는 마커에 대해 siRNA와 세포 골격과 지질 계 형질 감염 시약을 사용하여 다음날 형질.
- 1.3 절에 설명 된대로 배양 원하는 기간 후에, 시겔과 세포를 감염.
- 수정하고 1.4 절에 설명 된대로 세포를 레이블을 붙입니다.
- 약리 조작
참고 : 세포 골격은 미세 소관이 nocodazole 사용 해중합하는 액토 마이 오신 활동 사용 blebbistatin을 차단하거나 septin 조립 사용 forchlorfeneuron을 방해하기 위해, D 또는 latrunculin B 사이토 액틴 세포 골격의 사용을 해중합하기 위해, 예를 들어, 약학 적으로 조작 할 수 있습니다. 자식 작용은 라파 마이신을 사용하여 자극 또는 bafilomycin 사용하여 차단 될 수있다.- 박테리아가 세포를 입력하고 세포질에 phagosome에서 탈출하는 첫번째 충분한 시간을 1.3 절에 설명 된대로 시겔과 세포를 감염 허용, 이질균 감염시의 세포 골격을 조작하기 위해 (예를 들면.> 1.5 시간 게시물 감염).
- 5 M (사이토의 D, latrunculin B, nocodazole), (20) M (forchlorfeneuron) 또는 (50) M (blebbistatin)의 최종 농도 MEM에서 [디메틸 술폭 시드 (DMSO)에 현탁 원액] 스톡 용액으로부터 약물을 희석하고, 세포를 37 ° C에서 30 분을 취급합니다. 약물의 총량 (DMSO / D의 볼륨양탄자 혼합물) / 세포의 유리 병 미디어 2 ㎖ 당 원액에 따라 1 ~ 5 μL은 ()이다 접시 당 덧붙였다. 음성 대조군으로서 희석 MEM DMSO의 유사한 투여 량으로 치료 세포.
- 수정하고 1.4 절에 설명 된대로 세포를 레이블을 붙입니다.
참고 : (감염 또는 비감염 세포) autophagic 플럭스의 조작의 경우, 12 시간에 4에서 라파 마이신 (20 nM의) 또는 bafilomycin (160 nm의)를 사용하여 약물 치료를 확장 할 수 있습니다.
- 서쪽 오점
NOTE : Autophagic 활동은 P62와 같은 LC3 자식 작용 마커 단백질의 수준을 측정함으로써 정량화 될 수있다.- 인큐베이션 원하는 기간 후에 수집하고 면역 블 롯팅을 위해 세포를 용해. 8, 10, 또는 14 %의 아크릴 아마이드 젤에 실행 단백질 추출물.
- 즉 Autophagic 플럭스. (21, 22)에 설명 된대로 자식 작용의 환율을, 분석 할 수 있습니다.
- 현미경 이미징 및 정량
- 표면 형광 또는 공 초점 현미경 63X 또는 100X 개체를 사용IVE, 이질균 감염에의 siRNA의 효과 또는 약물 치료 정량적 현미경에 의해 평가 될 수있다 (즉, autophagosomes, septin 케이지 및 액틴 꼬리 카운트) 섹션 1.5에 설명하고도 2a 및도 2b에 도시 된 바와 같이.
S.의 생체 내 이미징에서 3 자식 작용과 세포 골격과 flexneri 상호 작용
NOTE : 시겔 감염 제브라 피쉬 모델은 생체 내에서 19 septin의 caging 및 자식 작용을 조사하기 위해 사용될 수있다.
- S. 준비 flexneri
- 문화 S. flexneri는 다음과 같이 섹션 1.1에 설명.
- OD 600 = 0.3-0.6, 10 분 동안 1,000 XG에 스핀 8 ㎖의 세균 배양에서. 10 분 동안 1,000 XG에 1X PBS와 펠렛 원심 분리기를 씻으십시오.
- ~ 2000 박테리아 / NL을 얻기 위해 0.1 % 페놀 레드 1X PBS 80 μL에 펠렛을 재현 탁. BACT 유지얼음에 erial 준비 성장을 느리게합니다.
주 : 페놀 레드를 추가하면 유충에 주입 할 때 접종을 시각화하는 데 도움이 될 것입니다.
- 사출을위한 Zebrafish의 유충을 준비
참고 : Zebrafish의 계란으로 배치되어 그들이 유충이라고 72 시간 게시물 수정 될 때까지 배아로 식별됩니다.- (즉, 생성 된 계란을 먹는 성인을 방지 할 수 있습니다) 대리석으로 덮여 바닥과 별도의 수조에 (1 비율로 일반적으로 2) 4 명의 남성과 8 명의 여성을 배치하여 웨스 (23)에 설명 된대로 성인 zebrafish의 새끼를 낳. 또한, 전날 밤 사육 탱크 내부에 달걀 수집 바구니를 배치합니다.
참고 : 달걀 조명이 제브라 피쉬 시설 (23)에 이동 후 ~ 30 분을 기름지게하고, 곰팡이의 성장을 방지하기 위해 가능한 한 빨리 수집해야합니다. 달걀 컬렉션 바스켓들이 쉽게 수확 될 수 있도록 계란을 수집하고 또한 성인에서 계란을 보호하는 역할을한다. - 배아를 수집s와 10 분 동안 0.003 % 표백제와 배아 미디어 (E2)에서 세척을 청소합니다. 배아 E2 매체에 5 배 세척, 표백제로 E2를 제거하고, 28 ° C에서 10cm 페트리 접시 (100 배아 / 50 ㎖의 E2 매체)의 배아를 성장.
- 배아 또는 유충이 24 시간 게시물 수정에서 현미경 연구에 사용되는 경우 melanization을 방지하기 위해 E2 매체에 0.003 % N-phenylthiourea를 추가합니다. 정상적인 개발을위한 28 ºC에서 배아를 보관하십시오.
참고 : Zebrafish의 유충은 72 시간 게시물 수정에서 감염에 대한 준비가되어 있습니다. - 감염과 현미경 절차, E2에서 200g / ㎖ tricaine에 제브라 피쉬의 애벌레를 마취.
- (즉, 생성 된 계란을 먹는 성인을 방지 할 수 있습니다) 대리석으로 덮여 바닥과 별도의 수조에 (1 비율로 일반적으로 2) 4 명의 남성과 8 명의 여성을 배치하여 웨스 (23)에 설명 된대로 성인 zebrafish의 새끼를 낳. 또한, 전날 밤 사육 탱크 내부에 달걀 수집 바구니를 배치합니다.
- 정맥 및 로컬 감염에 대한 Zebrafish의 유충의 준비
참고 : 이질균 감염시 제브라 피쉬의 생존을 평가 꼬리 정맥 주사를 수행합니다. 시겔에 septin와 자식 작용 (autophagy) 마커의 채용을 시각화하기 위해, 같은 꼬리 근육으로 현지화 된 사이트에서 감염을 수행합니다.- 꼬리 정맥 주사의 경우, 바늘을 향하도록 몸 윗면과 측면 마취 애벌레를 놓습니다. 도 3a에 도시 된 바와 같이, 꼬리 정맥을 목표 비뇨 개구 바늘 끝의 확대 (후방)에 배치하고, 피부를 관통하고 원하는 박테리아 투여 (주사 부피 1-5 NL)를 제공한다.
주 : 정맥 감염이 수행 할 도전이며,이 절차에 편안하게 훈련의 몇 주를 취할 것입니다. 훈련을 위해 (세균없이) 페놀 레드를 주입 제대로 주사 부위를 평가하는 데 도움이 될 것입니다.
NOTE : 시겔의 경우, 투여 량 의존적 실험 저용량 감염 (<1,000 CFU) 48 시간 이내에 해제되고, 고용량 감염 것으로 나타났다 (> 4000 CFU가) 48 시간 19 일 이내에 사망 호스트 리드. - 3.3.1에 설명 된대로 꼬리 근육 감염의 경우, 마취 애벌레를 놓습니다. 도 3a에 도시 된 바와 같이, 바늘을 배치 자르근육 somites (골격 근육, 즉 세그먼트) 이상 y를 소량 주입 (예., 한 NL) 박테리아의 준비를.
- 꼬리 정맥 주사의 경우, 바늘을 향하도록 몸 윗면과 측면 마취 애벌레를 놓습니다. 도 3a에 도시 된 바와 같이, 꼬리 정맥을 목표 비뇨 개구 바늘 끝의 확대 (후방)에 배치하고, 피부를 관통하고 원하는 박테리아 투여 (주사 부피 1-5 NL)를 제공한다.
- 애벌레에서 박테리아의 정맥 주사
- 24에 설명 된대로 붕규산 유리 마이크로 캐 필러를 빼냅니다.
- 입체 거친 수동 조작하는 사람의 홀더에 바늘을 연결하고 미세 핀셋 바늘 끝을 휴식.
- 바늘을로드하려면, 커버 슬립 위에 세균 배양 한 방울을 배치합니다. 약간 microinjector와 가스 실린더 스위치의 드롭에 바늘 끝 잠수함, 세균 준비 원하는 양의 바늘을 입력합니다.
- 분사량을 보정하기 위해, 커버 슬립에 미네랄 오일의 드롭을 배치하고 박테리아 제제를 주입. 마이크로 미터를 이용한 방울의 직경을 측정하고, 주입 부피 계산 [V = (4/3)를 πr 3].
참고 : bacteri로 분사 40 PSI의 설정 및 50 밀리 초를 사용하여같은 알 준비 ~ 2,000 CFU / NL를 제공합니다 3.1에 설명. - 웨스 23에서 설명한 플라스틱 금형을 사용하여 사출 플레이트를 준비한다.
- 주입 판에 유충을 전송하고 좋은 붓을 사용하여 정렬. 3.3.1에 설명 된대로 동양 유충을 주입합니다.
- 1 E2의 ㎖ / 잘 개별적으로 24 웰 플레이트에 제브라 피쉬의 생존, 전송 감염된 유충의 평가를 들어 28 ° C에서 배양한다. 시간 (그림 3B)를 통해 매일 다음 2-5일 및 플롯 생존에 감염된 유충을 모니터링합니다.
- 세균 정량 Zebrafish의 유충 도금
참고 : 오염을 방지하기 위해 멸균 후드 아래에 작업 할 수 있습니다.- (시간 0 시간 포스트 감염에서) 원하는 시점에서 박테리아 정량화 물고기 주입 박테리아의 수를 평가하기 위해, 과량의 tricaine (200-500 밀리그램 / L)와 지브라 피쉬 유충을 희생. 1.5 ML의 폴 개별 애벌레를 배치200 0.1 % 옥틸 페놀 에틸렌 옥 시드 축합 1X PBS ㎕의 기계적으로 ypropylene microcentrifuge 관은 유봉을 사용하여 균질화.
참고 : 사출 볼륨에서 세균 부하를 확인 멸균 1X PBS 드롭으로 동일한 용량 펌프와 그것을 판에. - 멸균 물에 제브라 피쉬 애벌레 균질의 용액을 희석을 만들어 판 한천 원성 국물 (LB)에 판. 유충은 독성 플라스미드를 유지 여부를 한 시겔 구별하기 위해 콩고 레드 TCS 판에 선택적으로 도금 될 수 있습니다.
참고 : 플레이트 세 이상 비감염 물고기 제어와 같은 감염에 사용되는 제브라 피쉬 애벌레의 상태를 확인합니다. - 37 ° C에서 접시의 하룻밤 배양 후, 박테리아 식민지를 계산합니다. 도 3c에 도시 된 바와 같이, 로그 스케일을 사용하여 나타낸다.
참고 : 제브라 피쉬의 유충 감염시 세균 부하는 형광 표지 시겔 현미경 난을 사용하여 시각화 할 수 있습니다3.7 절 또는 3.8 (그림 3D)에 설명 된대로 maging.
- (시간 0 시간 포스트 감염에서) 원하는 시점에서 박테리아 정량화 물고기 주입 박테리아의 수를 평가하기 위해, 과량의 tricaine (200-500 밀리그램 / L)와 지브라 피쉬 유충을 희생. 1.5 ML의 폴 개별 애벌레를 배치200 0.1 % 옥틸 페놀 에틸렌 옥 시드 축합 1X PBS ㎕의 기계적으로 ypropylene microcentrifuge 관은 유봉을 사용하여 균질화.
- Zebrafish의 유충 면역 염색
- 원하는 시점에서, tricaine의 과다 복용을 사용하여 유충을 희생. 1.5 ㎖의 폴리 프로필렌의 microcentrifuge 튜브 (10-20 유충 / 튜브)의 물고기를 수집합니다.
- (4 ° C에서) 2 (실온에서) 시간 또는 하룻밤 (애벌레 클러스터링을 피하기 위해) 1X PBS에 0.4 % 옥틸 페놀 산화 에틸렌 응축수와 4 % 파라 포름 알데히드를 사용하여 유충을 수정하고 궤도 교반기에서 배양한다.
참고 : 전자 현미경 감염된 제브라 피쉬의 유충의 미세 구조 분석에 사용할 수 있습니다. 이 경우, 마취 배아 Mostowy 등 19에있어서 고정되고 처리되어야한다. - 5 분 동안 1X PBS 0.4 % 옥틸 페놀 에틸렌 옥 시드 축합 물에서 세척 3X,이어서 실온에서 1 시간 동안 (1X PBS에 10 % 소 태아 혈청, 1 % DMSO, 0.1 % 폴리 옥시 에틸렌 소르 비탄 모노 라우 레이트) 용액을 블로킹 블록.
- 디류트 차단 솔루션의 기본 항체. 희석 차 항체에 유충을 추가하고 궤도 교반기에서 4 ° C에서 하룻밤 배양한다. 섹션 1.4.3에서 상술 한 바와 같이 차 항체를 사용합니다.
- 실온에서 PBS 1 배 0.1 %, 폴리 옥시 에틸렌 소르 비탄 모노 라우 레이트에서 15 분 동안 유충의 4 배를 씻으십시오.
- 차단 솔루션에있는 이차 항체를 희석. 희석 차 항체에 유충을 추가하고 궤도 교반기에서 4 ° C에서 하룻밤 배양한다. 섹션 1.4.4과 동일한 차 항체 및 phalloidin를 사용합니다.
- 실온에서 1X PBS, 0.1 % 폴리 옥시 에틸렌 소르 비탄 모노 라우 레이트에서 15 분 동안 세척 4X. 숙주 세포의 핵을 염색을 위해 이들 15 분의 세척 기간 동안 제 DAPI (150 nM의 최종 농도)을 추가한다.
- 형광 표지 된 유충의 보존을 위해, 15, 30, 60의 글리세롤 그라데이션으로 서서히을 배양하고, 80 %는 객실 성질에 2 시간 동안 1X PBS와 0.1 %의 폴리 옥시 에틸렌 소르 비탄 모노 라우 레이트 (희석아져)에 하룻밤 () 4 ° C에서.
참고 : 스테인드 애벌레가 오랜 기간 동안 저장 될 수있다 4 ° C에서 80 % 글리세롤 (예를 들어, 4개월.).
- 고정 Zebrafish의 유충 현미경 이미징
- 35mm (실체 현미경 용) 페트리 접시 나 (공 초점 miscopy에 대한) 전체 유리 바닥 접시에 80 % 글리세롤의 작은 방울에 고정 글리세롤 포함 된 유충을 전송합니다.
- 감염된 유충의 Z-스택 이미지 시리즈를 가지고 필요에 따라 이미지를 처리합니다.
- 표면 형광 또는 공 초점 현미경 및 전체 생물 이미징을위한 10 배 또는 20 배 목표를 사용합니다. 그런 다음 공 초점 현미경 및 개별 세포를 시각화하는 40X, 63X 또는 100X의 목적, 자식 작용 (autophagy)의 모집을 사용하여 생체 내에서 19 개별 박테리아 마커를 세포 골격 (도 4a 및도 4b).
참고 : 꼬리 근육에 물고기를 감염 및 개를 사용할 수 있도록 유리 바닥 접시의 바닥을 따라 글리세롤 평면에 탑재싸이 중점을두고 있습니다.
- 감염 Zebrafish의 유충의 현미경 영상을 라이브
참고 : 유충 따라서 생체 내에서 autophagosomes는 GFP-LC3 제브라 피쉬의 유전자 변형 라인 (25)을 사용하여 시각화 할 수 있으며, 광학적으로 액세스 할 수 있습니다. 3.3 절에 설명하고이 절에서 설명 마운트로 제브라 피쉬의 유충을 감염.- E2에서 저 융점 1 % 아가로 오스 (LMA)를 준비하고 유충 손상 / 살인을 방지하기 위해 35 ~ 37 °의 C로 냉각 할 수 있습니다. 35mm (실체 현미경 용) 페트리 접시 나 (공 초점 현미경) 전체 유리 바닥 접시에 LMA의 방울을 배포합니다.
- 전송이 LMA에 (가능한 한 적은 물) 개별적으로 제브라 피쉬의 애벌레를 마취 삭제합니다. 붓을 사용하여 아가로 오스가 강화 될 때까지 기다립니다 원하는 위치로 방향 애벌레.
- E2는 건조에서 준비를 피하기 위해 물고기가 물에서 산소를 교환 할 수 있도록 200 μg / ㎖의 tricaine을 포함와 전체 요리 LMA와 표면 및 오버레이를 커버.
- 표면 형광 또는 공 초점 현미경 및 전체 제브라 피쉬의 유충 이미징 10 배 또는 20 배 목표를 사용합니다. 공 초점 현미경 및 세균 authopagosomes을 시각화하는 40X, 63X 또는 100X 목표를 사용하여 생체 내에서 (즉, GFP-LC3 +는 시겔를 둘러싼 공포를했습니다).
- 실시간으로 (예를 들면., 몇 시간 동안 매 2 분) 시간이 지남에 감염된 유충의 Z-스택을 가지고 autophagosomes를 시각화하고, 자신의 역학.
자식 작용과 세포 골격 생체의 4 기능 분석
NOTE : 감염 과정에 자식 작용의 약리학 적 및 유전 적 교란의 영향은 전체 - 동물 수준에서 모니터링하고, 하나의 셀 레벨에서 할 수있다.
- 모르 폴리 노 주입에 의한 자식 작용 조작
- 10 분 동안 65 ° C에서 온난화에 의해 1 mm의 원액에 멸균 물에 모르 폴리 노 올리고 뉴클레오티드를 복원합니다. 스토어실온에서.
참고 : 모르 폴리 노 올리고 뉴클레오티드 주사 1-4 세포 단계의 배아에서 수행해야합니다. - 둘 베코 인산염 완충 생리 식염수 멸균 0.1 % 페놀 레드 모르 폴리 노 올리고 뉴클레오티드 작업 솔루션을 준비합니다. 3.4.3 항에 설명 된대로 섹션 3.4.2에 설명 된대로 바늘을 넣습니다., 모르 폴리 노 올리고 뉴클레오티드 주입 볼륨이 교정 될 수있다.
주 : 페놀 레드 주입하여 볼륨을 시각화하는 데 도움이 될 것입니다. - 배아 위치 챔버를 준비합니다 (예., 바늘에 직면 가장자리 10cm 페트리 접시 뚜껑에 시아 노 아크릴 레이트로 접착 현미경 슬라이드는 부분적으로 제거). 소량의 물과 함께 챔버 1-4 세포 단계 배아를 전송하고 미세 브러시로 정렬.
- 융모막 원활 노른자를 침투. 일단 내부, 모르 폴리 노 올리고 뉴클레오티드 용액을 원하는 부피를 주입 페달을 누르세요.
참고 : 0.5 주입의 볼륨 최소화 - 2 NL을; 볼륨 높은 그쪽으로N 5 NL 발달 결함의 원인과 계란 사망률이 증가 할 수 있습니다. - 미세 주입 한 후, (3.2 절에 설명 된대로 표백에 의한) 및 28 ° C에서 E2와 페트리 접시에 그들을 품어 청소 배아.
- 72 시간 후 시비 제어 감염 (즉, 제어 모르 폴리 노 올리고 뉴클레오티드 주사 제브라 피쉬의 유충) 또는 P62의 morphants (예., P62의 모르 폴리 노 올리고 뉴클레오타이드를 주입 한 제브라 피쉬의 유충) 섹션 3.4에 설명 된대로 시겔과 함께. 3.5 절에 설명 된대로 다음 2-5일에 대한 생존과 세균 부담을 평가합니다. 3.7 절에 설명 된 그림 4C에 강조, 또는 섹션 3.8에 설명 된대로 이미지 제브라 피쉬 애벌레 생활로 이미지 제브라 피쉬의 유충을 고정.
주 : 유효 모르 폴리 노 올리고 뉴클레오티드의 투여 량 성적 접합 또는 단백질 번역 (토론 참조) 억제하는 효율성을 기반으로 평가 될 수있다.
- 10 분 동안 65 ° C에서 온난화에 의해 1 mm의 원액에 멸균 물에 모르 폴리 노 올리고 뉴클레오티드를 복원합니다. 스토어실온에서.
결과
시험관, S.에서 조직 배양 세포의 감염시 flexneri는 phagosome를 종료하고 세포질에 침입 할 수 있습니다. 세포질에서, 숙주 세포는 septin 케이지 (그림 1A) 내부에 박테리아를 구획화하여 시겔의 액틴 기반의 운동성을 방지 할 수 있습니다. septin 새장에 갇힌 박테리아는 자식 작용 마커 P62 (그림 1B)와 LC3 (그림 1C)로 표시 할 수 있습니다. 이러한 관찰은 침입 병원균의 확산을 제한 호스트 방어의 새로운 메커니즘을 강조하고, 또한 자식 작용과 세포 골격 사이에 새로운 링크를 알 수있다. 놀랍게도, 자식 작용 마커의 고갈은 크게 박테리아 (그림 2A)의 septin의 caging을 줄이고, 작업도 septin의 caging의 고갈이 크게 자식 작용 마커 8의 채용을 줄일 것으로 나타났습니다. 따라서, 적어도 시겔의 경우, 케이지 어셈블리와 autophagosome 상자 형성을 septin 목록N은 상호 의존적 인 프로세스로 볼 수 있습니다. septin 케이지에 의해 시겔의 구획화에 대한 다른 세포 요구 사항은 액틴의 중합 및 액토 마이 오신 활동 (그림 2B)를 포함한다.
감염의 새로운 동물 모델, 제브라 피쉬 애벌레 19 혜택을 누릴 수있는 자연 마우스 세균성 이질의 모델 및 시겔의 병인, septin 생물학 및 생체 내에서 세균 자식 작용의 조사가 없습니다. 그러한 생체 현미경 (도 3A)에 대한 꼬리 정맥 생존 실험 주사, 꼬리 근육 주사 등 다양한 해부학 적 위치에있는 박테리아를 주입하여 제브라 피쉬 유충을 감염시킬 수있다. 용량, S.에 따라 flexneri 중 하나를 48 시간 게시물 감염에서 해제 할 수 있습니다 제브라 피쉬의 유충에 주입, 또는 진보적 궁극적으로 치명적인 감염 (그림 3B - 3D)가 발생할 수 있습니다. 시겔의 독성 FActors는 28 ° C, 제브라 피쉬의 최적 성장 온도에서 표현되고, 이질균에 의한 감염은 제브라 피쉬의 유형 III 분비 시스템 (T3SS) 19, 인간의 질병에 필수적인 독성 결정에 따라 엄격하게 의존한다. 촬영 함께, 이러한 관찰은 제브라 피쉬의 유충은 시겔 라 감염의 생체 분석을위한 유용한 새 호스트를 나타낸다는 것을 나타냅니다.
제브라 피쉬의 유충의 광학 접근성은 생체 내 (그림 4A)에서 septin의 caging 전에 포유류 호스트 모델을 사용하여 수행 된 적이없는 성취의 시각화를 가능하게한다. septin 케이지가 생체 내에서 자식 작용을 대상으로 박테리아를 포획 증거를 보완하기 위해, 하나는 GFP-LC3를 발현하는 형질 전환 제브라 피쉬의 유충 감염 시겔 (그림 4B)에 자식 작용 마커 모집을 관찰 할 수 있습니다. 생체 엘에서 시겔 autophagosomes의 ultrastrucutral 분석을 위해ectron 현미경 명확 이중 액포 막 (19)에 의해 세균의 세포질 격리를 표시하는데 사용될 수있다. 자식 작용은 세포 자율 면역의 핵심 구성 요소 및 intracytosolic 박테리아 14-16에 대한 중요한 방어 메커니즘으로 볼 수 있습니다. 생체 내에서 기능 자식 작용을 특성화하기 위해, P62의 모르 폴리 노 - 처리 된 애벌레 지브라 피쉬가 사용될 수있다. 핵심 자식 작용 기계는 달리 [예., 36 자식 작용 관련 단백질 (ATGs) 26], P62은 감염에 일반적으로 이전 개발할 수 있습니다 척추 개발 27 따라서 제브라 피쉬의 유충을위한 필수적인 것은 아니다. 놀랍게도, P62-고갈 유충 S. 접종 크게 증가 사망률 증가 박테리아 부담 19 flexneri 결과입니다. 그 septin 케이지 어셈블리를 보여주는 체외 작업과 일치 autophagosome 형성 7,8와 상호 의존적이며, 시겔에 septin 모집 명확하게 (P62-고갈 유충에 감소 그림 4C). 이 자료는 제브라 피쉬의 생존 세포 내 세균 감염을 제어하는 P62 매개 자식 작용 (autophagy)에 의존한다는 것을 보여줍니다.
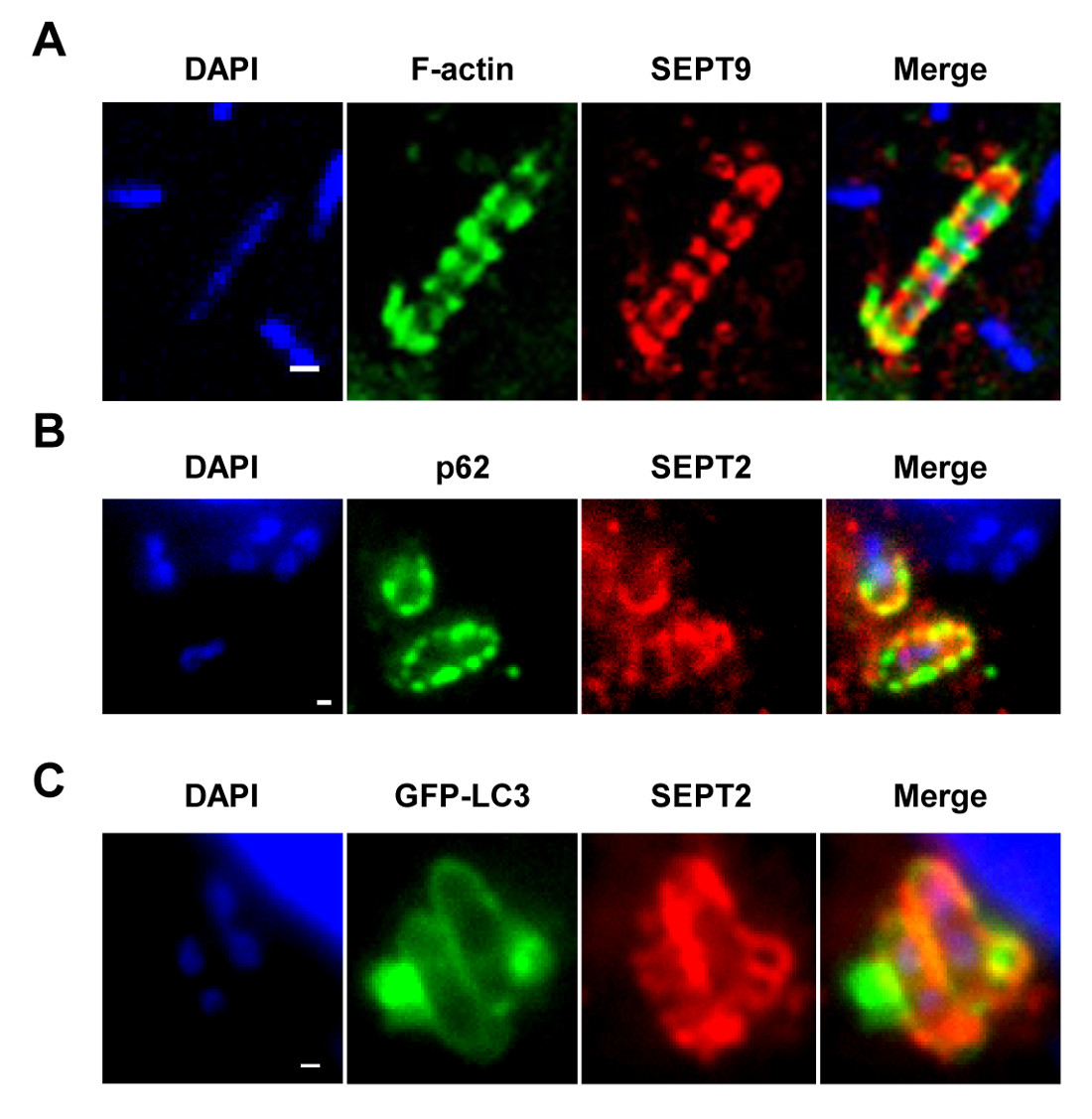
체외 septin 케이지 1도. (A) HeLa 세포를 감염되었다 S. flexneri는 4 시간 40 분 동안 고정 SEPT9 및 phalloidin에 대한 항체로 표지하고, 공 초점 축소 복사에 의해 촬상. 스케일 바, 1 μm의. (B) HeLa 세포는 S.에 감염되었다 flexneri는 4 시간 40 분, 고정, P62 및 SEPT2에 대한 항체로 표지하고, 형광 현미경으로 몇 군데. 스케일 바는, 1 μm의. (C) 헬라 세포는 GFP-ATG8 / LC3로 형질 S.에 감염되었다 4 시간 40 분 동안 flexneri, 고정, 형광등 마일에 의해 SEPT2에 대한 항체로 표지 및 영상화croscopy. 스케일 바, 1 μm의. 이 수치는 Mostowy 등 7에서 수정되었습니다.
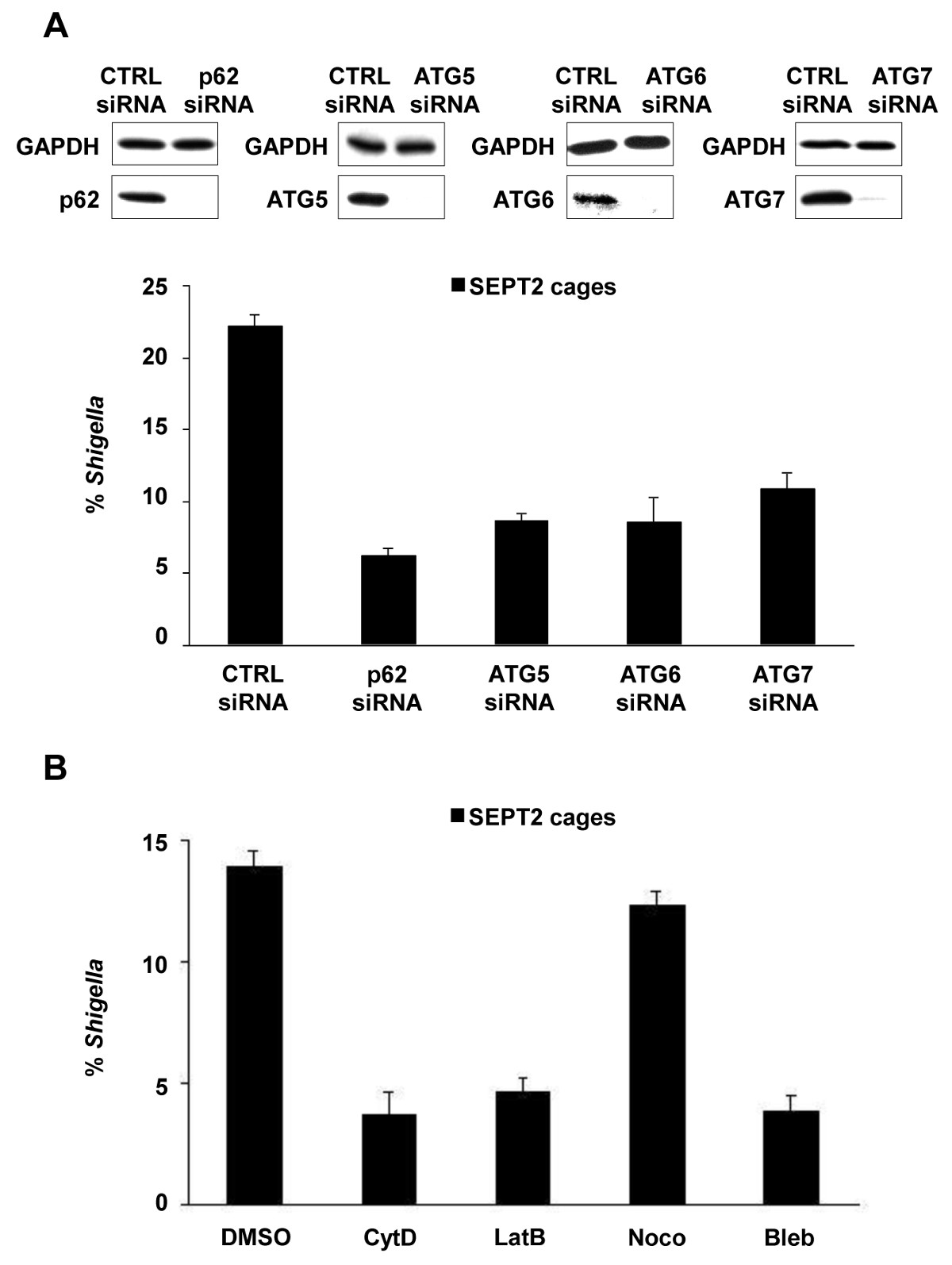
시겔 -septin 케이지 형성을위한 그림 2 셀룰러 요구 사항. (A) HeLa 세포가 제어 처리 하였다 (CTRL), P62, ATG5, ATG6 또는 ATG7의 siRNA. siRNA를 처리 한 세포의 전체 세포 용 해물은 siRNA의 고갈 (위)의 효율을 보여 GAPDH, P62, ATG5, ATG6 또는 ATG7 대해 immunoblotted 하였다. siRNA를 처리 한 세포는 S.에 감염되었다 고정 및 정량 현미경 표지, 4 시간 40 분 동안 flexneri. 그래프 (아래)는 처리 당 N ≥3 실험 SEPT2 케이지 내부 시겔의 SEM ± 평균 %를 나타냅니다. (B) 헬라 세포 S.에 감염되었다 FD (CytD) 사이토, DMSO로 처리 lexneri, latrunculin B (LATB), nocodazole (Noco) 또는 blebbistatin (물집)과 4 시간 후 40 분 고정하고 정량적 현미경 표지. 그래프 처리 당 두 개의 독립적 인 실험에서 SEPT2 케이지 내부 시겔의 SEM ± 평균 %를 나타냅니다.이 수치는 Mostowy 등 7에서 수정되었습니다.
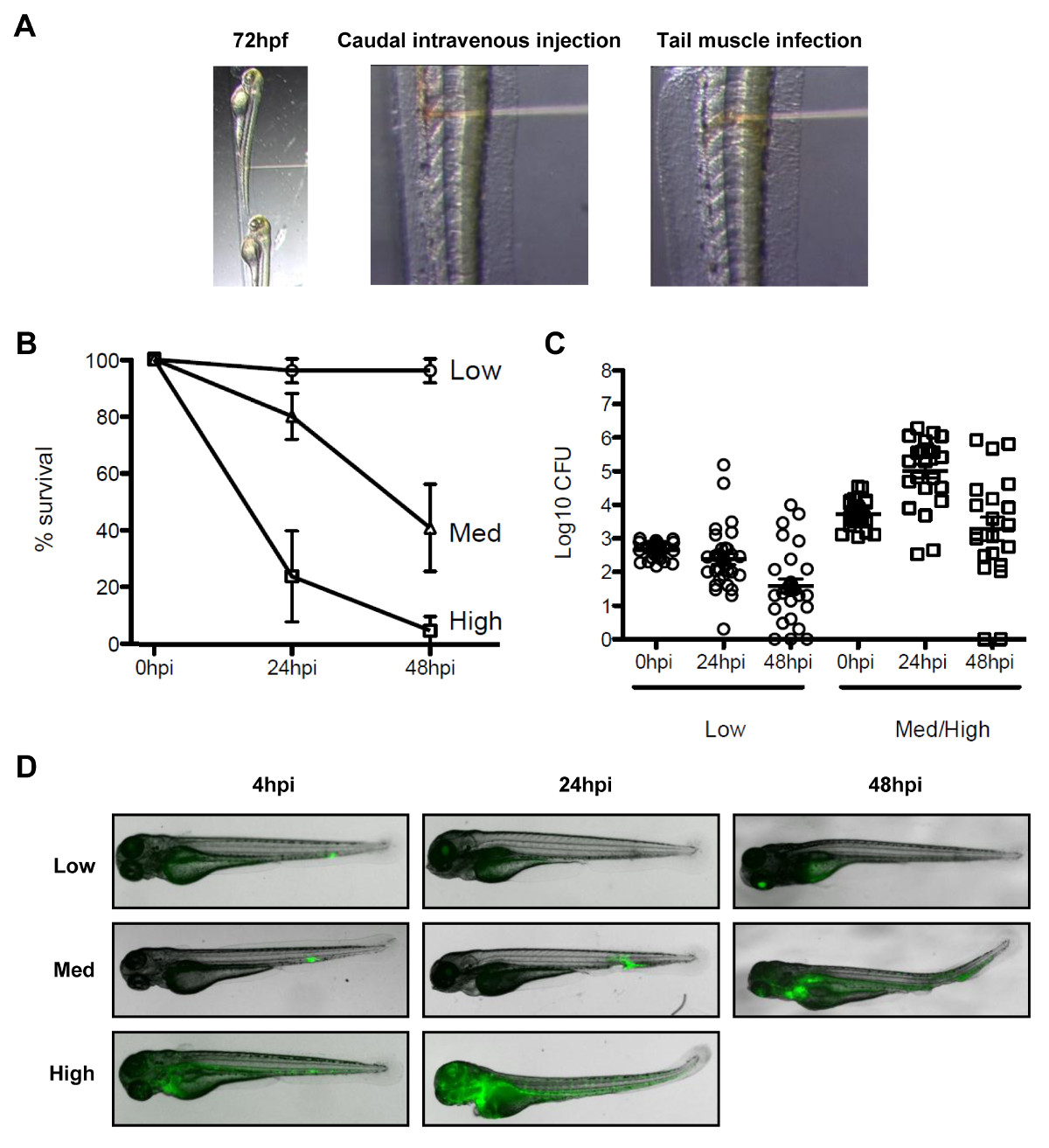
그림 3 이질 감염의 제브라 피쉬 모델입니다. (A) 이미지는 실체 현미경을 이용하여 제브라 피쉬 유충의 방향을 설명합니다. (왼쪽 패널) Zebrafish의 유충 72 시간 게시물 수정은 자신의 몸 윗면은 주사 바늘을 향 분사 플레이트 측면에 위치했다. (중앙 패널) 혈류 감염은 INJ에 의해 수행되었다꼬리 정맥에 박테리아 (빨간색 솔루션) 돌출 한, 비뇨 생식기 입구에 후방. 꼬리 근육 (오른쪽 패널) 감염은 체절을 통해 박테리아 (적색 용액)을 주입하여 수행 하였다. (B) 72 시간 후 수정 애벌레의 생존 곡선을 S.의 다양한 용량으로 주입 flexneri하고 48 시간 게시물 감염 28 ° C에서 배양 하였다. 유효 접종 낮은 (<10 세 CFU 오픈 원), 중 (~ 4 × 10 3 CFU 오픈 삼각형) 또는 높은 (~ 10 4 CFU, 열린 광장)으로 분류 하였다. 접종 클래스 당 N ≥3 실험에서 ± SEM % (가로 막대)를 의미한다. (C) 열거 개별 애벌레에서 균질에 살고있는 박테리아의 여러 번 (LB)에 도금에 의해 측정 된 게시물 감염에 참고 만 유충 열거 분석에 포함 된 감염을 살아나. 도 표시 ± SEM (가로 막대)를 의미한다. (D) GFP- 시겔의 분포에 의해 결정여러 번 낮음, 중간, 높음 용량 접종 (꼬리 정맥 주사)를 이용하여 게시물 감염에서 형광 실체 현미경을 사용하여 라이브 영상. . 전송 이미지 (회색)와 GFP의 형광 (녹색) (B)의 오버레이 - (D)이 수치는 Mostowy 등 19에서 수정되었습니다.
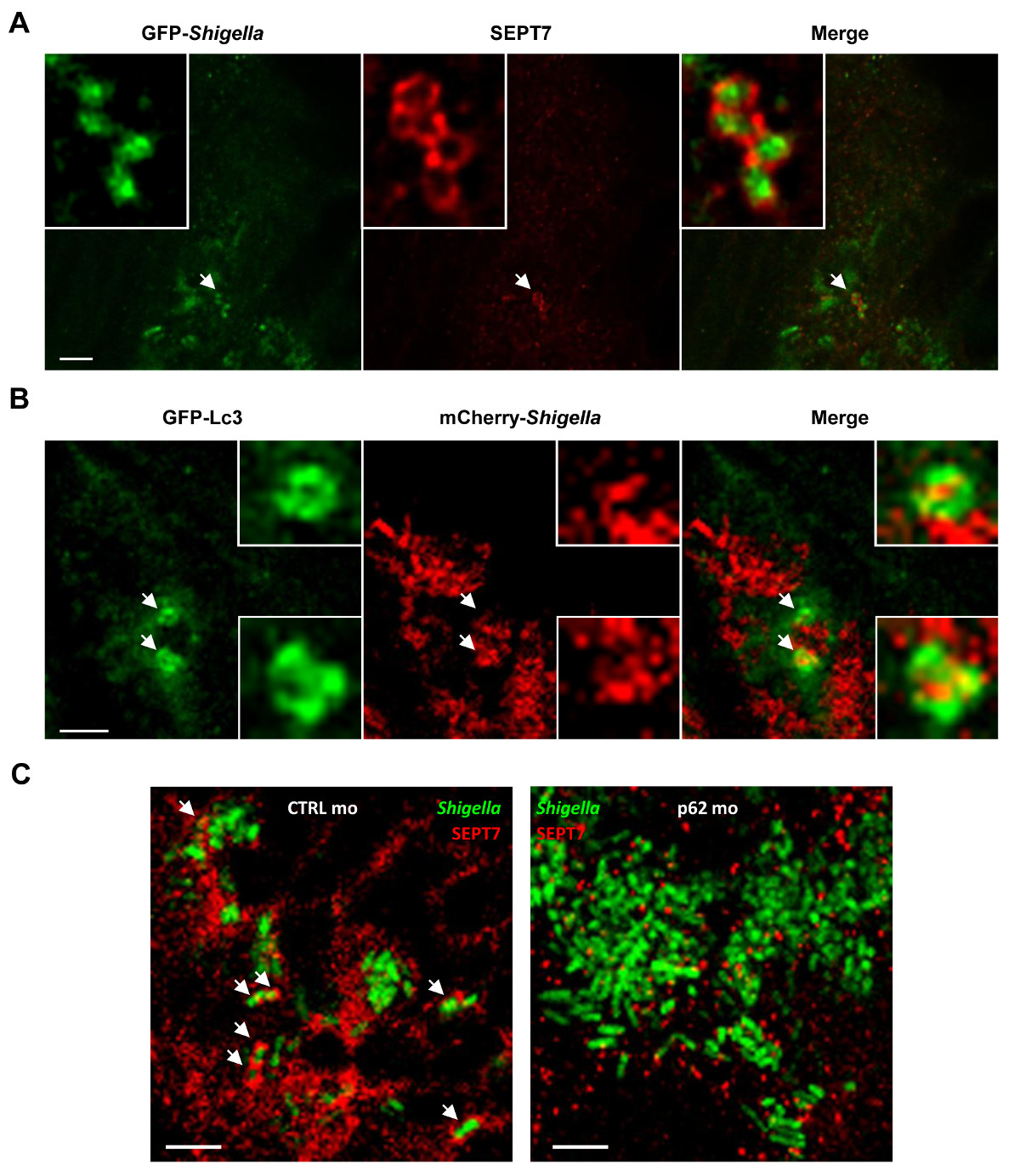
그림 4 생체 내에서 이질 감염 세포 생물학. (A) Zebrafish의 유충은 24 시간, 고정, GFP SEPT7 (빨간색)과 항체로 표지 (녹색에 대한 GFP- 시겔 (저용량)와 꼬리 근육에 감염된 ) 및 공 초점 현미경에 의해 촬상. 스케일 바, 5 μm의. (B) GFP-LC3 제브라 피쉬의 유충 mCherry- 시겔 (중간 용량)에 대한 감염되었다4 시간 고정, mCherry (빨간색)와 GFP (녹색)에 항체로 표지하고, 공 초점 현미경으로 몇 군데. . 또는 P62 (오른쪽 이미지) morpholinos가 SEPT7에 대한 항체 (표지, 고정, 4 시간 동안 GFP- 시겔 라 (중간 용량)에 감염되었다, 스케일 바, 1.5 μm의 (C)는 Zebrafish의 유충은 어느 컨트롤 (왼쪽 이미지 CTRL)로 처리 빨간색)와 GFP (녹색), 그리고 공 초점 현미경으로 몇 군데. 화살표를 septin 케이지 (CTRL) 여부에 갇힌 시겔의 몇 가지 예를 강조 4 시간 게시물 감염 (P62은 고갈). 스케일 바, 5 μm의. 이 수치는 Mostowy 등 19에서 수정되었습니다.
토론
조직 배양 세포를 이용한 시험 관내 및 세포 골격 자식 작용을 모니터링 할 때, 구역 1 및 2에 기재된 프로토콜은 조직 배양 세포 유형의 다양한 적용 할 수있다. 또한, 자식 작용을 따라 (예, ATG8 / LC3가 autophagosomes을했습니다 +)와 세포 골격 (예., 굴지의 꼬리, septin 케이지) 라이브 영상을 사용하여 이질 감염시 실시간으로 역학, 조직 배양 세포가 일시적으로 GFP-를 사용하여 형질 전환 할 수있다, 이전에 같은 RFP- 또는 CFP-태그 구조는 7,8을 설명했다. (. 즉, 시겔 100에서 HeLa 세포 5-30 %에 침입 할 수 있다는 것을 고려 실시간 분석을 위해 일반적으로 바람직 1 MOI) 이질균에 감염된 세포의 백분율을 증가시키는 (OD 직접 시겔 400 μl를 추가하고, 600 = 0.3 -0.6) 2 ㎖의 세포에 MEM (혈청에 굶주린)와 충분한 세균 항목에 대한 최소 1.5 시간 게시물 감염 기다려 phagosome, 복제, AU에서 탈출tophagy 인식과 septin의 caging. 또한, 하나는 어드 AfaE을 표현하고 상피 세포에서 더 높은 침략 능력 M90T 변형 28에 비해 한 시겔 M90T AfaI의 피로를 사용할 수 있습니다. 참고로, M90T AfaI 변형은 아직 제브라 피쉬를 사용하여 생체 내에서 테스트되지 않았습니다. 시겔 식민지의 플레이트 2 ~ 3 일 동안 4 ° C로 유지하고 여러 가지 실험에 사용 할 수 있습니다. 그러나, 시간이 지남에 따라, 또한 콩고 레드를 흡수하고 나타날 수있는 독성 플라스미드를 잃은 시겔의 식민지는 독성 플라스미드를 유지했다합니다. 이러한 이유로 우리는 가능하면 신선한 박테리아 주식을 사용하는 것이 좋습니다.
생체 내에서 감염 세포 생물학을 모니터링 할 때, 프로토콜 부 (3, 4)를 사용 야생형 AB 선 제브라 피쉬에 기재. 시각적으로는 DsRed : GFP 또는 lyz : 시겔 -leukocyte 상호 작용을 모니터링하기 위해 형질 전환 제브라 피쉬 라인은, 예를 들어, 메가 픽셀 사용할 수 있습니다호중구 19,29,30 또는 MPEG1을이지는 : mcherry 식세포 19,31를 시각화 할 수 있습니다. 3.8 절에 설명 된대로 생체 내에서 자식 작용을 시각화하기 위해, GFP-LC3 제브라 피쉬의 유전자 변형 라인 19,24 사용할 수 있습니다.
생체 내에서 자식 작용을 교란하기 위해 효과적인 모르 폴리 노 올리고 뉴클레오티드의 투여 량은 성적 접합 또는 단백질의 번역을 억제하는 효율에 기초하여 실험적으로 평가되어야한다. 이는 적정 실험을 수행하고, (스플 라이스 모르 폴리 뉴클레오티드에 대한) RT-PCR에 의해 고갈을 확인하거나 (병진 모르 폴리 뉴클레오티드에 대한) SDS-PAGE (32)에 의해 적당하다. 제브라 피쉬 배아 또는 유충으로부터 분리 RNA는 구 아니 디늄 티오 시아 네이트 - 페놀 - 클로로포름 추출을 이용하여 수행 될 수있다. 제브라 피쉬의 유충 (8-15 유충 / 관)에서 단백질을 추출하려면, 기계적, 0.01 % 옥틸 페놀 산화 에틸렌 condensat 200 μL 용해 버퍼 (1 M 트리스, 5 M의 NaCl, 0.5 M EDTA에서 유를 사용하여 균질화즉, 및 프로테아제 억제제). 15 분 동안 4 ° C에서 19,000 XG에 원심 분리기 튜브와 새로운 튜브에 뜨는을 전송합니다. 15 분 동안 95 ° C에서 샘플을 Laemmli에 버퍼를 추가하고 가열한다. 해물은 필요할 때까지 -80 ° C에 저장 될 수 있으며, 2.3 절에 설명 된대로 웨스턴 블로 팅에 의해 평가 될 수있다.
제브라 피쉬는 생체 내 약물 응용 프로그램을위한 훌륭한 모델입니다. 모르 폴리 노 올리고 뉴클레오티드를 사용하여 분석 자식 작용 (예를 들어, 라파 마이신 및 bafilomycin)를 조작하기 위해 설립 약물 보완 할 수 있습니다. 감염되지 않은 및 / 또는 감염 유충은 라파 마이신 (1.5 μM) 또는 bafilomycin (80nm의) E2로 희석하고, 25,33에 설명 된대로 autophagic 플럭스가 웨스턴 블 롯팅에 의해 평가 될 수로 처리 할 수있다. 섹션 3.5에 기재된 바와 같이 감염된 애벌레의 감염 및 생존의 결과에 자식 작용 조작의 결과는 평가 될 수있다.
숙주 세포를 연구 외에생체 외 및 생체 내 프로토콜의 결정은, 예를 들면., 시겔 ΔicsA이 (이질 단백질 ICSA는 N-WASP를 모집하고 Arp2 / 3, 차동 자식 작용에 의해 인식되는 박테리아의 돌연변이 균주를 사용하여 자식 작용 인식에 필요한 세균 결정을 평가하기 위해 적용 할 수 있습니다 그것의 부재에서, 그것의 휴무에 더 굴지의 꼬리, 아니 septin 케이지)와 ShigellaΔicsB (시겔은 ICSA에 자식 작용 기계의 채용을 방지 세균 이펙터 단백질 IcsB 통해 autophagic 응답을 피할 수있을 수 없다, 굴지의 꼬리와 septin 케이지 형성 더 septin 케이지, 더 많은 자식 작용) 7,8있을 수 있습니다.
시겔은 제브라 피쉬의 자연 병원체하지 않고 37 ℃에서 최적 성장한다. 그러나 작품은 싸이의 탐식 액포 및 복제에서 탈출, 시겔 침공에 요구되는 독성 요인을 보여 주었다tosol 표현 및 28 ° C 19에 제브라 피쉬의 유충에서 기능적 할 수 있습니다. 28 ° C 정상적인 제브라 피쉬의 개발 (23)을 보장하기 위해 제브라 피쉬의 양육 및 표준 온도에 가장 일반적으로 사용되는 온도이다. 놀랍게도 인간에서 세균성 이질로 이어질 주요 병원성 이벤트 (상피 세포 내에서 즉, 대식 세포의 죽음, 침략과 곱셈, 세포 간 확산, 호스트 상피 세포의 염증 파괴) 충실하게 시겔 라 감염의 제브라 피쉬 모델에서 재현 19.
자식 작용 및 세포 골격 재하 유전자 발현과 생물학적 기능의 넓은 범위가된다. 마우스 연구 5 배아 치명적인 필수적인 자식 작용 26 또는 septin 유전자의 넉 아웃을 도시 한, 그리고 이러한 문제는 제브라 피쉬 여러 가지고 있다는 사실에 의해 감소 될 수 있지만 이들 유전자 중 일부는 (지브라 피쉬 개발에 필수적 일 것이라는 가능성paralogous 유전자 33). 그렇다면 morpholinos 아래로 적정 수 (II) 자식 작용 및 세포 골격을 조절하는 (ⅰ) 약리학 적 시약의 사용을 포함하여 이런 문제를 극복하기 위해 여러 가지 대안이있는 유전자의 (ⅲ) 녹아웃는 특정 셀에 대해 설계 될 수있다 유형 및 / 또는 (IV) 동물 개발에 필수적인 없습니다 autophagic 인식에 관여하는 유전자 (예., P62)을 대상으로 할 수 있습니다.
제브라 피쉬는 자식 작용과 이질 감염시의 세포 골격을 조사 할 수있는 이상적인 모델 시스템이지만, 분자 도구는 현재 부족하다. 필드는 새로운 툴과 관심 단백질의 구동 셀 특정 식을 생성 할 필요가있다. 자식 작용 / 세포 골격 유전자의 발현을 녹아웃하기 위해, 새로운 시퀀스 모르가 필요하고, 유전체 공학을위한 신규 한 방법 (예를 들면, TALEN는 CRISPR / Cas9)도 사용될 수있다. 한편, 몇 가지 도구는 이전에 인간 또는 마우스 연구에 대해 생성똑같이 제브라 피쉬를 위해 작동하지 않을 수 있습니다.
세포 내 박테리아 S. flexneri는 면역 체계의 1, 2에 의해 인식되는 박테리아의 기능을 포함하여 생물학의 핵심 문제를 해결하기 위해 뛰어난 모델 생물로 떠오르고있다. 숙주 세포의 S. 운동성을 제한 septins을 채용 flexneri와 자식 작용으로, 대상 셀 자율 면역 7,8의 중요한 구성 요소입니다. 이러한 관찰은 자식 작용 (autophagy)과 세포질 박테리아를 분해 할 수있는 능력을 연구하기위한 새로운 분자 프레임 워크를 제안한다. 주요 문제는 완전히 기본 분자 세포 사건을 해독하고, 중요한 동물 모델을 사용하여 생체 내에서 세균 감염 동안 시험 관내 분석 이러한 이벤트를 확인하는 지금이다. 이를 위해, 제브라 피쉬는 S.의 분석을위한 유용한 새로운 호스트로 설정 한 내용 flexneri 감염 19. 박테리아 숙주 세포 사이의 상호 작용은 고해상도 영상화 할 수 있고,제브라 피쉬 모델 생체 내에서 시겔 감염 세포 생물학을 이해하는데 유용한다. 제브라 피쉬 유충 숙주 방어 세균 자식 작용의 역할을 조사하기 위해 사용될 수 있으며, 작업의 자식 작용 섭동 악영향 이질균 감염 19에 응답하여 호스트의 생존에 영향을 미칠 수 있다는 것을 보여 주었다.
관찰은 호스트 방어를 이해하는 근본적인 진보를 제공 할 수있는 제브라 피쉬의 유충을 사용하여 조직 배양 세포와 생체 내에서를 사용하여 시험 관내에서 caging와 자식 작용을 septin, 시겔의 연구에서 생성 된. 또한 감염성 질환을 퇴치 겨냥한 새로운 전략의 개발을 제안 할 수있다.
이 보고서의 주요 목적은 체외에서 분석 분자 및 세포 사건의 의미를 확인하는 것입니다 (즉, 자식 작용, 굴지의 꼬리, caging septin) 엔트의 맥락에서 생체 내에서 세균 감염시를제브라 피쉬의 유충을 사용하여 분노 생물. 제브라 피쉬의 생물학 및 취급 익숙하지 않으면, 하나는 적절한 제브라 피쉬 사육 (23)과 제브라 피쉬 감염 19,35의 생체 분석에 깊이 프로토콜에서 참조 할 수 있습니다.
공개
저자는 그들이 더 경쟁 금전적 이해 관계가 없다고 선언합니다.
감사의 말
SM의 실험실에서 작업은 웰컴 트러스트 (Wellcome Trust) 연구 경력 개발 원정대 [WT097411MA]에 의해 지원됩니다.
자료
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Sigma-Aldrich | B1793 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Borosilicate glass microcapillars | Harvard Apparatus | 30038 | |
| Coarse manual manipulator | Narishige | M-152 | |
| Cytochalasin D | Sigma-Aldrich | C6762 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes | D1306 | |
| Dumont #5 fine tweezers | Fine Science Tools | 11254-20 | |
| Forchlorfeneuron | Sigma-Aldrich | 32974 | |
| Goat anti-mouse IgG (H+L) antibody | Molecular Probes | N/A | |
| Goat ant-rabbit IgG (H+L) antibody | Molecular Probes | N/A | |
| JetPEI transfection reagent | Polyplus transfection | 101-01N | |
| Latrunculin B | Sigma-Aldrich | L5288 | |
| LC3 antibody | Novus Biologicals | NB100-2220 | |
| Low melting agarose | Promega | V2111 | |
| MatTek glass bottom dish | MatTek corporation | P35G-1.0-14 | |
| MEM plus L-alanyl-L-glutamine | GIBCO | 41090028 | |
| MEM non-essential amino acids solution | GIBCO | 11140-035 | |
| Microinjector | Narishige | IM-300 | |
| Micropipette puller device | Sutter Instrument Co., Novato, | P-87 | |
| Mineral oil | Sigma-Aldrich | P35G-1.0-14 | |
| Monoclonal anti-tubulin, acetylated antibody | Sigma-Aldrich | T6793 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| N-phenylthiourea | Sigma-Aldrich | P7629 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Phalloidin | Molecular Probes | A12379 | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Protease inhibitor cocktail | Roche | 4693116001 | |
| p62/SQSTM1 antibody | Cliniscience | PM045 | |
| Rapamycin | Sigma-Aldrich | R8781 | |
| Sodium pyruvate | GIBCO | 11360039 | |
| Transfection reagent | Life Technologies | 12252-011 | |
| Vectashield hard set mounting medium containing DAPI | Vector Laboratories | H-1500 |
참고문헌
- Ashida, H., et al. Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr Opin Immunol. 23, 448-455 (2011).
- Phalipon, A., Sansonetti, P. J. Shigella's ways of manipulating the host intestinal innate and adaptive immune system: a tool box for survival. Immunol Cell Biol. 85, 119-129 (2007).
- Welch, M. D., Way, M. Arp2/3-mediated actin-based motility: A tail of pathogen abuse. Cell Host Microbe. 14, 242-255 (2013).
- Haglund, C. M., Welch, M. D. Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton. J Cell Biol. 195, 7-17 (2011).
- Mostowy, S., Cossart, P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 13, 183-194 (2012).
- Saarikangas, J., Barral, Y. The emerging functions of septins in metazoans. EMBO Rep. 12, 1118-1126 (2011).
- Mostowy, S., et al. Entrapment of intracytosolic bacteria by septin cage-like structures. Cell Host Microbe. 8, 433-444 (2010).
- Mostowy, S., et al. p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways. J Biol Chem. 286, 26987-26995 (2011).
- Mostowy, S., et al. Septins regulate bacterial entry into host cells. PLoS One. 4 (15), (2009).
- Mostowy, S., et al. Septin 11 restricts InlB-mediated invasion by Listeria. J Biol Chem. 284, 11613-11621 (2009).
- Phan, Q. T., et al. Role of endothelial cell Septin 7 in the endocytosis of Candida albicans. mBio. 4 (e00542-13), (2013).
- Mostowy, S., Cossart, P. Septins as key regulators of actin based processes in bacterial infection. Biol Chem. 392, 831-835 (2011).
- Levine, B., Mizushima, N., Virgin, H. W. Autophagy in immunity and inflammation. Nature. 469, 323-335 (2011).
- Randow, F., MacMicking, J. D., James, L. C. Cellular self-defense: how cell-autonomous immunity protects against pathogens. Science. 340, 701-706 (2013).
- Mostowy, S. Autophagy and bacterial clearance: a not so clear picture. Cell Microbiol. 2 (12063), (2012).
- Mostowy, S., Cossart, P. Bacterial autophagy: restriction or promotion of bacterial replication. Trends Cell Biol. 22, 283-291 (2012).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr Opin Immunol. 22, 10-19 (2010).
- Renshaw, S. A., Trede, N. S. A model 450 million years in the making: zebrafish and vertebrate immunity. Dis Model Mech. 5, 38-47 (2012).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. Plos Path. 9, e1003588 (2013).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Fixation and permeabilization of cells and tissues. Cold Spring Harb Protoc. , (2008).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 8, 445-544 (2012).
- Mizushima, N., Yoshimori, T., Levine, B. Methods in mammalian autophagy research. Cell. 140, 313-326 (2010).
- Westerfield, M. A guide for the laboratory use of zebrafish (Danio rerio). The Zebrafish Book. , (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. 61 (e3781), (2012).
- He, C., Bartholomew, C. R., Zhou, W., Klionsky, D. J. Assaying autophagic activity in transgenic GFP-Lc3 and GFP-Gabarap zebrafish embryos. Autophagy. 5 (4), 520-526 (2009).
- Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell. 147, 728-741 (2011).
- Komatsu, M., et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell. 131, 1149-1163 (2007).
- Nowicki, B., Coyne, K. E., Lublin, D. M., Nowicki, S., Hart, A. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. J Exp Med. 178, 2115-2121 (1993).
- Hall, C., Flores, M., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7 (42), (2007).
- Renshaw, S. A., et al. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, 2010-2010 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (9), (2009).
- He, C., Klionsky, D. J. Analyzing autophagy in zebrafish. Autophagy. 6, 642-644 (2010).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 25 (496 (7446)), 498-503 (2013).
- Levraud, J. P., Colucci-Guyon, E., Redd, M. J., Lutfalla, G., Herbomel, P. In vivo analysis of zebrafish innate immunity. Methods Mol Biol. 415, 337-363 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유