Method Article
Kullanımı
Bu Makalede
Özet
Patojen yayılmasını karşı koymak için, konakçı hücreler bakteriler ve bölümlere Otofaji uyarabilme iskeletinin yeniden. Doku kültürü hücreleri, ev sahibi ve bu işlem altında patojen belirleyicileri kullanılarak Shigella enfeksiyonu tespit ve karakterize edilir. Shigella enfeksiyonu Zebra balığı modellerini kullanarak, keşfedilen moleküllerin ve mekanizmaların rolü in vivo incelenmiştir.
Özet
Shigella flexneri sitoplazmada ulaşmak için fagozomların kaçmak ve onun hareketliliği ve yaygınlaştırılmasını teşvik etmek iskeletinin aktin ana polimerize edebilen hücre içi patojendir. Yeni iş aktin tabanlı motilite yer alan proteinler aynı zamanda Otofaji hücre otonom bağışıklık için önemli bir hücre-içi ayrıştırma işlemi ile bağlantılı olduğunu göstermiştir. Çarpıcı bir konakçı hücreler, S. aktin tabanlı motilite önleyebilir bakterilere içinde 'septin kafesleri' compartmentalizing ve otofaji onları hedefleyerek flexneri. Bu gözlemler septins daha tam bir anlaşılması, lifli GTP bağlayıcı proteinler ailesidir, Otofaji sürecinde yeni görüşler işaret etmektedir. Bu rapor, S. neden Otofaji-iskeleti etkileşimlerin görüntülenmesi için protokollerini anlatır flexneri, in vitro doku kültürü hücreleri kullanılarak ve in vivo zebra balığı larva kullanılmıştır. Bu protokoller hücre içi mekaniği hakkında soruşturma etkinleştirmekmoleküler, hücresel, ve bütün organizma düzeyinde bakteri yayılmasını kontrol ms.
Giriş
Shigella flexneri, Gram-negatif invaziv enteropatojenik bakteri, sitoplazmada fagozomların kaçmak ve sitozolik immün yanıtları kaçmasına ve içi ve hücreler arası hareketi 1,2 teşvik etmek konak aktin iskeletinin polimerize olabilir. In vitro 3,4 aktin tabanlı motilite anlayışa rağmen, in vivo bakteri yayılmasını kısıtlayan mekanizmalar tam olarak tanımlanmamıştır. Bu doğuştan gelen bağışıklık ve konak savunma daha iyi anlaşılması için önemlidir.
Septins, Metazoan'da arasında proteinlerin yüksek oranda korunan bir aile hetero-oligomerik kompleksleri halinde birleşme ve hücresel membranlar ve hücre iskeleti ile ilişkilendirmek 5,6 polar olmayan filamentler oluşturmak proteinleri etmeye dayanır guanosin trifosfat (GTP) bulunmaktadır. Son çalışmalar, enfekte olmuş konakçı hücreler autoph hedeflenmiş bölümlere bakterilerin Shigella, aktin göre hareketlerini önleyebilir keşfetmiştiraktin esaslı hareketliliğini 7,8 dengeler ilk hücresel mekanizmayı ortaya agy içinde 'septin kafesleri',. Soruşturmanın geniş bir açık alanı artık 'septin biyoloji ve enfeksiyon' yatıyor. Patojenlerin yol açtığı septin montaj, (örneğin, Listeria monocytogenes 7,9,10, Mycobacterium marinum 7,8, Candida albicans 11), konak savunma 5,12 önemli bir konu olarak ortaya çıkabilir.
Otofaji, yüksek oranda korunmuş hücre içi bozulma süreci, çünkü lizozomdur 13,14 sitosolik bakteri teslim kabiliyetini hücre özerk bağışıklığın önemli bir bileşeni olarak görülüyor. Ancak, in vivo bakteriyel otofaji rolü kısıtlamak veya kötü 15,16 anlaşılamamış bakteri çoğaltma teşvik etmek. Bu optik olarak erişilebilir olduğu için zebra balığı (Br.rerio) enfeksiyonları çalışma için omurgalı bir model olarak ortaya çıkmıştırlarva aşamasında doğuştan gelen bağışıklık sistemi zaten 17,18 işlevsel olduğunda. Son çalışmalar S. Zebra balığı larvalarının duyarlılığını karakterize etti flexneri, bakteriyel otofaji 15 için bir paradigma, ve in vivo 19 antibakteriyel tedavi için otofaji manipülasyon çalışma Shigella -zebrafish enfeksiyon modeli kullandı.
Bu rapor yeni araçlar ve S. incelemek için tahliller sağlar otofaji ve hücre iskeleti ile flexneri etkileşimleri. Bir birinci basamakta, protokoller, hücre iskeleti otofaji-etkileşimleri insan epitel hücre hattı HeLa, Shigella enfeksiyonu kullanılarak anlatılmıştır izlemek için. In vitro Shigella enfeksiyonları sürecine otofaji-iskeleti etkileşimlerin rolünü değerlendirmek için, yöntemler sunulmaktadır Otofaji ve (siRNA'nın veya farmakolojik reaktifler kullanarak) iskeleti bileşenleri işlemek için. Yeni iş Shigella enfeksiyonu o kullanarak göstermiştirf zebra balığı larvası, benzer deneyler, in vivo enfeksiyon, hücre biyolojisi okumak için uygulanabilir. Protokoller hazırlamak ve Zebra balığı larvaları detaylı bulaştırmak ve in vivo Shigella enfeksiyonu için konak yanıtı değerlendirmek için, protokoller konak yaşam ve enfekte larva bakteriyel yükü sağlanır belirlemek için. (Yöntem (sabit veya canlı larva kullanılarak zebra balığı) Shigella için septin ve Otofaji belirteçlerinin işe izlemek ve yöntemleri [morfolino (1-4 hücre aşamasında embriyoların içine enjekte) oligonükleotidlerin ya da farmakolojik reaktifler kullanılarak, in vivo bu süreçlerin rolü test etmek için Zebra balığı banyo suyuna direkt ilave)] de tartışılmıştır. Bu iş programı sitozolik ana yanıtlarının enfeksiyonu kontrolü için gerekli mekanizmaların kavranmasını sağlaması bekleniyor.
Protokol
1. İzleme Otofaji ve In Vitro Hücre iskeleti Doku Kültürü Hücreler kullanma
- S. hazırlayın flexneri
- Plaka S. Bir Kongo Kırmızı üzerine -80 ° C'de gliserol stokundan flexneri M90T (vahşi tip) kazein soya (ASR) triptik agar plaka. 37 ° C'de gece boyunca inkübe edilir. Aynı plakası birçok deneyleri için de kullanılabilir.
- Tek bir koloni seçin ve 37 ° C'de gece boyunca bir çalkalama 8 mi ASR ortamda büyür.
NOT: bağlama Kongo-kırmızı virülans plazmid muhafaza edildiğini belirtir. - Üstel büyüme için alt-kültürü bakteri için, 1/80 seyreltmeden gece boyunca bakteri kültürü ile inoküle ve taze TCS = 0.3-0.6 OD 600, 37 ° C'de bir çalkalayıcı içinde büyür.
- 5 dakika boyunca 1000 x g'de bakteriyel alt kültür Spin. 5 dakika boyunca 1000 x g'de MEM ve santrifüj ile pelet yıkayın. = 0.3-0.6 OD 600 MEM pelet sulandırmak.
- HeLa Ce hazırlayınEnfeksiyon için lls
- 'Tam ortam ", yani HeLa hücreleri büyütün. MEM artı L-alanil-L-glutamin, 1 mM sodyum piruvat, 0.1 mM esansiyel olmayan amino asit çözeltisi ve% 10 cenin dana serumu ile takviye edilmiştir.
- Deney başlamadan önce, 6 oyuklu tabaklar 24 1-1.5 x 10 5 hücre ya da 48 saat Plate. Cam mikroskop için, 6 oyuklu plakalar içerisinde lamelleri ya da 35 mm 'lik cam taban yemekler plaka levhalar canlı görüntüleme için hazırlamaktır.
Not: (örn., Aktin kuyrukları, septin kafesleri) Otofaji izleyin canlı görüntüleme kullanılarak Shigella, enfeksiyon sırasında, gerçek zamanlı olarak ve hücre iskeleti dinamiklerini (örneğin, ATG8 / LC3 autophagosomes + ve), doku kültürü hücreleri geçici olarak, GFP ile transfekte edilebilir RFP- veya CFP-etiketli yapıları (Tartışma).
- Enfeksiyon
- 100 ile hücreleri enfekte: enfeksiyon 1 çokluğu (İçişleri Bakanlığı) Shigella arasında (OD 600 = 0,3-0,6) MEM seyreltilmiş; şirketinden 6-w kaplama HeLa hücrelerinde ekle(serum hasret) MEM 2 ml (1.2 bölümünde açıklandığı gibi) enfeksiyon 48 saat önce - 24 ell plakalar.
- Oda sıcaklığında 10 dakika boyunca 700 xg'de hücreler, santrifüj bakteriler ve konukçu hücrelere bakteriyel yapışmayı arttırmak için. Santrifüj işleminden sonra, 37 ° C,% 5 CO2 seviyesinde 30 dakika boyunca inkübe edilir ve enfeksiyon devam etmesine izin verin.
- Taze MEM ile iki kere yıkayın ve enfekte olmuş hücrelerin 1-4 saat için deneye bağlı olarak (hücre dışı bakterileri yok etmek için 50 ug / ml) gentamisin içeren komple ortam ile inkübe edilir.
- Mikroskopi için Enfekte HeLa Hücreleri Tespit ve Etiketleme
- 1x PBS ile iki kere yıkayın enfekte hücreleri, ve oda sıcaklığında 1 x PBS içinde% 4 paraformaldehit içinde 15 dakika için düzeltme. Paraformaldehid kaldırmak için, yıkama hücreler 1x PBS ile 2x.
- Oda sıcaklığında 10 dakika boyunca 50 mM amonyum klorür ile sabitleştirilmiş hücreler inkübe edin. Oda t% 0.1 oktilfenol etilen oksit kondensatı ile 4 dakika boyunca hücreler 1 x kez PBS ile yıkayın ve geçirgenemperature.
Not: Alternatif saponin ya da metanol gibi nüfuziyet kabiliyeti etilen oksit kondensatı oktilfenol için, hücresel yapıların 20 farklı muhafazası için uygulanabilir. - De (1x PBS hücreleri yıkayın ve 30 dakika boyunca (ör: P62 / SQSTM1) ya da septin hücre iskeleti (SEPT2, SEPT6, SEPT7, SEPT9 ve SEPT11 olmuş HeLa hücrelerinde ifade edilmiştir) Otofaji kritik bileşenlerine karşı primer antikorlar ile ıslak odasında inkübe gece boyunca oda sıcaklığı) (4 ° C'de).
- (4 ° C) gece boyunca (oda sıcaklığında) 30 dakika boyunca, falloidinle filamentli aktin (F-aktin) 1x PBS ile iki kez yıkanır ve hücreler sekonder antikor ile ıslak odasında inkübe ve etiketleyin. Ev sahibi hücre çekirdekleri boyama için 4 ", 6-diamidino-2-fenilindol (DAPI) ekleyin.
- 1x PBS hücreleri yıkayın ve montaj orta kullanarak slaytlar üzerinde cam lamelleri monte edin.
- Enfekte HeLa hücrelerinin mikroskopik görüntüleme
- Görüntünün inf içinyansıtılmaktadır hücreler Epifloresans veya konfokal mikroskop ve DAPI işaretli Shigella tanımlamak için bir ya da 63X objektif 100X kullanın.
Not: Şekil 1A'da gösterildiği gibi - 1C, septin kafesleri, halka benzeri yapılar olarak görselleştirilebilir ~ aktin polimerizasyon ve Otofaji belirteçleri (örneğin, P62 ve LC3) 7,8 alımı sitosolik bakteri çevresindeki çapı 0.6 um. Buna karşılık, aktin kuyrukları polimerize bakteri septin kafeslerle bölümlere olmayacak ve 7,8 Autophagy hedefleyen olmayacaktır. - Bir Epifloresans veya konfokal mikroskop ve bir ya da 63X objektif kullanılarak 100X, mikroskobik alan başına hücre içi bakteri sayısını belirlemek. Ayrıca bakteri septin kafeslerde hapsedilmiş ve otofaji hedefleyen, ya da aktin kuyrukları polimerize ve Otofaji kaçan sayısını ölçmek.
- INFE bir Z-yığın görüntü dizisi çekmek septin kafesler veya polimerize aktin kuyrukları sıkışmış bakteri yüzdesini belirlemek içinHücreler, işlem görsel cted ve en az 3 bağımsız deneyler, deney başına en az 500-1000 bakteri sayısı.
- Görüntünün inf içinyansıtılmaktadır hücreler Epifloresans veya konfokal mikroskop ve DAPI işaretli Shigella tanımlamak için bir ya da 63X objektif 100X kullanın.
Autophagy ve Sitoiskelet in vitro 2. Fonksiyonel Analiz
Not: genetik ve farmakolojik yaklaşımlar enfekte olmuş doku kültür hücrelerinde Otofaji perturb için kullanılabilir ve izlenebilir enfeksiyonu esnasında bu tedavilerin etkisi de.
- siRNA aracılı susturma
- Komple ortam içinde 6 oyuklu plakalar içerisinde cam lameller üzerine 0.8 x 10 5 HeLa hücrelerini Plate.
- Otofaji ve / veya hücre iskeleti belirteçleri karşı siRNA ile bir lipid-bazlı transfeksiyon ayıracı kullanılarak, ertesi gün transfekte.
- Bölüm 1.3 'de açıklandığı gibi arzu edilen inkübasyon süresinden sonra, Shigella ile hücreleri enfekte etmektedir.
- Düzeltmek ve Bölüm 1.4 de tarif edildiği gibi hücreleri etiketlemek.
- Farmakolojik Manipülasyon
NOT: iskeleti, mikrotübül nocodazole'nin kullanmak depolimerize aktomizin aktivite kullanım Blebbistatin engellemek veya septin montaj kullanımı forchlorfeneuron bozmaya, D veya latrunculin B sitokalasin aktin hücre iskeleti kullanımını depolimerize, örneğin, farmakolojik olarak manipüle edilebilir. Otofaji rapamisini kullanarak uyarılmış veya bafilomisin kullanılarak bloke edilebilir.- Bakteri hücreleri girin ve sitoplazmada fagozomun kaçmak için ilk yeterli zaman 1.3 bölümünde açıklandığı gibi Shigella ile hücreleri enfekte ve izin, Shigella enfeksiyonu sırasında iskeletinin işlemek için (örn.,> 1.5 saat sonrası enfeksiyon).
- (5 M sitokalasin D latrunculin B, nokodazol), 20 uM (forchlorfeneuron) veya 50 M (Blebbistatin) bir son konsantrasyona kadar MEM içinde [dimetil sülfoksit (DMSO) içinde süspansiyon haline getirilmiş bir stok çözeltisi] stok çözeltiden uyuşturucu seyreltin ve hücreler, 37 ° C'de 30 dakika muamele. Ilacın toplam miktarı (DMSO / d hacimkilim karışım) / hücrelerin flakon medya 2 ml başına stok solüsyonu bağlı olarak 1-5 ul () 'dir plaka başına ekledi. Bir negatif kontrol olarak MEM içinde seyreltilmiş DMSO benzer bir dozu ile tedavi hücreleri.
- Düzeltmek ve Bölüm 1.4 de tarif edildiği gibi hücreleri etiketlemek.
NOT: (enfekte veya enfekte olmayan hücrelerde) otofajik akının manipülasyonu için, 12 saat 4 ila rapamisini (20 nM) veya bafılomycin (160 nM) kullanılarak ilaç tedavisi uzatmak.
- Western-Blot
Not: Otofajik aktivitesi, P62 ve LC3 gibi Otofaji belirteçlerin protein seviyesini ölçmek suretiyle belirlenebilir.- İnkübasyonun İstenen süreden sonra, toplamak ve bağışıklık boyama için hücreler lize edildi. 8, 10 ya da% 14 akrilamid jel üzerinde yapılmıştır, protein ekstreleri.
- Yani Otofajik akı. 21,22 tarif edildiği gibi Otofaji oranı, analiz edilebilir.
- Mikroskopik Görüntüleme ve sayısallaştırılması
- Bir Epifloresans veya konfokal mikroskop ve bir 63X veya 100X nesnesi kullanmaive Shigella enfeksiyonu üzerindeki etkisi, siRNA veya ilaç tedavisi kantitatif mikroskobu ile değerlendirilebilmektedir (örneğin, autophagosomes, septin kafesleri ve aktin kuyrukları sayım) Bölüm 1.5 de tarif edilen ve Şekiller 2A ve 2B'de gösterildiği gibi.
S. Vivo Görüntüleme 3. Autophagy ve Sitoiskelet ile flexneri Etkileşimleri
Not: Shigella enfeksiyon modeli, zebra balığı, in vivo 19 septin kafes ve Otofaji araştırmak için kullanılabilir.
- S. hazırlayın flexneri
- Kültür S. flexneri olarak 1.1 bölümünde anlatıldığı.
- OD 600 = 0.3-0.6, 10 dakika boyunca 1000 x g'de dönüşte 8 ml bakteriyel altkültür at. 10 dakika boyunca 1000 x g'de 1x PBS ile pelet ve santrifüj yıkayın.
- ~ 2.000 bakteri / nl elde etmek için% 0.1 fenol kırmızı 1x PBS 80 ul pelletini. BacT tutunbuz üzerinde erial hazırlık büyümeyi yavaşlatmak için.
NOT: fenol kırmızı ekleme larva halinde enjekte ederken inokülumu görselleştirmek için yardımcı olacaktır.
- Enjeksiyon için Zebra balığı Larva hazırlayın
Not: Zebrafish yumurta gibi serilir ve larva denir 72 saat sonra döllenme kadar embriyo, olarak tanımlanır.- (Diğer bir deyişle yumurta kökenli yeme yetişkin önleyecektir) mermer ile kaplanmış olan alt kısma sahip bir ayrı balık tankına (1 oranı, genellikle, 2) 4 erkek ve kadın 8 yerleştirerek Westerfield 23 de tarif edildiği gibi yetişkin zebrafish Breed. Alternatif olarak, önceki gece yetiştirme tankları içindeki yumurta toplama sepetleri yerleştirin.
NOT: Yumurta ışıklar Zebra balığı tesisi 23 gitmek sonra ~ 30 dakika döllenir ve küf gelişimini engellemek için en kısa sürede alınmalıdır. Yumurta toplama sepetleri kolayca hasat edilebilir böylece yumurta toplamak ve aynı zamanda yetişkinlerin yumurtalarını korumak için hizmet vermektedir. - Embriyo toplayınS ve 10 dakika boyunca% 0.003 çamaşır suyu ile embriyo ortam (E2) yıkanarak temizleyin. Embriyolar E2 ortamda 5x yıkama, çamaşır suyu ile E2 çıkarın ve 28 ° C'de 10 cm Petri için (100 embriyolar / 50 mi E2 ortamı) embriyolar büyür.
- Embriyolar ya da larva 24 saat sonrası, döllenme esnasında, mikroskop çalışmaları için kullanılacak ise melanization bilmek E2 ortamına% 0.003, N-feniltiyoüre ekleyin. Normal gelişimi için 28 ° C'de embriyolar tutun.
NOT: Zebra balığı larva 72 saat sonra döllenme enfeksiyon için hazırız. - Enfeksiyon ve mikroskopi prosedürler için, E2 200 g / ml tricaine içinde Zebra balığı larvaları uyutmak.
- (Diğer bir deyişle yumurta kökenli yeme yetişkin önleyecektir) mermer ile kaplanmış olan alt kısma sahip bir ayrı balık tankına (1 oranı, genellikle, 2) 4 erkek ve kadın 8 yerleştirerek Westerfield 23 de tarif edildiği gibi yetişkin zebrafish Breed. Alternatif olarak, önceki gece yetiştirme tankları içindeki yumurta toplama sepetleri yerleştirin.
- İntravenöz ve Yerel Enfeksiyonu için Zebra balığı Larva hazırlanması
NOT: Shigella enfeksiyonu sırasında Zebrafish kalımı değerlendirmek kuyruk intravenöz enjeksiyon yapmak. Shigella için septin ve otofaji belirteçlerin işe görselleştirmek için, böyle kuyruk kas gibi lokalize sitelerde enfeksiyonu gerçekleştirin.- Kaudal Damar içi enjeksiyon için, iğne bakan sırt tarafında yanal olarak anestezi larvaları yerleştirin. Şekil 3A gösterildiği gibi, kuyruk damarından amaçlayan, ürogenital açılış iğne ucu close (posterior) yerleştirin ve deriyi delip istenilen bakteri dozu (enjeksiyon hacmi 1-5 nl) teslim.
NOT: Damar enfeksiyonu gerçekleştirmek zordur ve bu prosedür ile rahat olsun eğitim birkaç hafta alacaktır. Eğitim (bakteri olmadan) kırmızı fenol enjekte düzgün enjeksiyon yerinde değerlendirmek için yardımcı olacaktır.
Not: Shigella durumunda, doza bağlı bir düşük doz deneyleri, bir enfeksiyon (<1000 CFU) 48 saat içinde temizlenir ve yüksek dozda enfeksiyonu olduğu gösterilmiştir (> 4000 CFU) 48 saat 19 olan ölüm barındırmak için yol açar. - Bölüm 3.3.1 de açıklandığı gibi bir kuyruk kas enfeksiyonu için, anestezi larvaları yerleştirin. Şekil 3A'da gösterildiği gibi, iğne dikkatli yerleştirmekkas Somitlerin (iskelet kası, yani kesimleri) ve üzerinde y küçük bir hacim enjekte (yani., 1 nl) bakteriyel hazırlanması.
- Kaudal Damar içi enjeksiyon için, iğne bakan sırt tarafında yanal olarak anestezi larvaları yerleştirin. Şekil 3A gösterildiği gibi, kuyruk damarından amaçlayan, ürogenital açılış iğne ucu close (posterior) yerleştirin ve deriyi delip istenilen bakteri dozu (enjeksiyon hacmi 1-5 nl) teslim.
- Larvaları bakterilerin venöz içine enjekte
- 24 de tarif edildiği gibi, borosilikat cam mikrokapilerler çekin.
- Üç boyutlu kaba manuel manipülatör sahibine iğne bağlayın ve ince cımbız ile iğne ucu kırmak.
- Iğne yüklemek için bir örtücü cam üzerine bakteri kültürü bir damla yerleştirin. Hafif mikropüskürtücü ve gaz silindiri açın damla içine iğne ucu daldırın ve bakteriyel hazırlama istenilen miktarda iğne doldurun.
- Enjeksiyon hacmi kalibre etmek için, kapak üzerinde bir mineral yağ damla koyun ve bakteriyel preparatla enjekte edilir. Bir mikrometre kullanılarak damla çapı ölçülür ve hacmi hesaplamak enjekte [V = (4/3) πr 3].
NOT: Bir bakteri oluşumuna ile enjeksiyon, 40 psi ayarlarınızı ve 50 msn'den kullanmaolarak al hazırlık ~ 2.000 CFU / nl verecektir 3.1 bölümünde belirtilen. - Westerfield 23 de tarif edildiği gibi plastik bir kalıp kullanılarak enjeksiyon hazırlık plakası.
- Enjeksiyon plakasına larva transferi ve ince bir fırça kullanarak onları hizaya. Bölüm 3.3.1 açıklandığı gibi şark larvaları enjekte ve.
- E2 1 ml / oyuk ve tek tek 24-yuvalı plakalar içinde zebra balığı hayatta transfer enfekte larva değerlendirilmesi için 28 ° C'de inkübe edin. Zaman (Şekil 3B) boyunca günlük önümüzdeki 2-5 gün ve arsa hayatta kalmak için enfekte larvaları izleyin.
- Bakteriyel Kantifikasyon için Zebra balığı Larva Kaplama
NOT: kontaminasyonu önlemek için steril bir başlık altında çalışın.- (Zaman 0 saat, enfeksiyondan sonraki) ve istenen zaman noktalarında bakteriyel ölçümü için balık içine enjekte edilen bakterilerin sayısını değerlendirmek için, tricaine yüksek dozda (200-500 mg / L) ile zebra balığı larva kurban. 1.5 ml pol bireysel larva yerleştirin200% 0.1 oktil, etilen oksit yoğunlaşma 1x ul PBS ve mekanik ile ypropylene mikrosantrifüj tüpü içinde homojenize edilmiş ve homojen hale getirilir.
NOT: enjeksiyon hacmi içinde bakteri yükü teyit steril 1 x PBS damlasının içine eşit bir dozuyla karşılaştırıldığında pompa ve bunu kaplamak için. - , Steril su içinde zebra balığı larvası homojenatlarının bir seri seyreltme olun ve agar plakaları lizojeni etsuyu (LB) üzerine plaka. Larva öldürücü plazmid korunur ya da değil sahip Shigella ayırt Kongo Kırmızı TCS plakaları üzerine alternatif kaplama olabilir.
NOT: Plaka 3 veya daha fazla enfekte olmayan balık, bir kontrol olarak enfeksiyon için kullanılan Zebra balığı larvalarının durumunu kontrol etmek. - 37 ° C'de plakalar gece boyunca kuluçkalamadan sonra, bakteri kolonileri sayın. Şekil 3C'de gösterildiği gibi, bir günlük ölçeği kullanılarak temsil eder.
NOT: Zebra balığı larvalarının enfeksiyonu sırasında Bakteriyel yük de floresan etiketli Shigella ve mikroskopik i kullanılarak görüntülenebilirBölüm 3.7 ya da 3.8 ile (Şekil 3D) de tarif edildiği gibi maging.
- (Zaman 0 saat, enfeksiyondan sonraki) ve istenen zaman noktalarında bakteriyel ölçümü için balık içine enjekte edilen bakterilerin sayısını değerlendirmek için, tricaine yüksek dozda (200-500 mg / L) ile zebra balığı larva kurban. 1.5 ml pol bireysel larva yerleştirin200% 0.1 oktil, etilen oksit yoğunlaşma 1x ul PBS ve mekanik ile ypropylene mikrosantrifüj tüpü içinde homojenize edilmiş ve homojen hale getirilir.
- Zebra balığı Larva immün
- İstediğiniz zaman noktalarında, tricaine aşırı dozda kullanarak larvaları kurban. 1.5 ml polipropilen mikrosantrifüj tüpleri (10-20 larva / tüp) içinde balık toplayın.
- (4 ° C) 2 (oda sıcaklığında) saat veya gece boyunca (larva kümelenmeyi engellemek için), 1x PBS içinde% 0.4 oktilfenol etilen oksit kondensatı ile% 4 paraformaldehid ile larvaları saptamak ve bir orbital çalkalayıcı içinde inkübe edilir.
Not: Elektron mikroskobu enfekte zebra balığı larvası ultrastrüktürel analizler için de kullanılabilir. Bu durumda, anestezi embriyolar Mostowy et al 19'a göre sabit ve işlenmelidir. - 5 dakika boyunca 1x PBS% 0.4 oktil, etilen oksit yoğunlaştırılmış 3x yıkayın, sonra da oda sıcaklığında 1 saat boyunca (1 x PBS içinde% 10 fetal buzağı serumu,% 1 DMSO,% 0.1 polioksietilen sorbitan monolaurat) çözeltisi bloke bloke eder.
- DiUd çözüm engelleme birincil antikor. Seyreltilmiş birincil antikora larva ekleyin ve bir orbital çalkalayıcı içinde, 4 ° C'de gece boyunca inkübe edilir. Bölüm 1.4.3, yukarıda tarif edildiği gibi, birincil antikor kullanılır.
- Oda sıcaklığında PBS 1x% 0.1 polioksietilen sorbitan monolaurat 15 dakika boyunca larvaların 4x yıkayın.
- Çözümü engelleme ikincil antikor sulandırmak. Seyreltilmiş sekonder antikor larvaları ekleyin ve bir orbital çalkalayıcı içinde, 4 ° C'de gece boyunca inkübe edilir. Bölüm 1.4.4 tarif edildiği gibi, aynı ikincil antikorlar ve Phalloidin kullanın.
- Oda sıcaklığında PBS 1x% 0.1 polioksietilen sorbitan monolaurat içinde 15 dakika boyunca yıkama 4x. Ev sahibi hücre çekirdeklerinin boyanması için, bu 15 dakika yıkama sırasında ilk DAPI (150 nM son konsantrasyon) ilave edilir.
- Floresan etiketli larva Koruyucu madde olarak, 15, 30, 60, bir gliserol gradyanı içinde kademeli şekilde inkübe edin ve% 80 oda katkılı 2 st için 1x PBS ve% 0.1 polioksietilen sorbitan monolaurat (içinde seyreltilmişçalıçtırdıgınızda) gece boyunca () 4 ° C'de ilave edildi.
NOT: Vitray larva uzun süre saklanabilir 4 ° C'de% 80 gliserol (örneğin, 4 ay.).
- Sabit Zebra balığı Larva Mikroskopik Görüntüleme
- 35 mm (stereomikroskobi için) Petri kabı veya (konfokal miscopy için) tam cam alt çanak% 80 gliserol küçük bir damla sabit gliserol gömülü larva transferi.
- Enfekte larva Z-yığın görüntü dizisi çekmek ve gerektiği gibi görüntüleri işlemek.
- Bir Epifloresans veya konfokal mikroskop ve bütün organizma görüntüleme için bir 10X veya 20X objektif kullanın. Daha sonra konfokal mikroskop ve tek tek hücrelerin görselleştirmek için 40X, 63X ya da 100X amaç ve otofaji işe kullanımı ve in vivo olarak 19 ayrı ayrı bakterilerin imleyiciler, hücre iskeleti (Şekil 4A ve 4B).
NOT: kuyruk kas balık bulaştırmak ve ea etkinleştirmek için cam alt çanak alt kısmındaki gliserol düz montesy odak.
- Enfekte Zebra balığı Larva Mikroskopik Görüntüleme Canlı
Not: Larvalar, böylece in vivo autophagosomes GFP-LC3 zebra balığı transgenik hat 25 kullanılarak görüntülenebilir, optik olarak erişilebilir. 3.3 bölümünde açıklandığı gibi, bu bölümde açıklanan montaj gibi Zebra balığı larvaları enfekte.- E2, erime noktası düşük,% 1 agaroz (LM) hazırlayın ve larva hasarı / öldürme bilmek 35-37 ° C'ye kadar soğumaya bırakın. 35 mm (stereomikroskobi için) Petri kabı veya (konfokal mikroskopi için) tam cam alt çanak LMA damla dağıtın.
- Transferi LMA için (mümkün olduğunca az su ile) ayrı ayrı Zebra balığı larvaları anestezi düşer. Bir fırça kullanarak ve agaroz katılaşması için bekleyin istenilen pozisyona Orient larva.
- E2 kurumasını hazırlık önlemek ve balık sudan oksijen alışverişi için izin 200 ug / ml tricaine içeren bütün çanak LMA yüzeyi ve bindirme örtün.
- Bir Epifloresans veya konfokal mikroskop ve tüm Zebra balığı larvaları görüntülenmesinde 10X veya 20X objektif kullanın. Konfokal mikroskop ve bakteriyel authopagosomes görselleştirmek için 40X, 63X veya 100X objektif kullanın in vivo (yani, GFP-LC3 + Shigella çevreleyen vakuoller ve).
- Gerçek zamanlı, (örneğin., Birkaç saat içinde her 2 dk), zamanla enfekte olmuş larva Z-yığını alın autophagosomes görselleştirmek için, ve dinamikleri.
Autophagy ve Sitoiskelet ise Vivo 4. Fonksiyonel Analiz
Not: enfeksiyonun seyrine Otofaji farmakolojik ve genetik pertübasyon etki tüm hayvan düzeyde izlenir ve tek hücre düzeyinde olabilir.
- Morfolino Enjeksiyon Otofaji Manipülasyon
- 10 dakika boyunca 65 ° C'de ısıtma ile 1 mM'lik bir stok çözeltisine, steril su içinde morfolino oligonükleotitler sulandırın. Mağazaoda sıcaklığında karıştırılmıştır.
NOT: morfolino oligonükleotid enjeksiyonları 1-4 hücre aşamasında embriyoların yapılmalıdır. - Dulbecco fosfat tamponlu tuzlu su içinde% 0.1 steril fenol kırmızısı morfolino oligonükleotid çalışma çözeltisi hazırlayın. Bölüm 3.4.3 tarif edildiği gibi, bölüm 3.4.2 açıklandığı gibi iğne yerleştirin., Morfolino oligonükleotid enjeksiyon hacmi kalibre edilebilir.
NOT: Fenol kırmızı enjekte hacmini görselleştirmek için yardımcı olacaktır. - Bir embriyo konumlandırma odasını hazırlayın (yani., Iğne bakan kenarları 10 cm Petri kabı kapağı üzerine siyanoakrilat ile yapıştırılmış bir mikroskop lamı kısmen kaldırıldı). Küçük bir su miktarı ile haznesine 1-4 hücreli aşamada embriyolar aktarılır ve ince bir fırça ile hizaya gelir.
- Koriyon ve sorunsuz sarısı nüfuz eder. İçerde, morfolino oligonükleotid çözeltisi istenen ses enjekte pedalına basın.
NOT: 0.5 enjeksiyon hacmini en aza indirin - 2 nl; hacmi, yüksek than 5 nl gelişimsel bozukluklara neden ve yumurta mortalite artabilir. - Mikroenjeksiyon sonra (bölüm 3.2 'de anlatıldığı gibi ağartma maddesi) ve 28 ° C' de E2 ile bir petri tabağına inkübe temiz embriyolar.
- 72 saat sonra döllenme kontrolü enfekte (yani, kontrol morfolinodur oligonükleotid ile enjekte Zebra balığı larvaları) veya P62 morphants (yani., P62 morfolinodur oligonükleotid ile enjekte Zebra balığı larvaları) bölümünde 3.4 anlatıldığı gibi Shigella ile. 3.5 bölümünde açıklandığı gibi önümüzdeki 2-5 gün boyunca hayatta kalma ve bakteriyel yükünü değerlendirmek. Bölüm 3.7 anlatılan ve Şekil 4C vurgulanan veya bölüm 3.8 açıklandığı gibi görüntü Zebra balığı larvaları canlı olarak görüntü Zebra balığı larvaları sabit.
NOT: Etkin morfolinodur oligonükleotid doz transkript yapıştırma veya protein çeviri (Tartışma) inhibe etme verimliliğine dayalı değerlendirilebilir.
- 10 dakika boyunca 65 ° C'de ısıtma ile 1 mM'lik bir stok çözeltisine, steril su içinde morfolino oligonükleotitler sulandırın. Mağazaoda sıcaklığında karıştırılmıştır.
Sonuçlar
In vitro, S., doku kültürü hücrelerinin enfeksiyonu üzerine flexneri fagozomun kaçmak ve sitosola istila edebilir. Sitozol içinde, konakçı hücreler septin kafeslere (Şekil 1A) içine bakteri bölümlere göre Shigella aktin tabanlı motilite önleyebilir. Septin kafesler tarafından tutulan bakterileri de Otofaji belirteçleri P62 (Şekil 1B) ve LC3 (Şekil 1C) ile etiketlenebilir. Bu gözlemler invaziv patojenlerin yayılmasını kısıtlayan konak savunmasının yeni bir mekanizma vurgulamak ve otofaji ile hücre iskeleti arasında yeni bağlantılar ortaya. Çarpıcı otofaji belirteçlerin tükenmesi belirgin bakteri (Şekil 2A) septin kafes azaltır, ve aynı zamanda çalışma septin caging tükenmesi önemli Otofaji belirteçlerin 8 alımını engellediğini göstermiştir. Bu nedenle, en azından Shigella durumda, kafes aksamını ve autophagosome oluşumunu bir septin bölgesindekin birbirine süreçler olarak görülebilir. Septin kafeslerle Shigella kompartımanlara diğer hücresel şartlar aktin polimerizasyonunu ve aktomizin aktivitesi (Şekil 2B) içerir.
Enfeksiyon, yeni bir hayvan modeli, Zebra balığı larvalarının 19 yararlanabilir hiçbir doğal fare şigelloz modeli, ve Shigella patogenezi, septin biyoloji ve in vivo bakteriyel otofaji soruşturma bulunmaktadır. Bu tür in vivo mikroskobu (Şekil 3A) kaudal intravenöz enjeksiyon deneyleri için hayatta kalma ve kuyruk kas enjeksiyonu gibi çeşitli anatomik bölgeler bakteri enjekte zebra balığı larvası enfekte mümkündür. Doz, S. bağlı olarak, flexneri ya 48 saat sonrası enfeksiyon içinde silinebilir Zebra balığı larvalarının enjekte ya da ilerici ve sonuçta ölümcül enfeksiyon (Şekil 3B - 3D) neden olabilir. Shigella virülans factors 28 ° C, zebra balığı optimum büyüme sıcaklığında ifade edilir ve Shigella ile zebra balığı enfeksiyonunda sahip tip III sekresyon sisteminde (T3SS) 19, insan hastalığında temel bir hastalık oluşturma mekanizmasını belirleyen sıkı sıkıya bağlıdır. Taken birlikte, bu gözlemler Zebrafish larva Shigella enfeksiyonu in vivo analizi için değerli bir yeni dizi temsil ettiğini göstermektedir.
Zebra balığı larva optik erişilebilirlik in vivo (Şekil 4A) olarak septin caging önce, memeli konakçı modeller kullanılarak gerçekleştirilebilir hiçbir zaman bir başarı görselleştirme sağlar. Septin kafesleri in vivo otofaji hedefleyen bakteri tuzağa kanıtlar tamamlamak için, bir GFP-LC3 sentezleyen transgenik Zebra balığı larvaları enfekte ve Shigella (Şekil 4B) otofaji işaretleyici işe gözlemleyebilirsiniz. In vivo, el Shigella autophagosomes arasında ultrastrucutral analizi içinECTRON mikroskopi açık bir şekilde çift katlı bir zar 19 ile vaküol bakterilerin sitosolik sekestrasyonunu göstermek için kullanılabilir. Otofaji hücre özerk bağışıklığın önemli bir bileşeni ve intracytosolic bakterilere 14-16 karşı önemli bir savunma mekanizması olarak görülüyor. In vivo Otofaji işlevini karakterize etmek için, P62-morfolino muamele zebra balığı larvası kullanılabilir. Çekirdek Otofaji makineler aksine [örn., 36 otofaji ilgili proteinleri (ATG) 26], S62 olduğu enfeksiyona normal olarak önce gelişebilir, omurgalı gelişimi ve dolayısıyla 27 zebra balığı larvalar için gerekli değildir. Çarpıcı, P62-tükenmiş larvalar S. ile aşılanmış önemli ölçüde artmış mortalite ve artan bakteri yükünün 19 flexneri sonuç. Bu septin kafes aksamını gösteren in vitro çalışma ile anlaşma autophagosome oluşumu 7,8 ile birbirine bağlı olduğunu, Shigella için septin işe açıkça (P62-tükenmiş larva azalır Şekil 4C). Bu veriler, zebra balığı sağkalım, hücre içi bakteri enfeksiyonu kontrol etmek için P62-aracılı Otofaji bağlı olduğunu göstermektedir.
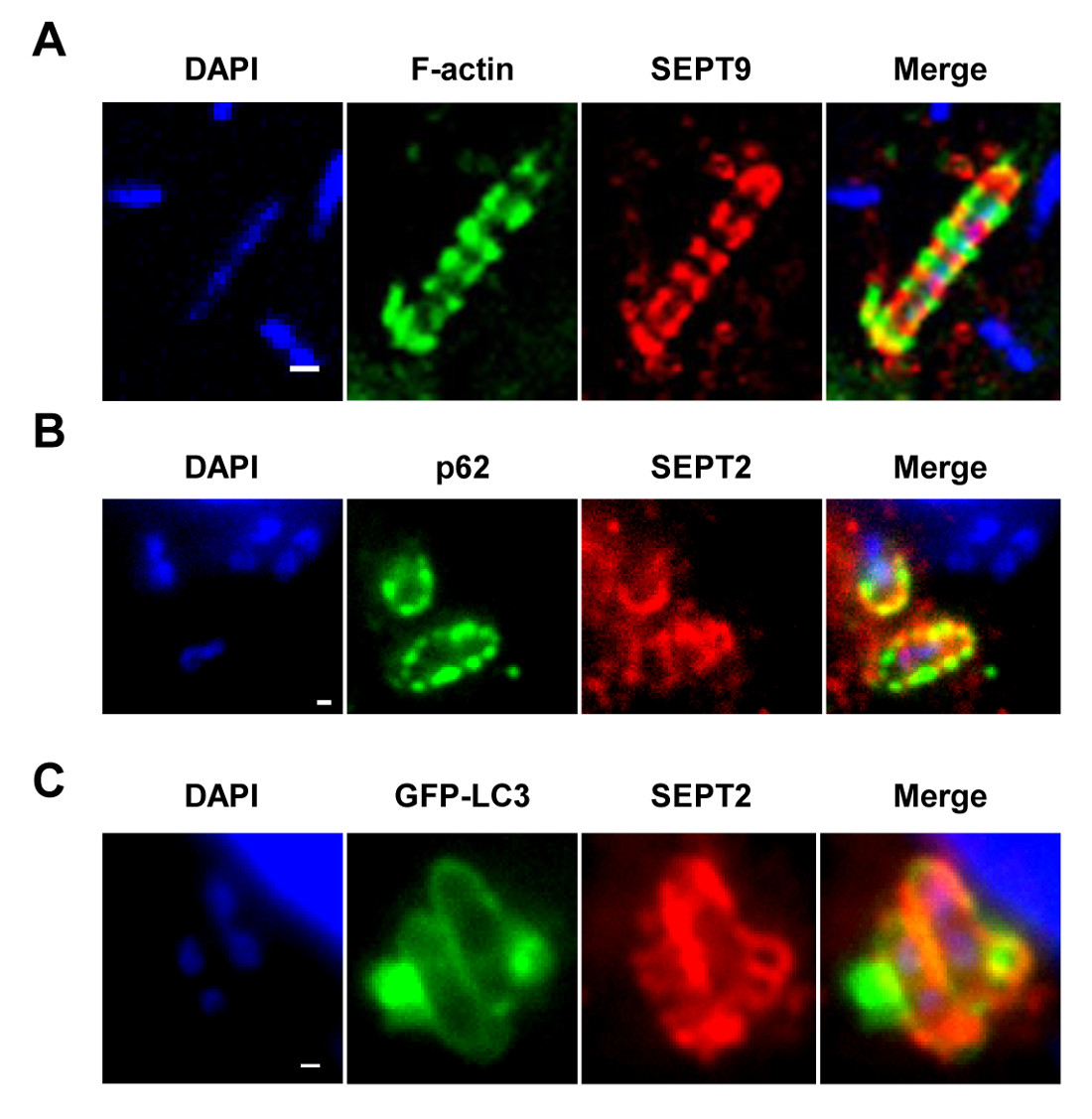
In vitro septin kafesin Şekil 1. (A). HeLa hücreleri S. ile enfekte edilmiştir flexneri 4 saat 40 dakika boyunca, sabit ve SEPT9 falloidinle antikorları ile etiketlenmiş ve konfokal küçük kopya ile görüntülendi. Ölçek bar, 1 mikron. (B) HeLa hücreleri S. ile enfekte edildi flexneri 4 saat 40 dakika boyunca, sabit, P62 ve SEPT2 antikorları ile etiketlenmiş ve flüoresan mikroskobu ile görüntülendi. Ölçek çubuğu, 1 mikron. (C) HeLa hücrelerinde GFP-ATG8 / LC3 transfekte S. ile enfekte edilmiştir 4 saat 40 dakika boyunca flexneri, sabit floresan ışığı mi tarafından SEPT2 antikorlar ile etiketlenmiş ve görüntülücroscopy. Ölçek bar, 1 mikron. Bu rakamlar Mostowy et al 7'den modifiye edilmiştir.
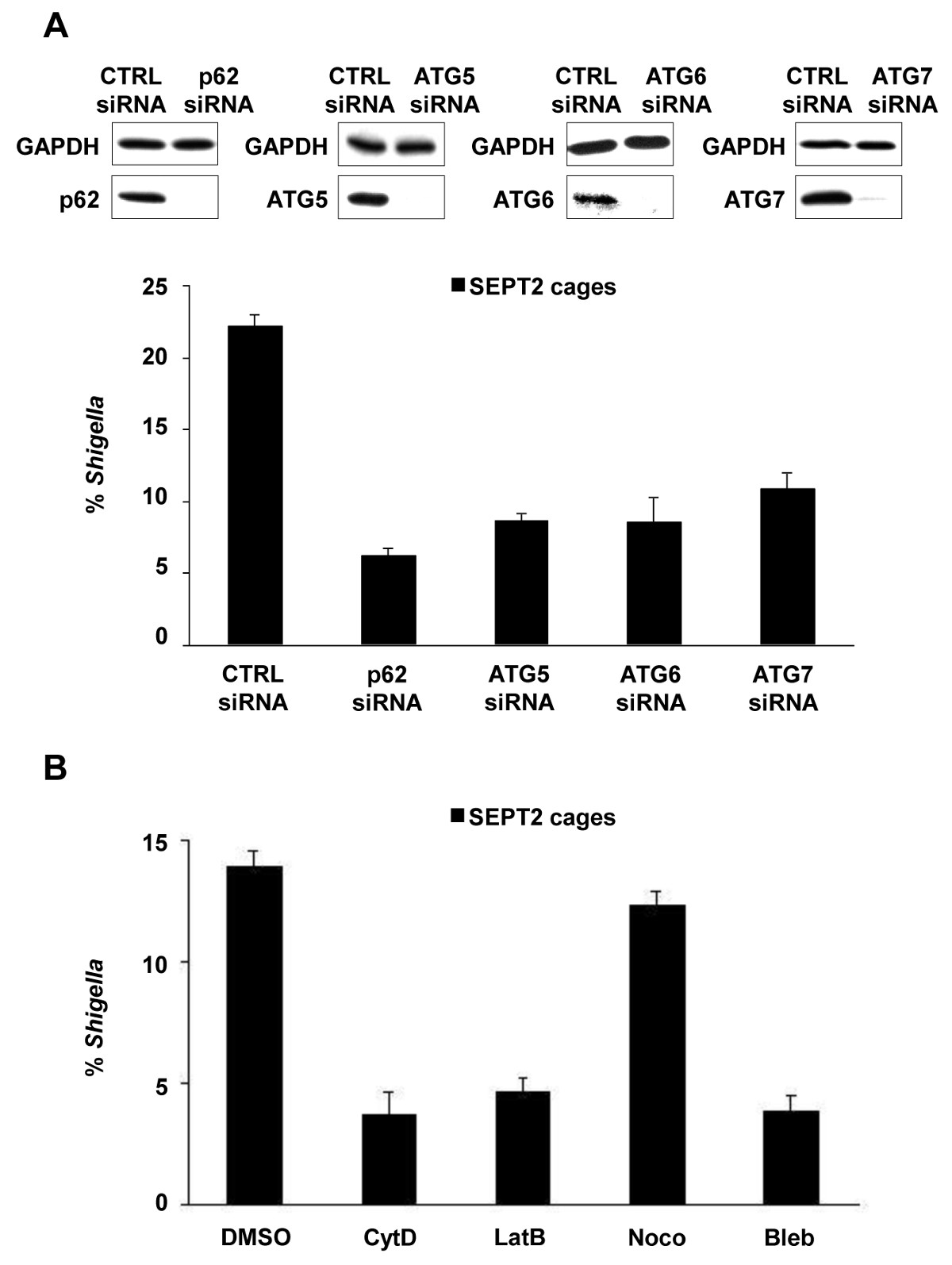
Shigella -septin kafes oluşumu için Şekil 2. Hücresel gereksinimleri. (A) HeLa hücreleri kontrolü ile tedavi edildi (CTRL), P62, ATG5, ATG6 veya ATG7 siRNA. SiRNA ile muamele edilmiş hücrelerin tüm hücre lizatları siRNA azalması (en üst) etkinliğini göstermek için GAPDH, P62, ATG5, ATG6 veya ATG7 için bağışık edilmiştir. siRNA ile muamele görmüş hücreler ile enfekte edilmiştir S. sabit ve kantitatif mikroskopi için etiketlenmiş, 4 saat 40 dakika flexneri. Grafikler (alt) muamele başına n, ≥3 deneylerden SEPT2 kafesleri içinde Shigella ± SEM ortalama% temsil etmektedir. (B), HeLa hücreleri S. ile enfekte edilmiştir fD (CytD) sitokalasin, DMSO ile muamele edilmiş lexneri, latrunculin B (LatB), nokodazol (Noco) veya Blebbistatin (kabarcık) ve 4 saat sonra 40 dakika sabitlendi ve nicel mikroskopi için işaretlenebilir. Grafikler tedavisi için iki bağımsız deneyden SEPT2 kafesleri içinde Shigella ± SEM ortalama% temsil etmektedir. Mostowy Bu rakamlar, et al 7'den modifiye edilmiştir.
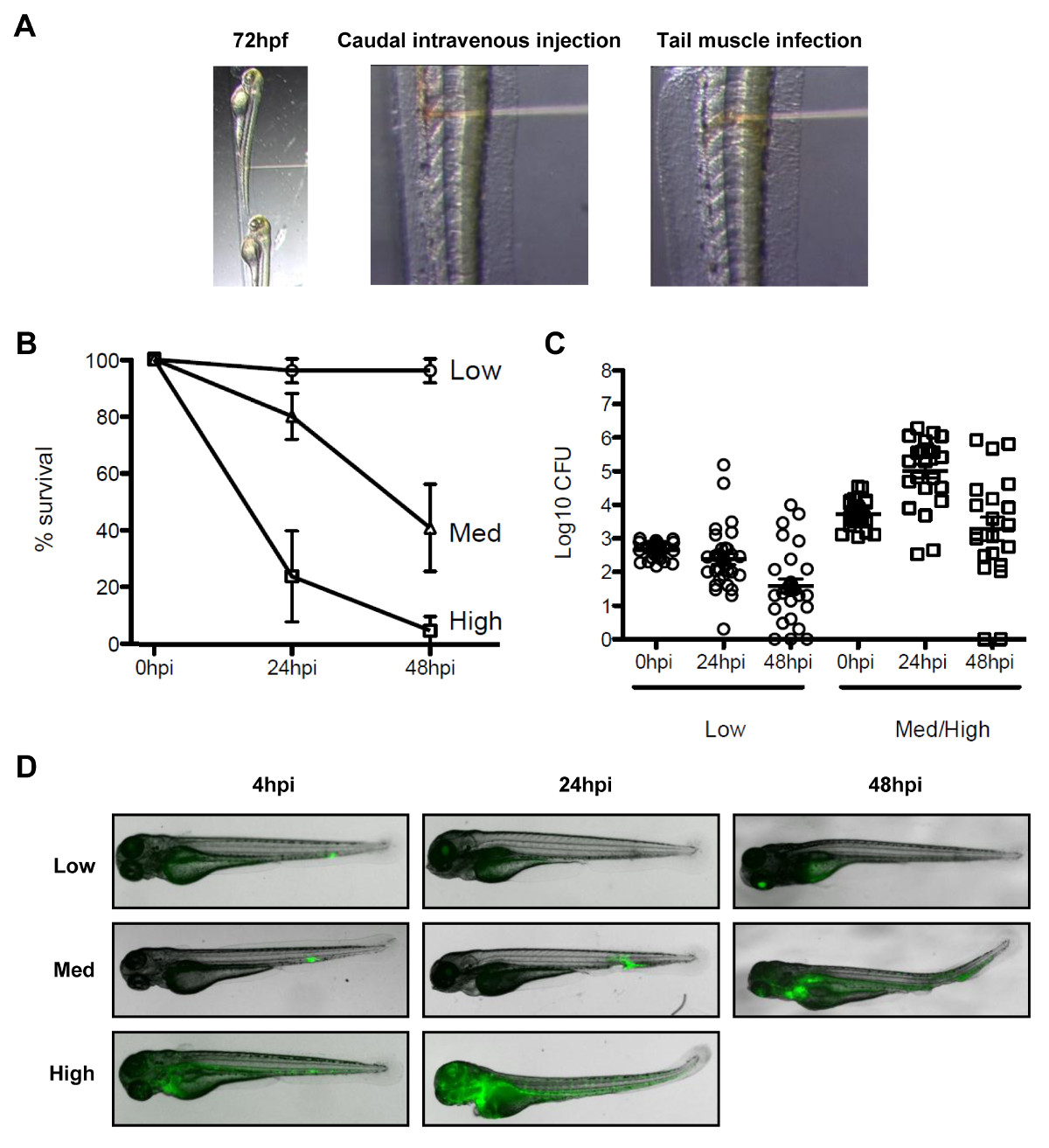
Şekil 3. Shigella enfeksiyonu Zebrafish modeli. (A) Görüntüler stereomicroscope altında Zebrafish larva yönünü göstermek için. (Sol panel) Zebra balığı larvalarının 72 saat sonra döllenme onların dorsal yüzü enjeksiyon iğnesi bakacak enjeksiyon plakasına yanal konumlandırılmış. (Orta panel) Kan dolaşımı enfeksiyonu enjeksiyon sureti ile gerçekleştirilmiştirkaudal damarından bakterileri (kırmızı çözelti) ecting, ürojenital açıklığına arka. Kuyruk kasında (sağ panel), bir hücre gruplarının Enfeksiyon fazla bakteri (kırmızı çözelti) enjekte edilmesiyle gerçekleştirildi. (B), 72 saat sonra döllenme larvalarının hayatta kalma eğrisi S. çeşitli dozlarda enjekte flexneri ve 48 saat sonrası enfeksiyon için 28 ° C'de inkübe edildi. Etkili inokulum düşük (<10 3 CFU, açık daireler), orta (~ 4 x 10 3 CFU, açık üçgenler) veya yüksek (~ 10 4 CFU, açık kareler) olarak sınıflandırıldı. Inokulum sınıf başına n ≥3 deneylerden SEM ±% (yatay çubuklar) idi. (C) Numaralandırma bireysel larva homogenatlarda canlı bakteri çeşitli zamanlarda LB üzerine kaplama ile ölçülen enfeksiyon sonrası at Not, sadece larva numaralandırma analize dahil edilmiştir enfeksiyonu atlattı sahip. Da gösterilmiştir ± SEM (yatay çubuklar) idi. (D) GFP- Shigella Dağılımı göre belirlenirÇeşitli kez düşük, orta veya yüksek doz inokulum (kaudal damardan enjeksiyonlar) kullanılarak enfeksiyon sonrası bir floresan stereomikroskopta kullanarak canlı görüntüleme. . Iletim görüntüsü (gri) ve GFP floresan (yeşil) (B) Kaplama - (D) Bu rakamlar Mostowy ve diğ 19 dan modifiye edilmiştir.
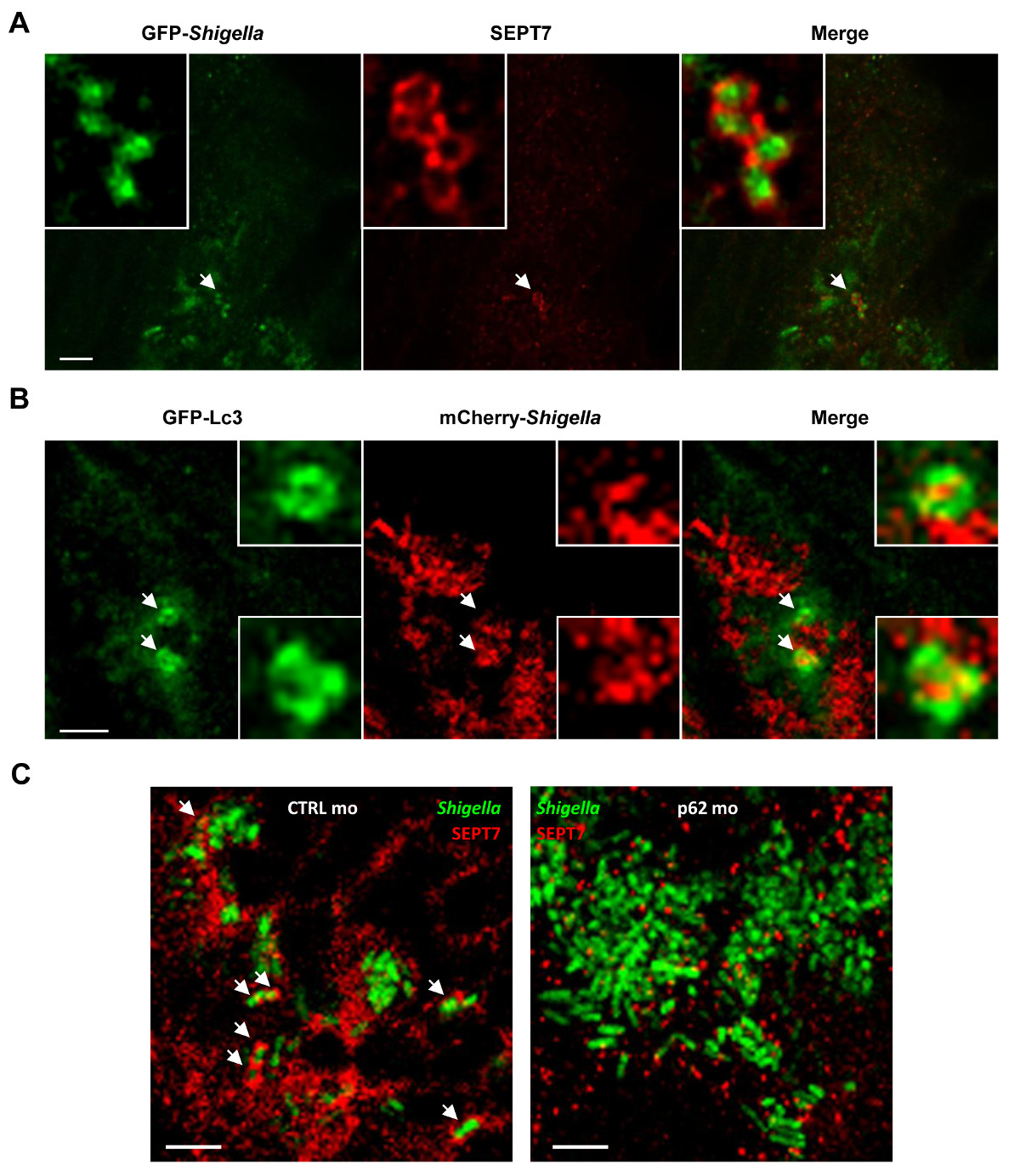
Şekil 4. in vivo Shigella enfeksiyonu hücre biyolojisi. (A) Zebra balığı larvalarının 24 saat, sabit, GFP SEPT7 (kırmızı) karşı ve antikorlar ile etiketlenmiş (yeşil için GFP- Shigella (düşük doz) ile kuyruk kas enfekte edildi ) ve konfokal mikroskobu ile görüntülenmiş. Ölçek bar, 5 mikron. (B) GFP-LC3 Zebra balığı larvaları mCherry- Shigella (orta doz) için enfekte edildi4 saat, sabit, mCherry (kırmızı) karşı ve GFP (yeşil) karşı antikorlar ile etiketlenir, ve aynı odaklı mikroskopi ile görüntülenmiştir. . Veya P62 (sağ görüntü) morpholinos SEPT7 karşı antikorların (ile etiketlenmiş, sabit, 4 saat boyunca GFP- Shigella (orta doz) ile enfekte edilmiştir, Ölçek çubuğu, 1.5 um (C) Zebrafish larvaları ya da kontrol (sol görüntü CTRL) ile işlemden geçirildi kırmızı) ve GFP (yeşil) için ve aynı odaklı mikroskopi ile görüntülenmiştir. Oklar septin kafeslere (CTRL) veya entrapped Shigella bazı örnekler vurgulamak 4 saat sonrası enfeksiyon (P62 tükenmiş). Ölçek bar, 5 mikron. Bu rakamlar Mostowy ve diğ 19 dan modifiye edilmiştir.
Tartışmalar
Doku kültürü hücrelerinin kullanılarak in vitro ve hücre iskeleti Otofaji gözlendiği zaman, Bölüm 1 ve 2'de tarif edilen protokoller doku kültür hücre tipleri çok çeşitli uygulanabilir. Ayrıca, Otofaji takip (örneğin, ATG8 / LC3 autophagosomes + ve) ve hücre iskeleti (örneğin,., Aktin kuyrukları, septin kafesler) canlı görüntüleme kullanılarak Shigella, enfeksiyon sırasında, gerçek zamanlı olarak dinamik, doku kültürü hücreleri geçici olarak GFP ile transfekte edilebilir, Önceden gibi RFP- veya CFP-etiketli yapıları 7,8 nitelendirdi. (. Yani, Shigella 100 de HeLa hücrelerinin% 5-30 istila edebilir düşünüyor gerçek zamanlı analiz için genellikle arzu: 1 İçişleri Bakanlığı) Shigella ile enfekte hücrelerin yüzdesini artırmak için (OD doğrudan Shigella 400 ul ekleyin, 600 = 0.3 -0.6) 2 ml hücreleri MEM (seruma acıktırıldı) ve yeterli bakteriyel girişi için en az 1.5 saatlik Enfeksiyon sonrası bekleyin fagosom, çoğaltma, Au kaçmaktophagy tanıma ve septin caging. Alternatif olarak, bir adezin AfaE ifade ve epitelyal hücrelerde çok daha yüksek istilası özellikler M90T suşu 28 karşılaştırdık Shigella M90T AfaI suşu kullanabilir. Notun, M90T AfaI türü henüz zebrafish kullanarak in vivo test edilmemiştir. Shigella koloniler plakalar 2-3 gün boyunca 4 ° C'de tutuldu ve çeşitli deneyleri için de kullanılabilir. Ancak, zamanla, ayrıca Kongo Kırmızı emer ve görünebilir virülans plazmid kaybetmiş Shigella koloniler virülens plazmid muhafaza etmek. Bu nedenle biz mümkün olduğunda taze bakteri stoklarını kullanmanızı öneririz.
In vivo enfeksiyon, hücre biyolojisi izlerken, protokoller bölüm 3 ve 4, yabani tip AB hattı zebrabalıkları tarif edilmiştir. Görsele DsRed GFP veya lyz: Shigella -leukocyte etkileşimlerin görüntülenmesi için, zebra balığı transgenik çizgiler, örneğin, MPX kullanılabilirnötrofiller 19,29,30 veya MPEG1 ize: mcherry makrofajlar 19,31 görselleştirmek için. Bölüm 3.8 'de tarif edildiği gibi in vivo Otofaji görselleştirmek için, GFP-LC3 zebra balığı transgen doğru, 19,24 kullanılabilir.
In vivo Otofaji bozmakta için, etkili bir doz, morfolino oligonükleotid transkript yapıştırma veya protein ötelenmesinin önlenmesi için verimine göre deneysel olarak değerlendirilmelidir. Bu titrasyon deneyi gerçekleştirmek için ve (uç uca ekleme morfolino oligonükleotid için) RT-PCR ile teyit tükenmesi ya da (morfolino oligonükleotid translasyon için) SDS-PAGE ile 32 tavsiye edilir. Zebra balığı embriyolarının ya da larva RNA izolasyonu guanidinyum tiyosiyanat-fenol-kloroform ekstraksiyonu kullanılarak gerçekleştirilebilir. Zebra balığı larvası (8-15 larva / tüp) proteininin, ayıklamak için, mekanik olarak,% 0.01 oktilfenol etilen oksit yoğunlaştırma 200 ul liziz tamponu (1 M Tris, 5 M NaCI, 0.5 M EDTA, bir havan tokmağı kullanılarak homojenizee ve proteaz inhibitörü). 15 dakika boyunca 4 ° C'de 19,000 x g'de santrifüj tüpleri ve yeni bir tüpe süpernatantı aktarın. 15 dakika boyunca 95 ° C'de numune Laemmli tamponu ilave edin ve ısıtın. Lizatlar, gerekli olana kadar -80 ° C'de muhafaza edilebilir ve Bölüm 2.3 'de tarif edildiği gibi Western blot analizi ile değerlendirilebilir.
Zebra balığı in vivo ilaç uygulaması için mükemmel bir model. Morfolino oligonükleotidler kullanılarak Analizi Otofaji (örneğin, rapamisini ve bafılomycin) işlemek için kurulan ilaçlar ile tamamlanabilir. Enfekte olmamış ve / veya enfekte olan larva rapamisin (1.5 uM) ya da bafilomycin (80 nM), E2 içinde seyreltilmiş ve 25,33 tarif edildiği gibi akış otofajik Western lekeleme yolu ile değerlendirilebilir ile muamele edilebilir. Bölüm 3.5 de tarif edildiği gibi enfekte larvaların enfeksiyon ve hayatta kalma sonucu üzerinde Otofaji manipülasyon sonucu değerlendirilebilir.
Konakçı hücre incelenmesine ek olarakin vitro ve in vivo protokollerde belirleyicileri örn. Shigella ΔicsA (Shigella, protein, N-ICSA WASP toplayan ve ARP2 / 3, diferansiyel Otofaji tarafından kabul edilen bakteri mutant türünü kullanarak otofaji tanınması için gerekli bakteriyel belirleyicilerini değerlendirmek için uygulanabilir , yokluğunda, yokluğunda hiçbir aktin kuyrukları, herhangi bir septin kafes) ve ShigellaΔicsB (Shigella ICso için Otofaji makine işe engelleyen bakteriyel efektör protein IcsB aracılığıyla otofajik yanıtı önler olabilir, aktin ve kuyruk septin oluşumu için kafes daha septin kafesleri, daha otofaji) 7,8 olabilir.
Shigella Zebrafish doğal bir patojen olmayan ve 37 ° C 'de en iyi şekilde büyür. Ancak, çalışma tta fagositik vakuol ve çoğaltma kaçmak, Shigella işgali için gerekli olduğunu virülans faktörleri göstermiştirtosol belirtilmiştir ve 28 ° C de 19 zebra balığı larvaları işlevsel olabilir. 28 ° C Normal zebra balığı gelişimini sağlamak için 23 zebra balığı ve sabit bir sıcaklıkta yetiştirilmesi için en yaygın olarak kullanılan sıcaklığıdır. Çarpıcı bir şekilde, insanlarda şigelloz yol önemli patojenik etkinlik (epitel hücreleri içinde, yani, makrofaj hücre ölümü, invazyon ve çarpma, hücreden hucreye yayılma konakçı epitel enflamatuar yok) sadık Shigella enfeksiyonun Zebrafish modelinde çoğaltılmaktadır 19.
Otofaji ve iskeleti genler yayg ifade ve biyolojik işlevleri geniş bir yelpazede vardır. Fareler üzerinde yapılan çalışmalarda 5 embriyonik öldürücü olan temel Otofaji 26 ya da septin genlerin nakavt göstermiştir, ve bu sorun, zebra balığı birden fazla olması gerçeği ile daha da azalabilir, ancak, bu genlerin bir kısmı da (zebra balığı gelişimi için gerekli olması da muhtemeldirparalog genler 33). Eğer öyleyse, morpholinos aşağı titre edilebilir, (ii) ve Otofaji iskeletinin düzenlenmesi için (i) farmakolojik reaktifler kullanılması da dahil olmak üzere, bu sorunu aşmak için birçok seçenek vardır, genlerin (iii) reseptörü sadece belirli bir hücre için tasarlanabilir tipleri ve / veya (iv) hayvan gelişimi için esas teşkil etmeyen otofajik tanıma ile ilgili genler (örneğin,., P62) hedeflenebilir.
Zebra balığı Otofaji ve Shigella enfeksiyonu sırasında iskeletinin araştırmak için ideal bir model sistem iken, moleküler araçlar şu anda eksiktir. Bu alan yeni araç ve söz konusu proteinlerin tahrik hücre özel ifade oluşturmak için gereklidir. Otofaji / iskeleti genlerin ifadesini yıkmak için, yeni morfolino dizileri gerekli değildir ve genom mühendisliği için yeni bir yöntem (örneğin, TALEN CRISPR / Cas9) de kullanılabilir. Bu arada, birçok araç önceki çalışmalar, insan ya da fare için oluşturulmuşeşit Zebra balığı için çalışabilir.
Hücre içi bakteriler, S. flexneri bağışıklık sistemi 1,2 ile tanınan bakterilerin yeteneği dahil olmak üzere biyoloji kilit sorunları ele almak için olağanüstü bir model organizma olarak ortaya çıkmıştır. Konakçı hücre S. motilitesini kısıtlamak için kullanır septins flexneri ve otofaji onları hedef hücre özerk dokunulmazlık 7,8 kritik bir bileşenidir. Bu gözlemler Otofaji ve sitozolik bakterileri indirgeme yeteneğini incelemek için yeni bir moleküler çerçeve önermek. Bir önemli konu tamamen altta yatan moleküler ve hücresel olayları deşifre etmek, ve ilgili hayvan modelleri kullanılarak in vivo bakteriyel enfeksiyon sırasında in vitro analiz bu olayları doğrulamak için şimdi. Bu amaçla, Zebra balığı S. analizi için değerli bir yeni bir ev sahibi olarak kurulmuştur flexneri enfeksiyonu 19. Bakteri ve konak hücreleri arasındaki etkileşim yüksek çözünürlükte görüntülü edilebilir veZebra balığı model, in vivo Shigella enfeksiyonu hücre biyolojisi anlamak için yararlı ispatlamak zorundadır. Zebra balığı larvalarının konak savunmasında bakteriyel otofaji rolünü araştırmak için kullanılabilir, ve iş otofaji pertürbasyon olumsuz Shigella enfeksiyonu 19 yanıt konak yaşamını etkileyebileceğini olduğunu göstermiştir.
Gözlemler konak savunmasını anlamakta temel gelişmeler sağlayabilir Zebra balığı larvaları kullanılarak doku kültürü hücreleri ve in vivo kullanılarak in vitro caging ve Otofaji septin, Shigella çalışma üretti. Onlar da bulaşıcı hastalıklarla mücadele edilmesini amaçlayan yeni stratejilerin geliştirilmesini hatırlatıyoruz.
Bu raporun kritik bir amacı in vitro analiz moleküler ve hücresel olayların mantıklı (yani, otofaji, aktin kuyrukları, caging septin) bir ent bağlamında in vivo bakteriyel enfeksiyon sırasındaZebra balığı larvaları kullanılarak ire organizma. Zebra balığı biyolojisi ve taşıma ile tanıdık, biri doğru Zebrafish hayvancılık 23 ve zebra balığı enfeksiyon 19,35 in vivo analizi derinlemesine protokoller başvurabilir.
Açıklamalar
Yazarlar hiçbir rakip mali çıkarlarının olmadığını beyan ederim.
Teşekkürler
SM laboratuarda çalışma, Wellcome Trust Araştırma Kariyer Geliştirme Bursu [WT097411MA] tarafından desteklenmektedir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| Bafilomycin A1 | Sigma-Aldrich | B1793 | |
| Blebbistatin | Sigma-Aldrich | B0560 | |
| Borosilicate glass microcapillars | Harvard Apparatus | 30038 | |
| Coarse manual manipulator | Narishige | M-152 | |
| Cytochalasin D | Sigma-Aldrich | C6762 | |
| 4',6-diamidino-2-phenylindole (DAPI) | Molecular Probes | D1306 | |
| Dumont #5 fine tweezers | Fine Science Tools | 11254-20 | |
| Forchlorfeneuron | Sigma-Aldrich | 32974 | |
| Goat anti-mouse IgG (H+L) antibody | Molecular Probes | N/A | |
| Goat ant-rabbit IgG (H+L) antibody | Molecular Probes | N/A | |
| JetPEI transfection reagent | Polyplus transfection | 101-01N | |
| Latrunculin B | Sigma-Aldrich | L5288 | |
| LC3 antibody | Novus Biologicals | NB100-2220 | |
| Low melting agarose | Promega | V2111 | |
| MatTek glass bottom dish | MatTek corporation | P35G-1.0-14 | |
| MEM plus L-alanyl-L-glutamine | GIBCO | 41090028 | |
| MEM non-essential amino acids solution | GIBCO | 11140-035 | |
| Microinjector | Narishige | IM-300 | |
| Micropipette puller device | Sutter Instrument Co., Novato, | P-87 | |
| Mineral oil | Sigma-Aldrich | P35G-1.0-14 | |
| Monoclonal anti-tubulin, acetylated antibody | Sigma-Aldrich | T6793 | |
| Nocodazole | Sigma-Aldrich | M1404 | |
| N-phenylthiourea | Sigma-Aldrich | P7629 | |
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| Phalloidin | Molecular Probes | A12379 | |
| Phenol red solution | Sigma-Aldrich | P0290 | |
| Protease inhibitor cocktail | Roche | 4693116001 | |
| p62/SQSTM1 antibody | Cliniscience | PM045 | |
| Rapamycin | Sigma-Aldrich | R8781 | |
| Sodium pyruvate | GIBCO | 11360039 | |
| Transfection reagent | Life Technologies | 12252-011 | |
| Vectashield hard set mounting medium containing DAPI | Vector Laboratories | H-1500 |
Referanslar
- Ashida, H., et al. Shigella are versatile mucosal pathogens that circumvent the host innate immune system. Curr Opin Immunol. 23, 448-455 (2011).
- Phalipon, A., Sansonetti, P. J. Shigella's ways of manipulating the host intestinal innate and adaptive immune system: a tool box for survival. Immunol Cell Biol. 85, 119-129 (2007).
- Welch, M. D., Way, M. Arp2/3-mediated actin-based motility: A tail of pathogen abuse. Cell Host Microbe. 14, 242-255 (2013).
- Haglund, C. M., Welch, M. D. Pathogens and polymers: microbe-host interactions illuminate the cytoskeleton. J Cell Biol. 195, 7-17 (2011).
- Mostowy, S., Cossart, P. Septins: the fourth component of the cytoskeleton. Nat Rev Mol Cell Biol. 13, 183-194 (2012).
- Saarikangas, J., Barral, Y. The emerging functions of septins in metazoans. EMBO Rep. 12, 1118-1126 (2011).
- Mostowy, S., et al. Entrapment of intracytosolic bacteria by septin cage-like structures. Cell Host Microbe. 8, 433-444 (2010).
- Mostowy, S., et al. p62 and NDP52 proteins target intracytosolic Shigella and Listeria to different autophagy pathways. J Biol Chem. 286, 26987-26995 (2011).
- Mostowy, S., et al. Septins regulate bacterial entry into host cells. PLoS One. 4 (15), (2009).
- Mostowy, S., et al. Septin 11 restricts InlB-mediated invasion by Listeria. J Biol Chem. 284, 11613-11621 (2009).
- Phan, Q. T., et al. Role of endothelial cell Septin 7 in the endocytosis of Candida albicans. mBio. 4 (e00542-13), (2013).
- Mostowy, S., Cossart, P. Septins as key regulators of actin based processes in bacterial infection. Biol Chem. 392, 831-835 (2011).
- Levine, B., Mizushima, N., Virgin, H. W. Autophagy in immunity and inflammation. Nature. 469, 323-335 (2011).
- Randow, F., MacMicking, J. D., James, L. C. Cellular self-defense: how cell-autonomous immunity protects against pathogens. Science. 340, 701-706 (2013).
- Mostowy, S. Autophagy and bacterial clearance: a not so clear picture. Cell Microbiol. 2 (12063), (2012).
- Mostowy, S., Cossart, P. Bacterial autophagy: restriction or promotion of bacterial replication. Trends Cell Biol. 22, 283-291 (2012).
- Kanther, M., Rawls, J. F. Host-microbe interactions in the developing zebrafish. Curr Opin Immunol. 22, 10-19 (2010).
- Renshaw, S. A., Trede, N. S. A model 450 million years in the making: zebrafish and vertebrate immunity. Dis Model Mech. 5, 38-47 (2012).
- Mostowy, S., et al. The zebrafish as a new model for the in vivo study of Shigella flexneri interaction with phagocytes and bacterial autophagy. Plos Path. 9, e1003588 (2013).
- Fischer, A. H., Jacobson, K. A., Rose, J., Zeller, R. Fixation and permeabilization of cells and tissues. Cold Spring Harb Protoc. , (2008).
- Klionsky, D. J., et al. Guidelines for the use and interpretation of assays for monitoring autophagy. Autophagy. 8, 445-544 (2012).
- Mizushima, N., Yoshimori, T., Levine, B. Methods in mammalian autophagy research. Cell. 140, 313-326 (2010).
- Westerfield, M. A guide for the laboratory use of zebrafish (Danio rerio). The Zebrafish Book. , (2000).
- Benard, E. L., et al. Infection of zebrafish embryos with intracellular bacterial pathogens. J Vis Exp. 61 (e3781), (2012).
- He, C., Bartholomew, C. R., Zhou, W., Klionsky, D. J. Assaying autophagic activity in transgenic GFP-Lc3 and GFP-Gabarap zebrafish embryos. Autophagy. 5 (4), 520-526 (2009).
- Mizushima, N., Komatsu, M. Autophagy: renovation of cells and tissues. Cell. 147, 728-741 (2011).
- Komatsu, M., et al. Homeostatic levels of p62 control cytoplasmic inclusion body formation in autophagy-deficient mice. Cell. 131, 1149-1163 (2007).
- Nowicki, B., Coyne, K. E., Lublin, D. M., Nowicki, S., Hart, A. Short consensus repeat-3 domain of recombinant decay-accelerating factor is recognized by Escherichia coli recombinant Dr adhesin in a model of a cell-cell interaction. J Exp Med. 178, 2115-2121 (1993).
- Hall, C., Flores, M., Storm, T., Crosier, K., Crosier, P. The zebrafish lysozyme C promoter drives myeloid-specific expression in transgenic fish. BMC Developmental Biology. 7 (42), (2007).
- Renshaw, S. A., et al. A transgenic zebrafish model of neutrophilic inflammation. Blood. 108, 3976-3978 (2006).
- Ellett, F., Pase, L., Hayman, J. W., Andrianopoulos, A., Lieschke, G. J. mpeg1 promoter transgenes direct macrophage-lineage expression in zebrafish. Blood. 117, 2010-2010 (2011).
- Bill, B. R., Petzold, A. M., Clark, K. J., Schimmenti, L. A., Ekker, S. C. A primer for morpholino use in zebrafish. Zebrafish. 6 (9), (2009).
- He, C., Klionsky, D. J. Analyzing autophagy in zebrafish. Autophagy. 6, 642-644 (2010).
- Howe, K., et al. The zebrafish reference genome sequence and its relationship to the human genome. Nature. 25 (496 (7446)), 498-503 (2013).
- Levraud, J. P., Colucci-Guyon, E., Redd, M. J., Lutfalla, G., Herbomel, P. In vivo analysis of zebrafish innate immunity. Methods Mol Biol. 415, 337-363 (2008).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır