Method Article
Robótico líquido manipulação montagem de dispositivos modulares DNA automática
Neste Artigo
Resumo
Aqui, um fluxo de trabalho automatizado para realizar a montagem de "dispositivo" modular do DNA usando um método de montagem clonagem de DNA modular em robôs de manipulação de líquido é apresentado. O protocolo usa uma ferramenta de software intuitivo para gerar picklists líquido manipulador para combinatória DNA dispositivo biblioteca geração, que demonstramos usando duas plataformas de manipulação de líquidos.
Resumo
Avanços recentes em técnicas de montagem modulares DNA permitiram biólogos sintéticos testar significativamente mais do que o disponível "espaço de design", representado por "dispositivos" criados como combinações de componentes genéticos individuais. No entanto, montagem manual de tão grande número de dispositivos é demorada, sujeito a erros e dispendiosa. A crescente sofisticação e escala de investigação de biologia sintética necessita de uma forma eficiente e reprodutível para acomodar a construção do dispositivo em grande escala, complexa e alta taxa de transferência.
Aqui, um protocolo de montagem de DNA utilizando a técnica de clonagem Modular (MoClo) endonuclease de restrição com base tipo-IIS é automatizado em duas plataformas de robóticas de manipulação de líquido. Robôs automatizados de manipulação de líquido requerem cuidado, muitas vezes tediosa otimização dos parâmetros de pipetagem de líquidos de viscosidades diferentes (por exemplo, enzimas, DNA, água, amortecedores), bem como programação explícita para garantir a correta aspiração e dispensação de partes do DNA e de reagentes. Isto faz manual script escrever para assemblies complexos tão problemáticos como montagem manual do DNA e necessita de uma ferramenta de software que pode automatizar a geração de script. Para este fim, nós desenvolvemos uma ferramenta de software baseado na web, http://mocloassembly.com, para gerar bibliotecas de dispositivo de DNA combinatórias de partes básicas do DNA carregadas como arquivos do Genbank. Nós fornecemos acesso à ferramenta, e um arquivo de exportação de nosso software líquido manipulador que inclui otimizado classes líquidas, labware parâmetros e layout do convés. Todas as peças de DNA utilizadas estão disponíveis através de Addgene, e seus mapas digitais podem ser acessados através do registro de gelo de BDC de Universidade de Boston. Juntos, esses elementos fornecem uma base para outras organizações automatizar a experimentos de clonagem modulares e protocolos semelhantes.
O DNA montagem fluxo de trabalho automatizado aqui apresentado permite a produção de alta produtividade, automatizada e repetível de dispositivos de DNA e reduz o risco de erro humano decorrentes de pipetagem manual repetitiva. Dados de sequenciamento mostram a montagem automatizada de DNA reações geradas a partir deste fluxo de trabalho são ~ 95% correta e exigir como pouco quanto 4% como hands-on muito tempo, em comparação com a preparação do manual de reação.
Introdução
Os primeiros dispositivos genéticos biológicos sintéticos como o Collins interruptor1 e o Elowitz repressilator2 demonstraram que sistemas biológicos poderiam ser projetados para a frente para têm funções específicas, deterministas. Desde então, os biólogos sintéticos tenham me esforçado para engenheiro de sistemas vivos para realizar progressivamente mais complexa funcionalidade no serviço de biomateriais3, biotherapeutics4,5,6, de biocombustíveis 7,8e biosensing aplicações9,10,11. Alcançar estas aplicações através da combinação de DNA modular "peças" em "dispositivos" com funcionalidade específica tem sido um dos principais objetivos da biologia sintética. Para este processo de escala, deve haver uma técnica que permite a criação de dispositivos complexos de grandes bibliotecas de peças em um tempo-eficiente, custo-eficiente e mais importante, forma reprodutível.
Como um processo de montagem expansiva justifica-se porque atualmente o campo carece de um entendimento completo das regras orientadores sistema biológico bem sucedido design e composição. Isso é agravado por insuficientemente caracterizadas DNA partes12, falta de compatibilidade e capacidade de combinação de partes13e inesperadas, indesejáveis interações entre componentes genéticos dentro dispositivos sintéticos14, 15. na ausência de modelagem preditiva confiável, dispositivos genéticos sintéticos funcionais são chegou por tentativa e erro, que exige dezenas ou mesmo centenas de variantes de um dispositivo pretendido são selecionadas de intensidade do sinal de entrada-saída e o "melhor" é selecionado para a composição com elementos a jusante16. Enquanto moderno padronizados métodos de montagem de DNA como Golden Gate17e clonagem Modular18,19,20 facilitar esse processo, um perito experimental ainda é necessário para executar cada protocolo. Como dispositivos sintéticos crescem em tamanho e complexidade, o espaço total disponível projeto vai se tornar muito grande construir e testar manualmente,21e o processo será também artesanais para qualquer progresso significativo que é replicável para ser feita no campo.
Até o advento da biologia sintética e repositórios de parte biológica como o Medren peças registro (http://partsregistry.org), as inventário de elementos compostos de JBEI22e SynBioHub23, genéticas partes não foram armazenadas em qualquer formato de montagem padronizada. Apenas um pequeno punhado de peças necessárias para ser clonado por projeto e assim, o volume de clonagem feito era pequeno e a realização de um dispositivo montado era viável e trivial em comparação com os objectivos de investigação propriamente dita. Clonagem molecular foi muitas vezes ad hoc e executada usando sumários de restrição com base na disponibilidade de local e endonuclease de restrição, e não na sequência de qualquer processo padronizado. A falta de padronização tornou impraticável para automatizar qualquer protocolo de clonagem, como era pouco provável que a próxima reação de clonagem iria seguir um protocolo idêntico. Além disso, automatizar a montagem do DNA necessário investimento monetário significativo no equipamento (manuseio de líquidos robôs e sua infra-estrutura de software e equipamento laboratorial associada) bem como o investimento de tempo para a geração de instruções para desenvolver precisos parâmetros para lidar com as várias classes de líquidos sendo processadas e a série precisa de instruções para executar estes protocolos. Pequena escala clonagem esforços não justificar essas despesas. A combinação de projetos maiores, mais complexos dispositivo genético juntamente com montagem padronizada protocolos24,25 cria um ambiente onde a automatização destes processos é muito prática. Robótica de baixo custo como o Opentrons OT-One26 também estão emergindo que permite mesmo modestamente financiados labs para aceder a esta tecnologia. Além disso, a "nuvem" laboratórios27 , incluindo Transcriptic e laboratório de nuvem Esmeralda, bem como académico "biofoundries", tais como a fundição de genoma de Edimburgo, o iBioFab UIUC, e a fundição do MIT-Broad, arnês robótica para montar diversos conjuntos de desenhos para uma variedade de clientes rapidamente e repetidamente enquanto manter um repositório comum de primitivos básicos do DNA e tecnologias de montagem para futuras encomendas.
Um dos maiores desafios em automatizar o processo de montagem do DNA é a geração dos comandos de pipetagem para o manipulador de líquido. Enquanto as interfaces de software para esses dispositivos são geralmente fáceis de usar, complexo pipetagem instruções como aqueles necessários para a montagem de DNA combinatória exigem o cientista explicitamente especificar cada aspirar e dispensar o comando manualmente. Isso cria um grande gargalo no fluxo de trabalho e deixa o processo de geração de script vulnerável aos erros de pipetagem mesmo como se o assembly foram realizado manualmente. Isto exige uma ferramenta de software que pode automatizar todas as partes deste processo, desde a concepção da biblioteca de dispositivo, para gerar as instruções de pipetagem e fornecendo o pesquisador com as configurações de placa/reagente necessárias para montá-las. Neste trabalho, alavancamos nossa ferramenta de software para automatizar o projeto de uma pequena biblioteca combinatorial de dispositivo de DNA, bem como a mistura dos reagentes (buffer, água, enzimas) e partes de DNA (Figura 1b) em 96 reações de montagem DNA modulares um pote. Uso da ferramenta não requer nenhuma experiência prévia de programação, é escalável e de alta produtividade e combinatória por padrão. Mostramos que clonagem reações preparado em duas plataformas diferentes manipulação automatizada de líquido clones de verificada a sequência correta de rendimento com frequência equivalente a reações preparado manualmente (95%) e com significativamente menos tempo hands-on.
Protocolo
1. especificar as peças para ser usado na biblioteca de dispositivo de DNA e gerar usuário/líquido manipulador de instruções [15 min]
- Usando qualquer navegador web, navegue até mocloassembly.com e carregar arquivos de Genbank para todas as partes do DNA que serão incluídas no projeto de dispositivo combinatório do DNA.
- Uma vez que todos os arquivos foram enviados, selecionar partes de DNA desejadas e arraste-os para a tela em branco, colocando parte tipos na ordem final pretendido de partes do DNA.
Nota: Coleções de peças, bem como peças individuais, podem ser selecionadas e colocadas na tela. Além disso, encomendar peças de DNA tal que o 5' e 3' overhangs para cada correspondência de parte. - Clique em 'Montar' no canto inferior direito da página.
Nota: A ferramenta só irá gerar assemblies válidos, compilável baseados as saliências de quatro pares de base que ladeiam cada parte após digestão com a enzima BsaI. Se não edificável dispositivos de DNA existem com base nas partes carregadas pelo cientista, a ferramenta irá indicar que nenhum assemblies foram encontrados. -
Navegue até a guia 'Planos' e baixar arquivos gerados pela ferramenta. Esses arquivos irão incluir:
- Mapas de placa legível para o cientista preparar amostras de DNA, bem como os reagentes necessários para as reações
- Uma 'lista de seleção' para o manipulador de líquidos
- Totalmente anotada Genbank arquivos para todos os dispositivos de DNA ser montada
Nota: Manuseio braço posicionamento ao acessar qualquer novo equipamento laboratorial de líquidos devem ser testado. Consulte o manual do fabricante para obter instruções detalhadas sobre como ajustar o braço pipetagem posicionamento nos X, Y e Z eixos conforme necessário.
2. prepare o Plasmídeo e reagentes para montagem [3 dias]
- [Dia 1] Com uma ansa de inoculação estéril e trabalhar perto de chamas ou de um capuz de fluxo laminar, raia fora estoques de glicerol bacteriana em placas LB-ágar suplementadas com o antibiótico adequado. Faça isso para todas as peças necessárias de DNA, certificando-se de esterilizar o laço entre cada amostra. Incube as placas a 37 ° C durante a noite.
Nota: Congelado bacteriana glicerol estoques devem ser mantidos em gelo, tanto quanto possíveis. Ciclos repetidos de congelamento-descongelamento diminuir a viabilidade das ações e devem ser evitados. - [Dia 2] Usando um loop de inoculação, palito ou ponta da pipeta estéril e trabalhar perto de chamas ou de um capuz de fluxo laminar, inocular 3 mL de caldo LB (suplementado com antibiótico apropriado) com uma única colônia das placas LB-ágar preparado no ponto 2.1. Incube as culturas durante a noite a 37 ° C e agitando a 300 RPM.
- [Dia 3] Purifica o Plasmídeo das culturas bacterianas usando qualquer kit de purificação de plasmídeo prep mini comercialmente disponível.
- Usando o arquivo de MoClo_Setup.xlsx fornecido, dilua cada amostra do ADN do plasmídeo para uma concentração de 20 fmol / µ l em água ou TE buffer.
- Seguir o mapa de placa do arquivo PDF gerado pela ferramenta de montagem, coloca o volume indicado de cada parte de DNA diluído dentro do poço apropriado em um prato PCR de 96 poços completo-contornou. Segure esta SetupPlate no gelo até ser necessário, ou selar com um selo adesivo de alumínio e armazenar a-20 ° C.
-
No gelo, preparar a reação mastermix com os seguintes componentes: para cada 20 µ l de reação adicionar 2 µ l de 10 x T4 DNA ligase buffer, 0,5 µ l de T4 DNA Ligase (HC) e 1 µ l da enzima BsaI. Uma folha de calculadora está incluída no arquivo MoClo_Setup.xlsx para ajudar com isso.
- Distribua o mastermix enzima nos poços adequados de uma nova cheia-contornou 96 PCR placa, seguindo o mapa de placa para o ReagentPlate no PDF gerado. Manter esta ReagentPlate no gelo ou em um frio-bloco de 96 poços.
Nota: O ReagentPlate só deve ser preparado quando estiver pronto para executar o assembly no manipulador de líquido.
- Distribua o mastermix enzima nos poços adequados de uma nova cheia-contornou 96 PCR placa, seguindo o mapa de placa para o ReagentPlate no PDF gerado. Manter esta ReagentPlate no gelo ou em um frio-bloco de 96 poços.
3. execute o Script de Assembly no manipulador de líquido [variável]
- Coloque o SetupPlate(s), o ReagentPlate(s) (em um frio-bloco de 96 poços) e o número necessário de pratos PCR 96 poços vazios cheio-contornou no convés do manipulador de líquido. As placas vazias será o OutputPlate(s) onde as reações são montadas.
- Preparar o líquido manipulador controlar software criando instâncias de cada placa amostra e reagente preparado, certificando-se de nomeá-los exatamente como aparecem nos mapas placa gerados por mocloassembly.com, incluindo um cavado de limpo, água desionizada rotulada ' Reservatório '.
- Usando o comando de 'lista de trabalho' do software de controle, carrega o arquivo .gwl gerado pela nossa ferramenta de software, seguida de outro comando 'lista ' de trabalho que irá executar o arquivo .gwl carregado no primeiro comando.
- Execute o script usando 'do software de controlador Executar' comando.
Nota: Sempre deixe o manipulador robótico líquido concluir a execução de um script antes de tentar acessar o espaço de convés. - Remova todas as placas do baralho manipulador de líquido. Restantes de DNA podem ser salvos por selar o SetupPlate(s) com filme de selagem de alumínio e armazenar a-20 ° C. Selar o OutputPlate(s) com película adesiva, coloque em um thermocycler ou calor-bloco e correr com os seguintes parâmetros do ciclo:
37 ° C por 2 h, 50 ° C por 5 min, 80 ° C por 10 min, segure a 4 ° C
Nota: Uma vez concluída a reação thermocycling, OutputPlate(s) pode ser armazenado a-20 ° C até que estejam prontos para ser transformado.
4. transformar as reações [1 dia]
-
Descongelar o número exigido de competentes de Escherichia coli célula alíquotas necessárias (10 µ l/reação) no gelo.
Nota: Para manter a esterilidade, as seguintes etapas devem ser executadas perto de uma chama aberta, ou dentro de um capuz de fluxo laminar.- Enquanto as células são descongelar, prepare placas LB-ágar (contendo antibiótico apropriado) por pipetagem 50 µ l de 0,1 M de IPTG e 50 µ l de 20 mg/mL X-galão para a superfície. Faça uma mistura de mestre se chapeamento um grande número de reações. Revestir as placas uniformemente com uma vareta de vidro estéril ou contas de vidro e deixe descansar a 37 ° C durante pelo menos 15 minutos antes do chapeamento bactérias as chapas.
Nota: Como alternativa, adicione IPTG e X-galão para ágar líquido antes de placas forem derramadas, 2 mM IPTG e concentração final da X-galão 40 µ g/mL. Guarde estas placas fora da luz directa como X-galão é sensível à luz.
- Enquanto as células são descongelar, prepare placas LB-ágar (contendo antibiótico apropriado) por pipetagem 50 µ l de 0,1 M de IPTG e 50 µ l de 20 mg/mL X-galão para a superfície. Faça uma mistura de mestre se chapeamento um grande número de reações. Revestir as placas uniformemente com uma vareta de vidro estéril ou contas de vidro e deixe descansar a 37 ° C durante pelo menos 15 minutos antes do chapeamento bactérias as chapas.
- No gelo, alíquota 10 µ l de células competentes para cada reação em uma nova placa PCR de 96 poços. Esta será a chapa de transformação.
- Adicionar 1-3 µ l de cada reação do OutputPlate(s) para o correspondente bem na transformação placa e incubar no gelo por 5 min.
- Selar a placa de transformação com adesivo choque filme e calor em um thermocycler a 42 ° C por 30 s. Então, imediatamente coloque a placa no gelo por 2 min.
- Aos poços da placa de transformação mesmos, adicione 150 µ l de mídia SOC, selar com um selo adesivo alumínio e incubar a 37 ° C e agitando a 900 RPM por 1 hora.
- O conteúdo completo de cada poço da placa de transformação nas placas LB-ágar preparadas em 4.1.1 usando uma vareta de vidro estéril ou grânulos de vidro uniformemente revestir a superfície da placa da placa. Incube as placas a 37 ° C durante a noite.
5. clone verificação [2 dias]
-
Prepare um ou vários blocos de 96-bem profunda cultura com 1,5 mL de caldo LB (contendo antibiótico apropriado).
- Semelhante ao passo 2.2, inocular o bloco (s) poço profundo cultura com colônias brancas única de cada placa LB-ágar de reações transformadas.
- Selo do bloco (s) cultura com um selo de gás-permeável e incubar durante uma noite a 37 ° C e agitando a 900 RPM.
Nota: O técnica de clonagem modular utiliza seleção azul e branco, então CFUs positivos aparecerá brancos na placa de ágar-LB, enquanto vetores de destino vazio aparecerá azuis.
- Isolar o Plasmídeo de culturas bacterianas (como em 2.3) e enviar para Sanger sequenciamento para verificar clones.
Resultados
Aqui Demonstramos a montagem modular automatizada de 96 dispositivos de DNA de várias partes de DNA básicos (Figura 1b) usando duas plataformas de manipulação líquidos robótico automatizado. Cada unidade transcricional é um arranjo linear de promotor, local obrigatório ribosomal, gene e terminador transcricional, clonado em um vetor de destino específico. O TUs são um componente chave em muitas circuito genético hierárquico desenhos28,29,30 e são, portanto, uma prova natural do conceito para esta abordagem. Sequência-verificado clones podem ser conseguidas no ~ 5 dias do início ao fim, e uma visão geral do fluxo de trabalho apresentado é apresentada na Figura 1a.
Usando a ferramenta descrita e protocolo, capturamos várias métricas úteis para determinar a plataforma de montagem ideal, dada um número definido de clonagem reações a serem gerados pelo cientista. Figura 2a ilustra uma comparação entre tempos de montagem de reação através de todas as três modalidades. Tempo de execução é o tempo total para completar todas as etapas de pipetagem precisava montar 96 reações, que inclui a distribuição de todas as partes do DNA e reagentes. Hands-on tempo refere-se o tempo total que um ser humano foi manualmente envolvido na preparação das reações clonagem ou instalação do software executando o manipulador de líquido. Figura 2b compara o custo entre os diferentes métodos. Os custos apresentados são para uma única reação preparada por cada método e incluir o preço das enzimas e pontas de pipetas descartáveis, dadas o volume menor reação típica (20 µ l para manipulador de líquido, 10 µ l para 250 manual, nL para dispensador de acústica). Único clones de todos os 96 reações para conjuntos de manipulador-preparados líquidos e manuais foram sequenciados, com um subconjunto de 12 sequenciados para as reações de acústica do distribuidor (Figura 2C). As sequências corretas foram obtidas por 95% dos 96 conjuntos manipulador manual e líquido. 83% do subconjunto dispensador acústica amostra estavam corretas, porém as finais duas reações não ceder qualquer colônias brancas, provavelmente devido à insuficiente mistura de gotículas após a distribuição de DNA e de reagentes estava completa. Figura 2d ilustra clonagem eficiências de reação, conforme medido pelo quociente de colônias brancas ao número total de colônias, que são comparáveis entre manualmente (94%) e líquido manipulador-montado (84%) reações. Curiosamente, quando escala abaixo o volume final de reação com o distribuidor de acústico, notamos uma queda marcada na eficiência da reação quando reações foram preparadas em volumes menores que 1 µ l (Supplemental Figura 1 & suplementar tabela 2). Isto é provavelmente devido a evaporação durante thermocycling de reação, que pode causar um aumento na concentração de sal na reação.
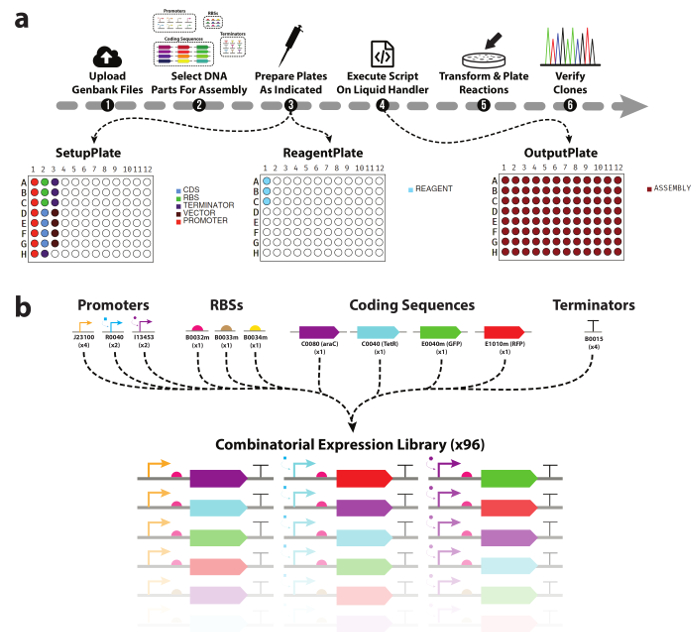
Figura 1. DNA dispositivo biblioteca montagem fluxo de trabalho automatizado.
(a) uma visão geral do fluxo de trabalho experimental apresentado neste trabalho. (1) pesquisadores primeiro carregar arquivos Genbank para todas as peças de DNA & vetores de destino que desejam usar. (2) em seguida, partes de DNA para ser incluído no assembly são selecionadas. (3) a ferramenta então irá gerar uma lista de seleção para um manipulador de líquido automático, bem como mapas de placa auxiliar com população manual com peças de DNA e enzima mastermix. (4) usando o DNA & placas de reagentes, bem como a lista de seleção gerada, pesquisadores executar a montagem das reações clonagem no manipulador de líquido. (5) uma vez completo, as reações são transformadas e chapeadas para análise a jusante. (b) lista de DNA as peças usadas neste trabalho. Um total de três promotores, três ribosomal vinculação sites, quatro codificação sequências, e um terminador transcricional foram usados geram a biblioteca combinatorial de 96 TUs. Clique aqui para ver uma versão maior desta figura.
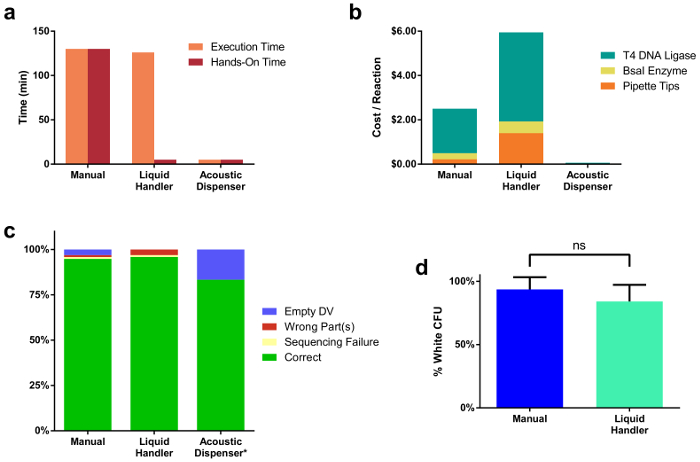
Figura 2. Comparações entre três modalidades de montagem de reação diferente.
(a) tempo de configuração de reação para 96 reações montados manualmente, através de um manipulador de líquidos e por um distribuidor de acústico. Montagem manual levou 2 h 10 min, tudo o que era tempo de hands-on. O manipulador de líquido tomou uma quantidade similar de tempo (2 h 6 min) para executar os comandos de pipetagem, no entanto apenas uma fração desse tempo (5 min) foi hands-on. O dispensador de acústico foi significativamente menos tempo para executar transferências líquidas (5 min) e teve o tempo mínimo de hands-on (5 min). (b) preço por reação de clonagem único para cada método de montagem. Este preço inclui o custo das enzimas usadas, bem como pontas de pipetas. (c) resultados de colônias único de todos os 96 de sequenciamento montado TUs. A porcentagem de clones corretos foi comparável entre todos os métodos de montagem. Note que somente um subconjunto (12) os total de 96 conjuntos foram transformados de distribuidor acústico preparou amostras. Duas reações não conseguiram produzir qualquer colônias brancas, provavelmente devido à insuficiente mistura de DNA & enzima mastermix gotas no OutputPlate. (d) comparação da eficiência da reação entre reações de manipulador-preparado líquidas e manuais de clonagem. Clique aqui para ver uma versão maior desta figura.
Suplementar, Figura 1. Eficiência de reação diminui com a redução do volume de reação.
Eficiências de reação cair acentuadamente quando escala para baixo volumes de reação abaixo de 1 µ l. Esta tendência é vista com duas diferentes concentrações de DNA finais; no entanto, os cientistas podem optar por usar volumes menores para economizar em custos de reagente se eficiência inferior pode ser tolerada. Clique aqui para baixar este arquivo.
Suplementar tabela 1.
Tabela de parâmetros de líquido classe DNA e enzimas para vários volumes de pipetagem. Clique aqui para baixar este arquivo.
Suplementar tabela 2.
Cálculos de eficiência da reação. Números brutos do UFC são dadas para 12 das 96 reações transformadas preparadas manualmente e através do manipulador de líquido. Números do UFC também são fornecidos para teste de menores volumes de reação final sobre o dispensador de acústico. Clique aqui para baixar este arquivo.
Discussão
Em conclusão, a automação do DNA dispositivo criação processo completo, desde a concepção no silico para manipulação de líquidos, é uma meta viável com atualmente existente tecnologia. Software e robótica moderna permitem a criação de fluxos de trabalho que são custo-eficiente, tempo-eficiente e escalável, enquanto também produzir mais resultados consistentemente reprodutíveis do que métodos manuais. Enquanto a automação não pode sempre ser a escolha mais econômica para a execução de um protocolo, ele faz melhorar a reprodutibilidade experimental e libera o tempo valioso do pesquisador. No entanto, dependendo do hardware utilizado, o uso de automação pode às vezes dirigir custo e tempo de execução bem abaixo do que pode ser conseguido através de métodos manuais convencionais. Além disso, automação capta protocolos explicitamente em uma maneira formalizada impedindo ad hoc, artesanal, e anedóticas melhores práticas com base em experimentação. Aqui a montagem automatizada de dispositivos modulares de DNA é demonstrada, e o protocolo, arquivos eletrônicos e recursos físicos de DNA necessários para o leitor a realizar estas e semelhantes, experiências por conta própria são fornecidas. Esperamos que a disponibilidade de nossa ferramenta, e a publicação do presente protocolo servirá como um recurso e mover o campo em direção a um futuro mais transparente e comunitário na área de processos de montagem de DNA e líquido manipulação robótica.
A utilidade de hardware de automação é largamente dependente da configuração & recursos de que hardware. Por exemplo, nosso manipulador de líquido usa deslocamento de fluidos sistema para accionar aspirado e distribuir comandos. Os pistões que o fluido do sistema de movimentação são relativamente grande 1 mL seringas que, embora útil para uma gama de volumes, impõe um limite inferior de 2 µ l para dosear com precisão dos reagentes. Como consequência, nós dimensionado o volume total da clonagem reações configurar no manipulador de líquido a 20 µ l, uma vez que cada comando preciso ser ≥2 µ l de dispensar. Isso efetivamente duplicou o custo por reação, para reações de manipulador-preparado líquidas, no entanto, a quantidade de tempo hands-on para a execução dessas reações foi significativamente reduzida. Em um esforço para resolver esse problema, repetimos a configuração de reação para todas as 96 reações em um distribuidor de líquido acústico. Este dispositivo usa a energia do som para dispensar fluido diretamente de uma placa para outra e pode conseguir dispensar volumes muito abaixo (2.5 nL) que é possível com o deslocamento de ar padrão baseado pipetas manuais. Usando este dispositivo, fomos capazes de reduzir o volume total de nossas reações a 250 nL, 40-fold redução em comparação com reações manualmente preparadas de 10 µ l. Devido os pequenos volumes dispensados e a falta de mudanças de ponta entre as etapas de pipetagem, o dispensador de acústico foi capaz de gerar as mesmas 96 reações em uma fração do tempo (< 5 min). Os menores volumes de reação também economizar em reagentes desperdiçados, já que normalmente apenas transformamos 1-3 µ l da reação. Sendo assim, o uso de hardware de automação, em conjunto com o software intuitivo, pode fazer a geração de um grande número de reações de montagem de DNA acessível para um público muito mais vasto acadêmico.
Aqui, vamos demonstrar a utilidade da nossa ferramenta de software, no entanto, existem uma série de características que ajudaria a ampliar sua utilidade. Em primeiro lugar, cada vez que a ferramenta é usada para gerar um assembly de combinatório, novas placas de parte do DNA devem ser geradas, exigir que o cientista preencher manualmente estas placas para cada assembly executar. Seria útil, em vez disso, se o cientista pode especificar a localização de peças em um prato de ADN para ser utilizado na montagem. Isso permitiria o uso do elevado-throughput do plasmídeo kits de purificação de DNA desde pesquisadores poderiam inocular culturas de um kit como o biblioteca de MoClo CIDAR e purificar todas as amostras juntas, mantendo o local bem de cada parte especificada no kit. Em segundo lugar, a ferramenta atualmente suporta apenas o uso de placas de 96 poços. Para projetos maiores, onde vários centenas dispositivos de DNA precisam ser construído, o número de DNA, reagente e placas de destino pode exceder a capacidade da plataforma do manipulador de líquido. Este problema poderia ser, pelo menos parcialmente, atenuado pelo suporte para formatos de placa de densidade mais elevados (384 ou bem-1536). Por último, a ferramenta atualmente suporta apenas um único tipo de manipulador de líquidos e a estratégia de montagem de DNA. Enquanto é relativamente fácil converter as instruções da ferramenta-produzido líquido manipulador em um formato acústico dispensador usando software de planilha, esperamos expandir o suporte nativo para muitos manipuladores de líquidos diferentes que seriam grandemente ampliar sua aplicabilidade, como compatibilidade com outras técnicas de montagem de DNA comuns gostaria de montagem Gibson31.
Uma parte crucial deste ecossistema de montagem automatizada é um conjunto de ferramentas de software que traduz-se planos de montagem de alto nível em protocolos de amigável de automação que são explicitamente programados para executar em robôs de manuseio de líquidos. Embora existem várias ferramentas de software que permitem aos pesquisadores projetar conjuntos em silico incluindo Benchling, MoClo planejador e Raven32, poucos têm a capacidade de traduzir esses desenhos em instruções executáveis para executar em um líquido manipulador de. Para que fim, trabalhar como PR-PR automação e marionetista33,34,35 começaram a disponibilizar essas ferramentas. Além disso, entidades comerciais, trabalhando nesta área estão procurando maneiras de introduzir "laboratórios de nuvem", que fornecem serviços experimentais para grandes grupos de utilizadores finais através de automação. O protocolo descrito neste documento pode servir como um pedaço de qualquer um destes esforços fornecidos que são apresentados como um serviço.
Enquanto a montagem automatizada de dispositivos de DNA é de valor imediato e óbvio, a biologia sintética, nosso protocolo é útil para a comunidade de biólogos moleculares também. Automatizar a montagem do DNA permite que um grande número de conhecidos, mas dispositivos similares, genéticos para ser criado em paralelo e pode permitam a rápida síntese de bibliotecas de expressão para a seleção e para fins de teste em estudos de desenvolvimento de drogas. Esperamos que nossa ferramenta de software vai fazer maior baseado em combinatória DNA montagem os esforços mais acessível e servir como um recurso útil para tanto a biologia sintética, bem como maior comunidade acadêmica.
Divulgações
Densmore é o Presidente e co-fundador da treliça Automation, Inc. Timmons e McCarthy são empregados do Lattice. Retículo faz software e serviços para a automação de muitos do processo descrito.
Agradecimentos
Agradecemos Swapnil Bhatia, Alejandro Pelaez e Johnson Lam para trabalhar no projeto do titereiro, bem como Swati Carr, Rachael Smith e Thomas Costa para ajuda com este manuscrito. Este trabalho foi financiado pela NSF carreira prêmio #1253856. Também é financiado pelo NSF expedições em computação prêmio #1522074.
Materiais
| Name | Company | Catalog Number | Comments |
| Hardware / Software | |||
| Freedom EVO 150 Liquid Handling Robot | Tecan | Custom liquid handler fitted with an 8-channel pipetting arm http://lifesciences.tecan.com/products/liquid_handling_and_robotics/freedom_evo | |
| Freedom EVOware Standard (Version 2.4 Service Pack 2) | Tecan | Software used to control the Freedom EVO 150 liquid handler http://lifesciences.tecan.com/products/software/freedom_evoware | |
| Echo 550 | Labcyte | Acoustic Liquid Dispenser http://www.labcyte.com/products/liquidhandling/echo-550-liquid-handler | |
| Sorvall Legend RT | Sorvall | Large benchtop swing-bucket sentrifuge | |
| MasterCycler Pro | Eppendorf | 950040015 | Thermocycler with 96-well heat block https://online-shop.eppendorf.us/US-en/PCR-44553/Cyclers-44554/Mastercycler-pro-PF-5193.html |
| ECHOTHERM Chilling/Heating Dry Bath | Torrey Pines Scientific | Heating/Chilling block for EVO 150 deck https://www.torreypinesscientific.com/products/chilling-and-heating-dry-baths/echotherm-ric20-series-remote-controlled-chillingheating-dr | |
| Tabletop Microcentrifuge 5418 | Eppendorf | 5418000017 | Stardard 18-well microcentrifuge https://online-shop.eppendorf.com/OC-en/Centrifugation-44533/Centrifuges-44534/Centrifuges-5418--5418R-PF-9257.html |
| Name | Company | Catalog Number | Comments |
| Resources | |||
| mocloassembly.com | Lattice Automation | Web-tool for combinatorial DNA assembly mocloassembly.com | |
| CIDAR MoClo Parts Kit | AddGene | 1000000059 | Kit of bacterial glycerol stocks for all DNA parts used in this study https://www.addgene.org/cloning/moclo/densmore/ |
| CIDAR ICE Registry | CIDAR Lab | Registry of plasmid DNA maps https://ice.cidarlab.org/folders/8 https://synbiohub.programmingbiology.org/public/bubdc_ice/bubdc_ice_folder_8/current | |
| Name | Company | Catalog Number | Comments |
| Labware | |||
| 50 μL Conductive Tips | Tecan | 30 057 818 | Sterile 50 μL conductive tips for Tecan liquid handler http://lifesciences.tecan.com/products/consumables/disposable_tips/liquid_handling_disposable_tips |
| 2 mL Deep 96-well Culture Plates | USA Scinetific | 5678-0285 | Bacterial culture plates used for culturing of large numbers of samples http://www.thermoscientific.com/en/product/nunc-1-3-2-0ml-deepwell-plates-shared-wall-technology.html |
| 1.5 mL Microcentrifuge Tubes | USA Scinetific | 1615-5599 | Disposable microcentrifuge tubes http://www.usascientific.com/Seal-Rite-1.5-ml-tube-colors.aspx |
| Breathe Easier sealing membrane | Sigma-Aldrich | Z763624-100EA | Breathable sealing membrane for bacterial culture plates http://www.sigmaaldrich.com/catalog/product/sigma/z763624?lang=en®ion=US |
| Full-Skirted, Low-Profile, 96-Well PCR Plates | GeneMate | T-3183-2 | PCR plates used for all steps https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-3183-R |
| Alluminum Sealing Foil for PCR Plates | GeneMate | T-2451-1 | Alluminum seals for PCR plate storage https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2451-1 |
| Polyolefin Sealing Film for PCR Plates | GeneMate | T-2450-1 | Plastic seals for PCR plates during cycling https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2450-1 |
| PCR Cooler | Eppendorf | 22510525 | 96-well cold block https://online-shop.eppendorf.us/US-en/Temperature-Control-and-Mixing-44518/Accessories-44520/PCR-Cooler-PF-55940.html |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| GenCatch Plasmid DNA Mini-Prep Kit | Epoch Life Sciences | 2160250 | Plasmid DNA purification kit http://www.epochlifescience.com/Product/PurificationKit/dna_mini.aspx |
| T4 DNA Ligase (HC) | Promega | M1794 | High concentration T4 DNA Ligase https://www.promega.com/products/cloning-and-dna-markers/molecular-biology-enzymes-and-reagents/t4-dna-ligase/?catNum=M1794 |
| BbsI Restriction Enzyme | New England Biolabs | R0539L | BbsI enzyme at 10,000 units/ml https://www.neb.com/products/r0539-bbsi |
| BsaI Restriction Enzyme | New England Biolabs | R0535L | BsaI enzyme at 10,000 units/ml https://www.neb.com/products/r3535-bsai-hf |
| T4 DNA Ligase Buffer Pack | Promega | C1263 | 10x T4 DNA ligase buffer https://www.promega.com/products/cloning-and-dna-markers/cloning-tools-and-competent-cells/t4-dna-ligase/ |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Zymo Research | I1001-25 | 0.5M IPTG Solution http://www.zymoresearch.com/buffers-solutions/chemicals/isopropyl-ss-d-thiogalactopyranoside-iptg |
| 5-bromo-4-chloro-3-indolyl ß-D-galactopyranoside (X-GAL) | Zymo Research | X1001-25 | 20 mg/ml X-GAL solution http://www.zymoresearch.com/buffers-solutions/chemicals/5-bromo-4-chloro-3-indolyl-ss-d-galactopyranoside-x-gal |
| Kanamycin Sulfate | Zymo Research | A1003-25 | 35 mg/ml Kanamycin solution http://www.zymoresearch.com/buffers-solutions/antibiotics/kanamycin-sulfate |
| Carbenicillin (Disodium Salt) | Fisher | BP26481 | 1 g Carbenicillin (Ampicillin analog) https://www.fishersci.com/shop/products/carbenicillin-disodium-salt-fisher-bioreagents-3/p-25005#?keyword=carbenicillin |
| SOC Broth Media | Teknova | S0225 | Powder media used to make SOC broth http://www.teknova.com/SOC-BROTH-MEDIA-p/s0225.htm |
| LB Broth (Lennox) Media | Sigma-Aldrich | L3022-1KG | Powder media used to make LB broth http://www.sigmaaldrich.com/catalog/product/sigma/l3022?lang=en®ion=US |
| LB Broth with agar (Lennox) Media | Sigma-Aldrich | L2897-1KG | LB with agar mix used for making solid media plates http://www.sigmaaldrich.com/catalog/product/sigma/l2897?lang=en®ion=US |
| Alpha-Select Gold Efficiency Competent Cells | Bioline | BIO-85027 | High efficiency chemically competent E. coli cells http://www.bioline.com/us/alpha-select-gold-efficiency.html |
| Name | Company | Catalog Number | Comments |
| Primers | |||
| Primer VF | 5'-TGCCACCTGACGTCTAAGAA-3' Primers used for Sanger sequencing and colony PCRs | ||
| Primer VR | 5'-ATTACCGCCTTTGAGTGAGC-3' Primers used for Sanger sequencing and colony PCRs |
Referências
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403 (6767), 339-342 (2000).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403 (6767), 335-338 (2000).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol. 23 (1), 47-55 (2005).
- Anderson, J. C., Clarke, E. J., Arkin, A. P., Voigt, C. A. Environmentally controlled invasion of cancer cells by engineered bacteria. J Mol Biol. 355 (4), 619-627 (2006).
- Xie, Z., Wroblewska, L., Prochazka, L., Weiss, R., Benenson, Y. Multi-input RNAi-based logic circuit for identification of specific cancer cells. Science. 333 (6047), 1307-1311 (2011).
- Ro, D. K., et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature. 440 (7086), 940-943 (2006).
- Georgianna, D. R., Mayfield, S. P. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature. 488 (7411), 329-335 (2012).
- Savage, D. F., Way, J., Silver, P. A. Defossiling fuel: how synthetic biology can transform biofuel production. ACS Chem Biol. 3 (1), 13-16 (2008).
- Fussenegger, M., et al. Streptogramin-based gene regulation systems for mammalian cells. Nat Biotechnol. 18 (11), 1203-1208 (2000).
- Boorsma, M., et al. A temperature-regulated replicon-based DNA expression system. Nat Biotechnol. 18 (4), 429-432 (2000).
- Malphettes, L., et al. A novel mammalian expression system derived from components coordinating nicotine degradation in arthrobacter nicotinovorans pAO1. Nucleic Acids Res. 33 (12), e107 (2005).
- Brophy, J. A., Voigt, C. A. Principles of genetic circuit design. Nat Methods. 11 (5), 508-520 (2014).
- Lou, C., Stanton, B., Chen, Y. J., Munsky, B., Voigt, C. A. Ribozyme-based insulator parts buffer synthetic circuits from genetic context. Nat Biotechnol. , (2012).
- Cardinale, S., Arkin, A. P. Contextualizing context for synthetic biology--identifying causes of failure of synthetic biological systems. Biotechnol J. 7 (7), 856-866 (2012).
- Carr, S. B., Beal, J., Densmore, D. M. Reducing DNA context dependence in bacterial promoters. PLoS One. 12 (4), e0176013 (2017).
- Yeung, E., Ng, A., Kim, J., Sun, Z. Z., Murray, R. M. . Decision and Control (CDC), 2014 IEEE 53rd Annual Conference on. , 5405-5412 (2014).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: a one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS One. 4 (5), e5553 (2009).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A modular cloning system for standardized assembly of multigene constructs. PLoS One. 6 (2), e16765 (2011).
- Iverson, S. V., Haddock, T. L., Beal, J., Densmore, D. M. CIDAR MoClo: Improved MoClo Assembly Standard and New E. coli Part Library Enable Rapid Combinatorial Design for Synthetic and Traditional Biology. ACS Synth Biol. 5 (1), 99-103 (2016).
- Casini, A., Storch, M., Baldwin, G. S., Ellis, T. Bricks and blueprints: methods and standards for DNA assembly. Nat Rev Mol Cell Biol. 16 (9), 568-576 (2015).
- Bhatia, S. P., Smanski, M., Voigt, C. A., Densmore, D. M. Genetic design via combinatorial constraint specification. ACS Synth Biol. , (2017).
- Ham, T. S., et al. Design, implementation and practice of JBEI-ICE: an open source biological part registry platform and tools. Nucleic Acids Res. 40 (18), e141 (2012).
- Madsen, C., et al. The SBOL Stack: A Platform for Storing, Publishing, and Sharing Synthetic Biology Designs. ACS Synth Biol. 5 (6), 487-497 (2016).
- Knight, T. . Draft standard for BioBrick biological parts. , (2007).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Ma, A. C., et al. FusX: A Rapid One-Step Transcription Activator-Like Effector Assembly System for Genome Science. Hum Gene Ther. 27 (6), 451-463 (2016).
- Check Hayden, E. The automated lab. Nature. 516 (7529), 131-132 (2014).
- Nielsen, A. A., et al. Genetic circuit design automation. Science. 352 (6281), aac7341 (2016).
- Woodruff, L. B. A., et al. Registry in a tube: multiplexed pools of retrievable parts for genetic design space exploration. Nucleic Acids Res. 45 (3), 1553-1565 (2017).
- Hasty, J., McMillen, D., Collins, J. J. Engineered gene circuits. Nature. 420 (6912), 224-230 (2002).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods Enzymol. 498, 349-361 (2011).
- Appleton, E., Tao, J., Haddock, T., Densmore, D. Interactive assembly algorithms for molecular cloning. Nat Methods. 11 (6), 657-662 (2014).
- Vasilev, V., Liu, C., Haddock, T., Bhatia, S., Adler, A., Yaman, F., Beal, J., Babb, J., Weiss, R., Densmore, D. A Software Stack for Specification and Robotic Execution of Protocols for Synthetic Biological Engineering. SynBERC Fall Retreat, Harvard University. , (2011).
- Beal, J., et al. An end-to-end workflow for engineering of biological networks from high-level specifications. ACS Synth Biol. 1 (8), 317-331 (2012).
- Bhatia, S., Densmore, D. Pigeon: a design visualizer for synthetic biology. ACS Synth Biol. 2 (6), 348-350 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados