Method Article
Automatizzato robot Liquid Handling Assembly di dispositivi modulari del DNA
In questo articolo
Riepilogo
Qui, un flusso di lavoro automatizzato per eseguire il montaggio modulare di "dispositivo" di DNA usando un metodo di assemblaggio modulare clonazione di DNA su robot di maneggio del liquido è presentato. Il protocollo utilizza uno strumento intuitivo software per la generazione di elenchi a discesa gestore liquido per combinatoria generazione della libreria dispositivo DNA, che dimostriamo utilizzando due piattaforme di gestione dei liquidi.
Abstract
Recenti progressi nelle tecniche di assemblaggio modulare del DNA hanno permesso i biologi di sintesi testare significativamente più del disponibile "spazio design" rappresentato da "dispositivi" creati come combinazioni di singoli componenti genetiche. Tuttavia, assemblaggio manuale di un numero così grande di dispositivi è tempo-intenso, soggetta a errori e costoso. La crescente sofisticazione e scala di ricerca di biologia sintetica necessita di ospitare la costruzione di dispositivi su larga scala, complessi e ad alta velocità di trasmissione in modo efficiente, riproducibile.
Qui, un protocollo di montaggio del DNA usando la tecnica di clonazione modulare (MoClo) tipo-IIS endonucleasi di restrizione basata è automatizzato su due piattaforme robotiche di liquido-manipolazione. Robot di liquido-movimentazione automatizzati richiedono attenzione, spesso volte noioso ottimizzazione dei parametri di pipettaggio per liquidi di viscosità diverse (es. acqua di enzimi, DNA, buffer), così come di programmazione esplicita per garantire la corretta aspirazione e dispensazione di parti di DNA e reagenti. Questo rende script manuale scrivendo per assiemi complessi solo come problematici come assemblaggio manuale di DNA e necessita di uno strumento software che è possibile automatizzare la generazione di script. A tal fine, abbiamo sviluppato uno strumento di software web-based, http://mocloassembly.com, per la generazione di librerie combinatoriali di dispositivo DNA da parti di DNA base caricati come file Genbank. Noi forniamo l'accesso allo strumento e un file di esportazione dal nostro software gestore liquido che include ottimizzato classi liquide, parametri di laboratorio e layout di coperta. Tutte le parti di DNA utilizzate sono disponibili tramite Addgene e loro mappe digitali sono accessibili tramite il registro che si occupa di BDC di ghiaccio a Università di Boston. Insieme, questi elementi forniscono un fondamento per altre organizzazioni automatizzare gli esperimenti di clonazione modulari e protocolli simili.
Il workflow automatizzato di DNA Assemblea qui presentato consente la produzione ripetibile, automatica, ad alta velocità di dispositivi del DNA e riduce il rischio di errori umani derivanti da pipettaggio manuale ripetitivo. Dati di sequenziamento Visualizza l'assemblaggio automatizzato del DNA sono reazioni generate da questo flusso di lavoro ~ 95% corretto e richiedono come poco come 4% come molto hands-on tempo, rispetto alla preparazione manuale reazione.
Introduzione
I dispositivi genetici biologici sintetici più in anticipo come il Collins toggle switch1 e il Elowitz repressilator2 ha dimostrato che i sistemi biologici potrebbero essere avanti progettati per hanno funzioni specifiche, deterministiche. Da allora, i biologi di sintesi hanno cercato di progettare sistemi viventi per svolgere progressivamente più complesse funzionalità nel servizio di biomateriali3, biotherapeutics4,5,6, biocarburanti 7,8e biosensori applicazioni9,10,11. Ottenere queste applicazioni attraverso la combinazione di DNA modulare "parti" in "dispositivi" con funzionalità specifiche è stato uno degli obiettivi principali della biologia sintetica. Per questo processo di scala, ci deve essere una tecnica che permette la creazione di dispositivi complessi da grandi librerie di parti in un tempo-efficiente, economicamente efficiente e la cosa più importante, modo riproducibile.
Ad un processo di assemblaggio espansiva è autorizzato perché attualmente il campo manca una comprensione completa delle regole guida design di successo sistema biologico e composizione. Ciò è aggravato dal non sufficientemente caratterizzati DNA parti12, mancanza di compatibilità e componibilità delle parti13e inaspettate, indesiderabili interazioni tra componenti genetiche all'interno di dispositivi sintetici14, 15. in assenza di modelli predittivi affidabili, funzionali periferiche sintetiche genetiche sono arrivate per tentativi ed errori, che esige decine o anche centinaia di varianti di un dispositivo di destinazione vengono proiettati la potenza del segnale di ingresso-uscita e la "migliore" viene selezionato per la composizione con elementi a valle16. Mentre moderno standardizzato metodi di assemblaggio di DNA come Golden Gate17e clonazione modulare18,19,20 semplificare questo processo, un esperto sperimentale è ancora necessario per eseguire ogni protocollo. Come periferiche sintetiche crescono in dimensioni e complessità, lo spazio totale disponibile design sarà diventato troppo grande per costruire e testare manualmente21e il processo sarà troppo artigianale per alcun progresso significativo che è replicabile da effettuarsi nel campo.
Fino all'avvento della biologia sintetica e archivi parte biologici quali iGEM parti del registro di sistema (http://partsregistry.org), le parti genetiche di inventario JBEI di elementi componibili,22e SynBioHub23, non sono state memorizzate in qualsiasi formato standardizzato dell'assembly. Solo una piccola manciata di parti necessarie per essere clonato per ogni progetto e così, il volume della clonazione fatto era piccolo e la realizzazione di un dispositivo montato era realizzabile e banale rispetto al conseguimento degli obiettivi di ricerca attuali. Clonazione molecolare era spesso ad hoc ed eseguita utilizzando digest di restrizione basata sulla disponibilità di sito e dell'endonucleasi di restrizione, piuttosto che seguire qualsiasi processo standardizzato. La mancanza di standardizzazione reso impraticabile per automatizzare qualsiasi protocollo di clonazione come era improbabile che la successiva reazione di clonazione seguirebbe un protocollo identico. Inoltre, l'automazione di assemblaggio di DNA richiesto monetario significativi investimenti in attrezzature (liquido robot di movimentazione e loro infrastrutture software e attrezzatura di laboratorio associate) così come l'investimento di tempo per la generazione di istruzioni per sviluppare accurati parametri per la gestione delle varie classi di liquidi in fase di elaborazione e la precisa serie di istruzioni per eseguire questi protocolli. Piccola scala clonazione sforzi non giustificano queste spese. La combinazione di dispositivo genetico più grandi, più complessi disegni accoppiato con protocolli standardizzati Assemblea24,25 crea un ambiente dove l'automazione di questi processi è molto pratico. Basso costo robotica come il Opentrons OT-One26 inoltre stanno emergendo che permette anche modestamente finanziato labs per accedere a questa tecnologia. Inoltre, "cloud" laboratori27 tra cui Transcriptic e Smeraldo Cloud Lab, nonché accademico "biofoundries" come la fonderia di genoma di Edimburgo, il iBioFab UIUC, e la fonderia di MIT-Broad, cablaggio robotica per assemblare diversi set di disegni per una varietà di clienti rapidamente e ripetutamente mentre il mantenimento di un archivio comune di primitive di base del DNA e tecnologie di assemblaggio per ordini futuri.
Una delle maggiori sfide in automatizzando il processo di assemblaggio del DNA è la generazione dei comandi pipettaggio per il gestore di liquido. Mentre le interfacce software per questi dispositivi sono in genere facile da usare, complesso pipettaggio istruzioni come quelli necessari per l'assemblaggio di DNA combinatoria richiedono lo scienziato specificare ogni aspirare e dispensare comando manualmente in modo esplicito. Questo crea un collo di bottiglia principale del flusso di lavoro e lascia il processo di generazione di script vulnerabili agli errori di pipettaggio stessi come se l'assembly sono stato effettuato manualmente. Ciò richiede uno strumento software in grado di automatizzare tutte le parti di questo processo, dalla progettazione la libreria del dispositivo, per generare le istruzioni di pipettaggio e fornendo il ricercatore con il setup di piastra/reagente necessario per assemblarli. In questo lavoro, sfruttiamo il nostro strumento software per automatizzare la progettazione di una piccola biblioteca di dispositivo combinatoria di DNA, così come la miscelazione dei reagenti (buffer, acqua, enzimi) e parti di DNA (Figura 1b) in 96 reazioni di assemblaggio DNA modulare di uno-pentola. Utilizzo dello strumento non richiede alcuna precedente esperienza di programmazione, è scalabile e ad alta produttività e combinatoria per impostazione predefinita. Mostriamo che clonazione reazioni preparati su due piattaforme diverse processatore automatico resa corretta sequenza-verificato cloni con frequenza paragonabile alle reazioni preparata manualmente (95%) e con molto meno tempo di hands-on.
Protocollo
1. specificare parti da utilizzare nella libreria del dispositivo DNA e generare le istruzioni di gestore utente/liquido [15 min]
- Utilizzando qualsiasi browser web, passare a mocloassembly.com e caricare file Genbank per tutte le parti di DNA che verranno incluse nella progettazione dispositivo DNA combinatoria.
- Una volta che tutti i file sono stati caricati, selezionare parti di DNA desiderati e trascinarli in tela bianca, piazzare parte tipi nell'ordine desiderato finale delle parti di DNA.
Nota: Le collezioni di parti, così come le singole parti, possono essere selezionati e posizionati sulla tela. Inoltre, ordinare parti di DNA in modo che 5' e 3' sovrasta per ogni partita di parte. - Fare clic su 'Montare' in basso a destra della pagina.
Nota: È possibile che lo strumento genererà solo assembly valido, può essere compilato in base agli strapiombi di quattro coppie di basi che fiancheggiano ogni parte sulla digestione con l'enzima BsaI. Se nessun dispositivo DNA costruibile esiste basata sulle parti caricate dallo scienziato, lo strumento indicherà che nessun assembly sono stato trovato. -
Passare alla scheda 'Piani' e scaricare i file generati dallo strumento. Questi file includono:
- Mappe di targa leggibile per lo scienziato preparare campioni di DNA, come pure i reagenti necessari per le reazioni
- Un elenco di selezione per il liquid handler
- Completamente annotato Genbank file per tutti i dispositivi di DNA essere assemblati
Nota: Liquid handling posizionamento del braccio quando si accede a qualsiasi nuova attrezzatura di laboratorio devono essere testati. Consultare il manuale del produttore per istruzioni dettagliate su come regolare il braccio di pipettaggio assi di posizionamento in X, Y e Z come necessario.
2. preparare il DNA del plasmide e reagenti per l'assemblaggio [3 giorni]
- [Giorno 1] Con un'ansa sterile inoculazione e lavorando vicino a fiamme o in una cappa a flusso laminare, striscia fuori stock di glicerolo batterica su piastre LB-agar completati con l'antibiotico adatto. Eseguire questa operazione per tutte le parti necessarie di DNA, assicurandosi di sterilizzare il ciclo tra ogni campione. Incubare le piastre a 37 ° C durante la notte.
Nota: Frozen batterica glicerolo scorte dovrebbero essere tenute su ghiaccio per quanto possibile. Cicli ripetuti di congelamento-scongelamento abbassare la redditività dello stock e dovrebbero essere evitati. - [2 ° giorno] Utilizzando una pipetta sterile, stuzzicadenti o ciclo di inoculazione e lavorando vicino a fiamme o in una cappa a flusso laminare, inoculare 3 mL di brodo LB (completato con antibiotico adatto) con una singola Colonia dalle piastre LB-agar preparata al punto 2.1. Incubare le colture durante la notte a 37 ° C mentre si stringono a 300 giri/min.
- [3 ° giorno] Purificare il DNA del plasmide da colture batteriche utilizzando qualsiasi kit di purificazione del plasmide commercialmente disponibili mini-prep.
- Utilizzando il file di MoClo_Setup.xlsx fornito, diluire ogni campione di DNA del plasmide ad una concentrazione di 20 fmol / µ l in acqua o buffer di TE.
- Seguendo la mappa di piastra del file PDF generato dallo strumento di montaggio, posizionare il volume indicato di ogni parte di DNA diluito nel pozzetto appropriato su una full-minigonna piastra PCR a 96 pozzetti. Tenere questo SetupPlate su ghiaccio fino a quando necessario, o sigillare con un sigillo adesivo e conservare a-20 ° C.
-
Su ghiaccio, preparare il mastermix reazione con i seguenti componenti: per ogni 20 µ l di reazione aggiungere 2 µ l di 10 x T4 DNA ligasi buffer, 0,5 µ l di T4 DNA ligasi (HC) e 1 µ l di enzima BsaI. Un foglio di calcolo è incluso nel file MoClo_Setup.xlsx per aiutare con questo.
- Distribuire il mastermix enzima negli appositi pozzetti di un nuovo full-minigonna PCR piastra a 96 pozzetti, seguendo la mappa di piastra per il ReagentPlate in PDF generato. Mantenere questo ReagentPlate su ghiaccio o su un blocco freddo a 96 pozzetti.
Nota: Il ReagentPlate dovrebbe essere preparata solo quando si è pronti per eseguire l'assembly sul gestore del liquido.
- Distribuire il mastermix enzima negli appositi pozzetti di un nuovo full-minigonna PCR piastra a 96 pozzetti, seguendo la mappa di piastra per il ReagentPlate in PDF generato. Mantenere questo ReagentPlate su ghiaccio o su un blocco freddo a 96 pozzetti.
3. eseguire Assembly Script sul gestore del liquido [variabile]
- Posizionare il SetupPlate(s), il ReagentPlate(s) (su un freddo di 96 pozzetti-blocco) e il numero necessario di piastre da 96 pozzetti pieno-minigonna vuote PCR sul ponte del gestore liquido. Le piastre di vuote sarà la OutputPlate(s) dove vengono assemblate le reazioni.
- Preparare il liquido gestore software di controllo mediante la creazione di istanze di ogni campione e reagente piatto preparato, assicurandosi di assegnare loro un nome esattamente come appaiono sulle mappe piastra generate da mocloassembly.com, tra cui un trogolo di pulito, acqua deionizzata con l'etichetta ' Serbatoio '.
- Utilizzando il comando 'Worklist' del software di controllo, caricare il file di .gwl generato dal nostro strumento software, seguita da un altro comando di 'lista ' di lavoro che verrà eseguito il file .gwl caricato nel primo comando.
- Eseguire lo script utilizzando comando 'Esegui' del software controller.
Nota: Attendere sempre il manipolatore robotizzato liquido completare l'esecuzione di uno script prima di tentare di accedere allo spazio di ponte. - Rimuovere tutte le piastre dal ponte liquido gestore. Restanti del DNA possono essere salvati sigillando la SetupPlate(s) con pellicola sigillante di alluminio e conservare a-20 ° C. Sigillare il OutputPlate(s) con pellicola adesiva, inserire in un termociclatore o calore-blocco ed eseguire con i seguenti parametri di ciclo:
37 ° C per 2 h, 50 ° C per 5 min, 80 ° C per 10 min, mantenere a 4 ° C
Nota: Una volta completata la reazione thermocycling, OutputPlate(s) può essere memorizzato a-20 ° C finché non sono pronti per essere trasformati.
4. trasformare le reazioni [1 giorno]
-
Scongelare il necessario numero di competenti Escherichia coli cell aliquote necessarie (10 µ l/reazione) sul ghiaccio.
Nota: Per mantenere la sterilità, la procedura seguente deve essere eseguita vicino a fiamme libere, o all'interno di una cappa a flusso laminare.- Mentre le cellule sono lo scongelamento, preparare piastre di LB-agar (contenente antibiotico appropriato) di pipettaggio 50 µ l di 0.1 M IPTG e 50 µ l di 20 mg/mL X-GAL sulla superficie. Fare un mix master se un gran numero di reazioni di placcatura. Rivestire le piastre in modo uniforme con una bacchetta di vetro sterile o perline di vetro e lasciate riposare a 37 ° C per almeno 15 min prima di placcatura batteri le piastre.
Nota: In alternativa, aggiungere IPTG ed X-Gal a agar liquido prima di piastre sono versati, a 2 mM IPTG e concentrazione finale X-Gal di 40 µ g/mL. Conservare queste piastre da luce diretta come il X-Gal è sensibile alla luce.
- Mentre le cellule sono lo scongelamento, preparare piastre di LB-agar (contenente antibiotico appropriato) di pipettaggio 50 µ l di 0.1 M IPTG e 50 µ l di 20 mg/mL X-GAL sulla superficie. Fare un mix master se un gran numero di reazioni di placcatura. Rivestire le piastre in modo uniforme con una bacchetta di vetro sterile o perline di vetro e lasciate riposare a 37 ° C per almeno 15 min prima di placcatura batteri le piastre.
- Su ghiaccio, aliquota 10 µ l di cellule competenti per ciascuna reazione in una nuova piastra per PCR a 96 pozzetti. Questa sarà la piastra di trasformazione.
- Aggiungere 1-3 µ l di ogni reazione dall'OutputPlate(s) ai corrispondenti bene la piastra di trasformazione e incubare in ghiaccio per 5 min.
- Sigillare la piastra di trasformazione con adesivo pellicola e calore shock in un termociclatore a 42 ° C per 30 s. Quindi, immediatamente mettere la piastra sul ghiaccio per 2 min.
- Per lo stessi pozzetti della piastra, trasformazione, aggiungere 150 µ l di media SOC, sigillare con un sigillo adesivo in alluminio e incubare a 37 ° C mentre si stringono a 900 giri/min per 1 ora.
- Piastra l'intero contenuto di ciascun pozzetto della piastra trasformazione sulle piastre LB-agar preparate in 4.1.1 utilizzando una bacchetta di vetro sterile o in vetro per ricoprire uniformemente la superficie della piastra. Incubare le piastre a 37 ° C durante la notte.
5. clonare verifica [2 giorni]
-
Preparare uno o più blocchi di 96 pozzetti profondi-pozzo cultura con 1,5 mL di brodo LB (contenente antibiotico adatto).
- Simile al punto 2.2, inoculare i blocchi di cultura profonda-pozzo con singole colonie bianchi da ogni piatto LB-agar di reazioni trasformate.
- Sigillare i blocchi di cultura con una guarnizione gas-permeabili e incubare a 37 ° C per una notte mentre si stringono a 900 giri/min.
Nota: Il modulare clonazione tecnica utilizza lo screening bianco-blu, così positivo CFUs apparirà bianco sul piatto LB-agar, mentre vettori di destinazione vuoto verranno visualizzato in blu.
- Isolare il DNA del plasmide da colture batteriche (come 2.3) e sottoporre a Sanger sequenziamento per verificare cloni.
Risultati
Qui dimostriamo l'assemblaggio automatizzato modulare di 96 dispositivi di DNA provenienti da varie parti del DNA base (Figura 1b) utilizzando due piattaforme di trattamento liquido robot automatizzato. Ogni unità trascrizionale è una disposizione lineare di promotore, sito di legame ribosomiale, gene e terminatore trascrizionale, clonato in un vettore di destinazione specifica. TUs sono una componente chiave in molti gerarchica circuito genetico disegni28,29,30 e sono quindi un naturale proof of concept per questo approccio. Sequenza-verificato cloni possono essere realizzati in ~ 5 giorni dall'inizio alla fine, e viene presentata una panoramica del flusso di lavoro presentato in Figura 1a.
Usando lo strumento descritto e protocollo, abbiamo catturato diversi parametri utili per la determinazione della piattaforma di montaggio ottimale data un numero definito di clonazione reazioni deve essere generato dallo scienziato. Figura 2a illustra un confronto tra tempi di assemblaggio di reazione attraverso tutte e tre le modalità. Tempo di esecuzione è il tempo totale per completare tutte le fasi di pipettaggio necessarie per assemblare 96 reazioni, che comprende l'erogazione di tutte le parti di DNA e reagenti. Hands-on tempo indica il tempo totale di che un essere umano è stato manualmente coinvolto nella preparazione delle reazioni clonazione, o l'installazione del software che esegue il gestore di liquido. Figura 2b confronta il costo tra i diversi metodi. Costi presentati sono per una singola reazione preparata da ogni metodo e include il prezzo degli enzimi e puntali monouso, dati il volume più basso reazione tipica (20 µ l per liquido gestore, 10 µ l per 250 manuale, nL per dispenser acustica). Sono stati sequenziati singoli cloni da 96 tutte le reazioni per set preparato gestore sia manuale che liquido, con un sottoinsieme di 12 sequenziati per le reazioni di acustica erogatore (Figura 2C). Sequenze corrette sono state ottenute per il 95% dei 96 set gestore manuale e liquido. 83% dei subset campione acustico dispenser erano corrette, tuttavia il finale due reazioni non è riuscito a produrre qualsiasi colonie bianchi, probabilmente a causa di insufficiente miscelazione di goccioline dopo l'erogazione del DNA e reagenti era completo. Figura 2d illustra clonazione efficienze di reazione, come misurato dal rapporto tra colonie bianche al numero totale di colonie, che sono paragonabili tra manualmente (94%) e liquido gestore-assemblati (84%) reazioni. È interessante notare che, quando Esegui la scalatura verso il basso il volume di reazione finale con il distributore di acustico, abbiamo notato un profondo calo nell'efficienza di reazione quando le reazioni sono state preparate a volumi inferiori a 1 µ l (Supplemental figura 1 & supplementare tabella 2). Ciò è probabilmente dovuto evaporazione durante la reazione thermocycling, che può causare un aumento nelle concentrazioni saline nella reazione.
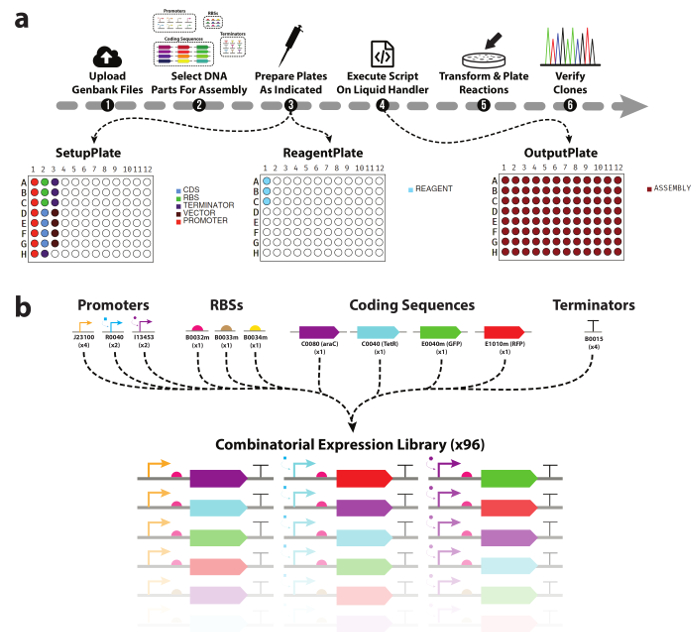
Figura 1. Workflow automatizzato a DNA dispositivo biblioteca Assemblea.
(a) una panoramica del flusso di lavoro sperimentale presentato in questo lavoro. (1) i ricercatori prima caricare i file Genbank per tutte le parti di DNA e vettori di destinazione che intendono utilizzare. (2) successivamente, vengono selezionate parti di DNA da includere nell'assembly. (3) lo strumento genererà quindi un elenco a discesa per un gestore di liquido automatizzato, nonché mappe piatto assistere con popolamento manuale con pezzi di DNA ed enzima mastermix. (4) utilizzando il DNA & piastre di reagenti, nonché l'elenco di selezione generato, ricercatori eseguire l'assembly delle reazioni clonazione sul gestore del liquido. (5) una volta completato, le reazioni di trasformazione e placcate per analisi a valle. (b) parti di elenco di DNA utilizzate in questo lavoro. Un totale di tre promotori, tre ribosomiale vincolanti siti, quattro codifica le sequenze, e sono stati utilizzati un terminatore trascrizionale generare la libreria combinatoria di 96 TUs. Clicca qui per visualizzare una versione più grande di questa figura.
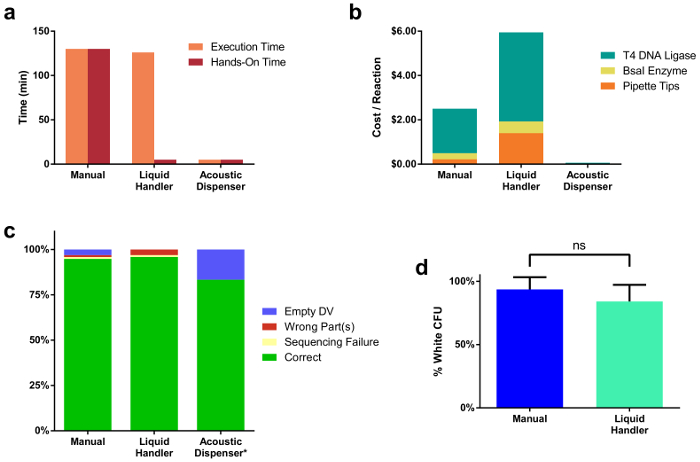
Nella figura 2. Confronti attraverso tre modalità di assemblaggio di reazione diversa.
(a) tempo di setup di reazione per 96 reazioni assemblati manualmente, tramite un gestore di liquido e da un dispenser di acustico. Assemblaggio manuale ha preso 2 h 10 min, tutti di che era tempo di preparazione manuale. Il gestore di liquido ha preso una simile quantità di tempo (2 h 6 min) per eseguire i comandi di pipettaggio, tuttavia solo una frazione di quel tempo (5 min) era pratica. Il dispenser acustico ha avuto significativamente meno tempo per eseguire trasferimenti di liquidi (5 min) e ha preso minimo hands-on tempo (5 min). (b) tariffa per singola reazione clonazione per ogni metodo di assemblaggio. Questo prezzo comprende il costo degli enzimi usati, così come i puntali per pipette. (c) sequenziamento risultati dalle singole colonie di 96 tutti assemblati TUs. La percentuale di cloni corretti era paragonabile in tutti i metodi di assemblaggio. Si noti che solo un sottoinsieme (12) degli assembly completo 96 sono stati trasformati dal dispenser acustico preparati campioni. Due reazioni non è riuscito a produrre qualsiasi colonie bianchi, probabilmente a causa di insufficiente miscelazione di DNA & enzima mastermix goccioline nella OutputPlate. (d) confronto delle efficienze di reazione tra manuale e liquide preparato gestore reazioni di clonazione. Clicca qui per visualizzare una versione più grande di questa figura.
Supplementare nella figura 1. Efficienza di reazione diminuisce con abbassamento volume di reazione.
Efficienze di reazione contrassegnato cadere quando la riduzione di volumi di reazione inferiore a 1 µ l. Questa tendenza è visto con due diverse concentrazioni di finale del DNA; Tuttavia, gli scienziati possono optare per utilizzare volumi più piccoli per risparmiare sui costi di reagente se efficienze inferiore possono essere tollerate. Per favore clicca qui per scaricare questo file.
Supplementare nella tabella 1.
Tabella dei parametri di classe liquido del DNA e l'enzima per vari volumi di pipettaggio. Per favore clicca qui per scaricare questo file.
Supplemental tabella 2.
Calcoli di efficienza di reazione. Numeri CFU grezzi sono date per 12 delle 96 reazioni trasformate preparate manualmente e tramite il gestore di liquido. Numeri di CFU sono inoltre forniti per la sperimentazione di piccoli volumi di reazione finale sul dispenser acustico. Per favore clicca qui per scaricare questo file.
Discussione
In conclusione, l'automazione del processo di creazione di dispositivo con i DNA completo, dalla progettazione in silico alla manipolazione dei liquidi, è un obiettivo praticabile con attualmente esistente tecnologia. Software e robotica moderna permettono la creazione di flussi di lavoro che sono costo-efficiente, tempo-efficiente e scalabile, producendo anche risultati più riproducibili in modo coerente rispetto ai metodi manuali. Mentre automazione non può essere sempre la scelta più conveniente per l'esecuzione di un protocollo, migliorare la riproducibilità sperimentale e libera tempo prezioso ricercatore. Tuttavia, a seconda dell'hardware utilizzato, l'uso di automazione può a volte guidare costo e tempo di esecuzione ben di sotto di ciò che può essere raggiunto attraverso metodi manuali tradizionali. Inoltre, automazione cattura protocolli in modo esplicito in un modo formalizzato che impedisce ad-hoc, artigianale, e aneddotica migliori pratiche base di sperimentazione. Qui l'assemblaggio automatizzato di dispositivi modulari di DNA è dimostrato, e il protocollo, documenti elettronici e le risorse fisiche del DNA necessarie per il lettore di eseguire queste e simili, sono forniti gli esperimenti per conto proprio. Ci auguriamo che la disponibilità del nostro strumento, e la pubblicazione del presente protocollo servirà come una risorsa e spostare il campo verso un futuro più trasparente e comunitaria in materia di processi di assemblaggio di DNA e di liquid handling robotica.
L'utilità di hardware di automazione è in gran parte dipende la configurazione e le funzionalità dell'hardware. Per esempio, il nostro gestore liquido utilizza spostamento fluido sistema per azionare aspirare e dispensare i comandi. I pistoni che unità il fluido sistema sono relativamente grande 1 mL siringhe che, mentre utile per una serie di volumi, impone un limite inferiore di 2 µ l per il dosaggio preciso dei reagenti. Di conseguenza, abbiamo scalato il volume totale della clonazione reazioni impostate sul gestore del liquido a 20 µ l, poiché ogni comando dovuto essere ≥ 2 µ l di dispensare. Questo di fatto raddoppiato il costo per reazione per reazioni di gestore-prepped liquide, tuttavia la quantità di hands-on tempo necessario per eseguire tali reazioni è stata ridotta significativamente. Nel tentativo di risolvere questo problema, abbiamo ripetuto l'installazione di reazione per 96 tutte le reazioni su un'acustica dispenser liquido. Questo dispositivo utilizza energia sonora per erogare il liquido direttamente da un piatto a altro e può raggiungere dispensare volumi molto di sotto (2.5 nL) cosa è possibile con lo spostamento d'aria standard basato Pipette manuali. Utilizzando questo dispositivo, siamo stati in grado di scalare verso il basso il volume totale delle nostre reazioni a 250 nL, una volta 40 riduzione rispetto al manuale preparate reazioni di 10 µ l. A causa di piccoli volumi dispensati e la mancanza di cambiamenti di punta tra i passaggi di pipettaggio, il distributore acustico era in grado di generare le stesse 96 reazioni in una frazione del tempo (< 5 min). I più piccoli volumi di reazione anche salvare sprecato dei reagenti, poiché in genere trasformiamo solo 1-3 µ l della reazione. Detto questo, l'utilizzo di hardware di automazione, in combinazione con un software intuitivo, può rendere la generazione di un gran numero di reazioni di assemblaggio di DNA accessibile ad un pubblico più ampio dell'accademico.
Qui, noi dimostrare l'utilità dei nostri software tool, tuttavia ci sono una serie di caratteristiche che sarebbe utile ampliare la sua utilità. In primo luogo, ogni volta che lo strumento viene utilizzato per generare un assembly di combinatorio, nuove piastre di parte del DNA devono essere generati, che richiedono lo scienziato inserire manualmente queste piastre per ogni assembly in esecuzione. Sarebbe utile, invece, se lo scienziato potrebbe specificare la posizione delle parti in una piastra di DNA per essere utilizzati nell'assemblaggio. Ciò consentirebbe l'uso di alto-rendimento plasmide Kit di purificazione del DNA poiché i ricercatori potrebbero inoculare colture da un kit come la biblioteca di MoClo CIDAR e purificare tutti i campioni insieme pur mantenendo la posizione ben di ogni parte specificata nel kit. In secondo luogo, lo strumento attualmente supporta solo l'utilizzo di piastre a 96 pozzetti. Per progetti di grandi dimensioni dove diverse centinaia dispositivi del DNA devono essere costruiti, il numero di DNA, reagente e piastre di destinazione può superare la capacità del ponte del gestore liquido. Questo problema potrebbe essere, almeno parzialmente, alleviato dal supporto per formati piastra ad alta densità (384 o 1536 pozzetti). Infine, lo strumento attualmente supporta solo un singolo tipo di gestore di liquido e strategia di assemblaggio del DNA. Mentre è relativamente facile convertire le istruzioni strumento-prodotto liquido gestore un erogatore acustico formato utilizzando software di foglio di calcolo, speriamo di espandere il supporto nativo per molti gestori diversi liquidi che ampliano notevolmente la sua applicabilità, come compatibilità con altre tecniche di assemblaggio di DNA comune vorrebbe Gibson Assemblea31.
Una parte cruciale di questo ecosistema di assemblaggio automatizzato è un insieme di strumenti software che traduce i piani di montaggio ad alto livello in protocolli amichevole di automazione che sono programmati in modo esplicito per eseguire il trattamento dei robot. Anche se esiste un numero di strumenti software che permettono ai ricercatori di progettare gli assembly in-silico tra cui Benchling, MoClo Planner e Raven32, pochi hanno la capacità di tradurre quei disegni in istruzioni eseguibili per eseguire su un liquido gestore. A tal fine, lavorare come PR-PR automazione e burattinaio33,34,35 hanno cominciato a rendere disponibili questi strumenti. Inoltre, entità commerciali che lavorano in questo settore stanno cercando modi per introdurre "nube labs", che forniscono servizi sperimentali a grandi gruppi di utenti finali tramite l'automazione. Il protocollo descritto in questo documento potrebbe servire come un pezzo di uno qualsiasi di questi sforzi forniti che si sono presentati come un servizio.
Mentre assemblaggio automatizzato di dispositivi del DNA è di valore immediato ed evidente per la biologia sintetica, il nostro protocollo è utile per la più grande comunità dei biologi molecolari pure. L'automazione di assemblaggio di DNA permette un numero elevato di noto, ma dispositivi simili, genetici deve essere creato in parallelo e possono consentano la rapida sintesi di librerie di espressione per lo screening e a scopo di test in studi sullo sviluppo di droga. Ci auguriamo che il nostro strumento software renderà più grandi sforzi di assemblaggio di DNA combinatoria basati più accessibile e servire come una risorsa utile per sia la biologia sintetica, nonché più grande comunità accademica.
Divulgazioni
Densmore è Presidente e co-fondatore di Lattice Automation, Inc. Timmons e McCarthy sono dipendenti della grata. Software e servizi per l'automazione di molti del processo descritto rende grata.
Riconoscimenti
Ringraziamo Swapnil Bhatia, Alejandro Pelaez e Lam Johnson per il lavoro sul progetto burattinaio, nonché Swati Carr, Rachael Smith e Thomas Costa per aiuto con questo manoscritto. Questo lavoro è stato finanziato dalla NSF carriera Premio n. 1253856. È anche finanziato dalle spedizioni NSF in Computing Award #1522074.
Materiali
| Name | Company | Catalog Number | Comments |
| Hardware / Software | |||
| Freedom EVO 150 Liquid Handling Robot | Tecan | Custom liquid handler fitted with an 8-channel pipetting arm http://lifesciences.tecan.com/products/liquid_handling_and_robotics/freedom_evo | |
| Freedom EVOware Standard (Version 2.4 Service Pack 2) | Tecan | Software used to control the Freedom EVO 150 liquid handler http://lifesciences.tecan.com/products/software/freedom_evoware | |
| Echo 550 | Labcyte | Acoustic Liquid Dispenser http://www.labcyte.com/products/liquidhandling/echo-550-liquid-handler | |
| Sorvall Legend RT | Sorvall | Large benchtop swing-bucket sentrifuge | |
| MasterCycler Pro | Eppendorf | 950040015 | Thermocycler with 96-well heat block https://online-shop.eppendorf.us/US-en/PCR-44553/Cyclers-44554/Mastercycler-pro-PF-5193.html |
| ECHOTHERM Chilling/Heating Dry Bath | Torrey Pines Scientific | Heating/Chilling block for EVO 150 deck https://www.torreypinesscientific.com/products/chilling-and-heating-dry-baths/echotherm-ric20-series-remote-controlled-chillingheating-dr | |
| Tabletop Microcentrifuge 5418 | Eppendorf | 5418000017 | Stardard 18-well microcentrifuge https://online-shop.eppendorf.com/OC-en/Centrifugation-44533/Centrifuges-44534/Centrifuges-5418--5418R-PF-9257.html |
| Name | Company | Catalog Number | Comments |
| Resources | |||
| mocloassembly.com | Lattice Automation | Web-tool for combinatorial DNA assembly mocloassembly.com | |
| CIDAR MoClo Parts Kit | AddGene | 1000000059 | Kit of bacterial glycerol stocks for all DNA parts used in this study https://www.addgene.org/cloning/moclo/densmore/ |
| CIDAR ICE Registry | CIDAR Lab | Registry of plasmid DNA maps https://ice.cidarlab.org/folders/8 https://synbiohub.programmingbiology.org/public/bubdc_ice/bubdc_ice_folder_8/current | |
| Name | Company | Catalog Number | Comments |
| Labware | |||
| 50 μL Conductive Tips | Tecan | 30 057 818 | Sterile 50 μL conductive tips for Tecan liquid handler http://lifesciences.tecan.com/products/consumables/disposable_tips/liquid_handling_disposable_tips |
| 2 mL Deep 96-well Culture Plates | USA Scinetific | 5678-0285 | Bacterial culture plates used for culturing of large numbers of samples http://www.thermoscientific.com/en/product/nunc-1-3-2-0ml-deepwell-plates-shared-wall-technology.html |
| 1.5 mL Microcentrifuge Tubes | USA Scinetific | 1615-5599 | Disposable microcentrifuge tubes http://www.usascientific.com/Seal-Rite-1.5-ml-tube-colors.aspx |
| Breathe Easier sealing membrane | Sigma-Aldrich | Z763624-100EA | Breathable sealing membrane for bacterial culture plates http://www.sigmaaldrich.com/catalog/product/sigma/z763624?lang=en®ion=US |
| Full-Skirted, Low-Profile, 96-Well PCR Plates | GeneMate | T-3183-2 | PCR plates used for all steps https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-3183-R |
| Alluminum Sealing Foil for PCR Plates | GeneMate | T-2451-1 | Alluminum seals for PCR plate storage https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2451-1 |
| Polyolefin Sealing Film for PCR Plates | GeneMate | T-2450-1 | Plastic seals for PCR plates during cycling https://www.bioexpress.com/store/catalog/product.jsp?catalog_number=T-2450-1 |
| PCR Cooler | Eppendorf | 22510525 | 96-well cold block https://online-shop.eppendorf.us/US-en/Temperature-Control-and-Mixing-44518/Accessories-44520/PCR-Cooler-PF-55940.html |
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| GenCatch Plasmid DNA Mini-Prep Kit | Epoch Life Sciences | 2160250 | Plasmid DNA purification kit http://www.epochlifescience.com/Product/PurificationKit/dna_mini.aspx |
| T4 DNA Ligase (HC) | Promega | M1794 | High concentration T4 DNA Ligase https://www.promega.com/products/cloning-and-dna-markers/molecular-biology-enzymes-and-reagents/t4-dna-ligase/?catNum=M1794 |
| BbsI Restriction Enzyme | New England Biolabs | R0539L | BbsI enzyme at 10,000 units/ml https://www.neb.com/products/r0539-bbsi |
| BsaI Restriction Enzyme | New England Biolabs | R0535L | BsaI enzyme at 10,000 units/ml https://www.neb.com/products/r3535-bsai-hf |
| T4 DNA Ligase Buffer Pack | Promega | C1263 | 10x T4 DNA ligase buffer https://www.promega.com/products/cloning-and-dna-markers/cloning-tools-and-competent-cells/t4-dna-ligase/ |
| Isopropyl-ß-D-thiogalactopyranoside (IPTG) | Zymo Research | I1001-25 | 0.5M IPTG Solution http://www.zymoresearch.com/buffers-solutions/chemicals/isopropyl-ss-d-thiogalactopyranoside-iptg |
| 5-bromo-4-chloro-3-indolyl ß-D-galactopyranoside (X-GAL) | Zymo Research | X1001-25 | 20 mg/ml X-GAL solution http://www.zymoresearch.com/buffers-solutions/chemicals/5-bromo-4-chloro-3-indolyl-ss-d-galactopyranoside-x-gal |
| Kanamycin Sulfate | Zymo Research | A1003-25 | 35 mg/ml Kanamycin solution http://www.zymoresearch.com/buffers-solutions/antibiotics/kanamycin-sulfate |
| Carbenicillin (Disodium Salt) | Fisher | BP26481 | 1 g Carbenicillin (Ampicillin analog) https://www.fishersci.com/shop/products/carbenicillin-disodium-salt-fisher-bioreagents-3/p-25005#?keyword=carbenicillin |
| SOC Broth Media | Teknova | S0225 | Powder media used to make SOC broth http://www.teknova.com/SOC-BROTH-MEDIA-p/s0225.htm |
| LB Broth (Lennox) Media | Sigma-Aldrich | L3022-1KG | Powder media used to make LB broth http://www.sigmaaldrich.com/catalog/product/sigma/l3022?lang=en®ion=US |
| LB Broth with agar (Lennox) Media | Sigma-Aldrich | L2897-1KG | LB with agar mix used for making solid media plates http://www.sigmaaldrich.com/catalog/product/sigma/l2897?lang=en®ion=US |
| Alpha-Select Gold Efficiency Competent Cells | Bioline | BIO-85027 | High efficiency chemically competent E. coli cells http://www.bioline.com/us/alpha-select-gold-efficiency.html |
| Name | Company | Catalog Number | Comments |
| Primers | |||
| Primer VF | 5'-TGCCACCTGACGTCTAAGAA-3' Primers used for Sanger sequencing and colony PCRs | ||
| Primer VR | 5'-ATTACCGCCTTTGAGTGAGC-3' Primers used for Sanger sequencing and colony PCRs |
Riferimenti
- Gardner, T. S., Cantor, C. R., Collins, J. J. Construction of a genetic toggle switch in Escherichia coli. Nature. 403 (6767), 339-342 (2000).
- Elowitz, M. B., Leibler, S. A synthetic oscillatory network of transcriptional regulators. Nature. 403 (6767), 335-338 (2000).
- Lutolf, M. P., Hubbell, J. A. Synthetic biomaterials as instructive extracellular microenvironments for morphogenesis in tissue engineering. Nat Biotechnol. 23 (1), 47-55 (2005).
- Anderson, J. C., Clarke, E. J., Arkin, A. P., Voigt, C. A. Environmentally controlled invasion of cancer cells by engineered bacteria. J Mol Biol. 355 (4), 619-627 (2006).
- Xie, Z., Wroblewska, L., Prochazka, L., Weiss, R., Benenson, Y. Multi-input RNAi-based logic circuit for identification of specific cancer cells. Science. 333 (6047), 1307-1311 (2011).
- Ro, D. K., et al. Production of the antimalarial drug precursor artemisinic acid in engineered yeast. Nature. 440 (7086), 940-943 (2006).
- Georgianna, D. R., Mayfield, S. P. Exploiting diversity and synthetic biology for the production of algal biofuels. Nature. 488 (7411), 329-335 (2012).
- Savage, D. F., Way, J., Silver, P. A. Defossiling fuel: how synthetic biology can transform biofuel production. ACS Chem Biol. 3 (1), 13-16 (2008).
- Fussenegger, M., et al. Streptogramin-based gene regulation systems for mammalian cells. Nat Biotechnol. 18 (11), 1203-1208 (2000).
- Boorsma, M., et al. A temperature-regulated replicon-based DNA expression system. Nat Biotechnol. 18 (4), 429-432 (2000).
- Malphettes, L., et al. A novel mammalian expression system derived from components coordinating nicotine degradation in arthrobacter nicotinovorans pAO1. Nucleic Acids Res. 33 (12), e107 (2005).
- Brophy, J. A., Voigt, C. A. Principles of genetic circuit design. Nat Methods. 11 (5), 508-520 (2014).
- Lou, C., Stanton, B., Chen, Y. J., Munsky, B., Voigt, C. A. Ribozyme-based insulator parts buffer synthetic circuits from genetic context. Nat Biotechnol. , (2012).
- Cardinale, S., Arkin, A. P. Contextualizing context for synthetic biology--identifying causes of failure of synthetic biological systems. Biotechnol J. 7 (7), 856-866 (2012).
- Carr, S. B., Beal, J., Densmore, D. M. Reducing DNA context dependence in bacterial promoters. PLoS One. 12 (4), e0176013 (2017).
- Yeung, E., Ng, A., Kim, J., Sun, Z. Z., Murray, R. M. . Decision and Control (CDC), 2014 IEEE 53rd Annual Conference on. , 5405-5412 (2014).
- Engler, C., Gruetzner, R., Kandzia, R., Marillonnet, S. Golden gate shuffling: a one-pot DNA shuffling method based on type IIs restriction enzymes. PLoS One. 4 (5), e5553 (2009).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A modular cloning system for standardized assembly of multigene constructs. PLoS One. 6 (2), e16765 (2011).
- Iverson, S. V., Haddock, T. L., Beal, J., Densmore, D. M. CIDAR MoClo: Improved MoClo Assembly Standard and New E. coli Part Library Enable Rapid Combinatorial Design for Synthetic and Traditional Biology. ACS Synth Biol. 5 (1), 99-103 (2016).
- Casini, A., Storch, M., Baldwin, G. S., Ellis, T. Bricks and blueprints: methods and standards for DNA assembly. Nat Rev Mol Cell Biol. 16 (9), 568-576 (2015).
- Bhatia, S. P., Smanski, M., Voigt, C. A., Densmore, D. M. Genetic design via combinatorial constraint specification. ACS Synth Biol. , (2017).
- Ham, T. S., et al. Design, implementation and practice of JBEI-ICE: an open source biological part registry platform and tools. Nucleic Acids Res. 40 (18), e141 (2012).
- Madsen, C., et al. The SBOL Stack: A Platform for Storing, Publishing, and Sharing Synthetic Biology Designs. ACS Synth Biol. 5 (6), 487-497 (2016).
- Knight, T. . Draft standard for BioBrick biological parts. , (2007).
- Gibson, D. G., et al. Enzymatic assembly of DNA molecules up to several hundred kilobases. Nat Methods. 6 (5), 343-345 (2009).
- Ma, A. C., et al. FusX: A Rapid One-Step Transcription Activator-Like Effector Assembly System for Genome Science. Hum Gene Ther. 27 (6), 451-463 (2016).
- Check Hayden, E. The automated lab. Nature. 516 (7529), 131-132 (2014).
- Nielsen, A. A., et al. Genetic circuit design automation. Science. 352 (6281), aac7341 (2016).
- Woodruff, L. B. A., et al. Registry in a tube: multiplexed pools of retrievable parts for genetic design space exploration. Nucleic Acids Res. 45 (3), 1553-1565 (2017).
- Hasty, J., McMillen, D., Collins, J. J. Engineered gene circuits. Nature. 420 (6912), 224-230 (2002).
- Gibson, D. G. Enzymatic assembly of overlapping DNA fragments. Methods Enzymol. 498, 349-361 (2011).
- Appleton, E., Tao, J., Haddock, T., Densmore, D. Interactive assembly algorithms for molecular cloning. Nat Methods. 11 (6), 657-662 (2014).
- Vasilev, V., Liu, C., Haddock, T., Bhatia, S., Adler, A., Yaman, F., Beal, J., Babb, J., Weiss, R., Densmore, D. A Software Stack for Specification and Robotic Execution of Protocols for Synthetic Biological Engineering. SynBERC Fall Retreat, Harvard University. , (2011).
- Beal, J., et al. An end-to-end workflow for engineering of biological networks from high-level specifications. ACS Synth Biol. 1 (8), 317-331 (2012).
- Bhatia, S., Densmore, D. Pigeon: a design visualizer for synthetic biology. ACS Synth Biol. 2 (6), 348-350 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon