Method Article
Um método eficiente para a Síntese de Peptóides com Monómeros Mixed tipo de lisina / arginina-tipo e avaliação da sua actividade anti-leishmaniose
Neste Artigo
Resumo
A protocol to synthesize peptoids with mixed cationic functionality in the same sequence is presented (lysine- and arginine-type monomers). Subsequent testing of these compounds against Leishmania mexicana, the protozoan parasites that cause cutaneous leishmaniasis, is also described.
Resumo
This protocol describes the manual solid-phase synthesis of linear peptoids that contain two differently functionalized cationic monomers. In this procedure amino functionalized 'lysine' and guanido functionalized 'arginine' peptoid monomers can be included within the same peptoid sequence. This procedure uses on-resin (N-(1-(4,4-dimethyl-2,6-dioxocyclohexylidene)ethyl) or Dde protection, orthogonal conditions to the Boc protection of lysine monomers. Subsequent deprotection allows an efficient on-resin guanidinylation reaction to form the arginine residues. The procedure is compatible with the commonly used submonomer method of peptoid synthesis, allowing simple peptoids to be made using common laboratory equipment and commercially available reagents. The representative synthesis, purification and characterization of two mixed peptoids is described. The evaluation of these compounds as potential anti-infectives in screening assays against Leishmania mexicana is also described. The protozoan parasite L. mexicana is a causative agent of cutaneous leishmaniasis, a neglected tropical disease that affects up to 12 million people worldwide.
Introdução
Peptóides (ou poli- N-substituído glycines) são uma classe de miméticos de péptidos-que oferecem propriedades semelhantes a péptidos e, como tal, estão cada vez mais a ser investigados para aplicações medicinais e materiais. Em péptidos, a cadeia lateral de cada aminoácido está ligado ao α-carbono da espinha dorsal de amida; em pept�des as cadeias laterais são deslocados para o átomo de azoto do esqueleto. Fundamentalmente, isto dá pept�des maior resistência à proteólise.
Peptóides são normalmente sintetizados utilizando o método submon�ero iniciada por Zuckermann et al., Onde monómeros pept�des pode ser construído por haloacetylation sequencial de uma funcionalidade amina ligado a um suporte sólido e subsequente deslocamento do halogéneo com uma amina primária. 1 O nosso grupo desenvolveu recentemente uma adaptação deste método para permitir submon�ero lisina- e do tipo arginina resíduos pept�des para ser incluído dentro da mesma sequência para o f peptóideirst tempo. 2 Esta abordagem manual em fase sólida para a síntese de pept�des utiliza reagentes comercialmente disponíveis e equipamentos de laboratório comum, tornando-o acessível para a maioria dos laboratórios. Peptóides ter sido demonstrado ter actividade promissora contra uma vasta gama de bactérias Gram-negativas, as espécies bacterianas e fúngicas Gram-positivas que são comparáveis aos diversos péptidos antimicrobianos conhecidos. 09/03
Em nosso trabalho, peptoids têm sido usados como compostos anti-infecciosos inovadoras para o tratamento da leishmaniose doença tropical negligenciada. 5,10 leishmaniose é endêmica em mais de 80 países em todo o mundo e estima-se que mais de 12 milhões de pessoas estão infectadas em todo o mundo. 11 A doença é causada por parasitas protozoários que são transmitidos pela picada de um mosquito pólvora. espécie de Leishmania pode causar leishmaniose cutânea, uma condição que conduz à formação de cicatrizes e a lesão das membranas mucosas, ou a leis visceral com risco de vidahmaniasis, o que provoca danos em órgãos fatal. Nenhuma vacina está actualmente disponível para esta doença e os tratamentos actuais dependem de um pequeno número de fármacos que têm efeitos secundários graves. Além disso, a resistência a fármacos existentes é um problema emergente e grave assim novos tratamentos são desesperadamente necessário para tratar eficazmente a leishmaniose no futuro 12-16.
Nestas aplicações antimicrobianas, peptóides são frequentemente concebidos para serem anfipático com uma mistura de monómeros hidrófobos e catiónico. Isto pode dar 3,4 pept�des um grau de selectividade em relação a células bacterianas, reduzir a toxicidade para as células de mamíferos, e para melhorar a sua actividade como transportadores moleculares . 17-20 a maioria dos pept�des anti-infecciosos na literatura contêm cadeias laterais catiónicas que são exclusivamente constituídas por qualquer amino funcionalizado monómeros do tipo lisina ou resíduos de tipo arginina. quimeras péptido-pept�des, onde as cadeias catiónicos são compostos de um amino ácidos lisina ou arginina, também foram sintetizados para analisar o efeito de grupos catiónicos sobre a actividade e a toxicidade 21-25.
pept�des poli-lisina podem ser facilmente sintetizados utilizando aminas protegidas com Boc comercialmente disponíveis. Os peptóides poli-arginina relatado pode ser feita utilizando um método que utiliza pirazole-1-carboxamidina como um agente guanidinylation. 18 No entanto, isso só pode ser realizada após a peptóide foi clivado a partir da resina e a protecção Boc na cadeia lateral removida, assim cada resíduo de tipo lisina dentro da sequência é transformada em um resíduo de arginina. Num esforço para aperfeiçoar as propriedades químicas e biológicas dos compostos, foi desenvolvido um método que permite a dupla funcionalidade catiónica (por exemplo, N e N Lys Arg) para ser incluído em qualquer dada sequência peptóide pela primeira vez 2.
Aqui, nós descrevemos a síntese, purificação e caracterização de TWo romance peptoids que contêm ambos os resíduos lisina- e do tipo arginina na mesma sequência. O método utiliza ortogonal protecção N-Boc e N -Dde em resina com pirazole-1-carboxamidina como um reagente guanidinylation. A avaliação biológica destas pept�des também é descrito em ensaios de citotoxicidade contra Leishmania mexicana, o agente causador da leishmaniose cutânea. Isto fornece um método prático para acessar peptoids com a funcionalidade catiônica dupla e para avaliar sua atividade biológica. Espera-se que este método vai ajudar a síntese de peptóides anfipáticos pela comunidade peptóide no futuro.
Protocolo
Síntese 1. em fase sólida de Peptóides
NOTA: Peptóides são sintetizados manualmente utilizando o procedimento submon�ero de síntese em fase sólida peptóide. Este método permite alta eficiência de acoplamento e bons rendimentos do produto final. Síntese em fase sólida, também permite que os reagentes em excesso para ser removida facilmente no final de cada passo e o método foi modificado aqui para permitir (resíduos ou seja, do tipo arginina e do tipo lisina) diferentes funcionalizados monómeros catiónicos para ser incluído dentro da mesma sequência. 1,2
- Síntese de um peptóide linear
Atenção: Realizar avaliações de segurança antes de iniciar a síntese. Realizar todas as reações em um exaustor e usar equipamento de protecção individual adequado, conforme apropriado (ou seja, luvas de borracha nitrílica descartáveis, óculos de segurança e uma bata de laboratório). Tome cuidado especial ao utilizar os seguintes reagentes e solventes. Dimetilformamida (DMF) é um agente teratogénico e d suspeitaichloromethane (DCM) é um agente cancerígeno. N, diisopropilcarbodiimida N '(DIC) e piperidina são perigosos para os olhos, pele, por inalação respiratório e pode causar sensibilização da pele. Hidrazina é um cancerígeno, fatal se for inalado e causa queimaduras graves na pele ou olhos. ácido bromoacético também é perigoso para a pele, olhos e trato respiratório e pode causar queimaduras por contacto. ácido trifluoroacético (TFA) é um líquido volátil e pode causar queimaduras graves por isso manuseie com cuidado. luvas pesados são recomendados.- Adicionar 0,12 g de resina de Rink amida protegida com Fmoc (0,1 mmol, carga típica 0,7 mmol / g) a um vaso reaccional de 20 ml de polipropileno tapados com duas fritas. Adicionar 5 ml de dimetilformamida (DMF) a inchar a resina e deixar o recipiente em repouso durante pelo menos 60 minutos à temperatura ambiente. Drenar o DMF, utilizando uma plataforma de vácuo de extracção em fase sólida.
- Para desproteger o grupo Fmoc na resina aumentada de volume, adiciona-se 2 ml de solução de piperidina (20% em DMF v / v). Colocar o recipiente sobreuma plataforma de agitação à temperatura ambiente (450 rpm) e agitar durante 5 min. Remover a solução através da estação de vácuo.
- Repetir desprotecção Fmoc com 2 ml de solução de piperidina e agita-se durante 15 min à temperatura ambiente. Escorra a solução como antes.
- Lava-se a resina por adição de 2 ml de DMF e a mistura da resina durante 30 seg. Escorra o DMF e repita três vezes mais.
- Para a acetilação, adicionar 1 ml de uma solução de ácido bromoacético (0,6 M em DMF) e 0,2 ml de N, solução de diisopropilcarbodiimida N '(DIC, 50% em DMF v / v). Deixar vaso de reacção a agitar durante 20 min à temperatura ambiente. Drenar a solução e lava-se a resina com 2 ml de DMF três vezes.
- Para o deslocamento, adicionar 1 ml de uma solução de amina (1,5 M em DMF). Agitar a resina durante 60 minutos à temperatura ambiente. Drenar a solução e lava-se a resina com 2 ml de DMF três vezes.
- Para adicionar um monômero do tipo arginina, siga o passo 1.7. Dependendo da sequência desejada peptóide, aminas diferentesserá adicionado.
- Repita os passos 1.1.4 e 1.1.5.
- Para incluir um monómero funcionalizado de guanidina (isto é, N Arg), adicionar 1 ml de uma solução de diamina não protegida (1,5 M no seio de DMF) à resina e agita-se durante 60 min à temperatura ambiente.
- Drenar a solução e lava-se a resina com 2 ml de DMF três vezes.
- Adicionar 2-acetyldimedone (0,2 g, 1 mmol em 0,5 mL de DMF, 10 equivalentes) para adicionar o grupo Dde para a amina primária livre e agitar por 60 min à temperatura ambiente. Drenar a solução e lava-se a resina com 2 ml de DMF três vezes.
- Continuar a síntese submon�ero como em 1.1.4 a 1.1.7 até que a sequência desejada é feita. Adicionar 2 ml de DMF para se lavar a resina e repetir três vezes.
- Para desproteger o grupo Dde em resina, adicionar solução de hidrazina 4 ml de 2% (em DMF v / v) e agita-se durante 3 minutos à temperatura ambiente. Escorra a solução e repita três vezes.
- Drenar a solução e lava-se a resina com 2 ml de DMF três times.
- Adicionar pirazole-1-carboxamidina (6 equivalentes por amina livre, ou seja, por monómeros N Arg, no volume mínimo de DMF) e N, N-diisopropiletilamina ou DIPEA (6 equivalentes por amina livre) e agitar à temperatura ambiente durante 60 min .
- Drenar a solução e lava-se a resina com 2 ml de diclorometano três vezes. Deixar a resina a secar ao ar durante 10 min, em seguida, a resina pode ser armazenado até clivagem (secção 2).
- Para interromper a síntese, lava-se a resina com 2 ml de DMF três vezes. Adicionar 2 ml de DMF, tapar o vaso de síntese e deixar à temperatura ambiente numa hotte.
NOTA: A síntese pode ser pausado depois (podem ser formadas, exceto o segundo passo deslocamento como dicetopiperazinas) qualquer fase de deslocamento.
- A desprotecção da cadeia lateral e clivagem a partir da resina
- Realizar um cleave de teste para verificar o progresso da síntese (pureza e massa) em qualquer ponto durante a síntese após o displaetapas de cimento, adição ou remoção dos grupo protectores Dde ou depois da sequência final tenha sido feita.
- Transferir cerca de 10 pérolas de resina do recipiente de reacção para um novo cartucho de filtro de vidro sinterizado 8 ml de polipropileno.
- Adicionar 1 ml de cocktail de clivagem de ácido trifluoroacético (contendo 95% de TFA, 2,5% de H2O, 2,5% de triisopropilsilano) e agitar durante 90 min à temperatura ambiente.
- Filtra-se o cocktail de clivagem de TFA da resina utilizando o vaso de reacção de vidro sinterizado de 10 ml em frasco de fundo redondo.
- Evapora-se o cocktail de clivagem utilizando um evaporador rotativo e redissolver o óleo resultante em 1 ml de acetonitrilo / água para a apresentação de LC-MS ou HPLC analítica.
- Para a clivagem final: no mesmo cartucho de frita de polipropileno de reacção utilizado para a síntese, adicionar 4 ml de cocktail de TFA a clivagem (95% de TFA, 2,5% de H2O, 2,5% de triisopropilsilano) e cobrir o recipiente. Agitar por 90 min à temperatura ambiente.
- th filtroe TFA cocktail de clivagem a partir da resina utilizando o vaso de reacção de vidro sinterizado de 50 ml em frasco de fundo redondo.
- Evapora-se o cocktail de clivagem utilizando um evaporador rotativo. Após o TFA foi removido, o produto deve ser obtido na forma de um óleo. Para facilitar a remoção de TFA a partir deste óleo em bruto, adiciona-se éter dietílico anidro e 2 ml da peptóide deve precipitar.
- De qualquer remover o éter dietílico através de uma pipeta e desfazer-se ou evapora-se utilizando um evaporador rotativo. Repita éter dietílico a precipitação três vezes.
- Dissolve-se o peptóide em bruto em 10 ml de solução de acetonitrilo / água acidificada (50% de acetonitrilo, 0,1% de TFA em água v / v). Transferir para um recipiente pré-pesado, congelar a 20 ° C e liofilizar para um pó seco.
- Realizar um cleave de teste para verificar o progresso da síntese (pureza e massa) em qualquer ponto durante a síntese após o displaetapas de cimento, adição ou remoção dos grupo protectores Dde ou depois da sequência final tenha sido feita.
2. Purificação e Caracterização
NOTA: A síntese peptóide pode ser monitorizado e o último peptóide avaliada através de fase reversa HPLC analítica utilizando uma coluna C18 e Elespectrometria ectrospray-cromatograf ia líquida de massa (LC-MS). Todos os solventes de HPLC de solventes para LC-MS deve ser preparada.
- CLAP analítica
- Pesar 1 mg de peptóide num pequeno frasco de vidro. Adicionar o volume mínimo de acetonitrilo para dissolver e dilua para 1 ml com água. Certifique-se de que o peptóide se ter dissolvido completamente.
- Injectam-se 10 uL para HPLC analítica (gradiente sugeriu 0 - 100% de solvente B ao longo de 30 minutos, onde o solvente A = 95% água, 5% acetonitrilo, 0,05% de TFA e o solvente B = 95% acetonitrilo, 5% de água, 0,03% de TFA) , de acordo com as instruções do fabricante.
- Visualizar espectro de UV a 220 nm.
- ESI CL-EM
- Adicione uma solução peptóide mg / ml, tal como no passo 2.1.1.
- Injectar 1 ul de electropulverização LC-MS para determinar se o peso molecular do peptóide alvo está presente, utilizando as instruções do fabricante.
- Verifique a massa alvo da sequência pept�de usando um Peptcalculadora oid, conforme instruções da calculadora. 26 Este utilitário web também permite a atribuição de quaisquer exclusão / produtos de adição visto no espectro de massa 26.
- HPLC de fase inversa preparativa
- Dissolver pept�des bruto em 2 ml de água acidificada / acetonitrilo (95% água, 5% de MeCN, 0,1% de TFA) e purifica-se por RP-HPLC preparativa utilizando o protocolo do fabricante. Determinar o gradiente por o tempo de eluição obtido a partir de HPLC analítica e a quantidade injectada irá depender das dimensões da coluna.
- Visualizar usando um detector ajustado a 220 nm.
- Recolha fracções em tubos de 15 ml de centrífuga, congelar a 20 ° C e liofilizar.
- Re-analisar fracções utilizando LC-MS e HPLC analítico de acordo com o protocolo do fabricante. Reunir em fracções purificadas.
3. Teste Biológica contra a Leishmania mexicana Parasitas
Caução:. As avaliações de segurança deve ser realizada antes de iniciar a síntese de Leishmania mexicana é classificada um perigo grupo 2 patógeno no Reino Unido e medidas de controlo adequadas devem estar no local antes de iniciar o teste. Todo o trabalho deve ser realizado numa câmara de segurança microbiológica classe 2 e equipamento de protecção individual adequado usado como adequadas (ou seja, luvas de borracha nitrílica, óculos de segurança e uma bata de laboratório).
- Subcultura de parasitas
- Descongelar 1 ml de -150 ° C estoque congelada Leishmania mexicana M379 colocando frasco num banho de água a 37 ° C durante 30 seg.
- Transferir a solução de reserva a 10 ml de meio de insecto de Schneider (a pH 7,0 suplementado com 15% de soro bovino fetal inactivado por calor e 1% de penicilina / estreptomicina) num balão de cultura de 25 centímetros de células 3 com uma tampa não-ventilada.
- Incubar a 26 ° C durante 72 h.
- Examine parasitas sob o microscópio (aumento de 400X) para verificar a condição. ºey deve ser promastigotas estágio de insetos, as formas procíclica em fase log com muitas células em divisão.
- Manter promastigotas procíclicos por parasitas sub-cultura a uma concentração de 5 x 10 5 parasitas / ml a cada três dias. Contagem de células utilizando um hemocitómetro de Neubauer melhorada.
- Transformação de L. mexicana estágio inseto em forma amastigota de mamíferos estágio axênico 27
- Dia 0: Preparar 10 ml de cultura de parasitas de fase log em 5 x 10 5 parasitas / ml em meio de insecto de Schneider (a pH 7,0 suplementado com 15% de calor-inactivado de soro fetal bovino e 1% de penicilina / estreptomicina) num três células 25 centímetros frasco de cultura com uma tampa não ventilada.
- Incubar a 26 ° C durante 48 h.
- Dia 3: Transferir 10 ml de cultura para um tubo de centrífuga de 50 ml e centrifugar a 447 xg durante 5 min.
- Deitar fora meio antigo e adicionar 10 ml de meio Insect da Schneider (pH 5,5 suplementado com 20% hcomer inactivado de soro fetal bovino e 1% de penicilina / estreptomicina). Suavemente ressuspender o sedimento de parasitas no novo meio utilizando uma pipeta.
- Contar o número de parasitas, utilizando uma melhoria hemocitômetro Neubauer. Dilui-se a uma concentração de 5 x 10 5 parasitas / ml, com pH 5,5 e meio de transferência para um frasco de cultura de 25 centímetros de células 3.
- Incubar a 26 ° C durante aproximadamente 6 dias.
- Dia 9: Examine parasitas sob um microscópio (400X). Eles devem estar no não-replicante, fase de promastigote infeccioso metacíclica.
- Contar o número de parasitas, utilizando uma melhoria hemocitômetro Neubauer. Dilui-se a uma concentração de 5 x 10 5 parasitas / ml com meio de pH 5,5.
- Retirar 10 ml de cultura de células e transferir para um frasco de cultura de células. Incubar a 32 ° C durante 5 dias.
- Dia 14: Verifique aparecimento de parasitas sob o microscópio (400X). Eles devem estar na fase de amastigote patogénico, sem o carácter flageloistic de promastigotas, e pronto para o ensaio.
- Ensaio de citotoxicidade em L. mexicana amastigotas axênicas.
NOTA: O teste biológico dos pept�des utiliza ensaios de alto rendimento realizados em placas de 96 poços. Este protocolo descreve o ensaio de L. mexicana amastigotas axênicas, mas ensaios idênticos também podem ser realizadas sobre os parasitas fase promastigotas em meio adequado. Os compostos são incubados com parasitas em concentrações a partir de 3 - 100 uM durante 60 min e, em seguida, incubadas durante 24 horas na sequência de uma diluição de 10 vezes. Os resultados são obtidos através da medição da fluorescência dos poços após a incubação com a solução de viabilidade celular baseado em Resazurina (por exemplo, alamarBlue).- Preparar soluções de reserva dos compostos. Pesar 1 mg do produto peptóide final purificado utilizando uma balança analítica. Adicionar o volume apropriado de sulfóxido de dimetilo de grau de biologia molecular (DMSO) a uma concentração de 5 mM. Faça 6 mL alíquotas econgelar a -20 ° C.
- Preparar soluções de compostos em placas de 96 poços (de uma placa de layout recomendada pode ser visto na secção de resultados, a Figura 6), em triplicado, 100-3 uM. Adicionar 2 ml de solução de estoque de 5 mM de cada composto da linha superior (isto é, A). Adicionar 48 ul de meio de insecto de Schneider fresco (a pH 5,5 e soro de bovino fetal a 20% (FBS), 1% de penicilina / estreptomicina (P / S)) a linha superior, utilizando uma pipeta multi-canal. Adicionar 25 ul meio de insecto de Schneider para todas as outras linhas (B - F).
- Realizar uma diluição em série por pipetagem 25 solução ul a partir da linha superior. Adicione a linha abaixo e misture. Efectuar diluições até a última fila, onde a última solução de 25 ul deve ser descartado.
- Use anfotericina B (5 mM de stocks) como um controlo positivo e DMSO (solução 2%) como um controlo negativo em triplicado.
- Preparar a solução parasita: cultura da transferência para um tubo de centrífuga de 50 ml e centrifugar a447 xg durante 5 min. Decantar meio antigo e adicionam-se 10 ml de meio de Schneider Insecto (a pH 5,5 e 20% de FBS, 1% de P / S).
- Suavemente dissolver o sedimento de parasitas no novo meio utilizando uma pipeta e contagem usando um hemocitómetro de Neubauer melhorada. Dilui-se a cultura a 8 x 10 6 parasitas / ml.
- Adicionar 25 ul L. Mexicana cultura a cada poço. Incubar as placas durante 60 min a 32 ° C.
- Remova a placa do incubador e remover a solução de 40 ul de cada poço.
- Adicionar 90 ul de meio fresco e incuba-se durante 24 h a 32 ° C.
- Adicionar 10 ul de solução de viabilidade celular baseado em Resazurina a cada poço. Incuba-se durante 4 h a 32 ° C.
- Medir a fluorescência utilizando um leitor de placas (ex λ = 540 nm, em = λ 600 nm), de acordo com as instruções do fabricante. Analisar os dados através da remoção de fundo médio (a partir de meio apenas poços) e comparando a fluorescência dos poços após a normalização em relação a tele DMSO controlos.
Resultados
Como um resultado representativo, a síntese e a caracterização de duas 12 pept�des resíduo contendo dois monómeros do tipo de lisina e arginina do tipo de dois monómeros de cada um serão descritas. Os resultados de ensaio de citotoxicidade subsequentes também são mostrados.
Dois peptóides [(N Narg N SPE N SPE) (N AE N SPE N SPE)] 2 (a) e [(hArg N SPE N SPE N) (N Lys N SPE N SPE)] 2 (b) foram sintetizados usando 120 mg de resina de Rink amida cada (carga = 0,79 mmol / g). Todos os passos de acetilação e de deslocamento foram realizados como descrito acima, com todos os reagentes adquiridos comercialmente. Para estes resíduos, as seguintes aminas foram usadas na fase de deslocamento: N SPE (S) - (-) - α-metilbenzilamina, N AE N - (terc-butoxicarbonil) -1,2-diaminoethane, N Lys N - (terc-butoxicarbonil) -1,4-diaminobutano. Para os resíduos derivado de arginina, as seguintes diaminas não protegidos foram acoplados: N hArg 1,4-diaminobutano ou N Narg 1,2-diaminoetano, seguido de protecção sobre resina com 2-acetyldimedone (Dde-OH). Depois de toda a sequência ter sido sintetizado, hidrazina desprotecção do Dde produz aminas livres nos guanidinylate.
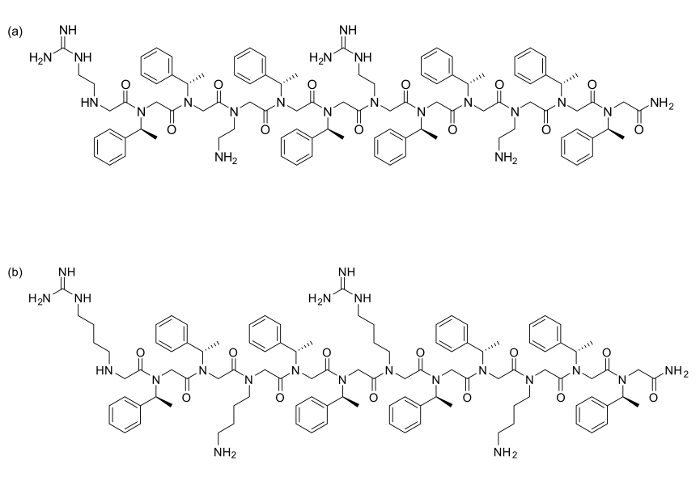
Figura 1. peptóide estruturas (a) [(N Narg N N SPE SPE) (AE N N N SPE SPE)] 2 e (b) [(N hArg N N SPE SPE) (N ng> Lys N spe N spe)] 2. Por favor clique aqui para ver uma versão maior desta figura.
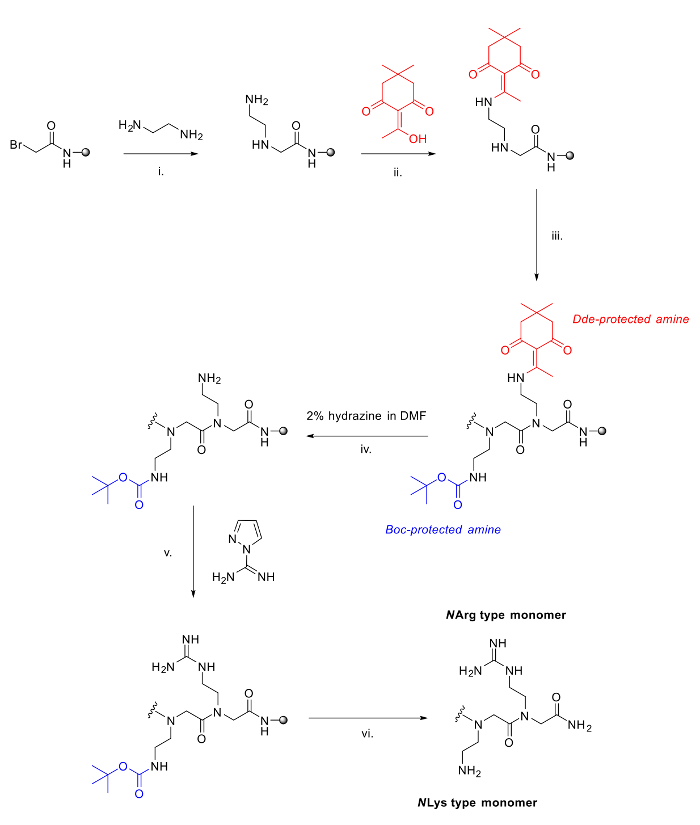
Figura 2. O método utilizado para sintetizar pept�des arginina / lisina mistos. I. etapa deslocamento padrão no método submon�ero com diamina; II. A adição de DDE-oh, 90 minutos para proteger amina livre; III. Mais adições para estender a cadeia peptóide usando o método submon�ero; IV. A desprotecção de Dde utilizando 2% de hidrazina em DMF; V. Guanidinylation de amina livre na resina com pirazole-1-carboxamidina e DIPEA em DMF; vi. clivagem ácida da resina e desprotecção de grupos Boc.large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
A seguir à clivagem a partir da resina e liof ilização, os produtos em bruto foram obtidos na forma de pós brancos: (a) 154 mg, (b) 163 mg. Os produtos foram purificados por meio de RP-HPLC, tal como descrito com um máximo de 50 mg injecções usando uma bomba de cromatografia líquida, com um detector de UV-VIS (λ = 250 nm) numa coluna analítica, 250 mm x 10 mm, 5 mm; caudal = 2 ml / min. As fracções correspondentes à massa alvo foram combinadas e obtido na forma de pós brancos: (a) 54 mg (b) 65 mg, rendimento final de aproximadamente 30% para as fracções> 90% puros.
As identidades composto final, depois da purificação foram confirmados por LC-MS (ver Figura 3), utilizando um espectrómetro de massa de quadrupolo triplo equipado com um UPLC e um detector de arranjo de fotodiodos. espectrometria de massa exata foi realizada usando o mesmo espectrómetro em t ele [M + 2H] 2+. A seguir, calculado e massas observadas foram encontrados em estreita concordância (Figura 4): (a) calculado = 896,0026 amu, observado = 896,0038 amu; (B) calculado = 952,0691 amu, observado = 952,0730 amu.
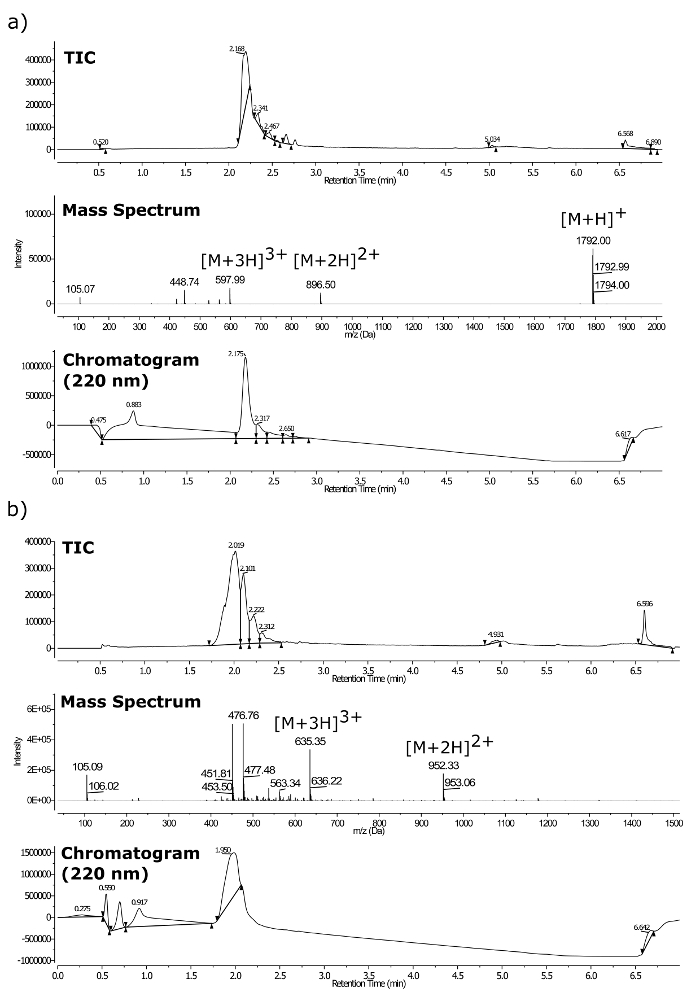
Figura 3. LC-MS para pept�des purificadas. (A) m / z = 1792 e (b) m / z = 1903. Onde o topo é TIC, meio espectro de LC-MS, cromatograma UV inferior a 220 nm. Por favor clique aqui para ver uma versão maior desta figura.
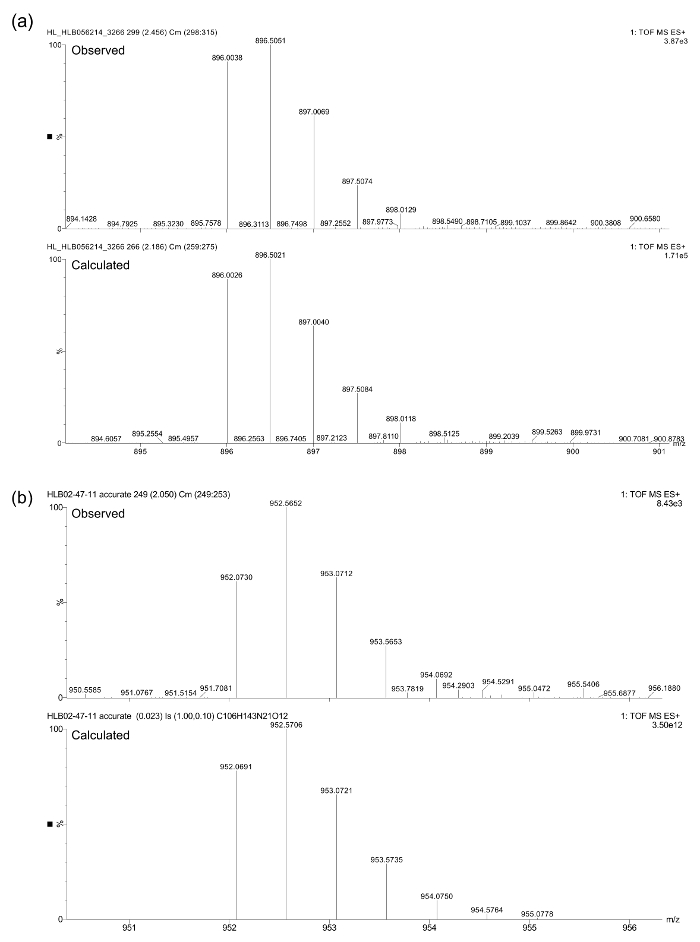
Figura 4. Dados de espectrometria de massa precisas para peptóides (a) e (b)."Https://www.jove.com/files/ftp_upload/54750/54750fig4large.jpg" target = "_ blank"> Clique aqui para ver uma versão maior desta figura.
A pureza do produto foi avaliada utilizando um RP-HPLC (Bomba LC com um detector de UV-vis numa coluna analítica, 4,6 mm x 100 mm, 3,5 uM; taxa de fluxo = 1 mL / min) analítica, e visualizados a 220 nm, a absorvância amida do esqueleto. a Figura 5a e 5b mostra que os compostos são homogéneas.
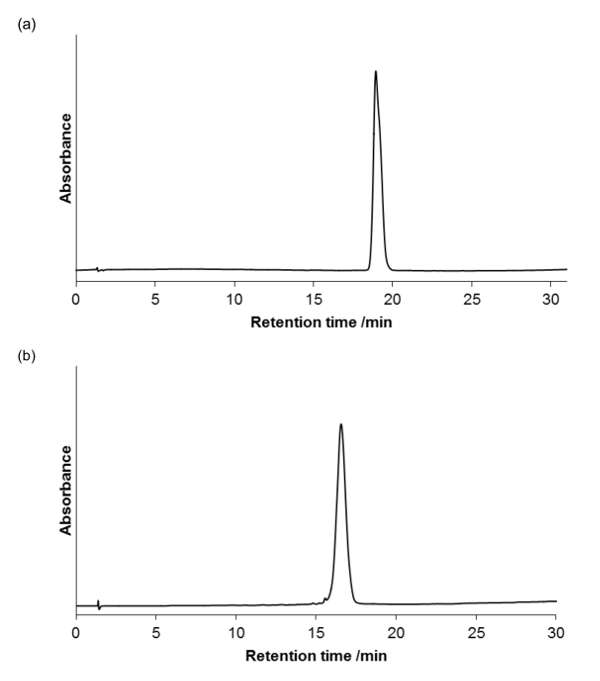
Figura 5. HPLC analítica para os pept�des purificados (a) e (b). Existe um gradiente de 0-100% de B ao longo de 30 minutos, forno de coluna a 40 ° C (A = 95% de H2O, 5% de MeCN, 0,05 % de TFA;. B = 95% de MeCN, 5% de H 2 O, 0,03% de TFA) Por favor click aqui para ver uma versão maior desta figura.
Os peptóides purificados (A) e (B) foram testadas em ensaios de citotoxicidade contra L. mexicana amastigotas axênicas. Reservas congeladas de L. Mexicana foram descongelados e transformado para o estádio de amastigote pronto para o ensaio. 72 horas após o descongelamento, os parasitas deve ser promastigotas estágio de insetos em sua forma pró-cíclica, em fase log com muitas células em divisão. Nesta fase, o parasita pode ser transformado no estádio de amastigote usando a mudança de pH e temperatura descrito. 27 No dia 9 da transformação, os parasitas se na fase de promastigote infeccioso metacíclica não replicantes. Finalmente, no dia 14, os parasitas deve estar na fase de amastigote patogénico parasitas onde falta a característica dos flagelos promastigotas 28.
Soluções reserva 5 mM dos compostos foram feitas em DMSO de grau de cultura de células e testado em triplicado sobreum mínimo de duas ocasiões, para assegurar um conjunto de dados robusto foi recolhido. Um plano de placa de 96 poços representativo é mostrado na Figura 6. No final do ensaio, o reagente de viabilidade celular foi adicionado a cada poço e a fluorescência foi medida como descrito para calcular a viabilidade dos parasitas em cada concentração ensaiada (ver Figura 7 ). Os valores de ED50 foram calculados como peptóide (a)> 100 uM e peptóide (b) 37 uM, respectivamente. As barras de erro plotados, mostram a variação entre os poços como um desvio padrão e pode ser visto que estes são razoáveis para a maioria das barras.
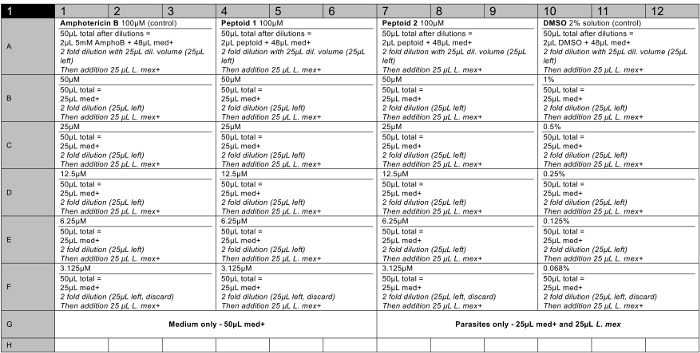
Figura 6. 96 representativas plano de placa bem para um ensaio de citotoxicidade em 2 pept�des soluções (incluindo os controlos positivos e negativos). Med + = médio (Insecto meio de Schneider, pH 5,5, 20% de FBS, 1% de P / S). L. mex. =8 x 10 6 / ml cultura parasita no med +. AmphoB = 5 mM em DMSO. solução de pept�de = 5 mM em DMSO. Poços vazios devem conter água estéril. Por favor clique aqui para ver uma versão maior desta figura.
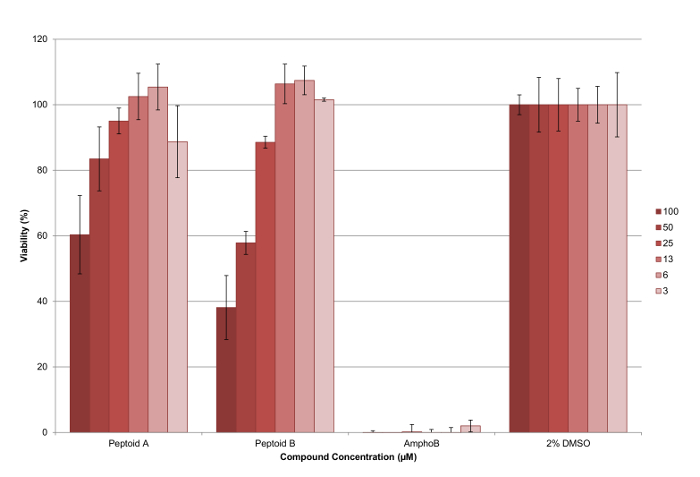
Figura 7. Resultados do ensaio de citotoxicidade contra L. mexicana axénica parasitas amastigotas usando peptóide (a) e (b). Pode ser visto que o peptóide (b) é mais eficaz do que peptóide (a) a redução da percentagem de parasitas viáveis, com ambos os compostos tendo um efeito dependente da dose. As barras de erro plotados mostram a variação entre os poços como um desvio padrão. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Peptóides estão cada vez mais a ser estudados na biologia química e campos de química medicinal em aplicações tais como novas terapias 3-5, agentes de entrega de células 18,20 e ferramentas de diagnóstico. 29 Tipicamente, estas sequências são catiónico para proporcionar um grau de selectividade para o agente patogénico sobre células de mamíferos, a capacidade de penetrar através das membranas celulares e também ajudar a solubilidade em sistemas aquosos. Existem inúmeros exemplos de peptoids catiônicos que contêm resíduos exclusivamente lisina- ou arginina-mimética na literatura. No entanto, até à data, a síntese de peptóides que contêm ambos estes resíduos catiónicos na mesma sequência tem sido dificultada pela falta de um processo de síntese adequado. O protocolo aqui descrito permite pept�des catiónicos mistos a ser sintetizado de uma maneira eficiente e é altamente desejável, uma vez que oferece uma via para modular as propriedades biológicas e químicas do pept�des anfipáticos.
nt "> O nosso método utiliza uma adaptação à síntese peptóide submon�ero comumente utilizados e permite a adição de ambos os monómeros de lisina- e do tipo arginina dentro da mesma sequência. Ela usa acoplamentos temperatura ambiente e estabeleceu protector da química do grupo assim prevê-se que este método irá ser útil para a maioria dos grupos de pesquisa. para adicionar protecção ortogonal para o resíduo de tipo arginina, uma diamina não protegida é adicionada sob condições padrão de deslocamento e, em seguida, protegida num acoplamento de 60 minutos com Dde-OH. uma variedade de diaminas podem ser utilizada que permite que as cadeias laterais de dois carbonos a 6 carbonos de comprimento ser instalado, ou seja, 1,2-diaminoetano, a 1,6-diamino-hexano respectivamente. a protecção Dde-OH dissolve bem em DMF e é um grupo de protecção muito eficaz e selectivo para aminas primárias. o grupo de protecção Dde-aminas secundárias folhas inalteradas, por exemplo, o terminal N desprotegido da cadeia peptóide. 30 Uma limitação é que todo o syntese foi realizada manualmente; No entanto, antecipa-se que as condições de acoplamento desenvolvido tornar o método favorável para uso com o péptido / sintetizadores automatizados pept�des.A resina na desprotecção dos grupos Dde é realizado utilizando-se uma solução de hidrazina a 2% em DMF para deixar aminas livres que podem ser guanidinylated na resina utilizando pirazole-1-carboxamidina. Seis equivalentes do pirazole-1-carboxamidina e seis equivalentes de DIPEA são utilizados por amina livre na resina (isto é, seis equivalentes de cada tipo de monómero N Arg a ser instalada). Mais uma vez, esta reacção também é eficiente e o reagente de pirazole-1-carboxamidina tem boa solubilidade em DMF. A conclusão da reacção é normalmente visto através de LC-MS depois de 60 minutos à temperatura ambiente.
Devido à versatilidade do método do submon�ero, uma ampla variedade de aminas primárias pode ser utilizado no passo de deslocamento de modo que as condições podem necessitar de ser optimizado para aumentar a efi acoplamentoeficiência e rendimentos globais de produtos ou pureza. 31 Para as sequências discutidas acima, há condições especiais eram necessárias para acoplamentos bem sucedidos. No entanto, tempos mais longos de deslocamento ou concentrações mais elevadas de amina pode ser utilizado para deslocamentos problemáticos (isto é, para aminas estericamente volumosos nucleofílicos ou mal). Algumas aminas podem não ser completamente solúveis em DMF, caso em que é recomendado para os dissolver em N-metil-2-pirrolidona (NMP), ou outros solventes adequados para as reacções em fase sólida, em vez de em um método para a síntese anterior abrangente submon�ero de peptóides. 32 para incorporar monómeros que contêm heteroátomos não protegidos nas cadeias laterais, acetilação utilizando ácido cloroacético tem sido mostrado para ser eficaz por outros grupos. 33 Adicionalmente, outras resinas podem ser utilizadas com este método para se obter pept�des com diferentes funcionalização do terminal C. Wang resinas e resinas de cloreto de 2-clorotritilo são rotineiramente utilizados nasubmon�ero síntese de peptóides. Por exemplo, este método tem sido usado com sucesso com resina de cloreto de 2-clorotritilo no nosso grupo. 2 diferentes suportes sólidos irá exigir um procedimento de carga diferente de Rink amida discutidos aqui (dependente da resina específica utilizada) de modo que este deve ser verificado com a literatura antes da síntese.
Semelhante a síntese de péptidos, as condições para a clivagem final da resina peptóide fora também pode ser optimizado para a sequência específica. Neste protocolo, um cocktail de clivagem TFA foi utilizado (com triisopropilsilano e água como catadores). Os peptoids aqui apresentados continha apenas protecção Boc que é um grupo lábil razoavelmente ácido. Para assegurar a desprotecção completa das sequências com uma maior proporção de resíduos de ácido protegido ou menos grupos de protecção lábil, os tempos de clivagem mais longos podem ser necessários (isto é, os tempos de clivagem em excesso de 2 horas são recomendados para sequências que contêm Pbf ou terc-buéster Tyl grupos protegidos). sequestrantes alternativos também podem ser usados para as cadeias laterais especializadas (por exemplo, de etanoditiol ou de 2-mercaptoetanol são muitas vezes utilizados em péptidos que têm cadeias laterais contendo enxofre tais como a cisteína ou metionina).
O ensaio biológico é apresentado um ensaio de citotoxicidade padrão que pode ser alterado para se adequar a diferentes linhas celulares. É importante notar que cada placa de 96 poços deverão conter controlos suficientes para permitir que a confiança nos resultados obtidos. Neste caso, a anfotericina B é utilizado como um controlo positivo, uma vez que é uma droga conhecida utilizada para tratar a doença e DMSO é usado como um controlo negativo como este é o solvente usado para fazer reservas de composto para o ensaio. Se outras linhas de células estão a ser utilizados, os controlos adequados, alternativos deve ser obtida e validada antes da utilização. L. Mexicana é incubada com o peptóide a concentrações entre 100 e 2 ^ M, durante uma hora, e, em seguida, a solução parasita / peptóide é diluída pelaum factor de dez para incubação durante a noite (isto é, os poços inicialmente com 100 uM da peptóide são diluídos para 10 | iM).
O reagente de viabilidade de células são adicionados a cada poço (10% do volume total do bem) no final do ensaio. Uma mudança de cor visível é visto entre poços com parasitas viáveis (rosa), os poços de controlo sem parasitas viáveis (azul) e um espectro entre com os números intermédios de parasitas viáveis. A fluorescência é proporcional ao número de células vivas e corresponde à actividade metabólica das células; resazurina corante (não fluorescente) é convertido para o fluorescente resorufina por meio de reacções de redução nas células metabolicamente activas. 34 Neste ensaio, o tempo de incubação com o reagente de viabilidade celular foi optimizado para L. mexicana. Os tempos de incubação com o reagente de viabilidade variará para placas semeadas em concentrações de células diferentes ou com diferentes linhas de células (por exemplo, este método também pode ser usadocom células de mamíferos). Dependendo do leitor de placas exacta utilizada, considerações devem ser feitas antes das medições de fluorescência são tomadas. Quaisquer bolhas de ar em cavidades deve ser removida para garantir leituras precisas podem ser tomadas. Alguns leitores de placas de ler a partir do fundo de placas, no qual caso de fundo plano de 96 placas de poços devem ser usados. Outras máquinas podem ler a partir do topo da placa, de modo que a tampa da placa deve ser removida antes da medição.
Finalmente, no futuro, este protocolo pode ser compatível com sintetizadores automatizados que são capazes de fazer muitas sequências em paralelo. Além disso, a síntese de peptóides cíclicos também é possível, utilizando este método. Este protocolo deve fornecer aos pesquisadores um procedimento sintético prático que pode ser usado para acessar novos scaffolds pept�des com ambos os monómeros lisina- e do tipo arginina, que podem ser de uso em muitas aplicações, incluindo materiais ou campos medicinais.
Divulgações
The authors have nothing to disclose.
Agradecimentos
Agradecemos ao Conselho de Engenharia e Ciências Físicas Research (EPSRC) para apoio financeiro (HLB). Agradecemos também Sridevi Maalika Ramanoudjame por sua assistência durante as filmagens deste procedimento.
Materiais
| Name | Company | Catalog Number | Comments |
| Polypropylene solid phase extraction cartridges with two frits | Crawford Scientific | 12131017 and 12131015 | 20 ml and 6 ml cartridges used in this preparation |
| Trifluoroacetic acid | Tokyo Chemical Industry (Europe) | T0431-100g | >98%; CAUTION: can cause severe burns and respiratory irritation |
| N,N'-diisopropylcarbodiimide | Sigma Aldrich | 38370-100ML | >98%; CAUTION: hazardous to eyes, skin and via respiratory inhalation, may also cause sensitisation |
| Dimethylformamide | Fischer Scientific | 10346180 | HPLC grade; CAUTION: suspected teratogen |
| Acetonitrile | Fischer Scientific | 10407440 | HPLC grade |
| Dichloromethane | Fischer Scientific | 10354263 | 99.8%; CAUTION: suspected carcinogen |
| Bromacetic acid | Sigma Aldrich | 17000-100G | >99%; CAUTION: causes burns and hazardous to skin, eyes and respiratory tract |
| (S)-(-)-alpha methylbenzylamine | Sigma Aldrich | 115568-100G | 98%; CAUTION: harmful if swallowed, toxic in contact with skin, causes severe skin burns and eye damage, used to synthesise the Nspe monomer |
| N-Boc 1,4-diaminobutane | Tokyo Chemical Industry (Europe) | A1373-25g | >98%; CAUTION: causes severe skin burns and eye damage, used to synthesise the NLys monomer |
| N-Boc 1,2-diaminoethane | Tokyo Chemical Industry (Europe) | A1371-25g | >97%; CAUTION: causes severe skin burns and eye damage, used to synthesise the Nae monomer |
| 1,2-diaminobutane | Sigma Aldrich | D13208-100G | 99%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NhArg monomer |
| 1,4-diaminoethane | Sigma Aldrich | 03550-250ML | >99.5%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NnArg monomer |
| 1H-pyrazole-1-carboxamidine HCl | Sigma Aldrich | 402516-10G | as HCl salt; CAUTION: harmful if swallowed and may cause an allergic skin reaction, causes serious eye damage |
| Hydrazine monohydrate | Sigma Aldrich | 207942-5G | reagent grade; CAUTION: suspected carcinogen, fatal if inhaled and causes severe burns to skin and eyes |
| 2-acetyl dimedone | Novabiochem | 8510150005 | Dde-OH |
| Rink Amide resin | Novabiochem | 8551190005 | 100-200 mesh, high loading |
| Piperidine | Sigma Aldrich | 411027-1L | >99.5%, a controlled substance, so adequate permission must be obtained before purchase; CAUTION: highly flammable liquid and vapour, harmful if swallowed and toxic in contact with skin or if inhaled, causes severe skin burns and eye damage, harmful to aquatic life with long lasting effects |
| Triisopropylsilane | Sigma Aldrich | 233781-50G | 98%; CAUTION: flammable liquid and vapour, causes skin irritation and serious eye irritation |
| alamarBlue | ThermoFischer | DAL1025 | Not classified as hazardous |
| Schneider's Insect Medium | Sigma Aldrich | S9895-1L | Powdered, medium must be made prior to use following manafacturers instructions; allow to warm to room temperature before use in biological assays |
| 96 well plates | VWR | 734-1793 | Flat bottom (to allow fluorescence measurement from the bottom), tissue-culture treated |
| Solvent reservoirs | VWR | 613-1182 | Used with multi channel pipette |
| Multi channel pipette | Eppendorf | 3122000043 | |
| Pipette tips | Starlab Group | S1111-3810, S1113-1810, S1111-6810 | Volume of tip dependent on pipette used. 10 µl, 10 - 200 µl and 1,000 µl recommended for assays |
| 25 cm3 cell culture flasks | VWR | 734-2312 | |
| 50 ml centrifuge tubes | VWR | 525-0791 | |
| dimethylsulphoxide (molecular biology grade) | Sigma Aldrich | D8418-50ML | Not classified as hazardous |
| Heat Inactivated Fetal Bovine Serum | ThermoFischer | 10082139-100mL | Gibco |
| Penicillin/Streptomycin | ThermoFischer | 15140148-20mL | Abbreviation: P/S |
| Amphotericin B | Sigma Aldrich | 46006-100mg | Amphotericin B trihydrate, VetranalTM analytical standard |
Referências
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids oligo(N-substituted glycines) by submonomer solid-phase synthesis. J. Am. Chem. Soc. 114, 10646-10647 (1992).
- Bolt, H. L., Cobb, S. L. A practical method for the synthesis of peptoids containing both lysine-type and arginine-type monomers. Org. Biomol. Chem. 14, 1211-1215 (2016).
- Mojsoska, B., Zuckermann, R. N., Jenssen, H. Structure-activity relationship study of novel peptoids that mimic the structure of antimicrobial peptides. Antimicrob Agents Chemother. , (2015).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc. Natl. Acad. Sci. USA. 105, 2794-2799 (2008).
- Eggimann, G. A., Bolt, H. L., Denny, P. W., Cobb, S. L. Investigating the Anti-leishmanial Effects of Linear Peptoids. Chem Med Chem. 10, 233-237 (2015).
- Kapoor, R., et al. Antimicrobial Peptoids Are Effective against Pseudomonas aeruginosa Biofilms. Antimicrob. Agents Chemother. 55, 3054-3057 (2011).
- Ryge, T. S., Frimodt-Moller, N., Hansen, P. R. Antimicrobial activities of twenty lysine-peptoid hybrids against clinically relevant bacteria and fungi. Chemotherapy. 54, 152-156 (2008).
- Huang, M. L., Benson, M. A., Shin, S. B. Y., Torres, V. J., Kirshenbaum, K. Amphiphilic Cyclic Peptoids That Exhibit Antimicrobial Activity by Disrupting Staphylococcus aureus Membranes. Eur. J. Org. Chem. , 3560-3566 (2013).
- Huang, M. L., Shin, S. B. Y., Benson, M. A., Torres, V. J., Kirshenbaum, K. A Comparison of Linear and Cyclic Peptoid Oligomers as Potent Antimicrobial Agents. Chem Med Chem. 7, 114-122 (2012).
- Bolt, H. L., Eggimann, G. A., Denny, P. W., Cobb, S. L. Enlarging the Chemical Space of Anti-leishmanials: a Structure-Activity Relationship Study of Peptoids against Leishmania mexicana, a Causative Agent of Cutaneous Leishmaniasis. Med Chem Comm. , (2016).
- Chon, S. Y., et al. Antibiotic overuse and resistance in dermatology. Dermatologic therapy. 25, 55-69 (2012).
- Alvar, J., et al. Leishmaniasis Worldwide and Global Estimates of Its Incidence. PLOS ONE. 7, (2012).
- Croft, S. L., Barrett, M. P., Urbina, J. A. Chemotherapy of trypanosomiases and leishmaniasis. Trends Parasitol. 21, 508-512 (2005).
- Kedzierski, L. Leishmaniasis Vaccine: Where are We Today?. J Global Infect Dis. 2, 177-185 (2010).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug resistance in leishmaniasis. Clin Microbiol Rev. 19, 111-126 (2006).
- Huang, W., et al. Learning from Host-Defense Peptides: Cationic, Amphipathic Peptoids with Potent Anticancer Activity. PLOS ONE. 9, (2014).
- Wender, P. A., et al. The Design, Synthesis, and Evaluation of Molecules That Enable or Enhance Cellular Uptake: Peptoid Molecular Transporters. Proc. Natl. Acad. Sci. USA. 97, 13003-13008 (2000).
- Schröder, T., et al. Peptoidic Amino- and Guanidinium-Carrier Systems: Targeted Drug Delivery into the Cell Cytosol or the Nucleus. J. Med. Chem. 51, 376-379 (2008).
- Kömel, D. K., et al. Cell-penetrating peptoids: Introduction of novel cationic side chains. Eur. J. Med. Chem. 79, 231-243 (2014).
- Hein-Kristensen, L., Knapp, K. M., Franzyk, H., Gram, L. Bacterial membrane activity of α-peptide/β-peptoid chimeras: Influence of amino acid composition and chain length on the activity against different bacterial strains. BMC Microbiology. 11, 1-12 (2011).
- Su, Y., Doherty, T., Waring, A. J., Ruchala, P., Hong, M. Roles of Arginine and Lysine Residues in the Translocation of a Cell-Penetrating Peptide from (13)C, (31)P and (19)F Solid-State NMR. Biochem. 48, 4587-4595 (2009).
- Andreev, K., et al. Guanidino groups greatly enhance the action of antimicrobial peptidomimetics against bacterial cytoplasmic membranes. BBA Biomembranes. 1838, 2492-2502 (2014).
- Foged, C., et al. Cellular uptake and membrane-destabilising properties of alpha-peptide/beta-peptoid chimeras: lessons for the design of new cell-penetrating peptides. BBA Biomembranes. 1778, 2487-2495 (2008).
- Vedel, L., et al. Antiplasmodial and prehemolytic activities of alpha-peptide-beta-peptoid chimeras. Chem Bio Chem. 8, 1781-1784 (2007).
- Lear, S., Cobb, S. L. Pep-Calc.com: a set of web utilities for the calculation of peptide and peptoid properties and automatic mass spectral peak assignment. J Computer-Aided Mol Des. , 1-7 (2016).
- Bates, P. A. Complete developmental cycle of Leishmania mexicana in axenic culture. Parasitol. 108, 1-9 (1994).
- Gossage, S. M., Rogers, M. E., Bates, P. A. Two separate growth phases during the development of Leishmania in sand flies: implications for understanding the life cycle. Int J Parasitology. 33, 1027-1034 (2003).
- Seo, J., Lee, B. C., Zuckermann, R. N., Ducheyne, P. . Comp Biomaterials. 2, 53-76 (2011).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde - A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Lett. 37, 2625-2628 (1996).
- Culf, A. S., Ouellette, R. J. Solid-phase synthesis of N-substituted glycine oligomers (alpha-peptoids) and derivatives. Molecules. 15, 5282-5335 (2010).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase Submonomer Synthesis of Peptoid Polymers and their Self-Assembly into Highly-Ordered Nanosheets. J Vis Exp. , e3373 (2011).
- Burkoth, T. S., Fafarman, A. T., Charych, D. H., Connolly, M. D., Zuckermann, R. N. Incorporation of unprotected heterocyclic side chains into peptoid oligomers via solid-phase submonomer synthesis. J. Am. Chem. Soc. 125, 8841-8845 (2003).
- Nakayama, G. R., Caton, M. C., Nova, M. P., Parandoosh, Z. Assessment of the Alamar Blue assay for cellular growth and viability in vitro. J Immunol Methods. 204, 205-208 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados