Method Article
Un metodo efficiente per la sintesi di peptoids con monomeri misto Lisina-tipo / Arginina-tipo e valutazione della loro attività anti-Leishmania
In questo articolo
Riepilogo
A protocol to synthesize peptoids with mixed cationic functionality in the same sequence is presented (lysine- and arginine-type monomers). Subsequent testing of these compounds against Leishmania mexicana, the protozoan parasites that cause cutaneous leishmaniasis, is also described.
Abstract
This protocol describes the manual solid-phase synthesis of linear peptoids that contain two differently functionalized cationic monomers. In this procedure amino functionalized 'lysine' and guanido functionalized 'arginine' peptoid monomers can be included within the same peptoid sequence. This procedure uses on-resin (N-(1-(4,4-dimethyl-2,6-dioxocyclohexylidene)ethyl) or Dde protection, orthogonal conditions to the Boc protection of lysine monomers. Subsequent deprotection allows an efficient on-resin guanidinylation reaction to form the arginine residues. The procedure is compatible with the commonly used submonomer method of peptoid synthesis, allowing simple peptoids to be made using common laboratory equipment and commercially available reagents. The representative synthesis, purification and characterization of two mixed peptoids is described. The evaluation of these compounds as potential anti-infectives in screening assays against Leishmania mexicana is also described. The protozoan parasite L. mexicana is a causative agent of cutaneous leishmaniasis, a neglected tropical disease that affects up to 12 million people worldwide.
Introduzione
Peptoids (o poli-N -substituted glicine) sono una classe di peptide-mimetici che offrono proprietà simili a peptidi e come tali sono sempre più oggetto di indagine per le applicazioni di medicinali e materiali. In peptidi, la catena laterale di ciascun amminoacido è collegato alla α-carbonio del backbone ammide; in peptoids le catene laterali sono spostati sul atomo di azoto del backbone. Fondamentalmente, questo dà peptoids maggiore resistenza alla proteolisi.
Peptoids sono comunemente sintetizzati con il metodo submonomer introdotta da Zuckermann et al., In cui i monomeri peptoid possono essere costruite da haloacetylation sequenziale di una funzionalità ammina attaccato ad un supporto solido e conseguente spostamento del alogene con un'ammina primaria. 1 Il nostro gruppo ha recentemente sviluppato un adattamento di questo metodo submonomer per consentire lysine- e arginina-tipo residui peptoid da inserire all'interno della stessa sequenza peptoid per la first tempo. 2 Questo manuale approccio in fase solida per peptoid sintesi utilizza reagenti commercialmente disponibili ed equipaggiamento di laboratorio, rendendolo accessibile per la maggior parte dei laboratori. Peptoids hanno dimostrato di avere attività promettenti contro una vasta gamma di batteri Gram-negativi, Gram specie batteriche e fungine positivi che sono paragonabili a molti peptidi antimicrobici conosciuti. 3-9
Nel nostro lavoro, peptoids sono stati utilizzati come composti anti-infettivi innovativi per il trattamento della leishmaniosi malattia tropicale trascurata. 5,10 leishmaniosi è endemica in più di 80 paesi in tutto il mondo e si stima che oltre 12 milioni di persone sono infettate a livello globale. Il 11 la malattia è causata da protozoi parassiti che vengono trasmessi dal morso di un sandfly. specie di Leishmania possono causare leishmaniosi cutanea, una condizione che porta a cicatrici e danni alle mucose, o la Leis viscerale pericolosa per la vitahmaniasis, che provoca danni agli organi fatale. Nessun vaccino è disponibile per questa malattia e trattamenti esistenti si basano su un piccolo numero di farmaci che hanno gravi effetti collaterali. In aggiunta, la resistenza ai farmaci esistenti è un problema emergente e serio così nuovi trattamenti sono disperatamente necessari per trattare efficacemente la leishmaniosi in futuro. 12-16
In queste applicazioni antimicrobici, peptoids sono spesso progettati per essere amphipathic con una miscela di monomeri cationici e idrofobi. 3,4 Questo può dare peptoids un grado di selettività verso cellule batteriche, ridurre la tossicità per le cellule di mammifero, e per migliorare la loro attività come trasportatori molecolari . 17-20 la maggior parte dei peptoids anti-infettivi in letteratura contengono catene laterali cationici che sono composti esclusivamente da entrambi ammino funzionalizzato monomeri lisina tipo o residui arginina-type. chimere Peptide-peptoid, dove le catene cationici sono composti da una dellamino acidi lisina o arginina, sono stati sintetizzati per esaminare l'effetto di gruppi cationici sull'attività e tossicità. 21-25
peptoids poli-lisina possono essere facilmente sintetizzati utilizzando disponibili in commercio ammine Boc-protetti. I peptoids poly-arginina, presentate può essere fatto utilizzando un metodo che utilizza pirazolo-1-carboxamidine come agente guanidinylation. 18 Tuttavia, questo può avvenire soltanto dopo l'peptoid è stato scisso dalla resina e la protezione Boc su catene laterali rimosso, così ogni lisina-tipo residuo all'interno della sequenza si trasforma in un residuo di arginina. Nel tentativo di calibrare le proprietà chimiche e biologiche dei composti, abbiamo sviluppato un metodo che permette funzionalità cationico duale (es, N Lys e Arg N) da includere in una determinata sequenza peptoid per la prima volta. 2
Qui, descriviamo la sintesi, purificazione e caratterizzazione di TWo nuovi peptoids che contengono sia residui lysine- e arginina-tipo nella stessa sequenza. Il metodo utilizza ortogonali N Boc e N -Dde protezione sul resina con pirazolo-1-carboxamidine come reagente guanidinylation. La valutazione biologica di questi peptoids è descritta anche in saggi di citotossicità contro Leishmania mexicana, l'agente eziologico della leishmaniosi cutanea. Questo fornisce un metodo pratico per accedere peptoids con doppia funzionalità cationico e per valutare la loro attività biologica. Si prevede che questo metodo aiuterà la sintesi di peptoids anfipatiche dalla comunità peptoid in futuro.
Protocollo
1. fase solida Sintesi di peptoids
NOTA: peptoids sono sintetizzati manualmente utilizzando la procedura submonomer della sintesi peptoid in fase solida. Questo metodo permette un'elevata efficienza di accoppiamento e buone rese in prodotto finale. Sintesi su fase solida permette anche reagenti in eccesso da rimuovere facilmente alla fine di ogni passo e il metodo è stato modificato qui per consentire (residui esempio, arginina-tipo e lisina tipo) diverse funzionalizzati monomeri cationici da inserire all'interno dello stesso sequenza. 1,2
- Sintesi di un peptoid lineari
Attenzione: effettuare valutazioni di sicurezza prima di iniziare la sintesi. Effettuare tutte le reazioni di una cappa aspirante e indossare adeguati dispositivi di protezione individuale adeguati (ad esempio, guanti di nitrile monouso, occhiali di sicurezza e un camice da laboratorio). Prestare particolare attenzione quando si utilizzano i seguenti reagenti e solventi. Dimetilformammide (DMF) è un teratogeno sospetto e Dichloromethane (DCM) è un agente cancerogeno. N, -diisopropylcarbodiimide N '(DIC) e piperidina sono pericolosi per gli occhi, la pelle, per inalazione respiratorio e possono causare sensibilizzazione cutanea. L'idrazina è un sospetto cancerogeno, letale se inalato e provoca gravi ustioni alla pelle o degli occhi. L'acido bromoacetico è anche pericoloso per la pelle, gli occhi e il tratto respiratorio e può causare ustioni al contatto. acido trifluoroacetico (TFA) è un liquido volatile e può causare gravi ustioni in modo da maneggiare con cura. Si consigliano guanti pesanti.- Aggiungere 0,12 g Fmoc-resina protetto Rink Amide (0,1 mmol, tipica loading 0,7 mmol / g) per un recipiente di reazione 20 ml polipropilene ricoperto con due fritte. Aggiungere 5 ml di dimetilformammide (DMF) per gonfiare la resina e lasciare la nave riposare per almeno 60 minuti a temperatura ambiente. Scolate la DMF utilizzando una piattaforma a vuoto di estrazione in fase solida.
- Per deproteggere il gruppo Fmoc sulla resina gonfio, aggiungere 2 ml di soluzione piperidina (20% in DMF v / v). Mettere il recipiente suuna piattaforma agitatore a temperatura ambiente (450 rpm) e agitare per 5 min. Rimuovere la soluzione tramite la stazione di vuoto.
- Ripetere Fmoc deprotezione con 2 ml di soluzione di piperidina e agitare per 15 minuti a temperatura ambiente. Scolare la soluzione come prima.
- Lavare la resina con l'aggiunta di 2 ml di DMF e mescolando la resina per 30 sec. Scolare la DMF e ripetere altre tre volte.
- Per l'acetilazione, aggiungere 1 ml di soluzione di acido bromoacetico (0,6 M in DMF) e 0,2 ml di N, soluzione -diisopropylcarbodiimide N '(DIC, 50% in DMF v / v). Lasciare recipiente di reazione ad agitare per 20 minuti a temperatura ambiente. Scolare la soluzione e lavare la resina con 2 ml di DMF tre volte.
- Per lo spostamento, aggiungere 1 ml di soluzione di ammina (1,5 M in DMF). Agitare la resina per 60 min a temperatura ambiente. Scolare la soluzione e lavare la resina con 2 ml di DMF tre volte.
- Per aggiungere un arginina-tipo monomero, seguire passo 1.7. A seconda della sequenza peptoid desiderata, ammine diversisarà aggiunto.
- Ripetere i punti 1.1.4 e 1.1.5.
- Per includere un guanidina funzionalizzato monomero (cioè, N Arg), aggiungere 1 ml di soluzione di diammina non protetto (1,5 M in DMF) alla resina e agitare per 60 min a temperatura ambiente.
- Scolare la soluzione e lavare la resina con 2 ml di DMF tre volte.
- Aggiungere 2-acetyldimedone (0,2 g, 1 mmol in 0,5 ml di DMF, 10 equivalenti) per aggiungere il gruppo Dde per l'ammina primaria gratuita e agitare per 60 min a temperatura ambiente. Scolare la soluzione e lavare la resina con 2 ml di DMF tre volte.
- Continuare sintesi submonomer come in 1.1.4 a 1.1.7 fino a quando viene effettuata la sequenza desiderata. Aggiungere 2 ml di DMF per lavare la resina e ripetere tre volte.
- Per deproteggere il gruppo Dde resina, aggiungere la soluzione di idrazina 4 ml 2% (in DMF v / v) e agitare per 3 minuti a temperatura ambiente. Scolare la soluzione e ripetere tre volte.
- Scolare la soluzione e lavare la resina con 2 ml di DMF tre tIME.
- Aggiungere pirazolo-1-carboxamidine (6 equivalenti per ammina libera, cioè, per monomeri N Arg, nel volume minimo di DMF) e N, N -diisopropylethylamine o DIPEA (6 equivalenti per ammina libera) ed agitare a temperatura ambiente per 60 min .
- Scolare la soluzione e lavare la resina con 2 ml di diclorometano tre volte. Lasciare la resina asciugare all'aria per 10 minuti quindi la resina può essere conservato fino fenditura (sezione 2).
- Per mettere in pausa la sintesi, lavare la resina con 2 ml di DMF tre volte. Aggiungere 2 ml di DMF, tappare il recipiente sintesi e lasciare a temperatura ambiente in una cappa aspirante.
NOTA: La sintesi può essere messo in pausa dopo (può essere formata tranne il secondo passo di spostamento come diketopiperazines) ogni passo di spostamento.
- Side-chain deprotezione e scissione in resina
- Intraprendere una Cleave test per verificare lo stato di avanzamento della sintesi (purezza e di massa) in qualsiasi momento durante la sintesi dopo il displasono stati fatti passi in cemento, aggiunta o la rimozione del gruppo Dde-proteggere o dopo la sequenza finale.
- Trasferire circa 10 perle di resina dal recipiente di reazione in una nuova cartuccia sinterizzato 8 ml polipropilene.
- Aggiungere 1 ml di cocktail trifluoroacetico scissione con acido (contenente 95% TFA 2,5% H 2 O, 2,5% triisopropylsilane) e agitare per 90 minuti a temperatura ambiente.
- Filtrare la scissione cocktail TFA dalla resina utilizzando il recipiente di reazione sinterizzato in un 10 ml pallone a fondo arrotondato.
- Evaporare il cocktail scissione usando un evaporatore rotante e ridisciogliere l'olio risultante in 1 ml di acetonitrile / acqua da sottoporre LC-MS o HPLC analitica.
- Per la scissione finale: nella stessa cartuccia reazione polipropilene poroso utilizzato per la sintesi, aggiungere 4 ml di scissione cocktail TFA (95% TFA 2,5% H 2 O, 2,5% triisopropylsilane) e coprire il vaso. Agitare per 90 minuti a temperatura ambiente.
- Filtro °e TFA scissione cocktail dalla resina utilizzando il recipiente di reazione sinterizzato in un 50 ml pallone a fondo arrotondato.
- Evaporare il cocktail scissione usando un evaporatore rotante. Dopo il TFA è stato rimosso, il prodotto deve essere ottenuto come un olio. Per facilitare la rimozione TFA da questo petrolio greggio, aggiungere 2 ml di etere etilico anidro e il peptoid dovrebbe precipitare.
- O eliminare l'etere etilico tramite pipetta e scartare o evaporare con un evaporatore rotante. Ripetere dietiletere precipitazione tre volte.
- Sciogliere il peptoid grezzo in 10 ml di soluzione di acetonitrile / acqua acidificata (50% acetonitrile, 0,1% TFA in acqua v / v). Trasferire in un contenitore pre-pesato, congelare a 20 ° C e liofilizzato in polvere secca.
- Intraprendere una Cleave test per verificare lo stato di avanzamento della sintesi (purezza e di massa) in qualsiasi momento durante la sintesi dopo il displasono stati fatti passi in cemento, aggiunta o la rimozione del gruppo Dde-proteggere o dopo la sequenza finale.
2. Caratterizzazione e Purificazione
NOTA: La sintesi peptoid può essere monitorato e il peptoid finale valutato tramite analisi HPLC in fase inversa utilizzando una colonna C18 e ELspettrometria ectrospray liquido-cromatografia di massa (LC-MS). Tutti i solventi HPLC di solventi per LC-MS devono essere preparate al momento.
- HPLC analitica
- Pesare 1 mg di peptoid in una piccola fiala di vetro. Aggiungere il volume minimo di acetonitrile per sciogliere e diluire a 1 ml con acqua. Assicurarsi che il peptoid ha completamente dissolto.
- Iniettare 10 pl per HPLC analitica (gradiente suggerito 0 - 100% di solvente B oltre 30 min, in cui il solvente A = 95% di acqua, 5% acetonitrile, 0,05% TFA e solvente B = 95% acetonitrile, acqua 5%, 0,03% TFA) , secondo le istruzioni del produttore.
- Visualizzare spettro UV a 220 nm.
- ESI LC-MS
- Fare 1 mg / ml soluzione peptoid come al punto 2.1.1.
- Iniettare 1 ml di electrospray LC-MS per determinare se è presente il peso molecolare del peptoid bersaglio, utilizzando le istruzioni del produttore.
- Controllare la massa di riferimento della sequenza peptoid utilizzando un PEPTcalcolatrice OID, come da istruzioni sulla calcolatrice. 26 Questa utility web permette anche l'assegnazione di eventuali cancellazione / prodotti di addizione visti nello spettro di massa. 26
- Preparativa HPLC in fase inversa
- Sciogliere peptoids greggio in 2 ml di acqua acidificato / acetonitrile (95% di acqua, 5% MECN, 0,1% TFA) e purificare da preparativo RP-HPLC usando il protocollo del produttore. Determinare il gradiente dal tempo di eluizione ottenuto da HPLC analitica e la quantità iniettata dipenderà dalle dimensioni della colonna.
- Visualizzare utilizzando un rivelatore fissato a 220 nm.
- Raccogliere frazioni in 15 ml provette da centrifuga, congelare a 20 ° C e liofilizzato.
- Rianalizzare frazioni utilizzando LC-MS e HPLC analitica secondo il protocollo del produttore. Ricombinare frazioni purificate.
3. Test biologica contro Leishmania mexicana parassiti
Cauzione:. le valutazioni di sicurezza devono essere effettuate prima di iniziare la sintesi Leishmania mexicana è classificato un rischio di gruppo 2 patogeno nel Regno Unito e misure di controllo adeguate deve essere a posto prima di iniziare il test. Tutti i lavori devono essere eseguiti in una cappa di sicurezza microbiologica di classe 2 e adeguati dispositivi di protezione individuale a seconda dei casi (ad esempio, guanti in nitrile, occhiali di sicurezza e un camice da laboratorio).
- Subculture di parassiti
- Scongelare 1 ml -150 ° C Stock Frozen Leishmania mexicana M379 mettendo flacone in un bagno d'acqua a 37 ° C per 30 sec.
- Trasferire la soluzione di riserva di 10 ml di mezzo insetti di Schneider (a pH 7,0 integrato con il 15% di siero fetale bovino inattivato al calore e l'1% di penicillina / streptomicina) in un 25 centimetri pallone di coltura 3 celle con un tappo non ventilato.
- Incubare a 26 ° C per 72 ore.
- Esaminare i parassiti al microscopio (400x) per verificare le condizioni. they dovrebbe essere promastigoti fase di insetti, forme prociclico in fase di log con molte cellule in divisione.
- Mantenere promastigoti prociclico di parassiti sub-coltura ad una concentrazione di 5 x 10 5 parassiti / ml ogni tre giorni. Contare le cellule utilizzando un emocitometro Neubauer migliorata.
- Trasformazione di L. mexicana fase insetto in mammiferi fase axeniche forma amastigote 27
- Giorno 0: Preparare 10 ml cultura di parassiti stadio di registro a 5 x 10 5 parassiti / ml in mezzo di insetti di Schneider (a pH 7,0 integrato con il 15% di calore-inattivato siero fetale bovino e 1% di penicillina / streptomicina) in 25 cm 3 celle pallone di coltura con un tappo non ventilato.
- Incubare a 26 ° C per 48 ore.
- 3 ° giorno: Trasferimento 10 ml cultura ad un 50 ml provetta da centrifuga e centrifugare a 447 xg per 5 min.
- Eliminare vecchi media e aggiungere 10 ml di mezzo insetti di Schneider (a pH 5,5 integrato con il 20% hmangiare-inattivato siero fetale bovino e 1% di penicillina / streptomicina). Risospendere delicatamente il pellet di parassiti nel nuovo mezzo con una pipetta.
- Contare il numero di parassiti che utilizzano un miglioramento emocitometro Neubauer. Diluire a una concentrazione di 5 x 10 5 parassiti / ml a pH 5,5 medio e trasferimento cm 25 pallone di coltura 3 celle.
- Incubare a 26 ° C per circa 6 giorni.
- Giorno 9: esaminare i parassiti al microscopio (400X). Essi dovrebbero essere nel non-replicante, infettiva fase promastigote metacyclic.
- Contare il numero di parassiti che utilizzano un miglioramento emocitometro Neubauer. Diluire a una concentrazione di 5 x 10 5 parassiti / ml con pH 5,5 medio.
- Rimuovere 10 ml di coltura cellulare e trasferire al pallone di coltura cellulare. Incubare a 32 ° C per 5 giorni.
- Giorno 14: Controllare comparsa di parassiti al microscopio (400X). Essi dovrebbero essere in fase amastigote patogeno, manca il carattere flagellumstico di promastigoti, e pronto per il dosaggio.
- Test di citotossicità su L. Mexicana amastigoti axeniche.
NOTA: Il test biologici di peptoids utilizza saggi high-throughput effettuate in piastre da 96 pozzetti. Questo protocollo descrive la sperimentazione di L. Mexicana amastigoti axeniche, ma dosaggi identici possono essere effettuate anche sui parassiti palco promastigote nelle matrici appropriate. I composti vengono incubate con parassiti a concentrazioni da 3 - 100 mM per 60 min e poi incubate per 24 ore dopo una diluizione di 10 volte. I risultati si ottengono misurando la fluorescenza dei pozzi dopo incubazione con la soluzione vitalità cellulare resazurina-based (ad esempio, alamarBlue).- Preparare soluzioni di composti. Pesare 1 mg del prodotto peptoid purificato finale utilizzando una bilancia analitica. Aggiungere il volume appropriato di biologia molecolare grado dimetilsolfossido (DMSO) ad una concentrazione di 5 mM. Fare 6 aliquote microlitri econgelare a -20 ° C.
- Preparare le soluzioni composte di 96 pozzetti (un layout piatto raccomandato può essere visto nella sezione risultati, Figura 6), in triplice copia 100-3 micron. Aggiungere 2 ml di 5 mm soluzione madre di ciascun composto nella riga superiore (ad esempio, A). Aggiungere 48 microlitri fresca medie Insect Schneider (a pH 5,5 e siero fetale bovino 20% (FBS), 1% di penicillina / streptomicina (P / S)) all'inizio fila utilizzando una pipetta multicanale. Aggiungere 25 ml di media insetti di Schneider a tutte le altre righe (B - F).
- Effettuare una diluizione seriale pipettando 25 microlitri soluzione dalla riga superiore. Aggiungere alla riga sotto e mescolare. Effettuare diluizioni fino a quando l'ultima riga, in cui deve essere eliminata l'ultima soluzione di 25 ml.
- Utilizzare amfotericina B (5 mM scorte) come controllo positivo e DMSO (soluzione al 2%) come controllo negativo in triplice copia.
- Preparare la soluzione parassita: la cultura trasferimento in una provetta da centrifuga da 50 ml e centrifugare a447 xg per 5 min. Eliminare vecchi media e aggiungere 10 ml di mezzo di Schneider insetti (a pH 5,5 e il 20% FBS, 1% P / S).
- sciogliere delicatamente il pellet di parassiti nel nuovo mezzo con una pipetta e contare con un miglioramento emocitometro Neubauer. Diluire la cultura a 8 x 10 6 / ml parassiti.
- Aggiungere 25 ml L. cultura mexicana in ciascun pozzetto. Incubare le piastre per 60 minuti a 32 ° C.
- Rimuovere la piastra dall'incubatore e rimuovere la soluzione 40 ml da ogni pozzetto.
- Aggiungere 90 ml mezzo fresco e incubare per 24 ore a 32 ° C.
- Aggiungere 10 ml soluzione di vitalità cellulare resazurina-based per ogni bene. Incubare per 4 ore a 32 ° C.
- Misurare la fluorescenza utilizzando un lettore di piastre (λ ex = 540 nm, λ em = 600 nm), secondo le istruzioni del produttore. Analizzare i dati rimuovendo medie di fondo (da media solo pozzi) e confrontando la fluorescenza dei pozzetti dopo normalizzazione rispetto ategli DMSO controlli.
Risultati
Di conseguenza rappresentante, la sintesi e la caratterizzazione di due 12 peptoids residui contenenti due monomeri lisina-tipo e di tipo due-arginina monomeri ciascuno saranno descritte. I successivi risultati di test di citotossicità sono mostrati anche.
Due peptoids [(N nArg N spe N spe) (N ae N spe N spe)] 2 (a) e [(N Harg N spe N spe) (N Lys N spe N spe)] 2 (b) sono stati sintetizzati utilizzando 120 mg Rink Amide resina ciascuna (carico = 0,79 mmol / g). Tutte le fasi di acetilazione e spostamento sono state eseguite come descritto sopra, con tutti i reagenti acquistati commercialmente. Per questi residui, le seguenti ammine sono stati utilizzati nel passo di spostamento: N spe (S) - (-) - α-metilbenzilammina, N ae N - (tert -butoxycarbonyl) -1,2-diaminoethane, N Lys N - (terz -butoxycarbonyl) -1,4-diamminobutano. Per i residui derivati arginina, le seguenti diammine non protetti sono stati accoppiati: N Harg 1,4-diamminobutano o N nArg 1,2-diamminoetano, seguiti da una protezione in resina con 2-acetyldimedone (DDE-OH). Dopo l'intera sequenza era stato sintetizzato, idrazina deprotezione del Dde produce ammine libere per guanidinylate.
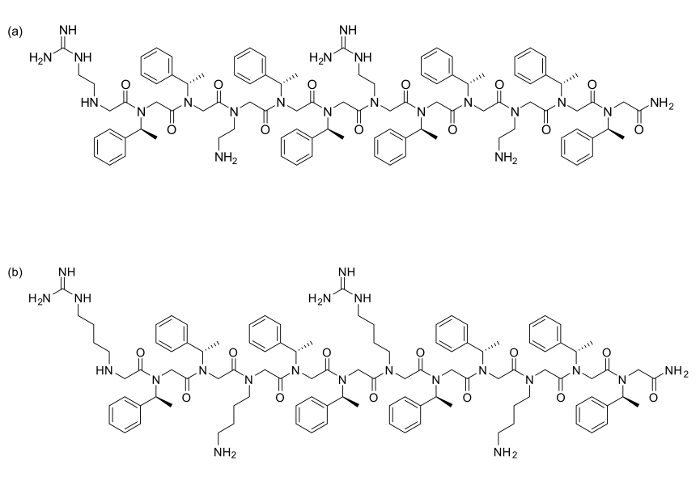
Figura 1. Strutture Peptoid (a) [(N nArg N spe N spe) (N ae N spe N spe)] 2 e (b) [(N Harg N spe N spe) (N ng> Lys N spe spe N)] 2. Clicca qui per vedere una versione più grande di questa figura.
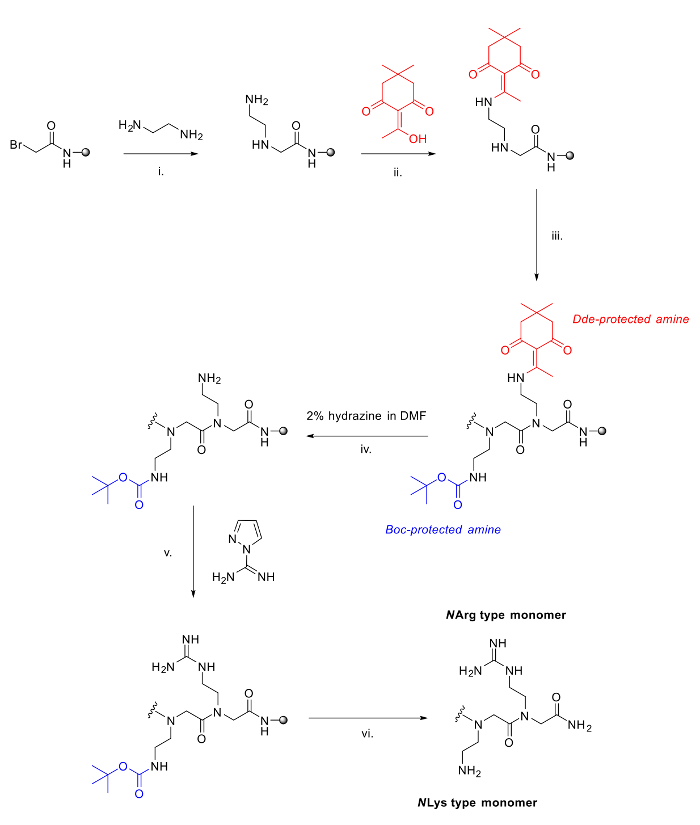
Figura 2. Il metodo utilizzato per sintetizzare peptoids arginina / lisina misti. I. passo di spostamento standard nel metodo submonomer con diammina; ii. L'aggiunta di DDE-OH, 90 minuti per proteggere ammina libera; iii. Ulteriori aggiunte di estendere la catena peptoid utilizzando il metodo submonomer; iv. Deprotezione di DDE che utilizza 2% idrazina in DMF; . V Guanidinylation di ammina libera di resina con pirazolo-1-carboxamidine e DIPEA in DMF; VI. clivaggio Acidic dalla resina e deprotezione dei gruppi Boc.large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.
Dopo clivaggio dalla resina e liofilizzazione, i prodotti grezzi sono stati ottenuti come polveri bianche: (a) 154 mg, (b) 163 mg. I prodotti sono stati purificati mediante RP-HPLC come descritto con massimi iniezioni di 50 mg utilizzando una pompa LC con un rivelatore UV-vis (λ = 250 nm) su una colonna analitica, 250 mm x 10 mm, 5 micron; portata = 2 ml / min. Le frazioni corrispondenti alla massa di destinazione sono stati combinati e ottenuti come polveri bianche: (a) 54 mg (b) 65 mg, rese finali di circa il 30% per frazioni> 90% puro.
Le identità composti finali dopo purificazione sono stati confermati da LC-MS (vedi Figura 3) con uno spettrometro di massa a triplo quadrupolo dotato di UPLC e un rivelatore di fotodiodi. spettrometria di massa accurata è stata effettuata utilizzando la stessa spettrometro su t egli [M + 2H] 2+ ioni. Di seguito calcolato e masse osservati sono stati trovati in stretto accordo (Figura 4): (a) calcolata = 896,0026 amu, osservato = 896,0038 amu; (B) calcolato = 952,0691 amu, osservato = 952,0730 amu.
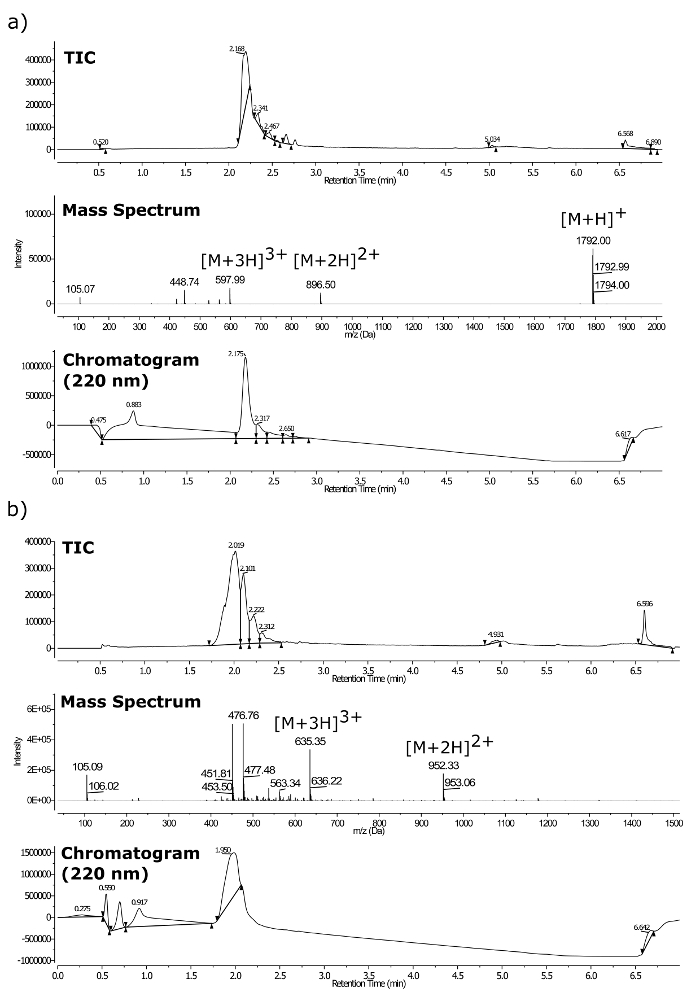
Figura 3. LC-MS per peptoids purificati. (A) m / z = 1.792 e (b) m / z = 1.903. Dove la parte superiore è TIC, Medio spettro LC-MS, fondo cromatogramma UV a 220 nm. Cliccate qui per vedere una versione più grande di questa figura.
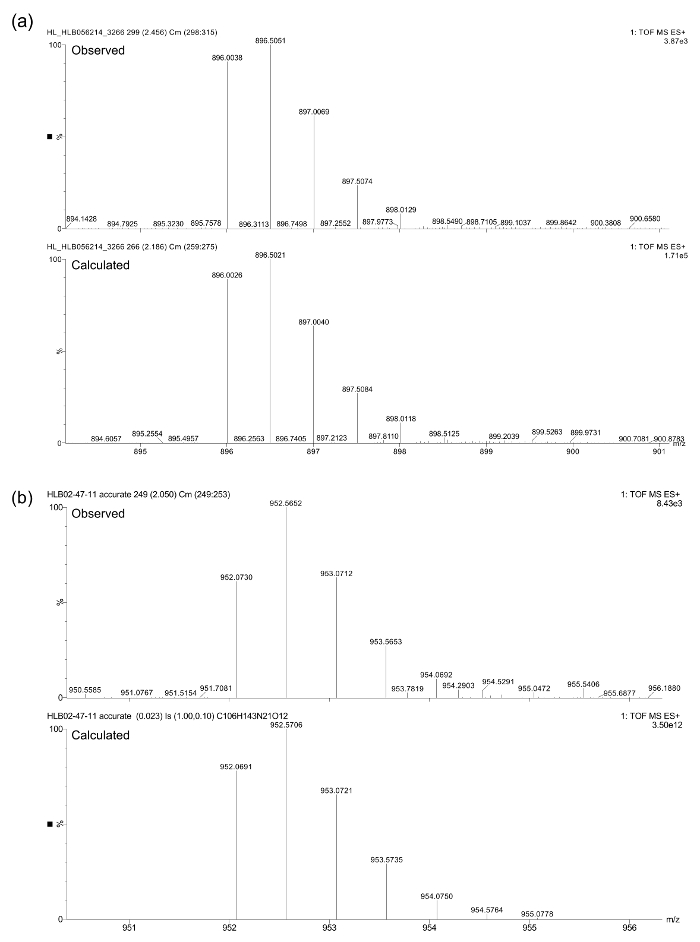
Figura 4. accurati dati di spettrometria di massa per peptoids (a) e (b).target "https://www.jove.com/files/ftp_upload/54750/54750fig4large.jpg" = "_ blank"> Clicca qui per vedere una versione più grande di questa figura.
purezza del prodotto è stata valutata utilizzando un RP-HPLC (pompa LC con rivelatore UV-vis su una colonna analitica, 4,6 mm x 100 mm, 3,5 micron; portata = 1 ml / min) analitica, e visualizzati a 220 nm, l'assorbanza di ammide backbone. Figure 5a e 5b mostrano che i composti sono omogenei.
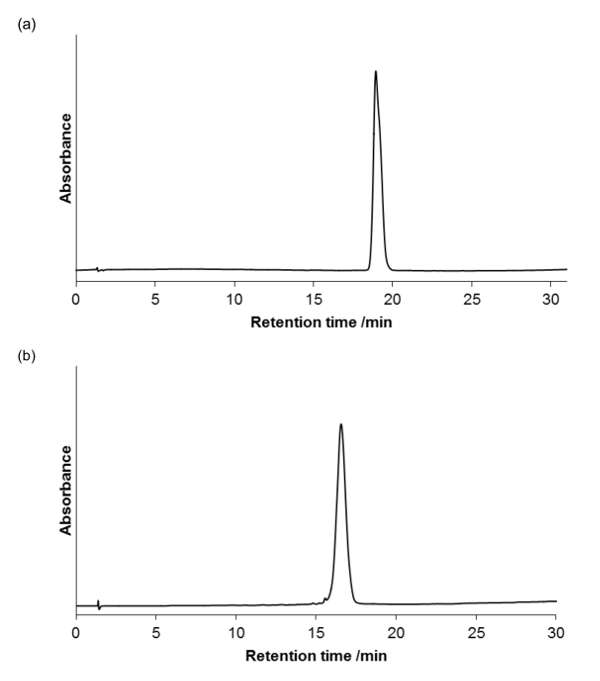
Figura 5. HPLC analitico per i peptoids purificati (a) e (b). Vi è un gradiente 0-100% B in 30 minuti, colonna forno a 40 ° C (A = 95% H 2 O, 5% MeCN, 0,05 % TFA;. B = 95% MeCN, 5% H 2 O, 0,03% TFA) Si prega di click qui per vedere una versione più grande di questa figura.
I peptoids purificati (a) e (b) sono stati testati in saggi di citotossicità contro L. Mexicana amastigoti axeniche. Scorte congelate di L. mexicana sono stati scongelati e trasformato alla fase amastigote pronto per il test. 72 ore dopo lo scongelamento, i parassiti devono essere promastigoti fase di insetti nella loro forma prociclico, in fase di log con molte cellule in divisione. In questa fase i parassiti possono essere trasformate in fase di amastigote utilizzando la variazione del pH e la temperatura descritto. 27 Al 9 ° giorno della trasformazione, i parassiti saranno nella non-infettiva replicando fase metacyclic promastigote. Infine al giorno 14, i parassiti devono essere in fase di amastigote patogeno in cui i parassiti non hanno la caratteristica dei flagelli promastigoti. 28
5 soluzioni madre mm di composti sono state effettuate in colture cellulari grado DMSO e testati in triplicato suun minimo di due volte per garantire un insieme di dati robusta stati raccolti. Un piano rappresentante piastra a 96 pozzetti è mostrato in Figura 6. Al termine del test, il reagente vitalità cellulare è stato aggiunto a ciascun pozzetto e la fluorescenza è stata misurata come descritto per calcolare la redditività di parassiti per ciascuna concentrazione testata (vedere Figura 7 ). ED 50 valori sono stati calcolati come peptoid (a)> 100 pM e del 37 mM peptoid (b). Le barre di errore tracciati, mostrano la variazione tra i pozzi come una deviazione standard e può essere visto che questi sono ragionevoli per la maggior parte dei bar.
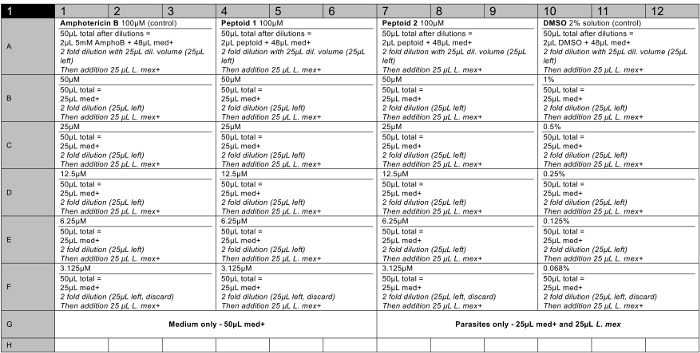
Figura 6. Rappresentante 96 piano piastra bene per un test di citotossicità su 2 soluzioni peptoid (compresi i controlli positivi e negativi). Med + = medio (di Schneider insetti Medium, pH 5,5, 20% FBS, 1% P / S). L. mex. =8 x 10 6 / ml cultura parassita med +. AmphoB = 5 mM in DMSO. Peptoid = 5 soluzione madre mM in DMSO. Pozzi vuoti devono contenere acqua sterile. Cliccate qui per vedere una versione più grande di questa figura.
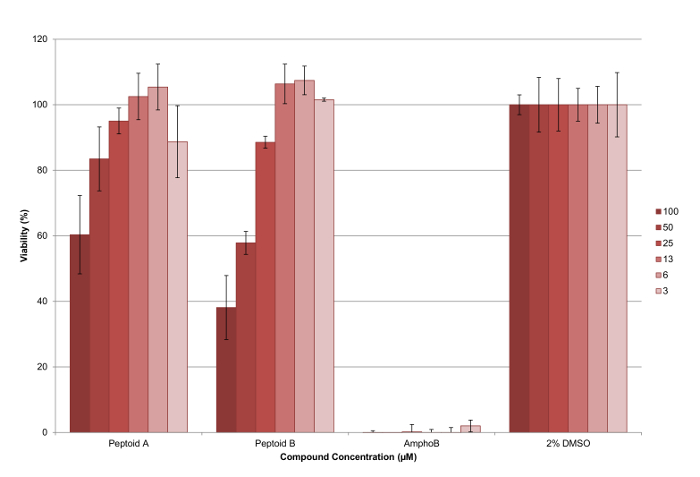
Figura 7. I risultati di test di citotossicità contro L. mexicana axeniche parassiti amastigote utilizzando peptoid (a) e (b). Si può vedere che il peptoid (b) è più efficace di peptoid (a) a ridurre la percentuale di parassiti vitali, con entrambi i composti aventi un effetto dose-dipendente. Le barre di errore tracciati mostrano la variazione tra i pozzi come deviazione standard. Cliccate qui per vedere una versione più grande di questa figura.
Discussione
Peptoids sono sempre più studiati nella biologia chimico e chimica farmaceutica in applicazioni come nuove terapie 3-5, agenti di consegna cellule 18,20 e strumenti diagnostici. 29 Tipicamente, queste sequenze sono cationico per fornire un grado di selettività per il patogeno over cellule di mammifero, la capacità di penetrare attraverso le membrane cellulari e anche aiutare solubilità in sistemi acquosi. Ci sono numerosi esempi di peptoids cationici che contengono residui esclusivamente lysine- o arginina-mimetica in letteratura. Tuttavia, ad oggi, la sintesi di peptoids che contengono entrambi questi residui cationici nella stessa sequenza è stata ostacolata dalla mancanza di un procedimento sintetico idoneo. Il protocollo qui descritto permette peptoids cationici misti da sintetizzare in modo efficiente ed è altamente desiderabile in quanto offre un percorso per modulare le proprietà biologiche e chimiche del peptoids anfipatiche.
nt "> Il nostro metodo utilizza un adattamento alla sintesi peptoid submonomer comunemente usato e consente l'aggiunta di due monomeri lysine- e arginina tipo all'interno della stessa sequenza. Utilizza innesti temperatura ambiente e stabilito protezione chimica gruppo così si prevede che questo metodo sarà utile per la maggior parte dei gruppi di ricerca. per aggiungere la protezione ortogonali per l'arginina-tipo residuo, una diammina non protetto viene aggiunto in condizioni di spostamento standard e quindi protetto in un accoppiamento di 60 minuti con DDE-OH. una varietà di diammine può essere utilizzato che consente catene laterali da 2 a 6 atomi di carbonio carboni lunghi per essere installato, cioè, 1,2-diamminoetano e 1,6-diamminoesano, rispettivamente. La protezione Dde-OH scioglie bene in DMF ed è un gruppo protettivo molto efficace e selettivo per ammine primarie. il gruppo Dde protezione lascia inalterati ammine secondarie, ad esempio, il terminale N non protetto catena peptoid. 30 Una limitazione è che tutto il syntesi di laurea è stato intrapreso manualmente; Tuttavia, si prevede che le condizioni di accoppiamento sviluppati rendono il metodo prestano all'uso con peptide / sintetizzatori peptoid automatizzati.La deprotezione su resina di DDE-gruppi viene effettuata utilizzando una soluzione di idrazina 2% in DMF a lasciare ammine libere che possono essere guanidinylated di resina utilizzando pyrazole-1-carboxamidine. Sei equivalenti del pirazolo-1-carboxamidine e sei equivalenti di DIPEA vengono utilizzati per ammina libera sulla resina (vale a dire, sei equivalenti per ogni tipo di monomero N Arg da installare). Di nuovo, questa reazione è anche efficace e il reagente pirazolo-1-carboxamidine ha buona solubilità in DMF. Il completamento della reazione si osserva tipicamente tramite LC-MS dopo 60 minuti a temperatura ambiente.
Grazie alla versatilità del metodo submonomer, un'ampia varietà di ammine primarie può essere utilizzato nel passo di spostamento così possono avere bisogno di essere ottimizzato per aumentare l'accoppiamento effi condizionicienza e le rese dei prodotti in generale o la purezza. 31 per le sequenze di cui sopra, senza condizioni particolari sono stati necessari per giunti di successo. Tuttavia, i tempi di spostamento più lunghi o concentrazioni di ammine superiori potrebbero essere utilizzati per spostamenti problematici (ad esempio, per ammine nucleofila o stericamente ingombranti scarsamente). Alcune ammine possono non essere completamente solubile in DMF, nel qual caso si raccomanda di sciogliere questi in N-metil-2-pirrolidone (NMP), o altri solventi appropriati per reazioni in fase solida invece come in un precedente metodo integrale per sintesi submonomer di peptoids. 32 per incorporare monomeri contenenti eteroatomi non protetti nelle catene laterali, acetilazione con acido cloroacetico ha dimostrato di essere efficace da altri gruppi. 33 Inoltre, altre resine possono essere utilizzati con questo metodo per produrre peptoids con diversa funzionalizzazione terminale C. Wang Resine e resine di cloruro di 2-chlorotrityl vengono comunemente impiegati nellasubmonomer sintesi di peptoids. Ad esempio, questo metodo è stato utilizzato con successo con resina cloruro di 2-chlorotrityl nel nostro gruppo. 2 diversi supporti solidi richiedono una procedura di caricamento diverso da Rink Amide discusso qui (a seconda della resina specifico utilizzato) quindi questo dovrebbe essere controllato con la letteratura prima sintesi.
Simile alla sintesi peptidica, le condizioni di scissione finale della resina peptoid off possono anche essere ottimizzati per la sequenza specifica. In questo protocollo, una scollatura cocktail TFA è stato utilizzato (con triisopropylsilane e l'acqua come spazzini). I peptoids qui presentati contenevano solo una protezione Boc che è un gruppo labile ragionevolmente acido. Per garantire la completa deprotezione delle sequenze con una maggiore percentuale di residui protette o meno acido labile proteggere i gruppi, i tempi di dissociazione più lunghi possono essere necessari (ad esempio, i tempi di dissociazione al di sopra di 2 ore sono raccomandati per le sequenze che contengono Pbf o terziaria-butyl estere di gruppi protetti). decontaminanti alternativi possono essere utilizzati anche per catene laterali specializzati (per esempio, etanditiolo o 2-mercaptoetanolo sono spesso usati in peptidi che hanno zolfo contenenti catene laterali come cisteina o metionina).
Il saggio biologico presentato è un test di citotossicità standard che può essere modificato per adattarsi alle diverse linee cellulari. È importante notare che ciascuna piastra da 96 pozzetti dovrebbe contenere controlli sufficienti a consentire fiducia nei risultati ottenuti. In questo caso, amfotericina B viene utilizzato come controllo positivo in quanto è un farmaco noto utilizzato per trattare la malattia e DMSO è usato come controllo negativo in quanto questo è il solvente usato per fare scorte composti per il saggio. Se si utilizzano altre linee cellulari, alternative, opportuni comandi devono essere ottenuti e convalidati prima dell'uso. L. mexicana viene incubato con il peptoid a concentrazioni comprese tra 100 e 2 mM per un'ora, e quindi la soluzione parassita / peptoid sono diluitiun fattore dieci per l'incubazione durante la notte (ad esempio, pozzi inizialmente con 100 micron magazzino peptoid vengono diluiti a 10 micron).
Il reagente vitalità cellulare viene aggiunto a ciascun pozzetto (10% del volume totale ben) al termine del test. Un cambiamento di colore visibile è visto tra i pozzetti con parassiti vitali (rosa), pozzetti di controllo senza parassiti vitali (blu) e uno spettro tra con i numeri intermedi di parassiti vitali. La fluorescenza è proporzionale al numero di cellule viventi e corrisponde all'attività metabolica delle cellule; resazurin dye (non fluorescente) viene convertito nel resorufina fluorescente reazioni di riduzione in cellule metabolicamente attive. 34 In questo test, il tempo di incubazione con il reagente vitalità cellulare è stata ottimizzata per L. mexicana. I tempi di incubazione con il reagente redditività varierà per piastre seminate a diverse concentrazioni di cellule o con differenti linee cellulari (per esempio, questo metodo può anche essere usatocon cellule di mammiferi). A seconda del lettore di esatto piastra utilizzata, considerazioni devono essere fatte prima di adottare misure di fluorescenza. Eventuali bolle d'aria nei pozzi dovrebbero essere rimossi per garantire letture precise possono essere prese. Alcuni lettori di piastre letti dal fondo di piastre, nel qual caso fondo piatto 96 pozzetti deve essere utilizzato. Altre macchine possono leggere dalla sommità della piastra, in modo che il coperchio della piastra devono essere rimossi prima della misurazione.
Infine, in futuro, questo protocollo può essere compatibile con sintetizzatori automatizzati che sono in grado di fare molte sequenze in parallelo. Inoltre, la sintesi di peptoids ciclici è possibile anche con questo metodo. Questo protocollo dovrebbe fornire ai ricercatori una procedura sintetica pratico che può essere utilizzato per accedere a nuovi ponteggi peptoid con entrambe le monomeri lysine- e arginina-tipo, che possono essere utili in molte applicazioni, compresi i materiali o campi di medicinali.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
Ringraziamo l'Ingegneria e Scienze Fisiche Research Council (EPSRC) per il sostegno finanziario (HLB). Ringraziamo anche Sridevi Maalika Ramanoudjame per la sua assistenza durante le riprese di questa procedura.
Materiali
| Name | Company | Catalog Number | Comments |
| Polypropylene solid phase extraction cartridges with two frits | Crawford Scientific | 12131017 and 12131015 | 20 ml and 6 ml cartridges used in this preparation |
| Trifluoroacetic acid | Tokyo Chemical Industry (Europe) | T0431-100g | >98%; CAUTION: can cause severe burns and respiratory irritation |
| N,N'-diisopropylcarbodiimide | Sigma Aldrich | 38370-100ML | >98%; CAUTION: hazardous to eyes, skin and via respiratory inhalation, may also cause sensitisation |
| Dimethylformamide | Fischer Scientific | 10346180 | HPLC grade; CAUTION: suspected teratogen |
| Acetonitrile | Fischer Scientific | 10407440 | HPLC grade |
| Dichloromethane | Fischer Scientific | 10354263 | 99.8%; CAUTION: suspected carcinogen |
| Bromacetic acid | Sigma Aldrich | 17000-100G | >99%; CAUTION: causes burns and hazardous to skin, eyes and respiratory tract |
| (S)-(-)-alpha methylbenzylamine | Sigma Aldrich | 115568-100G | 98%; CAUTION: harmful if swallowed, toxic in contact with skin, causes severe skin burns and eye damage, used to synthesise the Nspe monomer |
| N-Boc 1,4-diaminobutane | Tokyo Chemical Industry (Europe) | A1373-25g | >98%; CAUTION: causes severe skin burns and eye damage, used to synthesise the NLys monomer |
| N-Boc 1,2-diaminoethane | Tokyo Chemical Industry (Europe) | A1371-25g | >97%; CAUTION: causes severe skin burns and eye damage, used to synthesise the Nae monomer |
| 1,2-diaminobutane | Sigma Aldrich | D13208-100G | 99%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NhArg monomer |
| 1,4-diaminoethane | Sigma Aldrich | 03550-250ML | >99.5%; CAUTION: flammable liquid and vapour, harmful if swallowed or inhaled, toxic in contact with skin, causes severe skin burns and eye damage, used in the synthesis of the NnArg monomer |
| 1H-pyrazole-1-carboxamidine HCl | Sigma Aldrich | 402516-10G | as HCl salt; CAUTION: harmful if swallowed and may cause an allergic skin reaction, causes serious eye damage |
| Hydrazine monohydrate | Sigma Aldrich | 207942-5G | reagent grade; CAUTION: suspected carcinogen, fatal if inhaled and causes severe burns to skin and eyes |
| 2-acetyl dimedone | Novabiochem | 8510150005 | Dde-OH |
| Rink Amide resin | Novabiochem | 8551190005 | 100-200 mesh, high loading |
| Piperidine | Sigma Aldrich | 411027-1L | >99.5%, a controlled substance, so adequate permission must be obtained before purchase; CAUTION: highly flammable liquid and vapour, harmful if swallowed and toxic in contact with skin or if inhaled, causes severe skin burns and eye damage, harmful to aquatic life with long lasting effects |
| Triisopropylsilane | Sigma Aldrich | 233781-50G | 98%; CAUTION: flammable liquid and vapour, causes skin irritation and serious eye irritation |
| alamarBlue | ThermoFischer | DAL1025 | Not classified as hazardous |
| Schneider's Insect Medium | Sigma Aldrich | S9895-1L | Powdered, medium must be made prior to use following manafacturers instructions; allow to warm to room temperature before use in biological assays |
| 96 well plates | VWR | 734-1793 | Flat bottom (to allow fluorescence measurement from the bottom), tissue-culture treated |
| Solvent reservoirs | VWR | 613-1182 | Used with multi channel pipette |
| Multi channel pipette | Eppendorf | 3122000043 | |
| Pipette tips | Starlab Group | S1111-3810, S1113-1810, S1111-6810 | Volume of tip dependent on pipette used. 10 µl, 10 - 200 µl and 1,000 µl recommended for assays |
| 25 cm3 cell culture flasks | VWR | 734-2312 | |
| 50 ml centrifuge tubes | VWR | 525-0791 | |
| dimethylsulphoxide (molecular biology grade) | Sigma Aldrich | D8418-50ML | Not classified as hazardous |
| Heat Inactivated Fetal Bovine Serum | ThermoFischer | 10082139-100mL | Gibco |
| Penicillin/Streptomycin | ThermoFischer | 15140148-20mL | Abbreviation: P/S |
| Amphotericin B | Sigma Aldrich | 46006-100mg | Amphotericin B trihydrate, VetranalTM analytical standard |
Riferimenti
- Zuckermann, R. N., Kerr, J. M., Kent, S. B. H., Moos, W. H. Efficient method for the preparation of peptoids oligo(N-substituted glycines) by submonomer solid-phase synthesis. J. Am. Chem. Soc. 114, 10646-10647 (1992).
- Bolt, H. L., Cobb, S. L. A practical method for the synthesis of peptoids containing both lysine-type and arginine-type monomers. Org. Biomol. Chem. 14, 1211-1215 (2016).
- Mojsoska, B., Zuckermann, R. N., Jenssen, H. Structure-activity relationship study of novel peptoids that mimic the structure of antimicrobial peptides. Antimicrob Agents Chemother. , (2015).
- Chongsiriwatana, N. P., et al. Peptoids that mimic the structure, function, and mechanism of helical antimicrobial peptides. Proc. Natl. Acad. Sci. USA. 105, 2794-2799 (2008).
- Eggimann, G. A., Bolt, H. L., Denny, P. W., Cobb, S. L. Investigating the Anti-leishmanial Effects of Linear Peptoids. Chem Med Chem. 10, 233-237 (2015).
- Kapoor, R., et al. Antimicrobial Peptoids Are Effective against Pseudomonas aeruginosa Biofilms. Antimicrob. Agents Chemother. 55, 3054-3057 (2011).
- Ryge, T. S., Frimodt-Moller, N., Hansen, P. R. Antimicrobial activities of twenty lysine-peptoid hybrids against clinically relevant bacteria and fungi. Chemotherapy. 54, 152-156 (2008).
- Huang, M. L., Benson, M. A., Shin, S. B. Y., Torres, V. J., Kirshenbaum, K. Amphiphilic Cyclic Peptoids That Exhibit Antimicrobial Activity by Disrupting Staphylococcus aureus Membranes. Eur. J. Org. Chem. , 3560-3566 (2013).
- Huang, M. L., Shin, S. B. Y., Benson, M. A., Torres, V. J., Kirshenbaum, K. A Comparison of Linear and Cyclic Peptoid Oligomers as Potent Antimicrobial Agents. Chem Med Chem. 7, 114-122 (2012).
- Bolt, H. L., Eggimann, G. A., Denny, P. W., Cobb, S. L. Enlarging the Chemical Space of Anti-leishmanials: a Structure-Activity Relationship Study of Peptoids against Leishmania mexicana, a Causative Agent of Cutaneous Leishmaniasis. Med Chem Comm. , (2016).
- Chon, S. Y., et al. Antibiotic overuse and resistance in dermatology. Dermatologic therapy. 25, 55-69 (2012).
- Alvar, J., et al. Leishmaniasis Worldwide and Global Estimates of Its Incidence. PLOS ONE. 7, (2012).
- Croft, S. L., Barrett, M. P., Urbina, J. A. Chemotherapy of trypanosomiases and leishmaniasis. Trends Parasitol. 21, 508-512 (2005).
- Kedzierski, L. Leishmaniasis Vaccine: Where are We Today?. J Global Infect Dis. 2, 177-185 (2010).
- Croft, S. L., Sundar, S., Fairlamb, A. H. Drug resistance in leishmaniasis. Clin Microbiol Rev. 19, 111-126 (2006).
- Huang, W., et al. Learning from Host-Defense Peptides: Cationic, Amphipathic Peptoids with Potent Anticancer Activity. PLOS ONE. 9, (2014).
- Wender, P. A., et al. The Design, Synthesis, and Evaluation of Molecules That Enable or Enhance Cellular Uptake: Peptoid Molecular Transporters. Proc. Natl. Acad. Sci. USA. 97, 13003-13008 (2000).
- Schröder, T., et al. Peptoidic Amino- and Guanidinium-Carrier Systems: Targeted Drug Delivery into the Cell Cytosol or the Nucleus. J. Med. Chem. 51, 376-379 (2008).
- Kömel, D. K., et al. Cell-penetrating peptoids: Introduction of novel cationic side chains. Eur. J. Med. Chem. 79, 231-243 (2014).
- Hein-Kristensen, L., Knapp, K. M., Franzyk, H., Gram, L. Bacterial membrane activity of α-peptide/β-peptoid chimeras: Influence of amino acid composition and chain length on the activity against different bacterial strains. BMC Microbiology. 11, 1-12 (2011).
- Su, Y., Doherty, T., Waring, A. J., Ruchala, P., Hong, M. Roles of Arginine and Lysine Residues in the Translocation of a Cell-Penetrating Peptide from (13)C, (31)P and (19)F Solid-State NMR. Biochem. 48, 4587-4595 (2009).
- Andreev, K., et al. Guanidino groups greatly enhance the action of antimicrobial peptidomimetics against bacterial cytoplasmic membranes. BBA Biomembranes. 1838, 2492-2502 (2014).
- Foged, C., et al. Cellular uptake and membrane-destabilising properties of alpha-peptide/beta-peptoid chimeras: lessons for the design of new cell-penetrating peptides. BBA Biomembranes. 1778, 2487-2495 (2008).
- Vedel, L., et al. Antiplasmodial and prehemolytic activities of alpha-peptide-beta-peptoid chimeras. Chem Bio Chem. 8, 1781-1784 (2007).
- Lear, S., Cobb, S. L. Pep-Calc.com: a set of web utilities for the calculation of peptide and peptoid properties and automatic mass spectral peak assignment. J Computer-Aided Mol Des. , 1-7 (2016).
- Bates, P. A. Complete developmental cycle of Leishmania mexicana in axenic culture. Parasitol. 108, 1-9 (1994).
- Gossage, S. M., Rogers, M. E., Bates, P. A. Two separate growth phases during the development of Leishmania in sand flies: implications for understanding the life cycle. Int J Parasitology. 33, 1027-1034 (2003).
- Seo, J., Lee, B. C., Zuckermann, R. N., Ducheyne, P. . Comp Biomaterials. 2, 53-76 (2011).
- Nash, I. A., Bycroft, B. W., Chan, W. C. Dde - A selective primary amine protecting group: A facile solid phase synthetic approach to polyamine conjugates. Tetrahedron Lett. 37, 2625-2628 (1996).
- Culf, A. S., Ouellette, R. J. Solid-phase synthesis of N-substituted glycine oligomers (alpha-peptoids) and derivatives. Molecules. 15, 5282-5335 (2010).
- Tran, H., Gael, S. L., Connolly, M. D., Zuckermann, R. N. Solid-phase Submonomer Synthesis of Peptoid Polymers and their Self-Assembly into Highly-Ordered Nanosheets. J Vis Exp. , e3373 (2011).
- Burkoth, T. S., Fafarman, A. T., Charych, D. H., Connolly, M. D., Zuckermann, R. N. Incorporation of unprotected heterocyclic side chains into peptoid oligomers via solid-phase submonomer synthesis. J. Am. Chem. Soc. 125, 8841-8845 (2003).
- Nakayama, G. R., Caton, M. C., Nova, M. P., Parandoosh, Z. Assessment of the Alamar Blue assay for cellular growth and viability in vitro. J Immunol Methods. 204, 205-208 (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon